高危型人乳头瘤病毒感染女性及其配偶病毒检测结果分析
刘学伟,赵学英,张喜庄,杨永军,杨继宏,张 慧
(华北石油管理局总医院,河北 任丘 062552)
高危型人乳头瘤病毒感染女性及其配偶病毒检测结果分析
刘学伟,赵学英,张喜庄,杨永军,杨继宏,张慧
(华北石油管理局总医院,河北 任丘 062552)

[摘要]目的研究高危型人乳头瘤病毒(HPV)感染女性及其配偶病毒感染状况及HPV亚型分布,分析夫妻共患率。方法对120例经宫颈分泌物检测确诊高危型HPV阳性患者HPV亚型分布情况进行分析,并采集患者配偶尿道口上皮细胞和分泌物进行高危型HPV检测并分型,将检测结果与其妻子HPV检测结果进行对照分析。结果120例女患者共检测到高危型HPV亚型8种,常见亚型为16,58,18,52和33型。120例女患者配偶共检测到高危型HPV感染52例(43.33%),常见亚型为16,18,58,52和33亚型。夫妻HPV吻合率为15.83%(19/120)。结论高危型HPV感染女性的配偶也是病毒感染的高危人群。女性一旦检测出高危型HPV感染阳性,有必要对其配偶进行HPV筛查,并将其纳入HPV感染的管理、治疗和跟踪检测范围。
[关键词]男性;人乳头瘤病毒感染; 基因检测
人乳头瘤病毒 (human papilloma virus,HPV)是一种无包膜的小 DNA 病毒,有极强的嗜上皮细胞属性,可引发皮肤及黏膜病变。研究发现,随着宫颈病变的级别升高,HPV阳性率呈上升趋势,高危型HPV持续感染是导致宫颈癌的主要致病原因[1]。目前对成年女性进行HPV筛查已成为筛查子宫颈癌及癌前病变的常规检查项目。实际上男性也会感染HPV,高危型HPV感染女性的配偶也有可能是HPV的感染者。本研究采集高危型HPV感染女性配偶的尿道口上皮细胞和分泌物进行高危型HPV亚型检测,并将检测结果与其妻子的感染亚型进行比对,探讨夫妻间HPV感染类型的分布,为采取有效措施预防病毒传播、促进感染夫妇同期治疗提供理论依据。
1临床资料
1.1一般资料选择2013年1月—2015年6月在华北石油管理局总医院经宫颈组织HPV检测确定为高危型HPV阳性并取得分型结果的120例女性患者及其配偶,夫妻双方均自愿参加本研究。排除有尿道感染性疾病尚未治愈者、夫妻一方或双方有婚外性生活史者、妻子已确诊有宫颈糜烂及癌前病变等阳性体征者。男性年龄26~55岁,平均37.6岁;女性年龄24~54岁,平均35.2岁。
1.2标本采集女性标本采集由妇科医师进行,避开月经期,检查前3 d无阴道上药、冲洗等阴道和宫颈操作。取材时用窥器打开阴道,充分暴露宫颈,用无菌盐水棉球或干棉球拭净宫颈口处的分泌物,专用HPV取样器插入子宫颈管按照同一方向旋转3~5周,慢慢取出取样器,放入含有保存液的容器中待检。男性标本采集由泌尿外科医师进行:上翻受检者包皮并清洗,充分撑开尿道口,将特制的无菌细湿棉签置于尿道口内1~2 cm处,稍加压力顺时针旋转拭子5圈,以获得足够的尿道口上皮细胞和分泌物标本,缓慢抽出棉签,头端迅速置于洗脱管中并旋紧管盖。标本在2 h内进行DNA抽提,或存入-20 ℃冰箱内待测。
1.3检测方法HPV检测及分型步骤:①HPV-DNA提取;②HPV聚合酶链反应(PCR扩增);③核酸分子快速导流杂交及分型。试剂盒由凯普生物科技股份有限公司提供,实验室检测严格按照实验室流程进行,可一次性快速检测16,18,31,33,35,39,45,51,52,56,58,59,68亚型13种HPV高危亚型,结果分析按照试剂盒说明书进行。
2结果
2.1高危型HPV感染女性HPV亚型分布情况120例女性共检测到高危型HPV亚型8种,分别为16,18,31,33,45,52,58,68亚型,未检测到35,39,51,56,59亚型。单一亚型感染阳性率为84.17%(101/120),其余为多重感染。HPV亚型按出现的频率依次为16,58,18,52,33,45,31和68亚型。见表1。
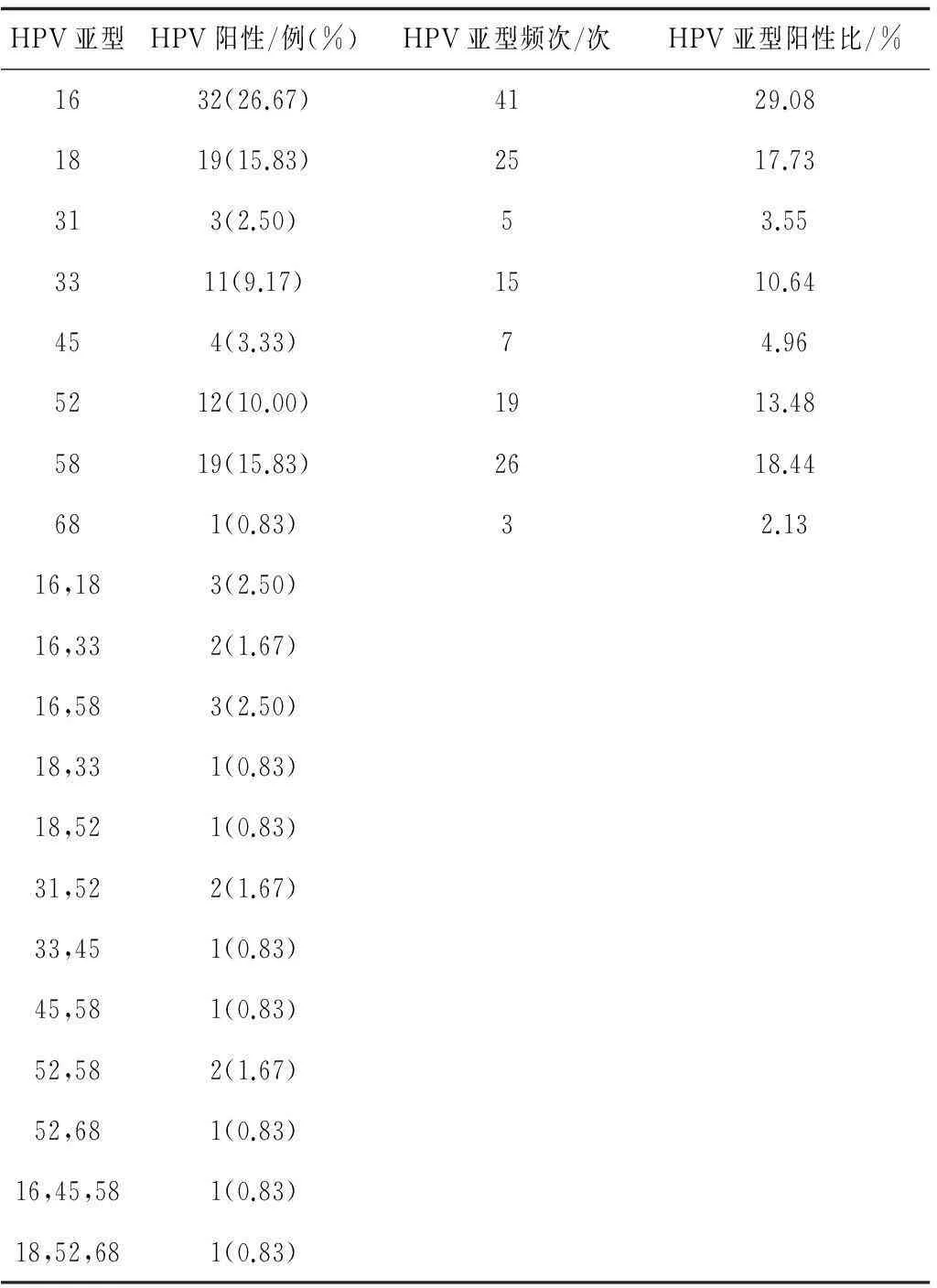
表1 高危型HPV感染女性HPV亚型分布情况
2.2高危型HPV感染女性配偶的HPV亚型分布情况120例男性共检测到高危型HPV感染52例,总感染率为43.33%。高危型HPV亚型有6种,分别为16,18,33,52,58,59亚型,未检测到31,35,39,45,51,56和68亚型。单一亚型感染阳性率为94.23%(49/52)。HPV亚型按其出现的频率依次为16,18,58,52,33和59亚型。见表2。
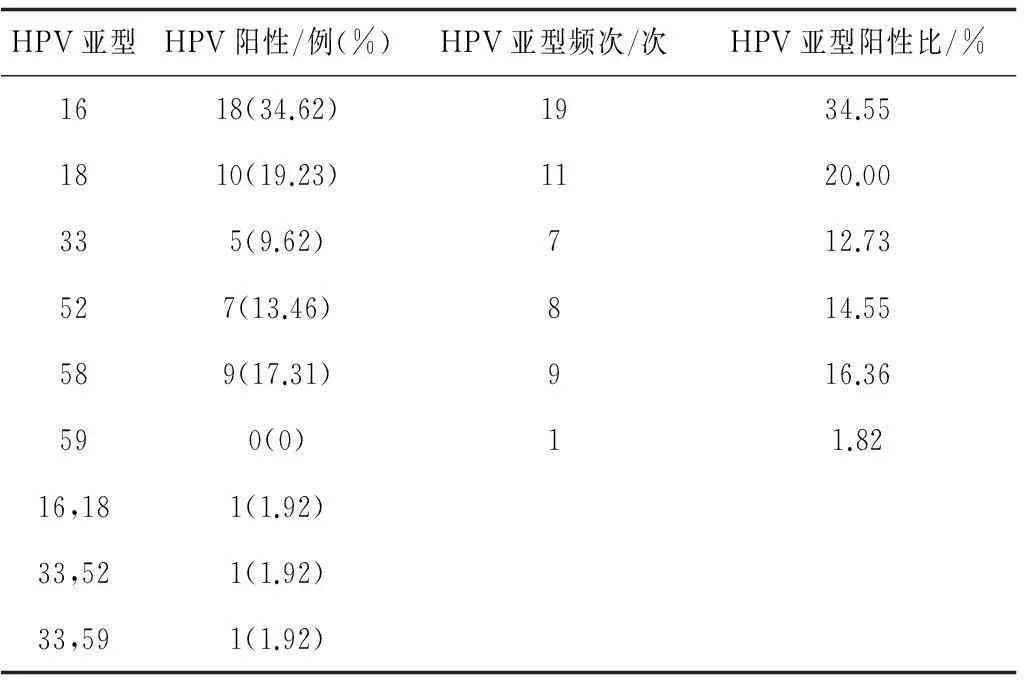
表2 高危型HPV感染女性配偶的HPV亚型分布情况
2.3夫妻配对亚型吻合情况配对后共检出16例HPV亚型完全吻合,双方均为单一亚型感染。另有3例亚型部分吻合,即一方为多重感染,其配偶为单一亚型感染且双方均有同一亚型,判为符合。未发现感染女性与其配偶同为多重感染者。夫妻HPV吻合率为15.83%(19/120),其余为感染亚型不同或单方检测阳性。见表3。
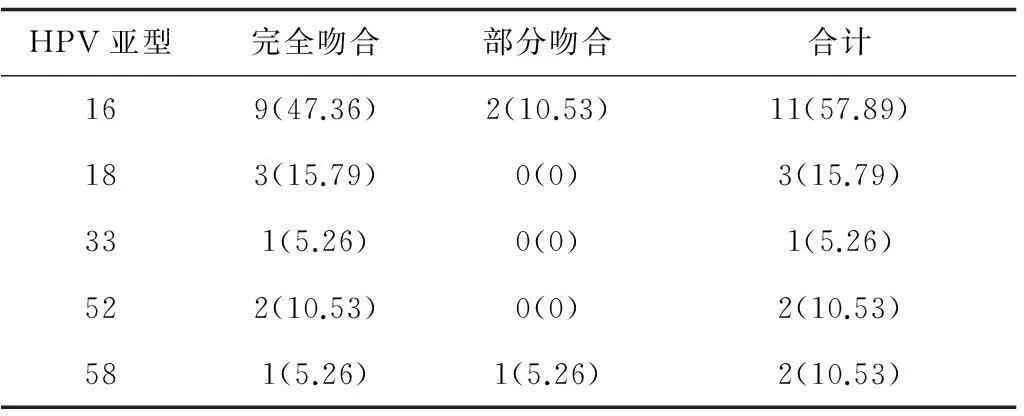
表3 高危型HPV感染女性与其配偶HPV亚型吻合
3讨论
在成年女性恶性肿瘤中,子宫颈癌发病率位于仅次于乳腺癌的第2位[2],占女性生殖系统恶性肿瘤的首位。据统计,我国每年新发子宫颈癌病例约为13.2万人,占全球宫颈癌新发病例的28.8%[3],严重威胁着成年女性的身心健康。从宫颈癌前病变发展成为浸润癌一般需要数年甚至10余年的时间,在此期间宫颈癌前病变如能够得到早期诊断、早期治疗,就有可能防止宫颈癌的发生[4]。近年来,宫颈液基薄层细胞学检查、HPV检测、阴道镜检查及活检、宫颈环形电切术等方法和技术在宫颈病变诊治中的应用为宫颈癌及癌前病变的防治起到了极大的促进作用[5]。特别是高危型HPV的检测具有取材方便、无创、可重复等特点,适宜大面积筛查,其结果能在一定程度上反映宫颈癌及癌前病变的发生、发展[6],是现阶段预防和控制子宫颈癌的主要手段之一。
HPV是感染泌尿生殖道黏膜的常见DNA病毒之一,根据其致癌危险性又分为低危型和高危型。低危型HPV包括6,11,42,43,44, 53,61等亚型,可引起外生殖器及其周边部位皮肤的感染性病变如尖锐湿疣等,极少引发浸润癌。高危型HPV包括16,18,31,33,35,39,45,51,52,56,58,59,68等亚型,可引起女性子宫颈高度鳞状上皮内病变和诱发宫颈癌,在男性可导致阴茎癌、肛门癌等恶性肿瘤的发生,对两性的生殖健康构成严重威胁。HPV感染是非常常见的,大多数女性HPV感染为一过性,女性特有的阴道酸性环境,可通过自身免疫清除一部分HPV病毒。但在35岁以上的成年女性中,有10%~15%的人持续感染HPV,这些人患宫颈癌的风险相对较高[7]。而男性生殖器无自洁功能,阴茎头、包皮、 尿道口均为男性的HPV易感部位,一旦感染病毒后多不能自行清除。男性感染后多不表现生殖器明显病变,人群中存在大量的无症状病毒携带者。病毒很容易通过性生活传染给女性,反之感染女性也可将病毒传染给男性性伴侣,使之成为病毒感染者。性伴侣过多是HPV感染的高危因素,不仅可以导致个体接触到HPV感染的概率增加,同时还会导致不同亚型感染使自身免疫力难以将之清除。性生活中男性使用避孕套是HPV感染发生的保护因素[8]。因此,在宫颈癌的防治工作中,特别是高危型HPV感染的防控工作中必须考虑到男性性行为、性卫生知识认知程度、性态度等因素的影响。本研究主要在夫妻间进行,且将已有性生活的未婚女性及夫妻一方或双方有婚外性生活史者排除在外,主要考虑HPV感染来源不确定,影响检测结果在两性间的配对分析。
HPV单一亚型的感染可使宫颈癌的发病风险增加19.9倍,而多重型别感染可使发病风险增加31.8倍[9]。多重感染属比较常见的感染类型,具有病毒载量更大、出现持续感染的可能性更高、自身免疫清除更为困难、更易导致生殖器恶性病变的特点。从既往研究结果来看,女性HPV感染以单一亚型感染为主,多重感染约占1/4[10]。本研究结果显示,高危型HPV在女性的分布主要以单一亚型感染为主占84.17%,常见16,58,18,52和33亚型感染。冉丹[11]对南阳地区1 886例女性的HPV基因型分布状况进行研究发现,当地女性高危型HPV感染率最高的依次是16,52,58,39等亚型。陈秀杰等[12]对82例女性健康体检者宫颈高危型HPV基因型别分布检测,其中HPV 16亚型的检出率最高,其次为 HPV 58亚型和HPV 18亚型;单一亚型感染阳性率为53.7%。这些研究的高危型HPV感染亚型大体一致,本研究单一亚型感染率比较高,多重感染率较低,考虑与本研究入组女性及其配偶均无婚外性生活史,接触到多种HPV亚型的概率较小有关,其次是感染存在地域、环境和人群的差异。
本研究发现,高危型HPV感染女性配偶的HPV感染率为43.33%,虽然夫妻之间的感染亚型不尽相同,但感染优势亚型都是以16,18,58,52,33亚型为主;配对比较发现夫妻HPV感染亚型吻合率为15.83%(19/120),多重感染女性其配偶多为单一亚型感染或无感染。刘北陆等[13]对57例HPV 16亚型,18亚型阳性妇女及其男性伴侣进行了检测,发现女性感染者的男性伴侣HPV 16亚型,18亚型阳性率为35.1%,男性感染者的女性伴侣均为阳性。本研究男性HPV感染阳性率较高,与本次检测的HPV亚型不仅限于16,18两型有关。刘北陆等[13]研究和本研究虽检测对象和检测项目有所不同,但都表明高危型HPV感染女性的配偶受感染的机会较大。唐努尔·阿布力米提等[14]对新疆某地维吾尔族400例男性尿道分泌物及女性宫颈分泌物进行HPV检测,发现HPV阳性的男性中HPV 16亚型的构成比高,与女性宫颈癌中HPV感染的亚型相符,在一定程度上说明男性在维吾尔族妇女宫颈癌发生过程中起一定的作用。由于男女双方在解剖生理、免疫功能和行为习惯等方面存在的差异,导致自身防御和清除病毒的能力不同,高危型HPV的感染率和感染亚型不尽相同。但在感染的优势亚型上双方大体一致,说明病毒可通过性生活在夫妻之间传播,在一定程度上也说明男性在HPV防治中的不可或缺性。
值得注意的是,近年来子宫颈癌的发病呈现出年轻化和上升的趋势[15-16]。由于男性在性活动中多起到主动作用,尽可能阻断男性HPV的传播链,减少HPV在两性间的传播已成为降低子宫颈癌发病率的关键所在。笔者认为,女性一旦检测出HPV感染,就应对女性的配偶进行HPV检测,如男性也检出HPV,就应对其行HPV管理和干预治疗。在我国,超过95%的男性没有行包皮环切术,与全球约30%男性包皮环切率相比,我国的包皮环切率很低(<5%)[17]。包皮环切术被誉为是两性生殖健康的“外科疫苗”,可以使包皮腔内多种危险因素的作用减弱,是有效减少艾滋病毒、HPV和单纯疱疹病毒通过性生活传播的有效措施。包皮过长、包茎男性感染和携带高危型HPV的可能性较大,应尽早行包皮环切术,以减轻或避免高危型HPV对男性自身及其性伴侣构成的威胁。
综上所述,高危型HPV感染女性的配偶也是病毒感染的高危人群,女性一旦检测出高危型HPV感染,对其配偶进行HPV筛查就成为HPV相关癌症预防中的重要一环。应将高危型HPV感染女性的配偶纳入HPV感染的管理、治疗和跟踪检测范围,在宫颈癌的一二级防治体系中给予更多的关注。
[参考文献]
[1]林秋兰,林竞,赵丽华,等. HPV分型检测及其在宫颈病变中的意义[J]. 现代中西医结合杂志,2013,22(32):3585-3587
[2]马静,袁世发,关丽云,等. 高危型人乳头瘤病毒检测对非典型鳞状细胞分流的临床意义[J]. 河北医科大学学报,2014,35(12):1382-1385
[3]赵方辉,胡尚英,张思维,等. 2004-2005年中国居民子宫颈癌死亡情况及30年变化趋势[J]. 中华预防医学杂志,2010,44(5):408- 412
[4]冯桂芬,甘宝姗,周捷. 宫颈癌筛查技术应用的现状及进展[J]. 实用医学杂志,2013,29(22):3379-3381
[5]朱俊美,靳东芳,白小英. 不同方法诊断宫颈病变的价值探讨[J]. 现代中西医结合杂志,2015,24(2):163-165
[6]王丽红,张美书,张玉杰,等.潍坊市人民医院妇科就诊患者高危型人乳头瘤病毒感染危险因素分析[J].中华临床感染病杂志,2014,7(5):447-450
[7]邹华春,张麟,周沛攀,等. 应在青少年男男性行为人群中推广人乳头瘤病毒疫苗[J]. 中华流行病学杂志,2014,35(9):1072-1073
[8]徐婧,陶冶,张艳,等. 已婚妇女子宫颈人乳头瘤病毒感染危险因素Logistic回归分析[J]. 中国妇幼保健,2012,27(29):4517-4519
[9]夏思钧,龚培尧,平春敏,等. 男性尿道口细胞HPV感染基因型分布的研究[J]. 国际检验医学杂志,2013,34(17):2231-2233
[10] 杨海丽,林力峰,孙冰纯. 人乳头状瘤病毒感染的年龄分布特点探讨[J]. 河北医药,2015,37(4):601-603
[11] 冉丹. 南阳地区女性人乳头状瘤病毒感染基因型分布状况研究[J]. 现代中西医结合杂志,2014,24(31):3500-3502
[12] 陈秀杰,李艳玲,曲芃芃. 459例女性健康体检者HPV基因型及高危因素分析[J]. 天津医药,2014,42(2):123-126
[13] 刘北陆,栾建兵,郭文潮. 分泌物 HPV16,18阳性女性及其性伴侣两年跟踪检测结果分析[J]. 中国妇幼保健,2012,27(27):4250-4252
[14] 唐努尔·阿布力米提,穆也沙尔·吐尔干,古扎丽努尔·阿不力孜,等. 新疆宫颈癌高发区维吾尔族人群人乳头瘤病毒亚型的研究[J]. 中华流行病学杂志,2011,32(5):477-479
[15] Shi JF,Canfell K,Lew JB,et al. The burden of cervical cancer in China:synthesis of the evidence[J]. Int J Cancer,2012,130(3):641-652
[16] 张敏,冯月萍. 宫颈癌前病变诊断与治疗[J]. 现代中西医结合杂志,2010,19(32):4234-4235
[17] 雷雨,万俊,潘连军,等. 南京城区女性宫颈人乳头瘤病毒感染状况与性伴侣包皮过长或包茎相关性的调查研究[J]. 中华男科学杂志,2012,18(10):876-880
Analysis of virus test results on 120 couples which wives infected with high-risk human papillomavirus
LIU Xuewei,ZHAO Xueying,ZHANG Xizhuang,YANG Yongjun,YANG Jihong,ZHANG Hui
(General Hospital of Huabei Petroleum Administration,Renqiu 062552,Hebei, China)
Abstract:Objective It is to study the infection status of high risk human papillomavirus (HR-HPV)and the distribution of HR-HPV subtypes in a man whose wife had been infected,and to analysis the concordance infection rate in couples. Methods Urethra epithelial cells and urethral secretions of 120 males whose wife infected with HR-HPV had been collected to detect 13 kinds of HPV subtypes.The result of HPV subtypes was been analysised with the results of his wife's. Results 8 kinds of HR-HPV subtypes from 120 cases of women's cervix swabs were detected.The common HR-HPV subtypes in women were:HPV16,58,18,52,33.52 cases had been infected HR-HPV in male,the infection rate was 43.33%.The common HR-HPV subtypes in men were:HPV16,18,58,52,33. The concordance infection rate in couples was 15.83%(19/120). Conclusion Male whose wife infected with HR-HPV is at high risk of infection. It is necessary to carry out HPV screening for her husband once womon have detected a HR-HPV infection. Male whose wife infected with HR-HPV should be included in the range of management,treatment and follow-detection of the HPV infection.
Key words:male; HPV infection;gene detection
[收稿日期]2015-10-09
[中图分类号]R711.7
[文献标识码]A
[文章编号]1008-8849(2016)08-0807-04
doi:10.3969/j.issn.1008-8849.2016.08.003
[基金项目]河北省医学科研重点课题计划项目(20150823)
[作者简介]刘学伟,女,副主任医师,副教授,从事妇科感染的临床研究。[通信作者]赵学英,E-mail:zhxy120@126.com

