香草兰生防细菌的筛选、分子鉴定及其抑菌机制的初步研究
高圣风 刘爱勤 桑利伟 孙世伟 苟亚峰


摘 要 通过平板对峙法从香草兰根际微生物中筛选出对香草兰根(茎)腐病菌(Fusarium oxysporum)、香草兰疫病菌(Phytophthora nicotianae)和香草兰细菌性软腐病菌(Erwinia carotovora)均有良好抑制效果的生防菌10株。通过16S rDNA序列比对及系统发育树分析,其中7株为解淀粉芽孢杆菌(Bacillus. amyloliquefaciens),2株为枯草芽孢杆菌(B. subtils),1株为甲基营养型芽孢杆菌(B. methylotrophicus)。提取脂肽类化合物进行抑菌分析,发现10株生防菌脂肽类提取物对香草兰根(茎)腐病菌和香草兰疫病菌均有良好的抑制效果,有4株的脂肽类粗提物对香草兰细菌性软腐病菌有强烈的抑制活性。对其中2个菌株脂肽类粗提物进行MALDI-TOF/TOF-MS检测,发现菌株 VX2R11 产生表面活性素(Surfactin)和伊枯草素A(IturinA)2种脂肽类化合物,菌株 VX2S02 仅产生伊枯草素A,推测产生伊枯草素A是菌株VX2R11和VX2S02拮抗香草兰根(茎)腐病菌和疫病菌重要机制;产生表面活性素是菌株VX2R11拮抗香草兰细菌性软腐病菌的重要机制。
关键词 香草兰 ;芽孢杆菌 ;16S rDNA 鉴定 ;脂肽类化合物
分类号 S435.73 Doi:10.12008/j.issn.1009-2196.2016.01.009
Abstract Ten bio-control Bacillus strains were selected via dual culture method from the isolates obtained from vanilla rhizosphere of Wanning city and Qionghai city in Hainan province. The selected isolates were highly antagonistic against vanilla pathogens:Fusarium oxysporum,Phytophthora nicotianae and Erwinia carotovora. Seven B. amyloliquefaciens strains, two B. subtils strains and one B. methylotrophicus strain were identified by the assays of 16S rDNA sequence and the phylogenefic tree. Lipopeptide compound analysis via dual culture method showed that all 10 lipopeptide extractions from each bio-control strain exhibited highly antagonistic against F. oxysporum and P. nicotianae, while 4 lipopeptide extractions were highly antagonistic against E. carotovora. Lipopeptide compound analysis via MALDI-TOF/TOF -MS showed that strain VX2R11 produced Surfactin and IturinA,while strain VX2S02 produced Iturin A, suggesting that strainVX2R11and VX2S02 might via the production of IturinA to antagonize pathogens F. oxysporum and P. nicotianae, while strainVX2R11 might via the production of Surfactin to antagonize pathogen E. carotovora.
Keywords Vanilla fragrans ; Bacillus spp ; 16S rDNA sequence ; lipopeptide
香草兰[Vanilla fragrans(salisb.)Ames(V.planifolia)]是一种经济附加值极高的热带经济作物,素有“食品香料之王”的称誉。香草兰根(茎)腐病是一种危害极大的土传病害,其病原物是尖孢镰刀菌(Fusarium. oxysporum)[1]。镰刀菌土传病害是世界性防治难题,其化学防治成本高、风险大;而且香草兰栽培品种极其单一,没有抗性品种,目前对该病害严重缺乏简单有效的防治手段。近年来,香草兰根(茎)腐病已在我国香草兰种植区爆发流行,造成很多香草兰种植园荒废,严重阻碍了香草兰产业的发展[2]。同时,香草兰疫病和香草兰细菌性软腐病也是香草兰上重要病害,其病原物分别为烟草疫霉(Phytophthora nicotianae)和胡萝卜欧文氏杆菌(Erwinia carotovora),每种病害每年给香草兰产业造成约15%~30%的损失,也是香草兰生产上的重要问题。
生物防治技术日益兴起,其防治谱广和对环境友好的特点使其成为当前的研究热点之一。目前,国内外已经开始利用生防菌防治香草兰病害的探索。Ramalingam等[3]发现荧光假单胞(Fluorescent pseudomonads)等生防菌株在温室和田间均能够显著降低香草兰根(茎)腐病的严重度。Radjacommarea等[4]发现17株木霉(Trichodema)对包括香草兰根(茎)腐病菌有抑制活性,其中2株木霉菌与荧光假单胞菌和壳多糖相结合获得了良好的大田防病效果。曾会才等[5]发现枯草芽孢杆菌(Bacillus subtilis)OBS-2菌株在盆栽和大田试验上对香草兰根(茎)腐病和香草兰疫病具有良好的防治效果。李霞等[6]在对搜集到的9株木霉、枯草芽孢杆菌和荧光假单孢菌进行了平板抑制活性分析。
迄今为止,国内外对香草兰生防菌筛选和应用的报道极少,对香草兰疫病和香草兰细菌性软腐病的报道几乎空白。已报道的生防菌株也多为分离自其他作物的外源菌株,鲜有来自香草兰生境的天然生防菌。这些香草兰生防菌的生防机制也尚未见报道。本研究以香草兰上主要病害香草兰根(茎)腐病、香草兰疫病和香草兰软腐病菌为靶标,对香草兰根际生防细菌开展了筛选、鉴定及作用机理分析等工作,为进一步研究香草兰重要病害的绿色高效防控提供基础。
1 材料和方法
1.1 材料
1.1.1 培养基
本研究中平板对峙培养所用培养基为马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA),细菌培养所用培养基为Luria-Bertani(LB)培养基;生防菌发酵所用培养基为Landy培养基[7]。
1.1.2 菌株
本研究所用3种病原菌香草兰根(茎)腐病菌、香草兰疫病菌和香草兰细菌性软腐病菌均来自中国热带农业科学院香料饮料研究所。
1.1.3 试剂和引物合成
本研究基因组的提取和PCR扩增均使用天根生化科技(北京)有限公司“快速DNA提取扩增套装”试剂盒完成;PCR片段纯化均采用天根生化科技(北京)有限公司“琼脂糖凝胶回收试剂盒”完成;PCR引物的合成均在深圳华大基因科技服务有限公司完成;其他试剂如氯化钠、磷酸二氢钾、七水硫酸镁、氯化钾、L-苯丙氨酸、硫酸锰、五水硫酸铜、七水硫酸亚铁等均为分析纯。PCR所用引物为细菌16S rDNA通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGYTACCTTGTTACGACTT- 3′)[7]。
1.2 方法
1.2.1 生防菌筛选
采用平板对峙培养法进行生防菌筛选。将香草兰根(茎)腐病和香草兰疫病的病原菌在PDA平板上活化后打成直径0.5 cm的圆形菌丝块,然后将菌丝块接种在新平板中央并在四周接种活化后的香草兰根际细菌。将浓度为109 cfu/mL的香草兰细菌性软腐病菌以2%比例加入到冷却至约50℃的PDA培养基中,摇匀后倒平板;然后将浓度为109 cfu/mL的香草兰根际细菌液5 μL接种在含菌平板上。所有平板均放置在28℃恒温培养箱中培养,5~7 d后测量抑菌圈直径。
1.2.2 生防菌16S rDNA序列分析鉴定
生防菌提取基因组DNA后,采用细菌16S rDNA通用引物进行16S序列扩增[7]。PCR产物经1%琼脂糖凝胶电泳分离后通过紫外凝胶成像仪检测并切胶回收,回收产物送到深圳华大基因科技服务有限公司测序。测序结果在NCBI网站的基本局部比对搜索工具(The Basic Local Alignment Search Tool, BLAST)进行序列比对分析。
将本研究获得的生防菌16S rDNA序列上传到GenBank,下载近源菌株的16S rDNA序列用于系统发育树的构建。用Clustal X 2.1和MEGA6.06软件进行系统发育树构建[7]。
1.2.3 脂肽类化合物分析
将待测菌株接种在LB培养基中200 r/min 37℃条件下培养12 h;然后以3%比例转接入50 mL landy培养基,在200 r/min 30℃条件下发酵40 h;用酸沉淀法[8]提取脂肽类化合物,粗提物浓缩至3 mL后经0.22 μm孔径滤膜过滤后备用。采用平板对峙培养法检测各菌株脂肽类粗提物的抑菌活性,方法见本研究“1.2.1生防菌筛选”,仅将“接种生防菌”更换为“滴加10 μL脂肽类粗提物”。通过AB SCIEX 5800 MALDI-TOF/TOF-MS仪器进行飞行时间质谱检测,根据质谱结果初步判断物质种类[9-10]。
2 结果与分析
2.1 生防菌筛选
通过平板对峙培养法从香草兰根际细菌中筛选到对香草兰根(茎)腐病菌、香草兰疫病菌和香草兰细菌性软腐病菌3种病原菌均有良好抑菌效果的菌株10株;对香草兰根(茎)腐病菌和香草兰疫病菌的抑菌圈平均直径均>15 mm,对香草兰细菌性软腐病菌的抑菌圈平均直径均>10 mm(图1、表1)。
2.2 香草兰根际生防菌鉴定
以生防菌DNA 为模板扩增 16S rDNA 片段,获得大小约 1.5 kb的 PCR片段,将测序结果在 NCBI 网站通过BLAST 软件与 GenBank 中己知序列进行比对分析。结果表明:GenBank 中与10株生防菌16S序列同源性最高的菌株均为芽孢杆菌属菌株;其中菌株VD18S15与甲基营养型芽孢杆菌 HB26的 16S rDNA 的序列同源性为 99%,菌株VD18R19和VX1R02与枯草芽孢杆菌 168的16S rDNA 的序列同源性均为100%,菌株VD18S27与解淀粉芽孢杆菌D15的 16S rDNA 的序列同源性为100%,菌株VD21R27和VX1S06与解淀粉芽孢杆菌 D12的 16S rDNA 的序列同源性均为100%,菌株VX2R11和VX2S02与解淀粉芽孢杆菌的 16S rDNA 序列同源性均为100%,菌株VX4S09和VX4S18与解淀粉芽孢杆菌 SQR-7的 16S rDNA 序列同源性均为100%。
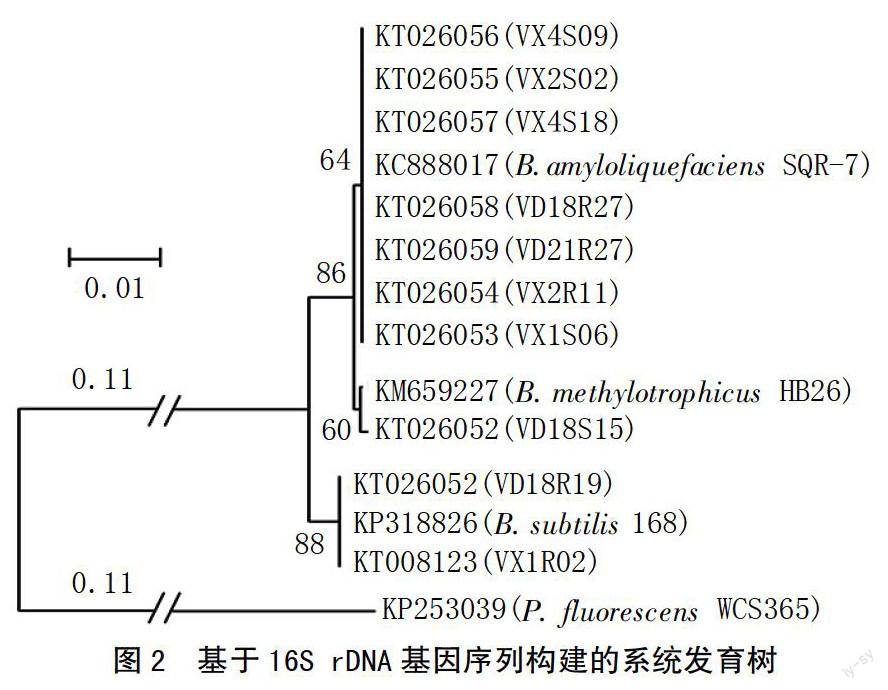
以1株荧光假单胞菌株WCS365(登陆号:KP253039)为外群,以枯草芽孢杆菌168(登陆号:KP318826)、甲基营养型芽孢杆菌HB26(登陆号:KM659227)和解淀粉芽孢杆菌SQR-7(登陆号:KC888017)为参照,构建系统发育树(图2)。结果发现:10株生防菌被聚类为3个分支;其中菌株VX4S09、VX2S02、VX4S18、VD18S27、VD21R27、VX2R11、VX1S06与解淀粉芽孢杆菌SQR-7聚类在同一分支,菌株VD18S15与甲基营养型芽孢杆菌 HB26被聚类在相同分枝,菌株VD18R19和VX1R02与枯草芽孢杆菌168被聚类在同一分支。
2.3 脂肽类化合物分析
10株生防菌发酵后均能成功得到脂肽类粗提物。所有的脂肽类粗提物对病原真菌F. oxysporum VFO62和病原细菌P. nicotianae VPN01的抑菌圈平均直径均>15 mm,大部分粗提物的抑菌圈平均直径达20 mm以上(表1、图3)。说明脂肽类化合物在这10株生防芽孢杆菌的抑制真菌机制和抑制卵菌机制中均起重要作用。但是对病原细菌 E. carotovora VEC03的抑菌效果呈现两极分化,出现强烈抑菌和完全不抑菌两组(表1、图3):VD18R19、VD18S15、VX1S06、VX2R11等4个菌株的抑菌圈平均直径均 >20 mm;其他6个菌株检测不到抑菌效果。该结果表明,脂肽类化合物在菌株VD18R19、VD18S15、VX1S06和VX2R11的抑制细菌机制中起重要作用;同时推测,其他6株生防菌可能产生其他种类的抑细菌物质。
从生防菌脂肽类粗提物中选取对真菌、卵菌和细菌均有良好抑制效果的VX2R11以及仅对真菌和卵菌抑制效果良好的VX2S02进行MALDI-TOF/TOF-MS检测。检测图谱显示(图4),菌株VX2R11在m/z值为1 030.631 0,1 044.621 9,1 058.660 9处有离子峰的出现,这3个离子峰对应于表面活性素的分子质量[9]; 在m/z值为1 065.534 1,1 079.546 6,
1 093.562 1,1 109.535 8处有离子峰的出现,这4个离子峰对应于伊枯草素A的分子质量[10]。菌株VX2S02在m/z值为1 065.504 0,1 079.515 4,
1 093.533 1,1 109.505 4处有离子峰的出现,这4个离子峰对应于伊枯草素A的分子质量[10]。MALDI-TOF/TOF-MS质谱分析结果表明,菌株 VX2R11 产生脂肽类化合物表面活性素和伊枯草素A,菌株 VX2S02 仅产伊枯草素A。
3 讨论与结论
香草兰通常种植于温暖、潮湿、荫蔽的环境中,该环境适于病原菌孳生,极易产生病害。本研究从香草兰根际筛选生防菌,希望利用香草兰生境中天然的生防菌来抑制病原菌数量达到防病的目的。本研究以香草兰上3种重要的病害为靶标进行抑菌筛选,得到了广谱生防菌10株。经过16S rDNA序列鉴定和系统发育树分析,发现10株生防菌均为芽孢杆菌属菌株,包含解淀粉芽孢杆菌7株、枯草芽孢杆菌2株和甲基营养型芽孢杆菌1株。芽孢杆菌类生防菌广泛分布于各种自然环境中,容易进行人工培养,可以产生芽孢抵抗紫外线、干旱、高温、低温等逆境,耐贮藏和运输,使芽孢杆菌类生防菌在开发和应用上更具优势。
当前国内外对香草兰生防菌的研究多在应用层面,对其生防机制知之甚少。脂肽类化合物是芽孢杆菌产生的最主要的抑菌物质[11-14],其分子量一般在900~2 000[15]。本研究通过生防菌脂肽类化合物分析来探讨其生防机制。采用酸沉淀法提取生防菌脂肽类化合物进行抑菌分析,结果发现,10株生防菌脂肽类粗提物对病原真菌和卵菌有良好的抑菌效果,4个菌株的脂肽类粗提物对病原细菌抑制效果良好。该结果说明,脂肽类化合物在生防菌抑制香草兰病原真菌、卵菌和细菌过程中起重要作用。
为了进一步分析香草兰生防菌的生防机制,本研究选出2个菌株,脂肽类粗提物对3种病原菌均有良好抑制活性的VX2R11菌株以及仅抑制2种病原菌的VX2S02菌株进行MALDI-TOF/TOF-MS检测,发现菌株 VX2R11产生表面活性素和伊枯草素A两种脂肽类化合物,菌株 VX2S02 仅产生伊枯草素A。前人研究表明,芽孢杆菌产生的脂肽类化合物中,表面活性素对细菌和病毒有良好的抑制活性[12,16],伊枯草素A对真菌和卵菌具有强烈的抑制活性[14-15],与本研究结果相符。由此推断,菌株VX2R11及VX2S02对香草兰根(茎)腐病菌和香草兰疫病菌的拮抗效果可能通过产生伊枯草素A实现;菌株VX2R11对香草兰细菌性软腐病菌的拮抗效果可能通过产生表面活性素实现;菌株VX2S02对病原细菌的拮抗效果可能来自于菌株产生的非脂肽类物质,其物质种类还有待于进一步研究。
本研究从拮抗物质的角度初步探讨了香草兰根际生防菌的生防机制。此外,还可能存在竞争、诱导寄主植物抗性等生防机制,需要更多的深入研究。虽然生防菌的应用目前尚不成熟,但是生防芽孢杆菌自身的天然、环境友好、易培养、耐贮藏、广谱等特性赋予其广阔的应用前景。
参考文献
[1] 高圣风,刘爱勤,桑利伟,等. 香草兰根(茎)腐病病原菌鉴定及其致病性测定[J]. 热带农业科学,2015,35(1):39-44.
[2] 欧阳欢. 香草兰产业发展历程和展望[J]. 农业与技术,2006,26(1):66-68.
[3] Ramalingam Radjacommare,Raju Usharani,Ramasamy Samiyappan. Genotyping antibiotic producing fluorescent pseudomonads to select effective rhizobacteria for the management of major vanilla diseases[J]. Annals of Microbiology, 2007, 57(2): 163-170.
[4] Radjacommarea R, Venkatesana S, Samiyappan R. Biological control of phytopathogenic fungi of vanilla through lytic action of Trichoderma species and Pseudomonas fluorescens[J]. Archives of Phytopathology and Plant Protection, 2010, 43(1): 1-17.
[5] 曾会才,张开明,文衍堂. 香草兰根腐病生防菌筛选及防治试验[J]. 热带作物学报,1998,19(2):65-69.
[6] 李 霞,王云月,朱有勇,等. 香荚兰根腐病主要病原的生防因子作用比较[J]. 热带农业科技,2003,26(2):1-3.
[7] 谢永丽,高学文. 高寒草甸根围拮抗芽孢杆菌筛选鉴定及脂肽化合物分析[J]. 中国生物防治学报,2012,28(3):367-374.
[8] 王 帅,高圣风,高学文,等. 枯草芽孢杆菌脂肽类抗生素发酵和提取条件[J]. 中国生物防治,2007,23(4):342-347.
[9] Alexandra K, Xiao-Hua C, Anke H, et al. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42[J]. Journal of Bacteriology, 2004, 186(186): 1 084-1 096.
[10] Cawoy Hélène, Debois Delphine, Franzil Laurent, et al. Lipopeptides as main ingredients for inhibition of fungal phytopathogens by Bacillus subtilis/amyloliquefaciens[J]. Microbial Biotechnology, 2015, 8(2): 281-295.
[11] Romero D, de Vicente A, Rakotoaly R H, et al. The iturin and fengycin familied of lipoppeptides are key factors in antagonism of Bacillus subtilis toward podosphaera fusca[J]. Molecular Plant-microbe Interactions, 2007, 20(4): 430-440.
[12] Stein T. Bacillus subtilis antibiotics:structures, syntheses and specific functions[J]. Molecular Microbiology, 2005, 56(4): 845-857.
[13] Kleinkauf H, Dohren H. Noribosomal biosynthesis of peptide antibiotics [J]. Europe Journal of Biochemistry, 1990, 192: 1-15.
[14] Konz D, Doekel S, Marahiel M A. Molecular and biochemical characterization of the protein template controlling biosynthesis of the lipopeptide Lichenysin[J]. Journal of Bacteriology, 1999, 181(1): 133-140.
[15] 许亚伟,陆豪杰,杨芃原. 蛋白质组学中基质辅助激光解吸电离的基质研究进展[J]. 分析化学,2007,35(3):455-460.
[16] Gao S, Wu H, Wang W, et al. Efficient colonization and harpins mediated enhancement in growth and biocontrol of wilt disease in tomato by Bacillus subtilis[J]. Letters in Applied Microbiology, 2013, 57(6): 526-533.

