苦瓜McAPX2基因及其启动子的克隆与表达分析
高山 许端祥 陈中钐 杜文丽 傅睿清 温庆放
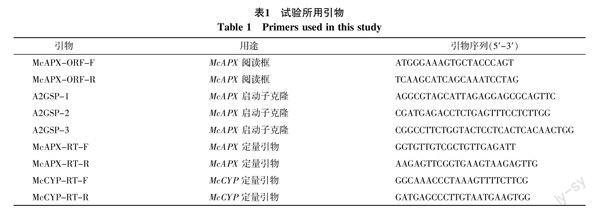

摘 要 基于苦瓜叶片均一化文库克隆得到McAPX2基因的cDNA全长序列(GenBank登录号:KJ722767.1),采用染色体步移法获得该基因的启动子序列,实时荧光定量PCR技术检测该基因在不同器官中的表达量及低温胁迫对McAPX2表达量的影响。结果表明:McAPX2基因全长1 086 bp,开放阅读框747 bp,编码249个氨基酸;McAPX2属于过氧化物酶家族ClassⅠ的成员,其脂肪族氨基酸指数为83.90,是一个亲水性蛋白,可推测定位于细胞质中;与甜瓜(NP_001284378.1)、黄瓜(ACO90193.1)、南瓜(AHF27424.1)、苦瓜(AGJ72851.1)同源性較高,分别为95%,94%,94%和93%;qRT-PCR结果显示,在苦瓜的根、茎、叶、雌花和幼果等组织器官中McAPX2的表达量存在显著差异,其中根的表达量最大,而在叶片中的表达量最低;在低温胁迫下,随着胁迫时间的延长,McAPX2表达量逐渐上调,处理12 h时达到最大,随后下降,说明该基因的表达与苦瓜耐低温胁迫相关。分离得到McAPX2基因上游调控序列1 267 bp,其启动子含有与GA、ABA、CTK、乙烯等激素和病原菌等生物胁迫以及热激、干旱、低温、光等非生物胁迫的相关元件。
关键词 苦瓜;McAPX2基因;启动子;表达分析
中图分类号 S642.5 文献标识码 A
低温胁迫打破植物细胞内活性氧(active oxygen, ROS)产生和消除的平衡机制,造成活性氧含量大幅增加,引发氧化胁迫,致使植物生长发育受阻,甚至死亡[1]。H2O2是一种较稳定的ROS物质,可以轻易地穿过植物细胞膜,生成最活跃的ROS物质——羟自由基(·OH-),进而干扰植物细胞光电子传递,影响膜系统稳定性,氧化大分子物质,造成细胞程序性死亡[2-4]。因此,及时清除过多H2O2对维持植物正常生理功能起重要作用。
抗坏血酸-谷胱甘肽循环(ascorbate-glutathione cycle, AGC)是高等植物长期进化产生的有效清除活性氧的保护机制之一[5],抗坏血酸过氧化物酶(APX, ascorbate peroxidase)是AGC清除H2O2的关键酶,其以抗坏血酸(AsA)为特殊电子供体(AH2),催化H2O2还原成H2O[6-7]。目前已从多种作物克隆出APX基因,许多研究发现APX基因参与植物响应氧化胁迫应答[8-14]。
中国南方冬春持续低温是影响设施大棚苦瓜(Momordica charantia L.)生长、发育、产量与品质形成的主要限制因子,但有关苦瓜低温胁迫分子机制研究尚未见报道。本试验从前期构建的苦瓜叶片均一化cDNA文库中获得一个EST序列,发现其与抗坏血酸过氧化酶基因高度同源。本研究以该序列设计特定引物,利用RACE技术克隆出苦瓜APX基因全长序列,分析其特征特性和在低温胁迫下时空表达模式,分离并分析McAPX基因的启动子,为进一步研究苦瓜APX在低温胁迫下的功能奠定基础,以期为苦瓜耐低温育种提供理论依据。
1 材料与方法
1.1 材料
供试材料为苦瓜强雌系‘24-K(Subgynoecious line,24-K),由福州市蔬菜科学研究所苦瓜课题组提供,参照高山等[14]方法,采用DSN与SMARTTM技术相结合构建苦瓜叶片均一化全长cDNA文库,基因克隆与表达在福建省农业科学院作物研究所内完成。
1.2 方法
1.2.1 初花期苦瓜低温处理 试验于2013年9月中旬进行,将供试‘24-K的苦瓜种子用60 ℃温水处理30 min,常温浸种12 h后,播种于10 cm×15 cm的营养钵中,营养基质为泥炭土 ∶ 珍珠岩 ∶ 蛭石=7 ∶ 1 ∶ 2(体积比),每个营养钵中保按照常规方法管理。待苦瓜长至9叶1心,出现雌蕊时,选择生长势一致的植株分别移置2台智能型人工气候箱(MGC-350HP-2)进行处理。(1)处理组A:温度8 ℃,湿度为60%,光强为200 μmol/(m2·s),光周期12 h/12 h;(2)处理组B或对照组:温度25 ℃,其它条件相同。在0~24 h内分别于0、1、3、6、12、
24 h定时取各处理单株第5片功能叶,经液氮速冻后,置于-80 ℃冰箱备用,进行基因表达分析。每个处理随机取6株,设3次重复。
1.2.2 苦瓜基因组DNA和总RNA提取纯化 采用改良CTAB法提取苦瓜强雌系24-K的基因组DNA[15];采用改良Trizol RNA提取试剂盒(Invitrogen)方法,分别提取苦瓜强雌系24-K开花初期(9叶1心)根、茎、叶、雌花和授粉5 d幼果的总RNA,用于McAPX2在苦瓜不同部位的表达分析。采用上述方法分别提取经不同时间低温处理和对照处理的苦瓜叶片总RNA,用于McAPX2表达模式分析。用1%琼脂糖凝胶电泳检测基因组DNA、总RNA 完整性,用紫外分光光度计检测基因组DNA、总RNA的浓度和纯度。
1.2.3 McAPX2基因的克隆 在已构建苦瓜叶片均一化cDNA文库基础上,测序后去除引物和载体片段,在Blast(http://blast.ncbi.nlm.nih.gov/)进行序列同源性比对分析,获得一个与多种植物APX基因有很高同源性的EST序列,该基因cDNA全长1 086 bp。利用软件Primer 5.0 设计ORF上下游引物McAPX-ORF-F/R(见表1),以稀释100倍文库为模板进行PCR扩增,回收的目的条带,克隆到TaKaRa的pMD18-T载体上,转化感受态细胞DH5α,筛选出阳性克隆,委托上海英骏生物技术公司测序,进行新基因验证。
1.2.4 McAPX2启动子的分离 根据苦瓜McAPX2的全长cDNA序列,从起始密码子下游200 bp内设计巢式引物A2GSP-1,A2GSP-2和A2GSP-3。参照刘志钦等[16]方法和Genome Walking kit试剂盒说明书,以纯化的苦瓜‘24-K基因组DNA为模板,进行3轮巢式PCR,分离克隆McAPX2上游调控区域的启动子序列。PCR产物纯化回收并克隆至pMD18-T载体上,委托上海英骏生物技术公司测序。
1.2.5 McAPX2生物信息学分析 由在线软件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找McAPX2最大开放阅读框,使用Blastn(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性分析;采用Maga5.01软件绘制系统进化树;利用在线软件Blastp、SOSUI、Signal3.0、TMHMM、TargetP1.1、SOPMA等(http://www.expasy.org/tools)分析McAPX2编码的氨基酸序列、蛋白结构、疏水性、跨膜结构、磷酸化位点等。利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测其顺式作用元件。
1.2.6 荧光定量PCR分析 以稀释10倍的反转录cDNA为模板,根据McAPX2基因序列设计荧光定量引物McAPX2-RT-F/R,以苦瓜环素基因(GenBank:HQ171897)作为内参基因[15],以McCYP-RT-F/R为荧光定量引物(表1),RT-qPCR分析在ABI7500荧光定量PCR仪上进行,每个样品进行3次重复。20 μL PCR扩增体系为:10 μL 2×Real Master Mix混合液、5~10 ng cDNA、上下游引物各0.5 μL,补ddH2O至20 μL。反应程序为:95 ℃预变性10 min;94 ℃ 15 s,60 ℃ 34 s,40次循环,清水模板为阴性对照。采用2-△△Ct法计算相对表达量。原始数据用Excel2007软件处理,用SPSS10.0软件进行相关分析。
2 结果与分析
2.1 McAPX2基因全长的克隆
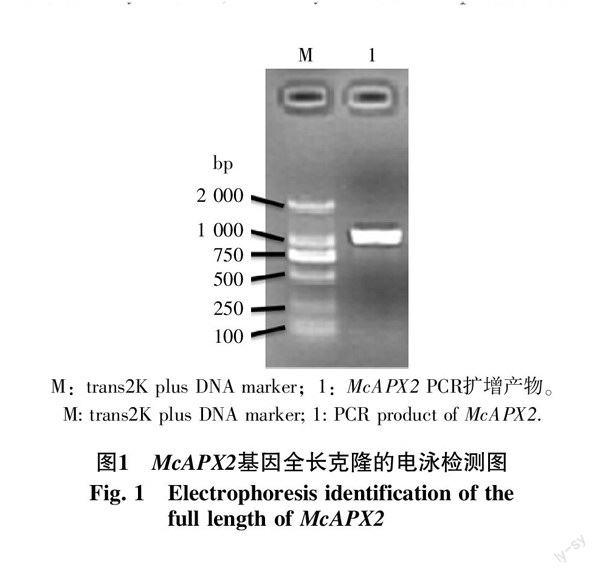
从苦瓜叶片均一化文库中克隆得到1个APX相关的EST片段,去除引物和载体片段,经blastn比对分析,发现与黄瓜L-ascorbate peroxidase(NM_001280706.1)的cDNA序列相似性为67.5%,经测序及序列分析,得到APX基因cDNA全长序列(图1、2),该序列全长为1 086 bp,包括89 bp的5′-UTR,250 bp的3′-UTR。起始密码子ATG附近有Kozak保守序列“A/GCCATGG”,cDNA末端含有PolyA序列,在PolyA之前20 bp含保守加尾信号“TGTAA”序列,这些均符合能有效翻译基因的全长cDNA特征,命名为McAPX2,GenBank登录号为KJ722767.1。
2.2 McAPX2基因推导氨基酸序列的生物信息学分析
经ORF Finder分析,McAPX2的开放閱读框为747 bp,编码249个氨基酸。ProtParam软件分析表明,McAPX2蛋白分子式为C1 236H1 912N326O365S5,相对分子量27.34 ku,理论等电点pI为5.43;负电荷残基(Asp+Glu)为36个,正电荷残基(Arg+Lys)为28个;脂肪系数为83.90,平均熟疏水性为-0.280;不稳定指数为34.80,属于稳定蛋白。经ProtScale软件推测该蛋白为亲水性蛋白。
采用TargetP1.1对McAPX2蛋白进行细胞内定位预测,结果显示定位在线粒体内(mTP值为0.131)或分泌到胞外(SP值为0.047)的可能性较小,极有可能在其它部位(other值为0.906)。经SignalP 4.1 Server软件分析,McAPX2蛋白不含信号肽,不是分泌蛋白。经TMpred程序分析,McAPX2蛋白不含跨膜区域。结果推测McAPX2蛋白定位在细胞质中。
经SOPMA预测McAPX蛋白二级结构显示,McAPX蛋白包含有104处α-螺旋(Alpha helix),占41.77%;22处β-转角(beta-turn),占8.84%;25处延伸链(Extended strand),占10.04%;98处无规则卷曲(Random coil),占39.36%。
通过NCBI的CDS软件分析,McAPX2蛋白属于植物来源的过氧化物酶超家族,该蛋白含有1个过氧化物酶活性位点或底物结合位点(33-44: APLMLRLAWHSA)区域,1个亚铁血红素配基结合区域或血红素结合位点(155-165:DIVALSGAHTL),发现7个与形成二聚体静电作用相关的保守氨基酸。利用DNAMAN软件进行氨基酸同源比对(图3),发现APX蛋白序列C-端高度保守,N-端相对不保守,与同属的甜瓜(Cucumis melo NP_001284378.1)、黄瓜(Cucumis sativus ACO90193.1)、南瓜(Cucurbia moschata AHF27424.1)、苦瓜(Momordica charantia AGJ72851.1)同源性分别为95%,94%,94%,93%,说明葫芦科APX氨基酸序列具有较高的保守性。
利用MEGA5.0软件,将McAPX2蛋白与其他27种植物的APX蛋白进行系统发育树构建(图4),参与构建进化树的27个APX蛋白已被证明或预测定位于细胞质中。结果显示,苦瓜McAPX蛋白与葫芦科植物甜瓜(NP_001284378.1)、黄瓜(ACO90193.1)的APX蛋白亲缘关系最近,与茄科的番茄(NP_001234782.1)、烟草(AAA86689.1)和辣椒(CAA57140.1)的APX具有相对较近的亲缘关系,与豆科的大豆(NP_001237785.1)、苜蓿(AES88707.1)、豇豆(AAB03844.1)等的APX蛋白亲缘关系相对较远,而与无患子科植物柚(ACM17463.1)和龙眼(ABS50864.1)的APX亲缘关系最远。结果表明,苦瓜McAPX2基因与其它植物的APX具有较高的保守性,这些APX蛋白功能在进行化上保守,推测McAPX2蛋白定位于细胞质中。
2.3 McAPX2在苦瓜不同器官表达
采用实时定量PCR技术分别检测McAPX2在苦瓜开花初期不同组织器官的表达情况,以叶片中相对表达量为1。从图5可见,McAPX2在根、茎、叶、雌花和授粉5 d幼果等器官中的表达量存在极显著的差异。在根、茎、幼果中大量表达,其中根的表达量最大,而在叶片中的表达量最低。
2.4 低温胁迫下McAPX2的表达模式
采用实时定量PCR技术检测在低温胁迫下苦瓜初花期叶片中McAPX2表达情况,以对照处理McAPX2相对表达量为1。结果发现,低温胁迫处理1 h时,苦瓜叶片McAPX2表达量与对照处理McAPX2表达量无显著差异;低温处理3 h时McAPX2表达量有显著的上调趋势;低温处理6 h时,McAPX2表达量是对照处理的16倍;低温处理12 h时McAPX2表达量达到最大,是对照处理表达量的23倍;低温处理24 h时,McAPX2表达量降低,仍比对照处理的表达量高17倍(图6)。
2.5 McAPX2启动子分离与序列分析
将启动子PCR扩增产物克隆到pMD18-T载体上,经酶切鉴定、测序,获得序列片段长为1 276 bp(图7)。结果发现,所获得的序列3′端116 bp序列与McAPX2 cDNA的5′端序列比对一致,表明所得序列为McAPX2基因上游的启动子区域。
使用在线neural network promoter prediction软件预测出转录起始点为T,位于起始密码子上游214 bp处;采用在线软件PlantCare分析,在转录起始位置上游30 bp位置预测到1个TATA-BOX,在上游68 bp位置预测到1个CAAT-BOX。发现该段序列上含有植物激素响应元件,如赤霉素响应元件GARE1OSREP1、赤霉素反应瞬时作用元件PYRIMIDINEBOXOSRAMY1A、脱落酸响应元件ABRE、乙烯响应元件ERELEE4和细胞分裂素响应元件ARR1AT;器官特异表达元件,如根器官特异表达元件ROOTMOTIFTAPOX1、花粉特异表达元件POLLEN1LELAT52;病原菌响应元件,如ASF1MOTIFCAMV、ELRECOREPCRP1、WBOXATNPR1;防御与胁迫响应元件,如DOFCOREZM、WBBOXPCWRKY1;光调控元件BOX4;逆境响应元件,如干旱诱导元件,如MYB1AT、MYB2CONSENSUSAT、MYBCORE,干旱和黑暗响应元件ACGTATERD1,热激盐诱导表达GT1GMSCAM4,低温诱导响应元件LTRE1HVBLT49(图8)。
3 讨论
本试验从苦瓜叶片均一化文库中克隆出1 086 bp的McAPX2全长cDNA序列,该基因编码含有249个氨基酸的完整开放阅读框。保守区分析发现该基因所编码的蛋白属于植物POD超家族,具有过氧化物酶活性位点和亚铁血红素配基结合区等与其他物种APX相同的保守域。在高等植物中APX是编码多基因家族,APX蛋白根据不同细胞定位可划分4种同工酶:叶绿体基质(sAPX)及类囊体膜APX(tAPX),线粒体膜APX(mitAPX)、过氧化物酶体(pAPX)和胞質APX(cAPX)[17]。4种APX同工酶的分子量、亚细胞定位、结构和序列存在差异。McAPX2蛋白分子量为27.43 ku,与拟南芥胞质型AtAPX1/2分子量27.5 ku相当。该蛋白含有7个参与二聚体界面静电作用的保守带电残基,说明McAPX2可能和拟南芥胞质型AtAPX1/2一样以二聚体结构存在[18]。亚细胞定位预测发现该蛋白序列的N-端不含信号肽,表明该蛋白不定位叶绿体或线粒体上,C-端不含跨膜区域,表明不定位在过氧化物酶体上,推测可能定位在细胞质。同源比对发现,该蛋白与同科植物甜瓜(95%),黄瓜(94%)和南瓜(94%)的cAPX有很高的同源性;系统聚类树分析显示,McAPX2与其它27种植物的cAPX具有较高的同源性,说明该基因家族在进化上十分保守。由此可以推断获得的苦瓜McAPX2基因属于APX基因家族的cAPX基因亚族[7]。
目前许多高等植物中不同类型的APX基因被克隆出来,有研究表明,APX基因的表达受各种环境胁迫因子的诱导。APXs,尤其是cAPX更有助于使植物免受氧化应激作用[17]。Park等[19]研究发现,甘薯受伤害胁迫诱导后APX表达量明显上调;Koussevitzky等[20]发现干旱和热激胁迫后拟南芥APX1的mRNA和蛋白质表达量达到最高;王超等[21]发现盐胁迫处理诱导白桦APX基因显著表达;Lu等[22]发现2种水稻cAPXs(OsAPXa和OsAPXb)基因均可以且在不同程度上提高转基因烟草的耐盐性,其中OsAPXb基因对盐胁迫更敏感。曾秀存等[23]发现低温胁迫诱导白菜型冬油菜cAPX基因上调表达,超强抗寒性品种‘陇油7号APX基因表达量高于抗寒性弱的品种‘天油4号;本研究表明低温胁迫下苦瓜McAPX表达量上调,与曾秀存等[23]研究结果相一致;另外,低温胁迫诱导植株体内的APX活性上调在水稻[24],咖啡[25],山楂[26]和辣椒[27]中也得到了证实。然而,有研究表明,低温胁迫可诱导cAPX下调表达,Morita等[28]发现低温处理水稻胞质型OsAPX2的表达量下调;Funatsuki等[29]发现大豆cAPX1缺失突变株比野生型更为耐寒。cAPX基因的表达差异可能与试验材料对低温的敏感程度、试验条件和胁迫强度等相关。对于低温敏感性植物而言,低温胁迫下植物主要遭受氧化胁迫,植株体内APX活性上调,清除过量的H2O2,以利于植物在更低温度或长时间低温下生存。对于特定处理条件下,低温胁迫可诱导cAPX下调表达积累H2O2,H2O2作为低温胁迫信号因子触发诱导下游防御基因的表达,表现出耐寒性[30]。
启动子作为一种顺式作用元件,是研究基因表达调控的重要因素之一。本研究通过染色体步移法从苦瓜果实中分离得到McAPX2基因上游1 276 bp的启动子序列。通过在线软件PLACE和PlantCare分析,该序列具有启动子的普遍特征,在转录起始位置有基因转录必须的与RNA聚合酶结合或互作的保守元件TATA-BOX和CAAT-BOX,含有与GA、ABA、CTK、乙烯等激素和病原菌等生物胁迫以及热激、干旱、低温、光等非生物胁迫的相关元件,这些元件的发现说明McAPX2基因可能在转录水平上受到激素、生物胁迫和非生物胁迫等多种因素的调节。该序列上的低温诱导响应顺式元件LTRE1HVBLT49[31-34]可能与低温胁迫下APX基因的差异表达有着重要关系;3个增强子元件CAATBOX、EECCRCAH1、GATABOX可能与增强启动子驱动下游McAPX2基因的表达相关。同时该序列中发现了器官特异表达元件,说明McAPX2在植物体内的表达可能具有器官特异性。McAPX2启动子各元件的具体功能还有待进一步研究验证。
参考文献
[1] 王国骄, 王嘉宇, 马殿荣, 等. 不同耐冷性杂草稻和栽培稻抗氧化系统对冷水胁迫的响应[J]. 中国农业科学, 2015(8): 1 660-1 668.
[2] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction.[J]. Annual Review of Plant Biology, 2004, 55(1): 728-749.
[3] 王春丽, 梁宗锁. 外源刺激对植物次生代谢的调节及其信号转导途径研究进展[J]. 西北植物学报, 2009, 29(5): 1 055-1 065.
[4] Sharma P, Jha A B, Dubey R S, et al. Reactive Oxygen Species, Oxidative Damage, and Antioxidative Defense Mechanism in Plants under Stressful Conditions[J]. Journal of Botany, 2012:1-26. doi: 10.1155/2012/217037.
[5] 罗 娅, 汤浩茹, 张 勇. 低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J]. 园艺学报, 2007, 34(6): 1 405-1 410.
[6] Pal R S, Bisht M. Antioxidative metabolites and enzymes: an overview[M]// Newer Approaches to Biotechnology, 2013: 595-601.
[7] 李澤琴, 李静晓, 张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J]. 遗传, 2013, 35(1): 45-54.
[8] Karpinski S, Reynolds H, Karpinska B, et al. Systemic signaling and acclimation in response to excess excitation energy in Arabidopsis.[J]. Science, 1999, 284(5414): 654-657.
[9] Yabuta Y, Motoki T, Yoshimura K, et al. Thylakoid membrane-bound ascorbate peroxidase is a limiting factor of antioxidative systems under photo-oxidative stress[J]. Plant Journal, 2003, 32(6): 915-25.
[10] Murgia I, Tarantino D, Vannini C, et al. Arabidopsis thaliana, plants overexpressing thylakoidal ascorbate peroxidase show increased resistance to Paraquat-induced photooxidative stress and to nitric oxide-induced cell death[J]. Plant Journal, 2004, 38(6): 940-953.
[11] Davletova S, Rizhsky L, Liang H, et al. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of Arabidopsis[J]. Plant Cell, 2005, 17(1): 268-281.
[12] Kangasjarvi S, Lepisto A, Hannikainen K, et al. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses[J]. Biochemical Journal, 2008, 412(2): 275-285.
[13] Wu G, Wang G, Ji J, et al. Cloning of a cytosolic ascorbate peroxidase gene from Lycium chinense, Mill. and enhanced salt tolerance by overexpressing in tobacco[J]. Gene, 2014, 543(1): 85-92.
[14] 高 山, 陈桂信, 许端祥, 等. 成熟软化期苦瓜果实均一化全长cDNA文库的构建与EST分析[J].分子植物育种, 2013(2): 211-216.
[15] 高 山, 陈桂信, 许端祥, 等. 苦瓜果实β-半乳糖苷酶基因的克隆、 表达及亚细胞定位[J]. 植物遗传资源学报, 2013, 14(6): 1 124-1 129.
[16] 刘志钦, 杨 晟, 蔡金森, 等. 辣椒CaWRKY5启动子的分离及其调控元件分析[J]. 应用与环境生物学报, 2013(3): 389-394.
[17] Shigeoka S, Ishikawa T, Tamoi M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1 305-1 319.
[18] Dabrowska G, Katai A, Goc A H M, et al. Characteristics of the plant ascorbate peroxidase family[J]. Acta Biologica Cracoviensia, 2007, 49(1): 7-17.
[19] Park S Y, Ryu S H, Jang I C, et al. Molecular cloning of a cytosolic ascorbate peroxidase cDNA from cell cultures of sweet potato and its expression in response to stress[J]. Molecular Genetics & Genomics, 2004, 271(3): 339-346.
[20] Koussevitzky S, Suzuki N, Huntington S, et al. Ascorbate peroxidase 1 plays a key role in the response of Arabidopsis thaliana to stress combination[J]. Journal of Biological Chemistry, 2008, 283(49): 34 197-34 203.
[21] 王 超, 杨传平, 王玉成. 白桦抗坏血酸过氧化物酶(APX)基因克隆及表达分析[J]. 东北林业大学学报, 2009, 37(3): 79-81.
[22] Lu Z Q, Liu D L, Liu S K. Two rice cytosolic ascorbate peroxidases differentially improve salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports, 2007, 26(10): 1 909-1 917.
[23] 曾秀存, 孙万仓, 方 彦, 等. 白菜型冬油菜抗壞血酸过氧化物酶(APX)基因的克隆、 表达及其活性分析[J]. 作物学报, 2013, 39(8): 1 400-1 408.
[24] Oidaira H, Sano S, Koshiba T, et al. Enhancement of antioxidative enzyme activities in chilled rice seedlings[J]. Journal of Plant Physiology, 2000, 156(5-6): 811-813.
[25] Fortunato A S, Lidon F C, Batista-Santos P, et al. Biochemical and molecular characterization of the antioxidative system of Coffea sp. under cold conditions in genotypes with contrasting tolerance[J]. Journal of Plant Physiology, 2009, 167(5): 333-342.
[26] Eltelib H A, Badejo A A, Fujikawa Y, et al. Gene expression of monodehydroascorbate reductase and dehydroascorbate reductase during fruit ripening and in response to environmental stresses in acerola(Malpighia glabra).[J]. Journal of Plant Physiology, 2011, 168(168): 619-627.
[27] Airaki M, Leterrier M, Rosa M, et al. Metabolism of reactive oxygen species and reactive nitrogen species in pepper(Capsicum annuum, L.)plants under low temperature stress[J]. Plant Cell & Environment, 2012, 35(2): 281-295.
[28] Morita S, Nakatani S, Koshiba T, et al. Differential expressions of two cytosolic ascorbate peroxidase and two superoxide dismutase genes in response to abiotic stress in rice[J]. Rice Science, 2011, 18(3): 157-166.
[29] Funatsuki H, Kurosaki H, Murakami T, et al. Deficiency of a cytosolic ascorbate peroxidase associated with chilling tolerance in soybean[J]. Theoretical & Applied Genetics, 2003, 106(3): 494-502.
[30] Prasad T K, Anderson M D, Martin B A, et al. Evidence for Chilling-Induced Oxidative Stress in Maize Seedlings and a Regulatory Role for Hydrogen Peroxide.[J]. Plant Cell, 1994, 6(1): 65-74.
[31] 阴 霞, 陈 雯, 王 磊, 等. 激素和非生物胁迫对月季RhPIP1;1启动子活性的调节作用[J].园艺学报, 2014, 41(1): 107-117.
[32] 徐孟亮, 李落叶, 陈荣军, 等. 一个新的水稻低温应答类糖基转移酶基因(OsCrGtl)的表达分析与克隆[J]. 农业生物技术学报, 2010, 18(4): 663-669.
[33] 张爱华. 西瓜玉米黄质环氧化酶基因及启动子的克隆与分析[D]. 保定: 河北农业大学, 2011.
[34] Md Abdul Kayum, Jong-In Park, Nasar Uddin Ahmed, et al. Alfin-like transcription factor family: characterization and expression profiling against stresses in Brassica oleracea[J]. Acta Physiologiae Plantarum, 2016, 38(5): 1-14.

