对瓜类疫霉菌诱导响应的黄瓜WRKY转录因子筛选研究
徐晓美 王瑞 吴廷全 何晓明 林毓娥


摘 要 以黄瓜感病品种‘B80为材料并通过RT-qPCR技术,针对黄瓜全基因组54个CsWRKYs基因,在瓜类疫霉菌侵染后对其进行表达分析,并在水杨酸(SA)和茉莉酸甲酯(MeJA)处理下对受瓜类疫霉菌诱导(或抑制)基因进行表达检测,分析其可能参与的抗病相关信号通路。研究结果表明:15个CsWRKYs基因(CsWRKY3、11、13、21、22、23、26、31、34、41、44、46、48、52和56)受瓜类疫霉菌诱导上调表达,仅CsWRKY6受瓜类疫霉菌抑制下调表达。在SA和MeJA处理下,7个CsWRKYs基因(CsWRKY26、34、41、46、48、52和56)受SA诱导,CsWRKY44同时受SA和MeJA诱导,CsWRKY6受MeJA抑制下调表达,推测 7个基因(CsWRKY26、34、41、46、48、52和56)可能通过SA介导的信号通路调控植物对病原菌的响应;CsWRKY6可能通过JA介导的信号通路调控植物防御反应过程;CsWRKY44则可能同时参与SA和JA介导的抗病相关信号通路。
关键词 黄瓜;WRKY转录因子;疫病;表达分析
中图分类号 S642.2 文献标识码 A
Screening of CsWRKYs Involved in Phytophthora Blight
Resistance in Cucumber(Cucumis sativus)
XU Xiaomei1,2, WANG Rui1,2, WU Tingquan1,2, HE Xiaoming1,2, LIN Yu′e1 *
1 Vegetable Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou, Guangdong 510640, China
2 Guangdong Key Lab for New Technology Research of Vegetables, Guangzhou, Guangdong 510640, China
Abstract By RT-qPCR technology, the expression patterns of 54 CsWRKYs in Phytophthora melonis(P. melonis)-susceptible cucumber cultivar‘B80were analyzed after inoculation with P. melonis and then P. melonis-induced(suppressed)CsWRKYs were analyzed under the treatment of salicylic acid(SA)and methyl jasmonate(MeJA)to investigate their signaling pathways. The results in this study showed that fifteen CsWRKYs(CsWRKY3, 11, 13, 21, 22, 23, 26, 31, 34, 41, 44, 46, 48, 52 and 56)were strongly induced and only CsWRKY6 suppressed by P. melonis. Among them, seven CsWRKYs(CsWRKY26, 34, 41, 46, 48, 52 and 56)were SA-inducible and up-regulated while CsWRKY6 was down-regulated after treatment of MeJA. CsWRKY44 was commonly up-regulated by both SA and MeJA. Based on the results above, we predicted CsWRKY26, 34, 41, 46, 48, 52 and 56 might be involved in Phytophthora blight resistance in cucumber by SA and(or)JA signaling pathway(s).
Key words Cucumber(Cucumis sativus); WRKY transcription factor; Phytophthora blight; Expression analysis
doi 10.3969/j.issn.1000-2561.2016.02.026
黄瓜是一种重要的蔬菜作物,华南地区受高温高湿气候条件的影响,黄瓜疫病病害严重,但由于高抗疫病材料匮乏,黄瓜抗疫病育种进展缓慢,国内外有关黄瓜疫病抗性遗传的研究也少有报道,谢大森等[1]认为开展以生物技术为主要手段的抗性转育研究是当前瓜类疫病抗性育种中的重点。
WRKY转录因子起源于早期真核生物并在高等植物中广泛存在,是植物中最大转录因子家族之一[2],因含有保守的WRKY结构域而得名,该结构域由约60个氨基酸组成,靠近氨基(N)末端的7个保守氨基酸残基WRKYGQK是该结构域的核心序列[3]。WRKY转录因子家族是个庞大的基因家族。目前,水稻中已鉴定了至少有109个WRKY成员[4],拟南芥74个[5],玉米136个[6],大豆133个[7],大白菜145个[8]。最早鉴定的WRKY转录因子SPF1存在于甘薯中,其生物学功能是调控糖信号途径的建立[9]。随后大量研究表明WRKY转录因子在植物对生物和非生物胁迫防御反应中发挥至关重要的调控作用,同时也参与植物花粉发育[10]、种子成熟和萌发[11]、植株叶片衰老[12]等生理过程。在植物应对生物胁迫反应中,WRKY转录因子基因主要参与了植物从基础免疫到获得抗性的多种抗病反应过程,通过调控多通路多层次的抗病信号转导途径影响植物对病原物的生理反应,在植物与病毒、细菌、真菌、线虫以及昆虫的相互作用过程中发挥重要作用[13]。Dong等[14]对72个拟南芥WRKY基因的表达谱进行分析,发现其中有49个基因受含无毒基因的病原菌或SA的诱导。在水稻中,45个被检测的WRKY基因中有15个受稻瘟菌诱导后显著表达上调,并且其中12个同时受白叶枯病菌不同程度诱导表达,信号通路检测发现,OsWRKY45和OsWRKY62受SA诱导表达上调;OsWRKY10、OsWRKY82和OsWRKY85受JA诱导上调;OsWRKY30和OsWRKY83同时响应SA和JA上调表达[15]。除拟南芥和水稻等模式植物外,随后的研究发现在棉花[16]、油菜[17]、大麦[18]等大宗作物和辣椒[19-20]、大白菜[8]等蔬菜作物中均有发现WRKY转录因子响应病原菌诱导反应。
随着黄瓜基因组测序的完成,Ling等[21]对黄瓜基因组进行搜寻后找到55个CsWRKY转录因子基因,并对55个基因在冷、旱和高盐胁迫下进行表达分析。目前,国内外尚未见WRKY转录因子参与黄瓜抗病反应的报道,本研究利用RT-qPCR技术,旨在对黄瓜CsWRKYs基因在瓜类疫霉菌处理下进行表达分析,筛选出抗病相关CsWRKYs基因并分析其可能参与的抗病相关信号通路,为研究CsWRKYs参与黄瓜疫病防御反应的分子功能奠定基础。
1 材料与方法
1.1 材料
供试植物材料为华北型黄瓜品种‘B80(感病材料),该材料为本实验室经多年选育获得的高代自交系。供试瓜类疫霉菌株为HNG5,为本实验室从广东省广州市白云实验基地黄瓜病株上分离并纯化获得。
1.2 方法
1.2.1 植物培养和接菌处理 植物材料种植:供试材料‘B80均在育苗杯中育苗,种植10杯,每杯播种5~6颗种子,置于人工气候箱(RTOP-1000Y)培养。培养条件为:28 ℃ 10 h光照和24 ℃ 14 h黑暗交替,湿度为85%。10 d苗期的黄瓜幼苗将用于接菌处理。
瓜类疫霉菌培养及诱孢:将分离保存的HNG5疫霉菌切一小块放于V8固体培养基(200 mL V8 果蔬汁,3.0 g CaCO3,20 g琼脂,800 mL无菌水,调pH值至6.3)并置于25 ℃黑暗环境下培养4 d,后将菌斑切成0.5 cm见方的小块,置于灭菌的三角瓶或组培瓶中(10个小块/瓶),加V8液体培养基至液面稍低于菌斑的高度,并每隔12 h换一次灭菌水,换水3 d即可诱孢:将培养瓶放于4 ℃冰箱15 min,后室温放30 min,即有大量孢子产生。用血球计数板计数游动孢子数量,调节至游动孢子浓度为5×103个/mL用于灌根接种黄瓜幼苗。
接种处理:接种前12 h将待接种幼苗浇透水,用量筒量取50 mL孢子悬浮液,小心灌入育苗杯内,同时以蒸馏水处理作对照,分别在处理后0、24、48和72 h 取幼苗根茎部固定于液氮中,置于-80 ℃冰箱中保存备用。
1.2.2 SA和MeJA处理 供试植株‘B80培养同上,在二叶一心幼苗期分别以5 mmol/L的SA和100 μmol/L的MeJA溶液(均溶解于10%的乙醇溶液中)喷洒幼苗叶片,以喷洒10%浓度的乙醇溶液为对照,分别在喷洒后0、12和24 h取植株根部以上部分固定于液氮中,置于-80 ℃冰箱中保存备用。
1.2.3 RNA提取和反转录 取-80 ℃冰箱中保存的单株样品,利用RNAiso Plus(Takara)提取其总mRNA,对mRNA样品进行DNaseⅠ处理(37 ℃,30 min)后以1%琼脂糖凝胶电泳检测并用NanoDrop 2000测定其浓度,确定mRNA质量合格后用于反转录反应。按照荧光定量PCR(RT-qPCR)专用反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser,Takara)操作说明合成第1链cDNA,稀释10倍后用作RT-qPCR反应模板。
1.2.4 引物设计和RT-qPCR基因表达分析 根据Ling等[21]提供的黄瓜WRKY基因注释号在黄瓜基因组数据库(http://cucumber.genomics.org.cn/page/cucumber/index.jsp)查找基因序列,按照RT-qPCR引物设计要求,利用引物设计软件Primer Premier 6.0设计引物并交由上海生工合成,引物经过检测合格后用于后续RT-qPCR反应。
RT-qPCR的操作均参照荧光定量试剂盒说明书(SYBRR Premix Ex TaqTMⅡ,Takara)进行,略有改动。反应体系10 μL:SYBRR Premix Ex TaqTMⅡ(2×)5 μL,上游和下游引物各1 μL,cDNA模板2.5 μL,无菌水0.5 μL,每个样品设3次重复。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s,40个循环。内参基因为Cs-UBQ,RT-qPCR反应均在BIO-RAD CFX96(Bio-Rad,USA)荧光定量PCR仪上进行。
1.3 数据处理和分析
RT-qPCR数据采用Microsoft Office Excel 2007进行整理分析,ct值>33.0时认为数据不可靠,不予进行后续计算和分析,基因相对表达量的计算方法采用2-△Ct法[22]。接菌处理下基因上调(下调)表达倍数计算方法:Ft=(Pt-P0)/P0-(Wt-W0)/W0。Ft表示接菌处理后某时间点基因上调或下调表达倍数,即分别指24、48和72 h的3个时间点;Pt表示接菌处理后某时间点基因相对表达量;P0表示接菌处理后0 h基因相对表达量;Wt表示对照处理,即水处理后某时间点基因相对表达量;W0表示对照处理后0 h基因相对表达量,本研究中P0=W0。∣Ft∣≥2时,该基因被认为受瓜类疫霉诱导(抑制)。SA(MeJA)处理下基因上调(下调)表达倍数计算方法同前,时间点为处理后12和24 h,时间较短,因此,∣Ft∣≥1时,该基因被认为受该外源激素诱导(抑制)。
2 结果与分析
2.1 RT-qPCR引物设计及筛选
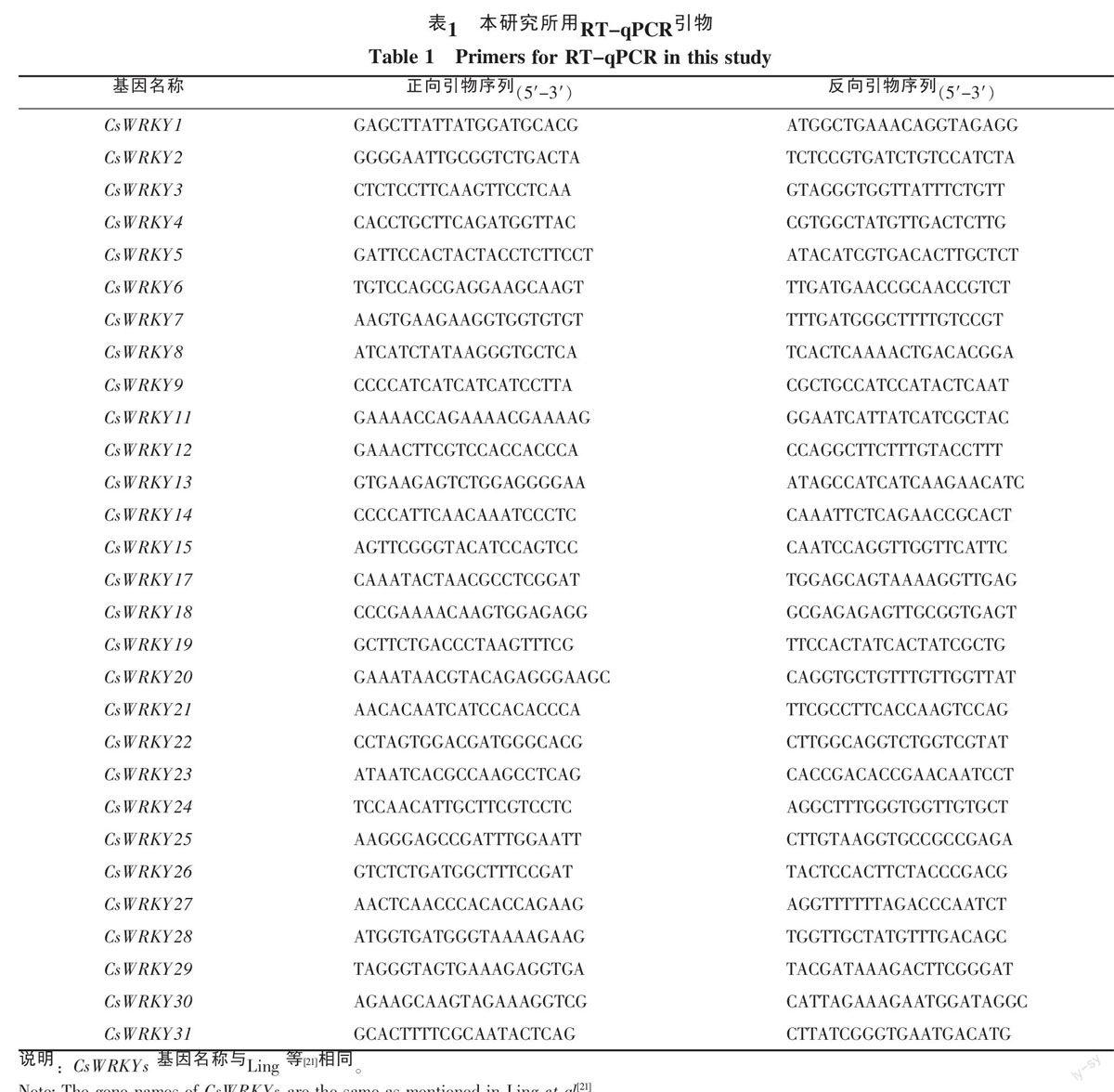
本研究针对黄瓜全基因组55个CsWRKYs进行引物设计合成,每对引物均通过RT-qPCR反应检测引物特异性、扩增效率和是否存在引物二聚体,经过多次设计、筛选后,除CsWRKY55以外,其它54个CsWRKYs均筛选到适用于RT-qPCR的引物(表1)。
2.2 瓜类疫霉处理下CsWRKYs基因表达分析
本研究对黄瓜全基因组54个CsWRKYs基因在瓜类疫霉处理后0、24、48和72 h进行表达分析。内参基因CsUBQ在瓜类疫霉处理后0、24、48和72 h样品中的ct值范围分别为19.37~21.42、19.97~22.55、18.71~21.39和18.40~22.70,在此条件下,待检测CsWRKYs的ct值>33.0,则该CsRKYs基因被认为表达量极低,数据不可靠,不参与后续分析。
CsWRKYs基因表达分析结果表明:黄瓜CsWRKYs基因表达水平普遍较低,在被检测样品中均低于内参基因CsUBQ的表达水平,其中8个CsWRKYs基因(CsWRKY9、20、28、30、35、36、38和39)表达水平极低,在个别样品中检测到ct>33.0,不予进行后续分析。剩余46个CsWRKYs基因数据处理分析结果显示如图1:有15个CsWRKYs基因(CsWRKY3、11、13、21、22、23、26、31、34、41、44、46、48、52和56)受瓜类疫霉菌诱导,表现出现2倍以上的上调表达,受诱导最强基因为CsWRKY44,上调表达量高达361倍。另外,CsWRKY13、26 、41和56受疫霉菌诱导也较强,基因上调表达量均在10倍以上。在15个受诱导表达基因中,11个基因(CsWRKY11、13、22、26、34、41、44、46、48、52和56)在接菌处理后72 h表达量达到最高;3个基因(CsWRKY21、23和31)在接菌处理后48 h表达量达到最高;只有1个基因(CsWRKY3)在接菌处理后24 h表达量达到最高。46个基因中只有CsWRKY6受瓜类疫霉菌抑制,在接菌处理后72 h基因下调表达量达3.2倍。
2.3 SA和MeJA处理下CsWRKYs基因表达分析
在接种瓜类疫霉处理后发现,被检测的46个CsWRKYs基因中有16个受瓜类疫霉诱导表达,同时发现有1个CsWRKYs基因表达受到抑制,推测这16个CsWRKYs基因有可能参与黄瓜抗疫病反应。为检测其抗病相关信号通路,本研究在外源激素SA处理下分别对这16个基因进行表达分析,结果如图2-A所示:16个基因中除CsWRKY6表达下调外,其它15个基因的表达量均有不同程度上调,且12个基因(CsWRKY3、11、13、CsWRKY21、22、23、26、31、34、41、44和46)均在SA处理后12 h表达量达到最高,随后有下降趋势,另外3个基因(CsWRKY48、52和56)在SA处理后表达逐渐上调,在24 h达到最高。15个表达上调基因中有8个CsWRKYs基因(CsWRKY26、34、41、44、46、48、52和56)上调表达量达1倍以上,其中CsWRKY44上调表达量最高,达9倍有余,这8个基因被认为极有可能与黄瓜抗疫病相关,并参与SA介导的抗病相关信号通路。本研究同时在外源激素MeJA处理下分别对这16个基因进行表达分析,如图2-B所示:在MeJA处理下,16个基因中只有CsWRKY6的下调表达量和CsWRKY44的上调表达量达1倍以上,部分基因(如CsWRKY3、13和21等)的表达量呈现小幅上调或下调,还有另一部分基因(如CsWRKY11、22和23)的表达量几乎不变。综上研究结果推测:16个受瓜类疫霉菌诱导(抑制)的基因中,9个基因(CsWRKY6、26、34、41、46、44、48、52和56)极有可能与黄瓜抗疫病相关,其中,7个基因(CsWRKY26、34、41、46、48、52和56)有可能通过SA介导的抗病相关信号通路调控植物对病原菌的响应;CsWRKY6可能通过JA介导的信号通路调控植物防御反应过程;CsWRKY44则可能同时参与SA和JA介导的抗病相关信号通路。
3 讨论与结论
Ling等[21]研究证实,在黄瓜中有23个CsWRKYs基因对冷、旱和高盐至少一种胁迫有响应,表现为胁迫处理后基因表达量呈显著差异,且该研究表明,在应对非生物胁迫时,黄瓜和拟南芥中同源WRKY转录因子基因的反应存在相关性。本研究筛选出15个受瓜类疫霉诱导和1个受瓜类疫霉抑制的CsWRKYs基因,其中7个基因(CsWRKY21、26、31、34、41、46和48)在拟南芥中均存在其同源基因[21]。已有的研究报道中,CsWRKY34的同源基因,即AtWRKY70,是RPP4介导抗性和对霜霉病菌基础性抗性的重要成员,在霜霉病菌诱导的抗性防御途径中调控活性氧中间体的产生和SA的积累[23]。CsWRKY46的同源基因AtWRKY8,受马铃薯晚疫病菌诱导,同时通过SA途径负调控对丁香假单胞菌的基础抗性并通过JA途径正调控对灰葡萄孢菌的抗性[24]。本研究推测,在应对生物胁迫反应中,黄瓜和拟南芥中同源WRKY转录因子基因也可能存在功能相关性。
WRKY是最重要的受病原体和SA诱导的转录因子基因,在调节水杨酸依赖基因的表达过程中发挥重要作用。Dong等[14]对72个拟南芥WRKY转录因子基因进行表达谱分析,发现其中有49个基因受含无毒基因的病原菌或SA诱导。本研究中,54个被检测的黄瓜CsWRKYs基因中有15个基因受瓜类疫霉菌诱导上调表达,其中8个基因同时受SA诱导,该结果与前人的认识较为一致。
SA和JA是2种常见的介导植物抗病反应的信号分子,前人研究表明,SA和JA介导的植物抗病反应途径并非相互独立,通常认为,两者是相互拮抗的[25]。拟南芥中,AtWRKY62基因受SA诱导,同时在抑制JA反应中发挥作用,Atwrky62突变体中JA响应基因表达增强,而AtWRKY62过量表达时JA响应基因的表达量降低[26]。水稻中,过量表达OsWRKY13能提高水稻对白叶枯病菌和稻瘟病菌的抗性,该过程是通过激活SA的生物合成和SA响应基因同时抑制JA信号途径来调控[27-28]。除此以外,两者之间的协同作用也有报道。在水稻中,OsWRKY30和OsWRKY83均受SA和JA诱导上调表达[15,29]。本研究中,CsWRKY44同时受SA和MeJA诱导上调表达,暗示CsWRKY44可能同时参与SA和JA介导的防御反应信号通路,处于2条通路的节点上。然而,防御反应调控是一个复杂过程,CsWRKY44是否真正协同调控SA和JA介导的信号通路还有待进一步研究。
参考文献
[1] 谢大森, 赵 芹, 何晓明, 等. 瓜类疫病研究进展[J]. 热带作物学报, 2010, 31(3): 503-507.
[2] Zhang Y, Wang L. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants[J]. BMC Evol Biol, 2005(5): 1.
[3] Maeo K, Hayashi S, Kojima-Suzuki H, et al. Role of conserved residues of the WRKY domain in the DNA-binding of tobacco WRKY family proteins[J]. Biosci Biotechnol Biochem, 2001, 65(11): 2 428-2 436.
[4] Ramamoorthy R, Jiang S Y, Kumar N, et al. A comprehensive transcriptional profiling of the WRKY gene family in rice under various abiotic and phytohormone treatments[J]. Plant Cell Physiol, 2008, 49(6): 865-879.
[5] Eulgem T, Rushton P J, Robatzek S, et al. The WRKY superfamily of plant transcription factors[J]. Trends Plant Sci, 2000, 5(5): 199-206.
[6] Wei K F, Chen J, Chen Y F, et al. Molecular phylogenetic and expression analysis of the complete WRKY transcription factor family in maize[J]. DNA Res, 2012, 19(2): 153-164.
[7] Yin G, Xu H, Xiao S, et al. The large soybean(Glycine max)WRKY TF family expanded by segmental duplication events and subsequent divergent selection among subgroups[J]. BMC Plant Biol, 2013(13): 148.
[8] Tang J, Wang F, Hou X L, et al. Genome-wide fractionation and identification of WRKY transcription factors in Chinese cabbage(Brassica rapa ssp. pekinensis)reveals collinearity and their expression patterns under abiotic and biotic stresses[J]. Plant Mol Biol Rep, 2014, 32(4): 781-795.
[9] Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J]. Mol Gen Genet, 1994, 244(6): 563-571.
[10] Zou C, Jiang W, Yu D. Male gametophyte-specific WRKY34 transcription factor mediates cold sensitivity of mature pollen in Arabidopsis[J]. J Exp Bot. 2010, 61(14): 3 901-3 914.
[11] Kang X, Li W, Zhou Y, et al. A WRKY transcription factor recruits the SYG1-like protein SHB1 to activate gene expression and seed cavity enlargement[J]. PLoS Genet, 2013, 9(3): e1 003 347.
[12] Jiang Y, Liang G, Yang S, et al. Arabidopsis WRKY57 functions as a node of convergence for jasmonic acid-and auxin-mediated signaling in jasmonic acid-induced leaf senescence[J]. Plant Cell, 2014, 26(1): 230-245.
[13] Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling[J]. Curr Opin Plant Biol, 2007, 10(4): 366-371.
[14] Dong J, Chen C, Chen Z. Expression profiles of the Arabidopsis WRKY gene superfamily during plant defense response[J]. Plant Mol Biol, 2003, 51(1): 21-37.
[15] Ryu H S, Han M, Lee S K, et al. A comprehensive expression analysis of the WRKY gene superfamily in rice plants during defense response[J]. Plant Cell Rep, 2006, 25(8): 836-847.
[16] Shi W, Hao L, Li J, et al. The Gossypium hirsutum WRKY gene GhWRKY39-1 promotes pathogen infection defense responses and mediates salt stress tolerance in transgenic Nicotiana benthamiana[J]. Plant Cell Rep, 2014, 33(3): 483-498.
[17] Wang Z, Fang H, Chen Y, et al. Overexpression of BnWRKY33 in oilseed rape enhances resistance to Sclerotinia sclerotiorum[J]. Mol Plant Pathol, 2014, 15(7): 677-689.
[18] Meng Y, Wise R P. HvWRKY10, HvWRKY19, and HvWRKY28 regulate Mla-triggered immunity and basal defense to barley powdery mildew[J]. Mol Plant Microbe Interact, 2012, 25(11): 1 492-1 505.
[19] Dang F F, Wang Y N, Yu L, et al. CaWRKY40, a WRKY protein of pepper, plays an important role in the regulation of tolerance to heat stress and resistance to Ralstonia solanacearum infection[J]. Plant Cell Environ, 2013, 36(4): 757-774.
[20] Dang F, Wang Y, She J, et al. Overexpression of CaWRKY27, a subgroup IIe WRKY transcription factor of Capsicum annuum, positively regulates tobacco resistance to Ralstonia solanacearum infection[J]. Physiologia plantarum, 2014, 150(3): 397-411.
[21] Ling J, Jiang W, Zhang Y, et al. Genome-wide analysis of WRKY gene family in Cucumis sativus[J]. BMC Genomics, 2011, 12(S2): 471.
[22] Wang Y, Nishimura M T, Zhao T, et al. ATG2, an autophagy-related protein, negatively affects powdery mildew resistance and mildew-induced cell death in Arabidopsis[J]. The Plant Journal, 2011, 68(1): 74-87.
[23] Knoth C, Ringler J, Dangl J L, et al. Arabidopsis WRKY70 is required for full RPP4-mediated disease resistance and basal defense against Hyaloperonospora parasitica[J]. Mol Plant Microbe In, 2007, 20(2): 120-128.
[24] Chen L, Zhang L, Yu D. Wounding-induced WRKY8 is involved in basal defense in Arabidopsis[J]. Mol Plant Microbe In, 2010, 23(5): 558-565.
[25] Mur L A, Kenton P, Atzorn R, et al. The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy, antagonism, and oxidative stress leading to cell death[J]. Plant Physiology, 2006, 140(1): 249-262.
[26] Mao P, Duan M, Wei C, et al. WRKY62 transcription factor acts downstream of cytosolic NPR1 and negatively regulates jasmonate-responsive gene expression[J]. Plant and Cell Physiology, 2007, 48(6): 833-842.
[27] Qiu D, Xiao J, Ding X, et al. OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling[J]. Molecular Plant-Microbe Interactions, 2007, 20(5): 492-499.
[28] Qiu D, Xiao J, Xie W, et al. Rice gene network inferred from expression profiling of plants overexpressing OsWRKY13, a positive regulator of disease resistance[J]. Molecular Plant, 2008, 1(3): 538-551.
[29] 彭喜旭, 胡耀军, 唐新科, 等. 茉莉酸和真菌病原诱导的水稻 WRKY30转录因子基因的分离及表达特征[J]. 中国农业科学, 2011, 44(12): 2 454-2 461.

