西瓜鸟氨酸氨甲酰转移酶粗提条件优化及特性分析
牛美丽 贺滉 党选民 詹园凤


摘 要 以西瓜叶片为材料,通过正交试验对影响西瓜OCT酶提取的缓冲液pH值、料液比、提取时间3个因素进行研究,优化提取条件。结果表明,西瓜鸟氨酸氨甲酰转移酶粗提的最佳条件为缓冲液pH8.5、料液比1 ∶ 5、提取时间4 h。酶学特性的结果表明:该酶的最适温度为30 ℃,最适pH为8.0,最适条件下鸟氨酸和氨甲酰磷酸的Km值分别为8.34、3.73 mmol/L,Vmax分别为0.22、0.32 μmol/(mL·min)。金属离子Ca2+、Mg2+和Mn2+对该酶活力有激活作用,而Fe3+和Cu2+对该酶活力起抑制作用。西瓜OCT酶提取条件的优化提高了该酶粗提的效果,为进一步纯化该酶奠定基础;对该酶特性的研究有利于对西瓜瓜氨酸合成代谢及抗逆调控作用机理的研究。
关键词 西瓜;鸟氨酸氨甲酰转移酶;条件优化;正交试验;酶学特性
中图分类号 Q946 文献标识码 A
Optimization on the Extraction Conditions and Properties of
Ornithine Carbamoyltransferase from Watermelon
NIU Meili1, HE Huang2 *, DANG Xuanmin2 *, ZHAN Yuanfeng2
1 College of Agriculture, Hainan University, Haikou, Hainan 570228, China
2 Tropical Crops Genetic Resources Institute, CATAS, Danzhou, Hainan 571737, China
Abstract Taking the watermelon leaves as the test materials, the pH of the extraction buffer solution, solid-liquid ratio, and extraction time were selected for orthogonal experiment to optimize the extraction process. The optimum conditions for the extraction of ornithine carbamoyltransferase from watermelon were pH8.5, solid-liquid ratio 1 ∶ 5, extraction time 4 h. Enzymatic characterization demonstrated that its optimum temperature and pH was 30 ℃ and 8.0, the Km for ornithine and carbamoyl phosphate value was 8.34 and 3.73 mmol/L, Vmax was 0.22 and 0.32 μmol/(mL·min), respectively. Metal ions Ca2+, Mg2+ and Mn2+ promoted the enzyme activity, whereas Fe3+ and Cu2+ could inhibit its activity. The optimization on the extraction conditions of crude enzyme of watermelon OCT greatly improved the effect of the crude extraction, and laid the foundation for further purification of the enzyme. The features of the enzyme would be good for the study of watermelon citrulline synthetic metabolism and mechanism of resilience regulation.
Key words Watermelon; Ornithinecarbamoyltransferase; Optimization; Orthogonal experiment; Protease activity
doi 10.3969/j.issn.1000-2561.2016.02.018
西瓜作为备受广大消费者青睐的水果之一,含有大量葡萄糖、苹果酸、果糖、氨基酸、番茄素及丰富的维生素C等物质,是一种纯净、安全、富有营养的食品。瓜氨酸是西瓜重要的功能性成分之一,是一种非必需氨基酸,因其由西瓜中首次提取获得而得名[1]。瓜氨酸不仅能促进血液循环,保护心血管,还可以作为抗衰老、提高免疫力的保健品和女性护肤品[2-5]。此外,瓜氨酸还是一种有效的羟基自由基清除剂和尿素循环中间体,在西瓜抗逆如抗旱、耐盐等代谢调控中发挥了非常重要的作用[6-9]。
鸟氨酸氨甲酰转移酶(OCTase/OCT,EC 2.1.3.3)是瓜氨酸合成代谢中的一个关键酶,它广泛存在于动植物与微生物中。在植物中,OCT是瓜氨酸合成代谢的一个关键酶,同时也是植物尿素代谢途径中的第一个酶,通过催化鸟氨酸和氨甲酰磷酸反应合成瓜氨酸和磷酸盐[10]。OCT在植物中最早是由Kleczkowski等[11]从豌豆苗中提取获得,纯化倍数约2 000倍,回收率达32%。1977年Glenn等[12]从甘蔗线粒体中提取出了OCT。此后,研究者们先后从葡萄[13]、胡萝卜[14]、狭刀豆[15]、菜豆[16]等植物中提取得到OCT,并对其特性进行了研究,但是未见对西瓜OCT的研究。本研究通过对西瓜OCT粗提条件的优化及酶学特性的研究,旨在为进一步纯化及更深入地研究酶的相关特性奠定基础,同时也有助于对OCT在瓜氨酸循环及植物抗逆中的作用机理的研究。
1 材料与方法
1.1 材料与仪器
材料:西瓜品种‘美月,来自于中国热带农业科学院热带作物品种资源研究所。
试剂:Tris-HCl缓冲液,L-鸟氨酸,氨甲酰磷酸盐(CP),三氯乙酸(TCA),安替比林,硫酸,磷酸,硫酸铁,二乙酰一肟,乙酸,异丙醇,考马斯亮蓝G250,L-瓜氨酸,盐酸,氢氧化钠,硫酸镁,氯化锰,硫酸铜,氯化钙。
仪器:PHSJ--4A型实验室pH计(上海),Z326K高速冷冻型离心机(德国),BLH-420电热恒温三用水箱(上海),Ultropec-2100pro紫外分光光度计(美国)。
1.2 方法
1.2.1 OCT酶的粗提取 称取新鲜西瓜叶片6 g,放入研钵中,加入适量Tris-HCl缓冲液冰浴研磨成匀浆,在4 ℃条件下静置一段时间,然后于4 ℃,10 000 r/min离心20 min,得到上清液即为酶粗提液。先采用对比试验对影响OTC酶粗提的缓冲液pH值、料液比以及提取时间进行筛选,pH值分别调整为7.5、8.0、8.5、9.0,料液比(m/V)分别为1 ∶ 3、1 ∶ 4、1 ∶ 5、1 ∶ 6,提取时间分别为1、2、3、4 h,然后采用正交试验确定最佳提取条件。
1.2.2 OCT酶活力的测定 酶活力测定方法参考文献[17-18],并加以改进。
测定管:取酶液0.1 mL,加入0.1 mol/L Tris-HCl缓冲液0.5 mL及10 mmol/L CP 0.2 mL,37 ℃水浴中预热2 min,再加入10 mmol/L鸟氨酸0.2 mL,混匀后于37 ℃水浴中准确保温15 min,最后加入10% TCA 1.0 mL终止反应。
对照管:取酶液0.1 mL,加入0.1 mol/L Tris-HCl缓冲液0.5 mL,10 mmol/L CP 0.2 mL以及10% TCA 1.0 mL,37 ℃水浴中预热2 min,再加入10 mmol/L鸟氨酸0.2 mL,混匀后于37 ℃水浴中准确保温15 min。将测定管与对照管分别离心取上清液,再分别加入安替比林-酸溶液1.0 mL、二乙酰一肟-异丙醇0.5 mL,于沸水浴中煮沸15 min后取出,冷却至室温后于波长460 nm下测定其光吸收值。
酶活力单位定义为1 mL酶液在37.0 ℃和pH8.5的条件下,1 min催化产生1 μmol瓜氨酸为1个酶活力单位,用U表示。
1.2.3 OCT酶的酶学特性 ①酶促反应的最适温度:取提取的酶液50 μL,加入pH为8.5的0.1 mol/L Tris-HCl缓冲液250 μL,分别放置于25、30、35、40、45、50 ℃温度下保温10 min,测定其酶活力。以酶活力(U)为纵坐标,温度(℃)为横坐标作图。重复3次实验。
②酶促反应的最适pH:取提取的酶液50 μL,分别加入pH为7.0、7.5、8.0、8.5、9.0、9.5的0.1 mol/L Tris-HCl缓冲液250 μL,根据①节的实验结果,在最适反应温度条件下保温测定其酶活力。以酶活力(U)为纵坐标,pH为横坐标作图。重复3次实验。
③酶促反应的Km与Vmax值的测定:a.以鸟氨酸为底物的酶促反应的Km与Vmax值的测定。取提取的酶液50 μL,加入 0.1 mol/L Tris-HCl缓冲液(最适pH)250 μL,分别加入浓度为2、4、6、8、10 mmol/mL的鸟氨酸,根据①节的实验结果,在最适反应温度条件下测定其酶活力。以底物鸟氨酸的浓度[S]为横坐标,鸟氨酸的浓度与反应速率的比值[S]/V为纵坐标作图,测定Km及Vmax值。重复3次实验。
b.以CP为底物的酶促反应的Km与Vmax值的测定。取提取的酶液50 μL,加入0.1 mol/L Tris-HCl缓冲液(最适pH)250 μL,分别加入浓度为2、4、6、8、10 mmol/mL的CP,根据①节的实验结果,在最适反应温度条件下测定其酶活力。以底物CP的浓度[S]为横坐标,CP的浓度与反应速率的比值[S]/V为纵坐标作图,测定Km值及Vmax值。重复3次实验。
④金属离子对酶活力的影响:取提取的酶液50 μL与 25 μL(浓度为5 mmol/L)不同的金属离子Ca2+、Mg2+、Fe3+、Cu2+、Mn2+混合,再加入0.1 mol/L的Tris-HCl缓冲液(最适pH)稀释到终体积为0.3 mL,根据①节的实验结果,在最适反应温度条件下测定其酶活性。以不加金属离子的酶液的酶活力为对照定义为100%,分别计算加入不同金属离子后酶活力与对照酶活力的相对百分比。重复3次实验。
1.3 数据处理
采用Excel 2007与SAS软件进行数据处理分析。
2 结果与分析
2.1 酶的粗提取
2.1.1 不同缓冲液pH值对OCT酶活力的影响
随着缓冲液pH值的不断升高,酶活力呈现先增加后减少的趋势,在pH7.5~8.5的范围内,酶活力先急剧后缓慢的升高,在pH8.5达到最大值,之后开始下降(图1)。因此选取pH为8.5的Tris-HCl缓冲液比较适宜。
2.1.2 料液比对OCT酶活力的影响 在其他因素都确定的情况下,料液比较低时,溶液较粘稠,影响酶的提取效果;料液比较高时,酶活力会下降。因此通过确定最佳料液比,得到的酶量和酶活力都相对较高[19]。本试验分别选取料液比为1 ∶ 3、1 ∶ 4、1 ∶ 5、1 ∶ 6,缓冲液pH为8.5,提取3 h,测定酶活力。试验结果表明,随着料液比的降低,酶活力逐渐升高,料液比为1 ∶ 5时达到最大值,然后酶活力开始下降(图2)。因此,选取料液比为1 ∶ 5比较适宜。
2.1.3 提取时间对OCT酶活力的影响 从植物组织中提取蛋白酶,提取效果与提取溶剂和提取时间有关。提取时间过短,酶不能充分溶解到提取溶剂中;时间过长,会降低酶活力[20]。在缓冲液pH为8.5、料液比为1 ∶ 5的条件下,不同提取时间对酶活力影响的测定结果如图3。在1~3 h内,随着提取时间的延长,酶活力随之不断升高,提取时间超过3 h后,酶活力有所下降。故确定提取时间为3 h。
2.2 正交试验优化酶粗液的提取工艺
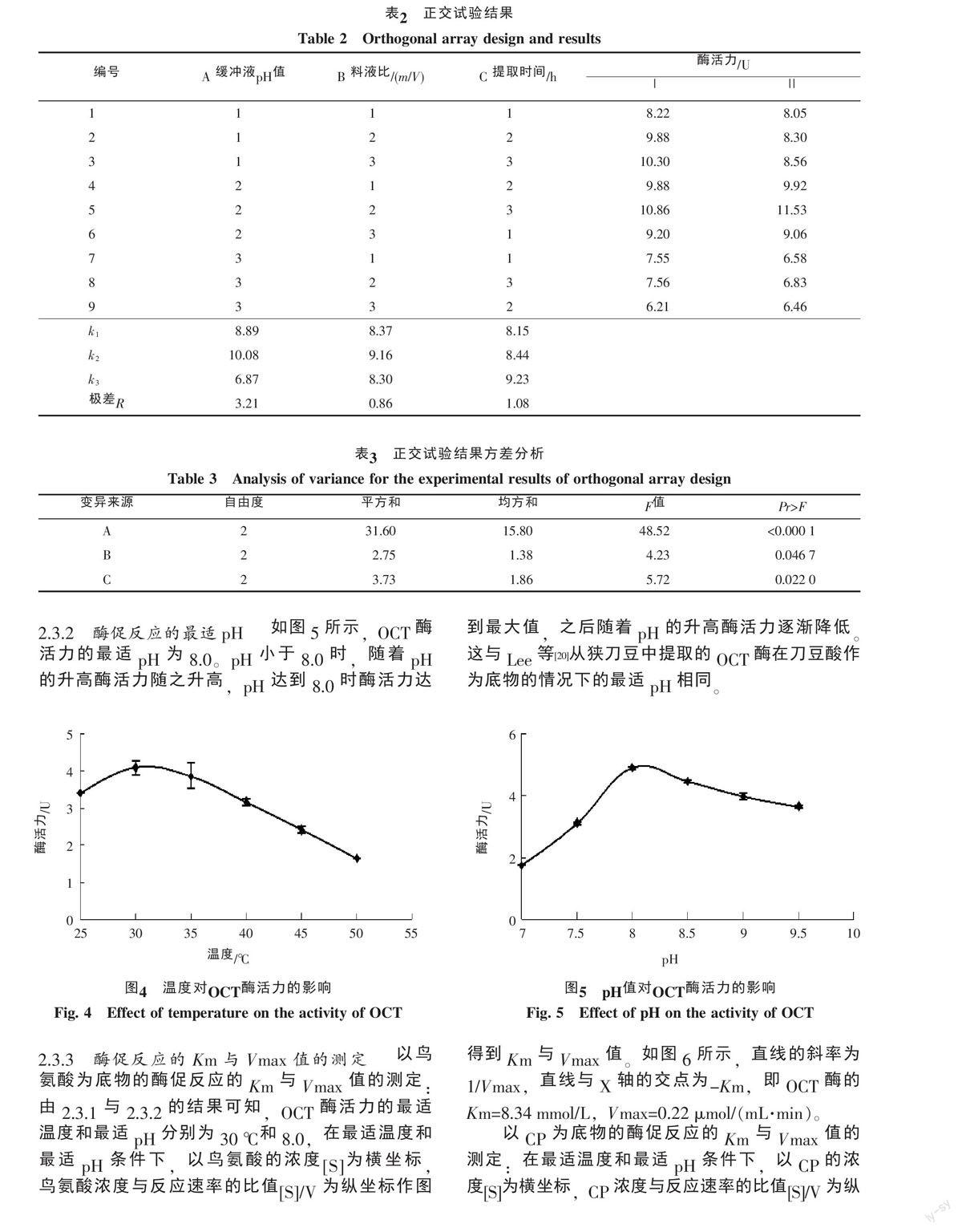
在单因素试验基础上,采用正交试验优化粗酶液提取的条件,以缓冲液的pH,料液比以及提取时间为试验因素,设计3因素3水平的正交试验(表1),以酶的活力为判断指标,并利用SAS软件对正交试验结果进行方差分析(表2和表3)。由表2正交试验的极差分析结果可知,影响西瓜OCT酶活力的因素顺序为A>C>B,即缓冲液pH值对西瓜OCT酶活力的影响最显著,其次是提取时间,最后是料液比。综合考虑试验的提取效果,选择最优水平组合为A2B2C3,即西瓜OCT粗提取的最佳条件:Tris-HCl缓冲液的pH为8.5,料液比1 ∶ 5,提取时间为4 h。这与表3的方差分析结果相同。
2.3 西瓜OCT酶的酶学特性
2.3.1 酶促反应的最适温度 酶的化学本质是蛋白质,适当的温度有利于酶促反应,温度过高会导致酶失活。如图4所示,OCT酶活力的最适温度为30 ℃,随着温度的不断升高,酶活力先升高后降低,在30 ℃时达到最大值。
2.3.2 酶促反应的最适pH 如图5所示,OCT酶活力的最适pH为8.0。pH小于8.0时,随着pH的升高酶活力随之升高,pH达到8.0时酶活力达到最大值,之后随着pH的升高酶活力逐渐降低。这与Lee等[20]从狭刀豆中提取的OCT酶在刀豆酸作为底物的情况下的最适pH相同。
2.3.3 酶促反应的Km与Vmax值的测定 以鸟氨酸为底物的酶促反应的Km与Vmax值的测定:由2.3.1与2.3.2的结果可知,OCT酶活力的最适温度和最适pH分别为30 ℃和8.0,在最适温度和最适pH条件下,以鸟氨酸的浓度[S]为横坐标,鸟氨酸浓度与反应速率的比值[S]/V为纵坐标作图得到Km与Vmax值。如图6所示,直线的斜率为1/Vmax,直线与X轴的交点为-Km,即OCT酶的Km=8.34 mmol/L,Vmax=0.22 μmol/(mL·min)。
以CP为底物的酶促反应的Km与Vmax值的测定:在最适温度和最适pH条件下,以CP的浓度[S]为横坐标,CP浓度与反应速率的比值[S]/V为纵坐标作图得到Km与Vmax值。如图7所示,直线的斜率为1/Vmax,直线与X轴的交点为-Km,即OCT酶的Km=3.73 mmol/L,Vmax=0.32 μmol/(mL·min)。
2.3.4 金属离子对OCT酶活力的影响 由表4可知,Ca2+、Mg2+和Mn2+对OCT酶均有激活作用,而Fe3+对酶活力有较弱的抑制作用,Cu2+的抑制作用最强为87.31%。
3 讨论与结论
本研究以西瓜OCT酶活力为生物水平指标,采用紫外分光光度法为检测方法,进行酶活力的测定,分别对影响西瓜OCT酶粗提取效果的缓冲液pH、料液比、以及提取时间3个重要因素进行了单因素研究,并通过正交试验确定了西瓜OCT酶粗提取的最佳条件为Tris-HCl缓冲液pH8.5、料液比1 ∶ 5、提取时间4 h,在此条件下OCT的平均酶活力为11.20 U,且缓冲液pH对该酶活力的影响最显著,这与Bellocco等[21]研究结果类似;但肖丽等[22]发现影响巴西松子中蛋白酶提取的最显著影响因素是提取时间,这说明不同蛋白酶提取的影响因素显著性不同,这可能与不同蛋白酶的性质有关。该酶的最适温度为30 ℃,最适pH为8.0,在此条件下氨甲酰磷酸和鸟氨酸的Km值分别为3.73、8.34 mmol/L,Vmax分别为0.32、0.22 μmol/(mL·min)。OCT酶与氨甲酰磷酸的亲和力大于与鸟氨酸的亲和力。Ca2+、Mg2+和Mn2+对OCT酶均有激活作用,且Mg2+和Mn2+的激活作用较强,而Fe3+和Cu2+对OCT酶起抑制作用,Laliberté等[23]研究发现Fe3+对微藻OCT酶起激活作用,这可能与不同物种本身有关。本研究对西瓜OCT酶粗提条件的优化是酶提取的前期步骤,它为该酶的进一步纯化奠定了基础,通过对西瓜OCT酶特性的初步了解,将有助于进一步研究OCT酶在西瓜瓜氨酸合成代谢和尿素循环中所起到的作用,也为西瓜抗逆代谢调控研究打下基础。
参考文献
[1] Guo S G, Zhang J G, Sun H H, et al. The draft genome of watermelon(Citrullus lanatus)and resequencing of 20 diverse accessions[J]. Nature Genetics, 2013, 45(1): 51-58.
[2] Lagerwerf F M, Wever R M F, Van Rijn H J M, et al. Assessment of nitric oxide production by measurement of[15N] citrulline enrichment in human plasma using high performance liquid chromatography-mass spectrometry[J]. Analytical Biochemistry, 1998, 257(1): 45-52.
[3] Wiesinger H. Arginine metabolism and the synthesis of nitric oxide in the nervous system[J]. Progress in Neurobiology, 2001, 64(4): 365-391.
[4] 万学闪, 刘文革, 阎志红, 等.无籽西瓜果实不同部位维生素C和番茄红素含量测定[J]. 中国瓜菜, 2009, 22(3): 4-9.
[5] 程志强, 刘文革, 邓 云, 等. 西瓜果实中L-瓜氨酸的提取与测定[J]. 果树学报, 2010, 27(4): 650-654.
[6] Akashi K, Miyake C, Yokota A. Citrulline, a novel compatible solute in drought-tolerant wild watermelon leaves, is an efficient hydroxyl radical scavenger[J]. FEBS Letters, 2001, 508(3): 438-442.
[7] Yokota A, Kawasaki S, Iwano M, et al. Citrulline and DRIP-1 protein(ArgE homologue)in drought tolerance of wild watermelon[J]. Annals of Botany, 2002, 89(7): 825-832.
[8] Akashi K, Yoshimura K, Nanasato Y, et al. Wild plant resources for studying molecular mechanisms of drought/strong light stress tolerance[J]. Plant Biotechnology, 2008, 25(3): 257-263.
[9] Dasgan H Y, Kusvuran S, Abak K, et al. The relationship between citrulline accumulation and salt tolerance during the vegetative growth of melon(Cucumis melo L.)[J]. Plant Soil and Environment, 2009, 55(2): 51-57.
[10] Thompson J F. Arginine synthesis, proline synthesis, and related processes. In: Miflin B J.The Biochemistry of plants.Vol5[M]. New York: Academic Press, 1980: 375-402.
[11] Kleczkowski K, Cohen P P. Purification of ornithine transcarbamylase from pea seedings[J]. Arichives of Biochemistry and Biophysics, 1964, 107(2): 271-278.
[12] GLenn E, Maretzki A. Properties and Subcellular Distribution of Two Partially Purified Ornithine Transcarbamoylases in Cell Suspensions of Sugarcane[J]. Plant Physiology, 1977, 60(1): 122-126.
[13] Roubelakis K A, Kliewer W M. Enzymes of krebs-henseleit cycle in Vitis vinifera L.I.Ornithine carbamoyltransferase: isolation and some properties[J]. Plant Physiology, 1978, 62(3): 337-339.
[14] Baker S R, Yon R J. Characterization of ornithine carbamoyltransferase from cultured carrot cells of low embryogenic potential[J]. Phytochemistry, 1983, 22(10): 2 171-2 174.
[15] Lee Y, Lee C B, Kim S G, et al. Purification and characterization of ornithine carbamoyltransferase from the chloroplasts of Canavalia lineata leaves[J]. Plant Science, 1997, 12(2): 217-224.
[16] Lee Y, Jun B O, kim S G, et al. Purification of ornithine carbamoyltransferase from kidney bean(Phaseolus vulgaris L.)leaves and comparison of the properties of the enzyme from canavanine-containing and-deficient plants[J]. Panta, 1998, 205(3): 375-379.
[17] Slocum R D, Richardson D P. Purification and characterization of ornithine transcarbamylase from pea(Pisum sativum L.)[J]. Plant Physiology, 1991, 96(1): 262-268.
[18] 施伟红. 改良二乙酰一肟-安替比林法测定游泳水中尿素[J]. 中国卫生检验杂志, 2008, 18(7): 1 319-1 320.
[19] 吴宪禹. 蛋白质纯化实验方案与应用[M]. 北京: 化学工业出版社, 2010.
[20] Lee Y, Kwon Y M. Identification of an isoform of ornithine carbamoyltransferase that can effectively utilize canaline as a substrate from the leaves of Canavalia lineata[J]. Plant Science, 2000, 151(2): 145-151.
[21] Bellocco E, Leuzzi U, De Greqorio A, et al. Partial purification and properties of ornithine carbamoyltransferase from citrus limonum leaves[J]. Biochemistry and Molecular Biology International, 1993, 29(2): 281-289.
[22] 肖 丽, 应铁进, 蔡路昀, 等.巴西松子中蛋白酶的分离纯化及酶学性质[J]. 食品科学, 2013, 34(1): 239-243.
[23] Laliberté G, Hellebust J A. Partial characterization of ornithine carbamoyltransferase in three microalgae.anabolic role only[J]. Plant Physiology, 1990, 93(1): 62-66.

