块茎特异性启动子驱动的hIL-12在转基因马铃薯中的表达
杨加伟,龙朝康,张海桥,葛正龙
(遵义医学院 生物化学教研室,贵州 遵义 563099)
基础医学研究
块茎特异性启动子驱动的hIL-12在转基因马铃薯中的表达
杨加伟,龙朝康,张海桥,葛正龙
(遵义医学院 生物化学教研室,贵州 遵义563099)
[摘要]目的 检测人白细胞介素-12(hIL-12)蛋白在转基因马铃薯块茎中的表达量、遗传稳定性以及组织特异性。方法 提取转基因马铃薯块茎与叶片总蛋白,利用hIL-12抗体进行western blot和ELISA检测。结果 在5株转基因马铃薯的块茎中检测到了hIL-12蛋白的表达,表达量最高达到3.04 μg/g(总蛋白)。此外,同一植株的多个块茎中hIL-12的表达具有一致性,而在叶片中未检测到明显的表达。选取2株马铃薯植株的块茎进行种植,其后代也能检测到稳定的hIL-12蛋白表达。结论 本研究获得了稳定高表达hIL-12蛋白的转基因马铃薯植株,为利用马铃薯生物反应器高效表达生产hIL-12蛋白提供了理论依据。
[关键词]人白细胞介素-12;蛋白表达;植物生物反应器;Ppatatin启动子
人白细胞介素-12(hIL-12)是一种大小约为75 kD,由单核细胞-巨噬细胞分泌的糖蛋白细胞因子,由1个约35 kD的小亚基和1个约40 kD的大亚基通过二硫键连接[1]。它的生物学功能包括增强细胞毒性反应;诱导INF-γ、IL-2及肿瘤坏死因子TNF-α的生成;以及抗血管生成和抗肿瘤效应等[1-2]。此外,IL-12还被用作佐剂和某些抗原共同注射以增强机体对胞内病原体的免疫力[3],在临床上将有着广阔的应用前景。植物生物反应器具有操作简便、产物活性高、成本低、易扩大规模等优点,利用植物生物反应器高效表达生产IL-12,降低IL-12的生产成本,具有重大的应用价值[4]。
本实验室前期研究中,构建了马铃薯块茎特异性启动子Ppatatin驱动的hIL-12表达载体并导入马铃薯基因组,获得了阳性转基因植株[5-6]。因此,本研究接下来对阳性转基因马铃薯中hIL-12在蛋白水平的表达情况进行检测,为利用马铃薯高效表达生产hIL-12蛋白提供理论依据。
1材料与方法
1.1实验材料与主要试剂本研究用转基因马铃薯材料由本实验室前期研究获得[6]。主要试剂有人hIL-12抗体(Abcam公司),HRP标记二抗(碧云天生物技术公司)、化学发光试剂盒(Bio-Rad公司)、SDS-PAGE凝胶试剂盒(碧云天生物技术公司)、hIL-12 ELISA试剂盒(生工生物工程上海股份有限公司)等。
1.2马铃薯块茎总蛋白提取切取马铃薯块茎约0.5 g,加入3 mL总蛋白提取液(0.1 mol/L Tris-HCl,pH 7.5,50 mmol/L EDTA,0.5% SDS,1%蛋白酶抑制剂),冰上研磨至匀浆,12 000 r/min 离心10 min,收集上清液利用BCA法测定蛋白质浓度后保存。
1.3Western blot分析Western blot方法参考文献[7]并进行适当改进。配制浓度为12%的SDS-PAGE凝胶,将处理后的蛋白样品点入上样孔进行电泳。电泳完毕后按照“滤纸-凝胶-硝酸纤维膜-滤纸”从负极到正极的顺序进行组装置于电转仪中,恒流200 mA转移1~2 h。将膜用TBS清洗1次(5 min),浸入5%脱脂奶粉(TBS溶解)中37 ℃封闭1 h后,将膜取出,TBS清洗1次(5 min);在5%脱脂奶粉(TBS溶解)中按照1∶2 000的稀释比例加入一抗,膜浸入其中,37 °C孵育1 h;将杂交膜1×TTBS清洗5次,每次5 min;在5%脱脂奶粉中按照1∶5 000的稀释比例加入二抗(辣根过氧化物酶标记的羊抗兔IgG),将膜浸入其中,37 °C孵育1 h;1×TTBS清洗5次,每次5 min,1×TBS洗15 min;利用化学发光试剂盒进行发光后利用化学发光成像仪(Bio-Rad)进行曝光照相。
1.4ELISA分析将待测样品稀释50倍后用人IL-12 Elisa检测试剂盒测定样品中hIL-12的含量,按照试剂盒说明书进行操作。主要步骤包括:将蛋白质样品(包括标准品与待测样)、生物素标记抗体及酶试剂加入hIL-12包被的酶标板,混匀后37 ℃保温1 h,洗板后加入显色液,5 min后加入终止液于450 nm测量OD值。

2结果
2.1hIL-12蛋白在转基因马铃薯中的表达在前期研究中,获得了大量Ppatatin驱动的hIL-12转基因马铃薯植株,RT-PCR实验显示其中有7株转基因植株的块茎中检测到了hIL-12 mRNA的表达[6]。本研究接下来提取这7个植株块茎中的总蛋白,利用hIL-12抗体进行western blot检测hIL-12在蛋白水平的表达情况。结果(见图1B)显示:其中的3、8、9、10、11号5个植株块茎能明显检测到hIL-12蛋白表达,另外的7号和12号植株块茎未检测到明显信号(见图1A)。本研究进一步利用ELISA技术对hIL-12蛋白的表达进行定量检测,结果与western blot实验一致,除7号和12号植株外,其余5个转基因植株的块茎中均检测到明显的蛋白表达,表达量为1.0~3.1 μg/g(总蛋白),和野生型植株相比有统计学差异(P<0.05)(见图1B)。其中,3号植株的马铃薯块茎hIL-12表达量最高,达到(3.04±0.11) μg/g(总蛋白)。

“-”和“+”分别表示野生型材料阴性对照和hIL-12重组蛋白阳性对照,其余编号表示不同的阳性单株块茎;*表示与阴性对照相比有统计学差异(P<0.05)。 图1 Western blot(A)和ELISA(B)方法检测hIL-12蛋白在转基因马铃薯块茎中的表达
2.2hIL-12蛋白表达的一致性与组织特异性检测为检测外源基因在同一植株所有后代中的表达量是否具有一致性,从表达量最高的3号植株和表达量最低的8号植株中各挑取6个马铃薯薯球进行ELISA检测,结果表明,所有的12个薯球中均检测到hIL-12蛋白表达(见图2A)。其中,3号植株的6个马铃薯块茎中hIL-12的表达量为2.9~3.3 μg/g(总蛋白), 8号植株的6个马铃薯块茎中hIL-12的表达量为0.9~1.1 μg/g(总蛋白)。统计学分析结果显示:3号植株不同马铃薯块茎中的蛋白表达量除了3-4和3-5间有统计学差异外(P<0.05),其余块茎蛋白表达量无差异(P>0.05);而8号植株的6个马铃薯块茎中hIL-12蛋白的表达差异也和3号植株类似,仅8-2和8-6间有差异(P<0.05)。以上结果表明hIL-12蛋白在同一植株不同后代中的表达基本具有一致性。由于本研究中驱动hIL-12基因表达的启动子为块茎特异性启动子,该启动子在马铃薯其它组织中几乎不表达。为检测hIL-12蛋白的表达是否也具有组织特异性,本研究对在块茎中能检测出hIL-12蛋白表达的5个植株的叶片进行western blot和ELISA检测。Western blot显示,在这5个植株的叶片中均未检测到蛋白表达信号(见图2B)。同时,ELISA实验显示,8号和10号植株叶片中hIL-12蛋白的表达与野生型植株无统计学差异(P>0.05),而3、9、11这3株植株叶片中虽然能检测到hIL-12蛋白的表达,但其hIL-12表达量极低,每克总蛋白中hIL-12的表达量均小于0.35 μg(见图2C),远低于其在块茎中的表达量,初步表明hIL-12蛋白的表达具有块茎组织特异性。
2.3hIL-12蛋白表达遗传稳定性检测选取hIL-12蛋白表达量较高的3号和9号转基因植株的块茎进行种植并获得其子代马铃薯块茎。从这2个转基因植株中随机取4株子代植株的块茎,提取其总蛋白后利用western blot和ELISA检测hIL-12在转基因后代中的表达情况。Western blot结果显示,所有的8个样品中均检测到了hIL-12蛋白的表达。ELISA实验结果和western blot一致,大部分子代植株中hIL-12蛋白的表达量和亲代相近,与野生型植株相比有统计学差异(P<0.05)。本实验表明转基因植株在经过一次繁殖后,外源基因的表达稳定(见图3)。
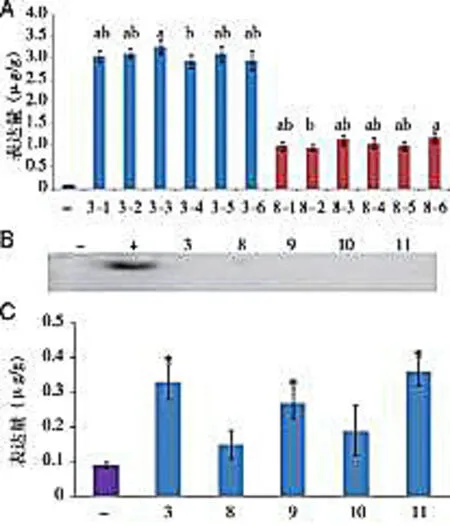
A:ELISA检测3号和8号植株不同块茎中hIL-12的表达±s,n=3);“-”表示野生型材料阴性对照,3-1至3-6表示3号转基因植株所结的不同块茎,8-1至8-6表示8号转基因植株所结的不同块茎。字母表示在0.05水平上的差异显著性。B:Western blot检测hIL-12蛋白在转基因马铃薯植株叶片中的表达;“-”和“+”分别表示野生型材料阴性对照和hIL-12重组蛋白阳性对照,其余编号表示不同的阳性单株块茎。C:ELISA检测hIL-12蛋白在转基因马铃薯植株叶片中的表达±s,n=3),编号含义同图2B,*表示与阴性对照相比有统计学差异(P<0.05)。图2 hIL-12蛋白表达的一致性与组织特异性检测
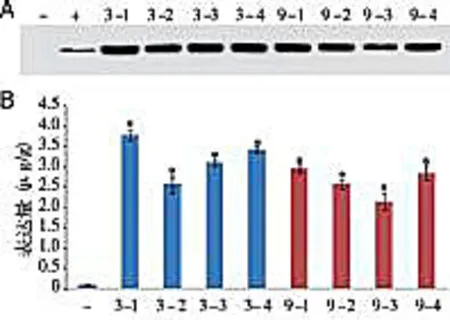
A:Western blot检测hIL-12蛋白在3号和9号转基因植株后代块茎中的表达;B:ELISA检测hIL-12蛋白在3号和9号转基因植株后代块茎中的表达±s,n=3)。“-”和“+”分别表示野生型材料阴性对照和hIL-12重组蛋白阳性对照,3-1至3-4和9-1至9-4分别表示3号与9号转基因植株的后代,*表示与阴性对照相比有统计学差异(P<0.05)。图3 hIL-12蛋白在转基因植株后代中的表达检测
3讨论
目前,利用外源重组表达系统生产的生物技术药物已在癌症、心脑血管疾病、糖尿病等重大疾病的治疗方面起着举足轻重的作用[8]。自1998年Magnuson等[9-10]首次报道用烟草悬浮细胞表达了具有活性的人IL-2和IL-4[11]以来,现已有多种白细胞介素先后在植物中成功表达。相比于工业上常用的微生物反应器和动物反应器,植物由于具有细胞培养简单、转基因体系成熟、与动物细胞相似的真核基因表达机制等各种优越性,使得开发植物生物反应器表达具有应用价值和应用潜力的药用蛋白受到了许多科研工作者的重视[12-13]。而马铃薯由于具有遗传转化体系完善、转化周期较短、无性繁殖技术成熟、生长容易及产量高等优势,被广泛用来进行药用蛋白表达研究[10,14]。
但是,相比于微生物反应器的高效性,植物表达系统的外源蛋白表达量太低[10-11],大大限制了其发展。Gutiérrez-Ortega等[15]早在2004年便在烟草中成功表达了具有生物学活性的hIL-12蛋白,但表达量仅为30 ng/g(鲜重);在本实验室的前期研究中,利用组成型的CaMV35S启动子驱动hIL-12基因在马铃薯中表达,获得了具有生物学活性的重组蛋白,但表达量非常低[16-17]。因此,如何提高外源蛋白在植物中的表达量引起不少研究者的关注。启动子是决定外源蛋白能否高表达的重要因素,而选择利用组织特异性的强启动子驱动外源基因,在植物的某一特定组织内获得高表达重组蛋白,是优化植物生物反应器的途径之一。如:Park等[10]利用Ppatatin启动子驱动白介素-2(IL-2)蛋白的表达,表达量得到大大提高,最高可达到约110 μg/g(总蛋白)。马铃薯的PATATIN蛋白是一类分子量约为40 kD的糖蛋白,其在块茎可溶性总蛋白中的含量高达40%,而在其它组织中的含量极少[18],因此本研究选择了该基因的启动子Ppatatin来驱动hIL-12基因的表达。本研究将前期实验得到的7个阳性转基因马铃薯株系进行蛋白表达检测,western blot和ELISA实验均表明,其中的5个植株在蛋白水平有大量的表达,在每克总蛋白中hIL-12蛋白的表达量可超过3 μg,外源蛋白的表达量相比前期研究大大提高[16]。此外,在随机选择的2个植株不同块茎中均能检测到一致的hIL-12蛋白表达,初步表明同一株植株不同块茎中外源蛋白的表达具有一致性。
由于植物基因组遗传的复杂性,外源基因在转基因植物中的遗传稳定性颇受关注,而药用蛋白基因的遗传稳定性是影响植物生物反应器生产效率的决定因素之一[19]。由于马铃薯的繁殖方式以无性繁殖为主,因此选择马铃薯作为生物反应器也可以在一定程度上避免因有性繁殖带来的遗传稳定性问题。为验证本研究实验材料的遗传稳定性,选择了部分转基因植株进行种植,并对后代hIL-12的表达量进行了检测,结果显示,所有的实验材料均能检测到hIL-12蛋白的表达,初步表明本研究的外源基因在马铃薯植株中的表达具有非常好的遗传稳定性。
总之,本研究对前期获得的Ppatatin驱动的hIL-12转基因马铃薯中hIL-12蛋白的表达情况进行了检测,并检测了蛋白表达的遗传稳定性,最终获得了能稳定遗传的表达hIL-12蛋白的转基因马铃薯植株。本研究对马铃薯生物反应器在药用蛋白表达中的应用提供了理论基础。
[参考文献]
[1] Hamza T, Barnett J B, Li B. Interleukin 12 a key immunoregulatory cytokine in infection applications[J]. Int J Mol Sci, 2010, 11(3): 789-806.
[2] Yao L, Pike S E, Setsuda J, et al. Effective targeting of tumor vasculature by the angiogenesis inhibitors vasostatin and interleukin-12[J]. Blood, 2000, 96(5): 1900-1905.
[3] Palendira U, Kamath A T, Feng C G, et al. Coexpression of interleukin-12 chains by a self-splicing vector increases the protective cellular immune response of DNA and Mycobacterium bovis BCG vaccines against Mycobacterium tuberculosis[J]. Infect Immun, 2002, 70(4): 1949-1956.
[4] 杨加伟,龙朝康,葛正龙.马铃薯叶特异性启动子驱动的人白细胞介素-12的遗传转化[J]. 基因组学与应用生物学, 2015, 34(8): 1625-1630.
[5] 杨加伟, 李伟, 葛正龙. 马铃薯块茎特异性启动子克隆及其驱动的hIL-12 表达载体构建[J]. 遵义医学院学报, 2014, 37(4): 38-43.
[6] 杨加伟, 程小玲, 龙朝康. 马铃薯块茎特异性启动子驱动的人白细胞介素-12的遗传转化研究[J]. 生物技术通报, 2016, 32(5): 1-6.
[7] Yang J W, Fu J X, Li J, et al. A novel co-immunoprecipitation protocol based on protoplasttransient gene expression for studying protein-proteininteractions in rice[J]. Plant Mol Biol Rep, 2014, 32(1): 153-161.
[8] 胡显文, 陈惠鹏, 张树庸. 全球生物制药产业概况[J]. 中国医药生物技术, 2009, 4(2): 85-89.
[9] Magnuson N S, Linzmaier P M, Reeves R, et al. Secretion ofbiologically active human interleukin-2 and interleukin-4 fromgenetically modified tobacco cells in suspension culture[J]. Protein Expr Purif, 1998, 13(1): 45-52.
[10] Park Y, Cheong H. Expression and production of recombinant humaninterleukin-2 in potato plants[J]. Protein Expr Purif, 2002, 25(1): 160-165.
[11] Bortesi L, Rossato M, Schuster F, et al. Viral and murine interleukin-10 are correctly processed and retain their biological activity when produced in tobacco[J]. BMC Biotechnol, 2009, 19(9): 22.
[12] Daniell H, Singh N D, Mason H, et al. Plant-made vaccine antigens and biopharmaceuticals[J]. Trends Plant Sci, 2009, 14(12): 669-679.
[13] Lico C, Santi L, Twyman R M, et al. The use of plants for the production of therapeutic human peptides[J]. Plant Cell Rep, 2012, 31(3): 439-451.
[14] Yusibov V, Streatfield S J, Kushnir N. Clinical development of plantproducedrecombinant pharmaceuticals: vaccines, antibodies andbeyond[J]. Hum Vaccin, 2011, 7(3): 313-321.
[15] Gutiérrez-Ortega A, Avila-Moreno F, Saucedo-Arias L J, et al. Expression of a single-chain humanInterleukin-12 gene in transgenic tobacco plants and functionalstudies[J]. Biotechnology and Bioengineering, 2004, 85(7): 734-740.
[16] 陈佳瑜, 罗果, 葛正龙. 人白介素IL-12转基因马铃薯中hIL-12的表达[J]. 安徽农业科学, 2010, 38(15): 7767-7768.
[17] 黄进,陈佳瑜,罗果,等. 从转基因马铃薯中纯化的人白细胞介素-12的生物学活性分析[J]. 遵义医学院学报, 2008, 31(6): 571-572.
[18] Stupar R M, Beaubien K A, Jin W, et al. Structural diversity anddifferential transcription of the patatin multicopy gene family duringpotato tuber development[J]. Genetics, 2006, 172(2): 1263-1275.
[19] Twyman R M, Schillberg S, Fischer R. Optimizing the yield of recombinant pharmaceutical proteins in plants[J]. Curr PharmDes, 2013, 19(31): 5486-5494.
[收稿2016-01-04;修回2016-02-16]
(编辑:王静)
Expression of human IL-12 driven by tuber specific promoter in transgenic potato (Solanumtuberosum)
YangJiawei,LongChaokang,ZhangHaiqiao,GeZhenglong
(Department of Biochemistry, Zunyi Medical University, Zunyi Guizhou 563099, China)
[Abstract]Objective To detect the expression level, genetic stability and tissue specificity of human IL-12 (hIL-12) in transgenic potato plants.Methods Total proteins were extracted from tubers and leaves of transgenic potato plants. Then, western blot and ELISA techniques were used to detect the expression of hIL-12.Results The hIL-12 was expressed in 5 transgenic potato plants with the maximal accumulation of approximately 3.04 μg/g total proteins in the tubers. Furthermore, the expression of hIL-12 in different tubers from 1 transgenic plant was consistent, while rarely hIL-12 expression was detected in leaves of transgenic potato plants.Conclusion Transgenic potato plants expressing hIL-12 with high level and stability were obtained in this study, which providing fundamental basis for efficient production of hIL-12 in potato bioreactor.
[Key words]human IL-12; protein expression; plant bioreactor; promoter patatin
[中图法分类号]Q786
[文献标志码]A
[文章编号]1000-2715(2016)02-0134-05
[基金项目]国家自然科学基金资助项目(NO:31460230);贵州省科学技术基金资助项目(NO: 黔科合J字[2013]2324);遵义医学院博士启动基金资助项目(NO: F-587)。
——李红,安明哲,苟梓希.CN 114180719A

