杨梅素诱导人宫颈癌HeLa细胞凋亡及凋亡通路的研究
李有富,李 辉,韩 涛,丁楠楠
(湖北文理学院附属襄阳市中心医院,襄阳 441021)
杨梅素诱导人宫颈癌HeLa细胞凋亡及凋亡通路的研究
李有富,李辉*,韩涛,丁楠楠
(湖北文理学院附属襄阳市中心医院,襄阳441021)
摘要:目的研究杨梅素体外对人宫颈癌HeLa细胞增殖、凋亡及凋亡通路的影响。方法体外培养人宫颈癌HeLa细胞,MTT和SRB法检测细胞增殖抑制率;流式细胞仪检测细胞凋亡,计算机分析细胞周期;Western Blot法检测caspase-3、caspase-9和survivin含量。结果杨梅素对HeLa细胞的体外增殖具有抑制作用,并具有浓度和时间依耐性;杨梅素体外诱导HeLa细胞凋亡,并将细胞周期阻滞在S期;杨梅素促进caspase-3和caspase-9蛋白表达,抑制survivin蛋白表达。结论杨梅素可抑制HeLa细胞的增殖,诱导其凋亡,其凋亡途径同时涉及细胞内途径和细胞外途径。
关键词:杨梅素;HeLa细胞;增殖;凋亡;caspase-3;caspase-9;survivin
杨梅素(myricetin,Myr)化学名为 3,3,4,5,5,7-六羟基黄酮,异名为杨梅树皮素、杨梅黄酮和杨梅酮,是多羟基黄酮类化合物,主要存在于杨梅树的树皮中[1]。现有的研究表明,杨梅素具有广泛的药理作用,包括降血糖、护肝、抗氧化、抗自由基、免疫调节以及抗肿瘤等多种生物学活性[2-3],近年来其抗肿瘤作用备受关注,但是目前国内学者对杨梅素的抗肿瘤活性及其机制研究较少。本研究主要观察杨梅素对人宫颈癌HeLa细胞增殖、凋亡、细胞周期和信号通路等方面的影响,考察其诱导细胞凋亡的作用机制,为其抗肿瘤治疗奠定基础。
1仪器与材料
1.1仪器Multiskan Ascent酶标仪,美国Thermo Electron公司;CO2培养箱,法国JOUAN公司;SW-4J-1F净化工作台,苏州净化设备有限公司;TE2000-S型倒置显微镜,Nikow公司;TDL-5低速大容量离心机,上海安亭科学仪器厂;96孔培养板,Coming公司。
1.2材料人宫颈癌HeLa细胞购于中国科学院上海细胞生物学研究所,用含体积分数为10%的胎牛血清的RPMI 1640培养液进行培养;杨梅素由本实验室制备所得,批号20130727,质量分数为98.1%(HPLC);RPMI 1640培养液,GIBCO公司;胰酶、四甲基偶氮唑蓝(MTT)和SRB试剂均购于Sigma公司;survivin、caspase-3和caspase-9单克隆抗体购于Abcam公司;Western及IP细胞裂解液、蛋白提取试剂盒、SDS-PAGE蛋白上样缓冲液、GAPDH抗体和BCIP/NBT碱性磷酸酯酶显色试剂盒均购于北京碧云天生物科技有限公司。
2方法
2.1细胞培养将人宫颈癌HeLa细胞置于含体积分数为10%的胎牛血清、质量浓度为0.05 g·L-1的青霉素以及质量浓度为0.05 g·L-1链霉素的RPMI 1640培养液中培养,置于37 ℃、体积分数为5%的CO2和95%的饱和湿度培养箱中,每隔3 d用胰蛋白酶消化后进行传代,用倒置显微镜观察细胞形态,取处于对数生长期的细胞用于实验研究。
2.2体外抗肿瘤作用2.2.1MTT法检测对宫颈癌细胞增殖的影响收集处于对数生长期的HeLa细胞稀释成1×105个·mL-1的细胞悬液,接种于96孔培养板中,每孔100 μL,培养
24 h。将杨梅素溶解于1640培养液中,分别加入96孔培养板,使每组杨梅素终质量浓度分别为10,20,40,80,160和320 μg·mL-1,每组有6个平行孔,空白对照组加入1640培养液,分别在培养24,48和72 h时各取出一板,按照MTT法进行实验:从各孔中吸取100 μL上清液,加入MTT 10 μL(终质量浓度为5 mg·mL-1),再次培养4 h后,每孔加入DMSO 100 μL,微量振荡器充分振荡使其溶解,置于酶标仪上570 nm处测定A值。按照“细胞平均抑制率(%)=(1-给药孔平均A值/对照孔平均A值)×100%”计算,以剂量和抑制率绘制各板生长曲线。
2.2.2SRB法检测对宫颈癌细胞增殖的影响按照2.2.1项下方法将HeLa细胞接种于96孔板中培养,24 h后加入杨梅素,分别培养24,48和72 h后,进行SRB法检测:每孔加入预冷的体积分数为50%的三氯乙酸50 μL,固定,静置5 min,将96孔板移至4 ℃下放置1 h;倒掉固定液,去离子水洗5遍,干燥后每孔加SRB液100 μL,室温避光放置10 min;用10 mL·L-1的醋酸洗5遍,空气干燥,加150 μL 10 mmol·L-1非缓冲Tris碱液(pH值为10.5)溶解,置于515 nm处测定A值。按照2.2.1项下方法绘制生长曲线。
2.3流式细胞术检测对宫颈癌细胞凋亡和周期的影响将对数生长期的HeLa细胞调整浓度至1×106个·mL-1,接种于培养瓶中,24 h后随机分为40,80和160 μg·mL-1的杨梅素组和阳性对照顺铂组,对照组加1640培养液,置于培养箱中,48 h后消化洗涤细胞,用4 ℃冰箱中预冷的体积分数为70%的乙醇将HeLa细胞固定。检测凋亡前,先离心弃去上清液,用PBS洗涤细胞后置于柠檬酸缓冲液中放置1 h以上,调整浓度为1×106个·mL-1左右,置于流式细胞仪中检测细胞凋亡率,用计算机分析细胞周期。
2.4Western Blot法检测对宫颈癌细胞survivin、caspase-3和caspase-9含量的影响将4个质量浓度组(0,20,40和80 μg·mL-1)的杨梅素分别作用于细胞48 h后,用胰酶消化细胞,按照总蛋白提取试剂盒说明书要求将消化后的HeLa细胞置于EP管中,加入100 μL细胞裂解液吹打使其均匀,置于冰上30 min,4 ℃ 以14 000 r·min-1离心10 min,取上清液,每管取30 μg总蛋白加入上样缓冲液煮沸5 min,SDS/PAGE凝胶电泳,湿转法转至PVDF膜,用体积分数为5%的脱脂牛奶封闭2 h,一抗(1∶1 000) 4 ℃孵育过夜,二抗(1∶500)室温孵育2 h,采用二氨基联苯胺显色,结果进行灰度扫描分析,实验重复3次。
3结果
3.1对HeLa细胞增殖的影响同时采用MTT法和SRB法 2种方法检测杨梅素对HeLa细胞增殖的抑制作用,发现2种方法结果一致,杨梅素体外能抑制HeLa细胞的增殖,各剂量杨梅素作用的细胞生长抑制率与同板上空白对照组相比均具有显著性差异(P<0.05),不同板之间,同一质量浓度组的抑制率随着作用时间的延长而增大。因此可见杨梅素体外可抑制HeLa细胞的生长,并具有质量浓度和时间依赖性。见图1。

图1MTT法和SRB法检测杨梅素对HeLa细胞增殖的影响
A.MTT法;B.SRB法
Fig.1The impact of myricetin on proliferation of HeLa cells by MTT and SRB
A.MTT method;B.SRB method
3.2对HeLa细胞凋亡的影响各剂量组的杨梅素作用于HeLa细胞后,均能诱导其凋亡。质量浓度为40,80和160 μg·mL-1的杨梅素诱导细胞凋亡率分别为24.70%,29.25%和35.18%,明显高于对照组,细胞凋亡率随着剂量的增加而明显增加。见表1。
表1杨梅素对HeLa细胞凋亡的影响
Tab.1 The impact of myricetin on apoptosis of HeLa cells

±s,n=3)
注:与细胞对照组比较**P<0.01。
3.3对HeLa细胞周期的影响数据表明,杨梅素作用过的HeLa细胞,各细胞周期均发生变化,3组细胞的S期比例均有明显增加,与对照组相比,P<0.05;S期所占比例随药物剂量的增加也增加;而G0~G1期和G2~M期比例则相应减少,但与对照组相比没有显著性差异。由此可推测,杨梅素通过将HeLa细胞周期阻滞于S期而抑制其增殖。见表2。
表2杨梅素对HeLa细胞周期的影响
Tab.2 The impact of myricetin on cell cycle of HeLa cells
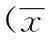
±s,n=3)
注:与细胞对照组比较**P<0.01,*P<0.05。
3.4对survivin、caspase-3和caspase-9含量的影响见表3和图2。结果显示,杨梅素各组抑制survivin蛋白的表达,促进caspase-3和caspase-9的表达,与对照组相比,结果均具有统计学差异(P<0.05,0.01或0.001),同时具有剂量依赖性。
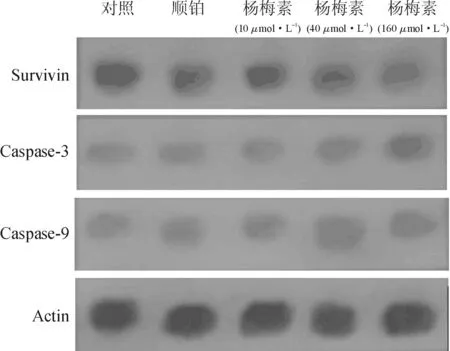
图2杨梅素对HeLa细胞survivin、caspase-3和caspase-9和蛋白表达的影响
Fig.2 The impact of myricetin on the expressions of survivin,caspase-3 and caspase-9 of HeLa cells
表3杨梅素对HeLa细胞survivin,caspase-3和caspase-9蛋白表达的影响
Tab.3 The impact of myricetin on the expressions of survivin,caspase-3 and caspase-9 of HeLa cells

组别剂量/μmol·L-1蛋白表达水平survivin/ng·L-1caspase-3/pmol·L-1caspase-9/pmol·L-1细胞对照—513.03±21.0923.58±1.4222.97±1.84顺铂40313.10±21.48***24.17±1.6030.69±1.39**杨梅素10497.32±11.5126.32±0.82*27.78±1.37*杨梅素40296.64±33.96***31.44±2.89*30.43±1.03**杨梅素160282.30±25.64***38.90±0.92***36.84±1.55***
注:与细胞对照组比较*P<0.05,**P<0.01,***P<0.001。
4讨论
宫颈癌严重危害妇女的健康,其发病率呈逐年上升趋势,其全球死亡率居女性肿瘤第2位[4]。宫颈癌的治疗方法包括手术、放疗、化疗,但其不良反应较严重。随着中药有效成分在恶性肿瘤的辅助治疗中逐渐被临床工作者应用,越来越多的学者也致力于各种中药有效成分抗肿瘤作用的研究[5-6]。杨梅素是广泛存在于多种天然中草药中的化学成分,具有抗肿瘤、提高免疫力、毒性低等优点,可作为一种潜在的抗肿瘤辅助药物。因此,本文主要从凋亡机制及通路等方面研究杨梅素对宫颈癌HeLa细胞生长的影响。
本研究同时采用MTT法和SRB法2种方法观察杨梅素对HeLa细胞增殖的影响。结果表明,杨梅素能够明显抑制HeLa细胞的生长,并且具有良好的剂量和时间依赖性,2种方法相互印证,杨梅素具有体外抗肿瘤作用,结果准确可靠。而流式细胞仪检测发现,杨梅素处理过的细胞凋亡率明显增加,它将细胞阻滞于S期,提示杨梅素通过影响细胞周期从而抑制HeLa细胞的生长。
凋亡是细胞在外界的影响下为了更好地适应在众多基因调控下进行的程序性死亡过程,与肿瘤的发生、发展过程密切相关[7-8]。细胞的增殖和凋亡在正常机体内应处于一种平衡状态,若这种状态被打破,可导致肿瘤的发生。国内外研究表明,机体可通过caspase依赖途径以及非caspase依赖途径诱导细胞凋亡,caspase家族是引起细胞凋亡的关键执行者。激活caspase家族又分为细胞内信号途径(线粒体通路)和细胞外信号途径(死亡受体通路)。细胞内信号途径通过线粒体释放促凋亡分子(如细胞色素C)进入细胞质,其与凋亡蛋白酶活化因子(Apaf-1)形成多聚复合体,激活caspase-9,导致DNA降解和染色体浓缩,从而启动细胞凋亡[9]。细胞外信号途径中细胞外部因子激活caspase家族中成员,无活性前体pro-caspase-3被激活剪切,形成活性片段cleaved caspase-3,再激活下游的caspase家族,最终引起细胞凋亡[10]。caspase-3是细胞凋亡过程中主要的效应因子,大多数细胞凋亡途径均通过caspase-3诱导的信号传递过程[11]。survivin是重要的凋亡抑制蛋白,发挥抑制细胞凋亡的作用,从而促进肿瘤细胞的增殖。survivin还可通过抑制凋亡终末效应酶Caspase-3活性而减少caspase依赖途径诱导的细胞凋亡,survivin基因表达水平下调还可增加肿瘤细胞对化疗药物的敏感性[12-13]。
本研究采用Western Blot检测发现,杨梅素在诱导HeLa细胞凋亡的同时,能够通过活化基因蛋白caspase-3、caspase-9,抑制survivin蛋白从而促进细胞凋亡,且具有剂量依赖性,提示杨梅素可同时通过细胞内途径和细胞外途径诱导HeLa细胞凋亡。但是诱导细胞凋亡的过程极其复杂,可能还涉及其他的基因蛋白,还需进一步研究。
参考文献:
[1]Liu I M,Tzeng T F,Liou S S,et a1. Myricetin a naturally occurring flavonol,ameliorates insulin resistance induced by a high-fructose diet in rats[J]. Life Sci,2007,81(21/22):1479-1488.
[2]林国钡,谢燕,李国文.杨梅素的研究进展[J].国际药学研究杂志,2012,39(6):483-487.
[3]Bian J,Gu M,Hou S Y,et a1.Invitroresearch on function and mechanism of myricetin-mediated apoptosis of human liver cancer cell line HepG2[J]. China Med Herald,2012,9(36):7-9.
[4]Dehari R,Nakamura Y,Okamoto N,et a1. Increased nuclear expression of growth receptor in uterine cervical neoplasms of women under 40 years old[J]. Tohoko J Exp Med,2008,216(2):165-172.
[5]史海敏,丁库克,张新.中药有效成分影响宫颈癌HeLa细胞凋亡机制的研究进展[J].环球中医药,2015,8(1):124-127.
[6]陆文总,杨亚丽,贾光锋,等.桔梗多糖对U-14宫颈癌抗肿瘤作用的研究[J].西北药学杂志,2013,28(1):43-45.
[7]商潇云,李鑫,于波,等.甘草提取物(GC-3)体外诱导HeLa细胞凋亡及机制研究[J].中华临床医师杂志:电子版,2013,7(23):10798-10801.
[8]易岚,伍尤华,谭晖,等.Rac2在二烯丙基二硫诱导人白血病K562细胞凋亡中的作用[J].西北药学杂志,2014,29(5):472-477.
[9]刘跃亮,罗进勇,张彦,等.双氢青蒿素对人骨肉瘤细胞株143B增殖和凋亡的作用[J].中国药理学通报,2012,28(12):1719-1723.
[10]刘金娟,杨成流,蒋继宏,等.鱼腥草地下茎提取物诱导胃癌细胞SGC-7901凋亡机制的研究[J].中国药理学通报,2014,30(2):257-261.
[11]Ulukaya E,Acilan C,Yilmaz Y. Apoptosis:why and how does it occurin biology [J]. Cell Biochem Funct,2011,29(6):468-480.
[12]郑志宏,潘云苓,陈英玉,等.志苓胶囊通过激活Caspase-3抑制K562细胞增殖和诱导细胞凋亡[J].中国药理学通报,2009,25(9):1244-1247.
[13]何小婷,李娟,柴晓静,等.survivin基因在急性白血病患者中的表达及其临床意义[J].现代肿瘤医学,2014,22(2):408-412.
Effects of myricetin on apoptosis and apoptosis pathway of human cervical cancer HeLa cells
LI Youfu,LI Hui*,HAN Tao,DING Nannan
(Xiangyang Central Hospital Affiliated to Hubei University of Arts and Science,Xiangyang 441021,China)
Abstract:ObjectiveTo investigate the activity of myricetin on proliferation,apoptosis and to study the apoptosis signaling pathway on human cervical cancer HeLa cells. MethodsHeLa cells were cultured in vitro,and MTT and SRB were performed to observe the proliferation. Flow cytometry was utilized to measure the apoptosis and analysis of the cell cycle. The expressions of caspase-3,caspase-9 and survivin were determined by Western Blot. ResultsMyricetin could inhibit the proliferation of HeLa cells in vitro,in a concentration and time-dependent manner. Myricetin could elevate the apoptosis rates,and cell cycle was blocked in S phase. Myricetin was able to promote the expressions of caspase-3 and caspase-9,inhibit the expression of survivin. Conclusion Myricetin could inhibit the proliferation of HeLa cells,induce apoptosis,and the apoptosis pathway propably involves both intracellular and extracellular pathways.
Key words:myricetin;HeLa cells;proliferation;apoptosis;caspase-3;caspase-9;survivin
(收稿日期:2015-07-01)
中图分类号:R285.5
文献标志码:A
文章编号:1004-2407(2016)03-0270-05
doi:10.3969/j.issn.1004-2407.2016.03.015
*通信作者:李辉,女,主管药师
作者简介:李有富,男,主管药师

