FLAER多参数检测PNH克隆的意义
梁悦怡,谢守军
(承德医学院,河北承德 067000)
FLAER多参数检测PNH克隆的意义
梁悦怡,谢守军△
(承德医学院,河北承德 067000)
摘要:目的探讨荧光标记的嗜水气单胞菌溶素变异体(FLAER)、CD45、CD15、CD24多参数检测粒细胞PNH克隆对于疾病诊断和鉴别诊断的意义,并与CD59检测进行比较。方法应用流式细胞仪分别检测阵发性睡眠性血红蛋白尿症(PNH)、再生障碍性贫血(AA)、骨髓增生异常综合征(MDS)和正常人粒细胞FLAER和红细胞CD59的缺失率。结果与AA、MDS及正常组相比,PNH患者外周血CD59、FLAER缺失率均明显增高(P<0.05);在PNH组中,FLAER缺失率显著高于CD59缺失率(P<0.05);在AA和MDS组中,个别CD59缺失率为0的患者,检测出FLAER的缺失。结论FLAER检测较CD59相比灵敏性和特异性更高,对微小PNH克隆更敏感,对PNH、MDS和AA的诊断鉴别具有一定的意义。
关键词:阵发性睡眠性血红蛋白尿症;流式细胞术;荧光标记的嗜水气单胞菌溶素变异体
阵发性睡眠性血红蛋白尿症(PNH)是一种获得性克隆性造血干细胞疾病,其发病机制主要是由于体细胞X染色体上的PIG-A基因突变,导致血细胞膜表面糖化磷脂酰肌醇(GPI)锚合成障碍,锚连接蛋白缺失[1]。传统的诊断方法主要有蔗糖溶血试验、酸溶血试验、尿含铁血黄素试验,但这些方法敏感性、特异性差[2]。近些年来,通过流式细胞仪检测CD55、CD59已经成为诊断PNH的常规方法,特别是CD59,其敏感性高于CD55,在PNH诊断过程中被认为是一个优于CD55的指标[3]。荧光标记的无活性嗜水气单胞菌溶素前体的变异体(FLAER)可以特异性的与GPI锚连蛋白结合,经流式细胞仪检测,其特异性和敏感性较传统方法更好。PNH、再生障碍性贫血(AA)和骨髓增生异常综合征(MDS)均为骨髓衰竭性疾病,具有相似的发病机制和临床表现,早期鉴别诊断常很困难。本文联合FLAER、CD45、CD15、CD24多参数检测粒细胞PNH克隆以及CD59检测红细胞PNH克隆,旨在有效提高PNH克隆检测的敏感性、特异性,有助于骨髓衰竭性疾病的早期鉴别诊断,现报道如下。
1资料与方法
1.1一般资料所有病例均来自于本院血液科连续48例住院患者。其中PNH患者9例,AA患者13例,诊断均符合血液病诊断及疗效标准[4];MDS患者11例,符合2008年WHO诊断分型标准[5]。对照组15例均为巨幼细胞性贫血患者。
1.2仪器与试剂FACSAria型流式细胞仪,溶血素、磷酸盐缓冲液(PBS)和CD59、CD45、CD15、CD24试剂和均购自BD公司,FLAER试剂购自加拿大Protox Biotech公司。
1.3方法
1.3.1外周血红细胞CD59检测取EDTA抗凝全血100 μL,经PBS洗涤后稀释于1.5 mL的PBS中,取100 μL加入CD59-PE单抗20 μL,4 ℃避光孵育30 min后,1 000 r/min离心5 min,弃上清,用2 mL PBS液洗涤2遍,重悬于1 mL PBS液中上机检测,用流式细胞仪测定CD59细胞的表达率。
1.3.2外周血粒细胞FLAER检测取EDTA抗凝全血100 μL,加入CD45、CD15、CD24、FlAER抗体各20 μL,避光孵育30 min后,加入2 mL溶血素,室温下避光10 min,溶血完全后1 000 r/min离心5 min,弃上清,用2 mL PBS液洗涤2遍,重新悬于500 μL的PBS液中液上机检测,用流式细胞仪测定FLAER的表达率。
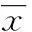
2结果
2.1临床特征PNH患者9例,男6例、女3例,年龄16~60岁,中位年龄30岁;AA患者13例,男5例、女8例,年龄7~63岁,中位年龄38;MDS患者11例,男5例、女6例,年龄41~72岁,中位年龄53岁,其中RCMD 1例,RCUD 6例,RAEB-Ⅰ2例RAEB-Ⅱ1例,5q-综合征1例;对照组15例,男6例、女9例,年龄19~61岁,中位年龄34岁。
2.2不同方法对PNH患者检测的比较PNH组患者FLAER缺失率和CD59缺失率分别为(70.07±28.77)%和(38.51±29.15)%,显著高于对照组、AA组、MDS组,差异有统计学意义(P<0.05)。FLAER检测结果明显高于CD59检测,差异有统计学意义(P<0.05)。其中,有2例患者,一例CD59缺失率为7.8%,FLAER缺失率为88.1%;另一例CD59缺失率为5.5%,FLAER缺失率为23.2%,见图1。
2.3不同方法对非PNH患者检测的比较各组中FLAER缺失率平均值均大于CD59缺失率,但差异无统计学意义(P>0.05),见表1,表明在非PNH组中FLAER和CD59检测无显著差异。对照组中FLAER缺失率为0.0%,特异性100%,有3例存在CD59缺失,缺失率均小于1%。13例AA患者中5例检测出FLAER缺失,其中4例检测出CD59缺失,1例未检测出,见图2;11例MDS患者中3例检测出FLAER缺失,其中2例存在CD59缺失,1例CD59缺失率为0,见表2。结果说明FLAER检测比CD59检测更为敏感,特异性更好。

A:PNH患者FLAER缺失率为5.5%;B:PNH患者CD59缺失率为23.2%。

图1 PNH患者FLAERD59和CD59的缺失率
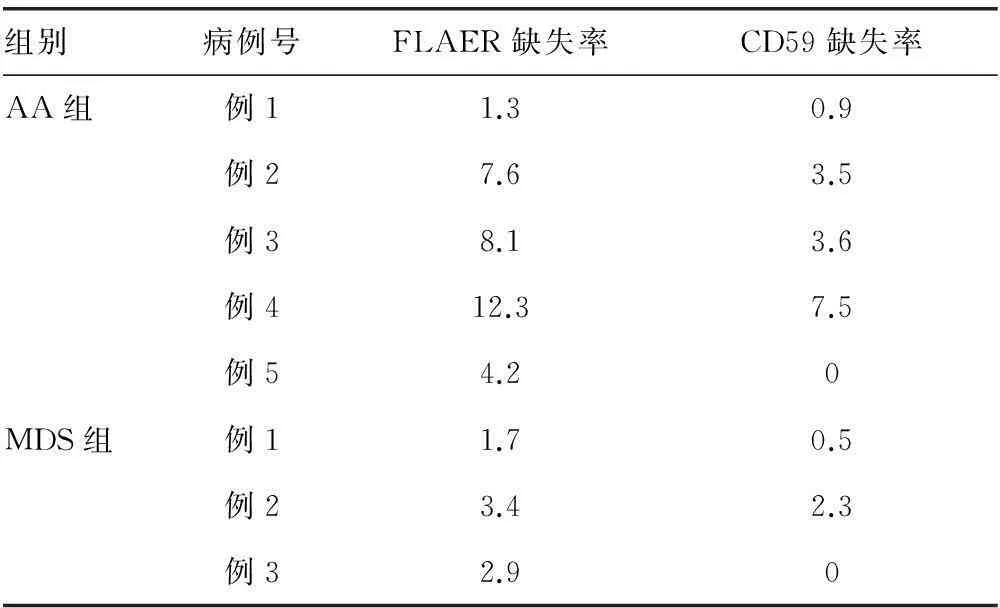
表2 PNH阳性MDS和AA患者FLAER和
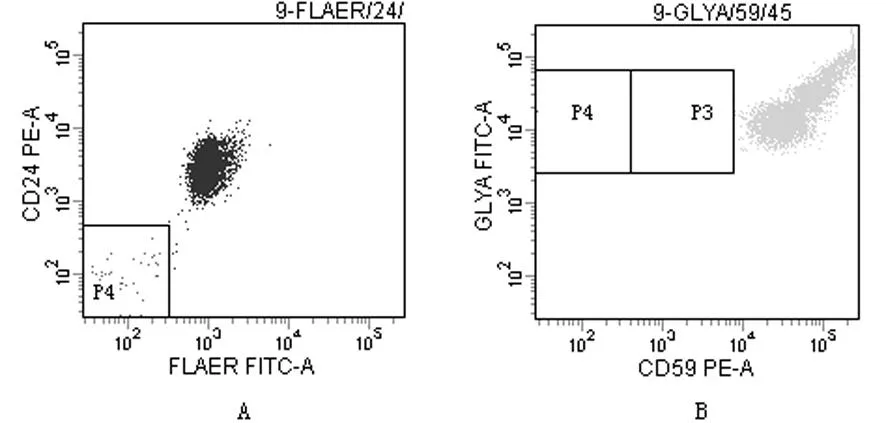
A:AA患者FLAERD59缺失率为4.2%;B:AA患者CD59缺失率为0%。
图2AA患者FLAERD59和CD59的缺失率
3讨论
到目前为止,已经发现了20多种蛋白在PNH患者血细胞表面表达缺乏,其中红细胞膜上衰变加速因子(CD55)和反应性溶血膜抑制物(CD59)的缺失被认为是引起PNH病理生理的主要原因[6]。红细胞数目多、抗体表达强是灵敏度检测最好的目标细胞。尤其是在一些粒细胞减少的疾病中如AA、MDS,红细胞检测尤为重要。同时,通过比较红细胞和白细胞的数值,可以给临床提供更多信息[7]。CD55分子在红细胞上表达较低,而CD59分子的荧光染色强且均一,近些年来已成为PNH诊断的“金标准”。然而,越来越多的研究发现检测红细胞CD59表达对PNH的诊断有一定的局限性。本研究发现,在PNH组的两例患者中,一例CD59缺失率为5.5%,另一例CD59缺失率为2.9%,而FLAER缺失率分别为23.2%和47.7%。可能是由于患者正处于疾病的活动期,接受输血治疗,影响了红细胞CD59的表达,导致CD59表达出现假阳性。有研究表明,在小细胞低色素性贫血时,病人的红细胞膜表面的CD59表达均有降低,但粒细胞是正常的,若只检测红细胞的CD59会造成其表达假阴性[8]。此外,正常细胞衰老时表面分子CD59还有可能自发丢失,均可导致检测值偏离事实[9]。随着技术不断进步,人们研究出了FLAER技术,FLAER是Alexa-488标记的无活性的嗜水气单胞菌溶素前体的变异体,可以特异性地与GPI锚链蛋白结合,在所有具有GPI锚连蛋白的粒细胞上均有特异性表达,不会因不同细胞表达GPI锚链蛋白的多少和种类不同造成误差。由于FLAER能直接检测GPI蛋白,有助于识别真正的PNH和免疫性血细胞减少症,明确真正的GPI阴性细胞。本研究中对照组FLAER检测缺失率均为0,与CD59相比检验结果更具有特异性;在PNH组中,FLAER的缺失率显著高于CD59,敏感性更高。FLAER也是防止门内出现污染细胞最好的抗体。如果门内污染了少量的CD24阴性表达的细胞群,可能会被误认为是小的PNH克隆,而FLAER与CD24一起使用可以提高PNH检测的准确性,CD24/FLAER双阴性细胞群才是真正PNH克隆细胞群。FLAER多参数检测要求外周血标本采集后必需及时送检,否则会导致粒细胞存活率下降,细胞非特异性染色增强,影响检测效果。这在一定程度上影响了FLAER在临床上的应用。PNH克隆的检出对于MDS和AA的临床表现、治疗及转归有重要意义。部分具有PNH克隆的AA患者对免疫治疗效果更好,即使小于0.1%的克隆也会影响治疗效果[7]。对于检测出少量PNH克隆的AA患者,需监测PNH克隆数的变化,因为患者有可能发展为溶血性贫血。在本研究中,PNH与MDS的关系只局限在低危MDS中,表现为血细胞减少,骨髓增生低下;遗传学异常发生率低,临床过程惰性进展,更多地表现为骨髓衰竭的特点。AA组、MDS组中FLAER的缺失率均大于CD59的缺失率。由于AA和低增生性MDS的鉴别十分困难,但到目前为止还没有报道MDS的患者进展为PNH,监测PNH克隆对于这两种疾病的鉴别具有一定的意义。AA、MDS患者中检测出的PNH克隆常常很小,CD59检测不易测出。在这两组中各有1例患者CD59缺失率为0,而FLAER表达均有缺失,缺失率分别为4.2%、2.9%。FLAER检测更敏感,与CD59相比灵敏度更高。由于AA、低增生性MDS和PNH均属于骨髓衰竭性疾病,具有相似的发病机制、临床表现和生物学特性,三种疾病之间的鉴别很困难。FLAER检测与CD59相比灵敏性和特异性更高。能够早期提供更为灵敏、特异的PNH克隆依据,在临床症状不典型、诊断不明确的疑似PNH患者,辅以FLAER检测有助于早期确诊或除外诊断。因此,FLAER高灵敏度检测PNH克隆对这三种疾病及疾病之间的诊断鉴别及了解临床过程、预后及转归具有一定的意义。
参考文献
[1]Sutherland DR,Keeney M,Illingworth A.Practical guidelines for the high-sensitivity detection and monitoring of paroxysmal nocturnal hemoglobinuria clones by flow cytometry[J].Cytometry B Clin Cytom,2012,82(4):195-208.
[2]付蓉.阵发性睡眠性血红蛋白尿症现代诊断与治疗[J].中国实用内科杂志,2012,32(5):327-330.
[3]Tembhare P,Ramani M,Syed K,et al.Flow cytometric analysis of erythrocytes in paroxysmal nocturnal hemoglobinuria reveals superiority of CD59 as a diagnostic marker compared to CD55[J].Indian J Pathol Microbiol,2010,53(4):699-703.
[4]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:6-9.
[5]Steven HS,Campo E,Harris NL,et al.WHO classification of tumours of haematopoietic and lympnhoid tissues[M].Lyon:IARC press,2008:99.
[6]Brodsky RA.Paroxysmal nocturnal hemoglobinuria[J].Blood,2014,124(18):32011-32084.
[7]Borowitz MJ,Craig FE,Digiuseppe JA,et al.Guidelines for the diagnosis and monitoring of paroxysmal nocturnal hemoglobinuria and related disorders by flow cytometry[J].Cytometry B Clin Cytom,2010,78(4):211-230.
[8]Piedras J,López-Karpovitch X.Flow cytometric analysis of glycosylphosphatidyl-inositol-anchored proteins to assess paroxysmal nocturnal hemoglobinuria clone size[J].Cytometry,2000,42(4):234-238.
[9]Hillmen P,Lewis SM,Bessler M,et al.Natural history of paroxysmal nocturnal hemoglobinuria[J].N Engl J Med,1995,333(19):1253-1258.
(收稿日期:2016-01-12)
DOI:10.3969/j.issn.1673-4130.2016.08.055
文献标识码:A
文章编号:1673-4130(2016)08-1139-03
△通讯作者,E-mail:shoujunxie69@163.com。
·临床研究·

