两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较
袁惠君,刘 轲,王春梅,谢辉灿,李虎军,贾鸿震
(1.兰州理工大学生命科学与工程学院,甘肃 兰州730050; 2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较
袁惠君1,刘 轲1,王春梅2,谢辉灿1,李虎军1,贾鸿震1
(1.兰州理工大学生命科学与工程学院,甘肃 兰州730050; 2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
摘要:以宁夏枸杞(Lycium barbarum)中的两个品种扁果枸杞和宁杞0702为材料,对比二者在渗透胁迫、盐处理以及渗透胁迫和盐处理互作条件下的生长特征、叶组织含水量以及各器官Na+、K+积累量分析。结果表明,与对照相比,-0.5 MPa渗透胁迫下,扁果枸杞和宁杞0702的生长均受到抑制,其鲜重分别降低了34%和38%,根长分别降低了32%和17%;与对照相比,50 mmol·L-1NaCl使扁果枸杞幼苗的鲜重显著增加了38%(P<0.05),干重、株高和根长均不受影响,但宁杞0702幼苗鲜重、干重、株高和根长分别显著降低了27%、34%、44%和14%(P<0.05);渗透胁迫+盐处理下,扁果枸杞幼苗与对照组差异不显著(P>0.05),而宁杞0702幼苗的鲜重、干重、株高和根长分别显著降低了37%、28%、44%和13%。与对照相比,渗透胁迫下,扁果枸杞叶组织含水量维持稳定,而宁杞0702显著降低了12%(P<0.05);在盐处理下,扁果枸杞和宁杞0702叶组织含水量分别显著增加了25%和18%(P<0.05),在渗透胁迫+盐处理下二者均维持稳定。在扁果枸杞中,鲜重和叶组织含水量与叶、茎中Na+浓度呈极显著正相关(P<0.01),而在宁杞0702中,鲜重仅与叶中的K+浓度极显著正相关(P<0.01),与茎中的Na+则呈显著负相关(P<0.05),叶组织含水量则与各器官中的Na+、K+浓度均不相关。与对照相比,扁果枸杞在渗透胁迫和盐处理下ST值分别显著增加了84%和43%(P<0.05),而宁杞0702则分别显著降低了63%和47%(P<0.05)。上述结果表明,扁果枸杞能通过体内积累适量的Na+,调控体内Na+、K+平衡,改善体内的水分状况,维持其正常的生长,具有盐生植物的特点;宁杞0702 则不具备这些特征。
关键词:宁夏枸杞;扁果枸杞;宁杞0702;耐渗透胁迫;耐盐
干旱和土壤盐渍化是人类面临的世界性难题,也是导致作物减产、天然植被退化和生态环境恶化的两种主要的非生物因素[1-2]。全世界干旱、半干旱荒漠地约占陆地面积(1.49亿km2)的1/3[3],约10%(9.50×108hm2)的地表面积和50%的灌溉地(2.3×108hm2)受到盐渍化危害[4]。我国是世界上旱灾和土壤盐碱化最严重的国家之一,干旱半干旱地区占国土面积的50.8%[5-6],盐碱土面积约为3.5×107hm2[7],是制约我国农业生产和生态环境建设的主要因素。
宁夏枸杞(Lyciumbarbarum)是一种我国西北地区广泛栽培的经济灌木,具有极强的耐旱、耐盐碱和耐贫瘠性,是防风固沙和开发盐碱地的先锋植物,也可作为优良饲草[8-10]。宁夏枸杞在年降水量300 mm左右的半干旱地区大量分布[11];在持续干旱导致土壤含水量降至3.56%时进行复水,宁夏枸杞叶仍具有活力[12];宁杞1号在土壤含盐量为0.3%~0.6%条件下能够正常生长,其耐盐极限值为9 g·kg-1,相当于对照土壤含盐量(1.2 g·kg-1)的7.5倍[13]。同时,宁夏枸杞根、叶、果实均可入药,尤其是其干燥果实——枸杞子,作为名贵中药和滋补品已有两千多年的历史,在东南亚地区享有盛誉,其生产销售具有独占性优势,成为当地重要的经济支柱[14]。因此,作为西北半干旱地区重要的药用栽培经济林种,宁夏人工栽培枸杞已有近600年历史,利用杂交育种、系统育种、辐射育种等方法培育出了多个宁夏枸杞优良品种[15-16]。但是,由于品种来源、选育方向等不同,各品种的抗逆特性存在显著差异。系统地研究宁夏枸杞品种间耐渗透胁迫和耐盐的特性,是开发利用旱地、盐碱地并提高干旱和盐碱化地区宁夏枸杞产量和品质的重要手段。
本研究以扁果枸杞和宁杞0702为材料,对比二者在渗透胁迫、盐处理、渗透胁迫与盐互作条件下,其生长特征、叶相对含水量、各器官Na+、K+积累值,旨在阐明二者耐渗透胁迫、耐盐能力的差异及在逆境下生理变化的规律,为宁夏枸杞耐盐抗旱品种选育及评价提供依据。
1材料与方法
1.1材料培养
宁夏枸杞品种“扁果枸杞”和“宁杞0702”种子于2013年采自白银市景泰县玉杰农贸有限公司枸杞引种示范基地。挑选籽粒饱满的种子用2%次氯酸钠消毒8~10 min后,蒸馏水冲洗8~10次,然后将消毒好的种子均匀铺在有湿润滤纸的平皿里,置于4 ℃冰箱24 h后,于26 ℃下避光培养4~5 d。待种子萌发,胚根长至0.5 cm长时,种于装有蛭石的穴盘中,浇灌1/2 Hoagland营养液。1/2 Hoagland营养液包括1 mmol·L-1KNO3,0.25 mmol·L-1NH4H2PO4,0.125 mmol·L-1MgSO4·7H2O,0.125 mmol·L-1Ca(NO3)2·4H2O,0.25 mmol·L-1Fe-citrate,46 mmol·L-1H3BO3,9 μmol·L-1MnCl2·4H2O,0.8 μmol·L-1ZnSO4·7H2O,0.3 μmol·L-1CuSO4·5H2O,0.35 μmol·L-1(NH4)6Mo7O24·4H2O[17]。每3 d换一次营养液,温室的昼夜温度为(24±2) ℃/(18±2) ℃,光照时间16 h·d-1,光照强度约600 μmol·m-2·s-1,相对湿度约为50%。4周后,挑选健壮整齐幼苗用于试验。
1.2试验处理
将4周龄宁夏枸杞幼苗进行如下处理:1)用正常的1/2 Hoagland营养液浇灌(对照组,Control);2)用山梨醇(D-sorbitol)配成总渗透势为-0.5 MPa的1/2 Hoagland溶液浇灌(渗透胁迫组,-0.5 MPa);3)用含有50 mmol·L-1NaCl的1/2 Hoagland营养液浇灌(盐处理组,50 mmol·L-1NaCl);4)用山梨醇将含有50 mmol·L-1NaCl的1/2 Hoagland营养液配成的总渗透势为-0.5 MPa的1/2 Hoagland溶液浇灌(渗透胁迫+盐处理组,-0.5 MPa+50 mmol·L-1NaCl)。每天更换一次处理液,3 d后取样测量有关指标。每处理6~8个重复,每个重复包括2~3株幼苗。
1.3各种指标的测量方法
鲜重、干重和叶组织含水量的测定方法为:幼苗用蒸馏水快速冲洗表面灰尘,吸水纸吸干表面水分,迅速将其分成根、茎、叶,测量鲜重(Fresh Weight,FW)和株高,并把根放入预冷至0 ℃的20 mmol·L-1CaCl2中润洗8 min(每4 min为1次,共两次),以交换细胞壁间中的离子,然后用蒸馏水冲洗3次,吸干表面水分,测量根长;鲜材料放入105 ℃的烘箱中杀青10 min后,80 ℃烘干至恒重,称干重(Dry Weight,DW)[18]。所得烘干材料用于测定各器官中Na+、K+离子含量。
叶组织含水量=(FW-DW)/DW.
式中,FW为鲜重,DW为干重[19]。
Na+、K+浓度的测定参考文献[18]的方法,将烘干至恒重的根、茎、叶样品捣碎,放入20 mL试管中,加100 mmol·L-1的冰乙酸10 mL后,密封试管,置于96 ℃沸水中水浴2 h,冷却,过滤,稀释适当倍数后,在火焰光度计(2655-00,Cole-Parmer Instrument Co.,USA)上测定离子含量。
根系K+、Na+选择性运输系数(ST)=(地上部的K+/ Na+)/(根中的K+/ Na+)[20-24]。ST值表示根系选择性运输K+、Na+能力的大小。ST值越大,表示根系控制Na+、促进K+向植株地上部运输的能力越强[25-26]。
1.4数据计算和统计分析
用Excel制图,SPSS 13.0软件进行统计分析,采用单因素方差分析、相关性分析和A×B析因分析比较不同处理间各项指标的差异。
2结果与分析
2.1渗透胁迫和盐处理对扁果枸杞和宁杞0702生长的影响
-0.5 MPa渗透胁迫下,与各自对照相比,扁果枸杞幼苗的鲜重、干重和根长分别显著降低了34%、33%和32%(P<0.05),而宁杞0702的鲜重、株高和根长亦分别显著下降了38%、60%和17%,说明渗透胁迫对两种宁夏枸杞的生长均有显著抑制作用(图1)。
但在50 mmol·L-1NaCl处理下,扁果枸杞幼苗的鲜重显著增加38%(P<0.05),且在有50 mmol·L-1NaCl存在的情况下,渗透胁迫对幼苗的生长无抑制作用,渗透胁迫+盐处理使其鲜重、干重、株高和根长与对照组相比差异不显著(P>0.05)。然而,上述处理却对宁杞0702幼苗生长表现出抑制作用,盐处理使其鲜重、干重、株高、根长分别显著降低了27%、34%、44%和14%(P<0.05);渗透胁迫+盐处理组的鲜重、干重、株高、根长分别显著降低了37%、28%、44%和13%(P<0.05,图1)。
-0.5 MPa渗透胁迫和50 mmol·L-1NaCl对扁果枸杞鲜重和干重的主体效应分别达到极显著(P<0.01)和显著(P<0.05)水平,盐处理的影响均大于渗透胁迫,但渗透胁迫和盐处理互作不影响扁果枸杞鲜重和干重(表1),说明50 mmol·L-1NaCl是促进扁果枸杞鲜重增加和维持干重稳定最主要的因素。在宁杞0702中,-0.5 MPa渗透胁迫对其鲜重和50 mmol·L-1NaCl对其干重的主体效应也分别达到极显著(P<0.01)和显著(P<0.05)水平,且渗透胁迫和盐处理对鲜重的降低均有交互作用,但对干重没有交互作用(表1),表明-0.5 MPa渗透胁迫和50 mmol·L-1NaCl分别是导致宁杞0702鲜重和干重降低的主要因素;且渗透胁迫和盐处理互作影响宁杞0702的鲜重,但不影响干重。3种处理均不影响扁果枸杞的株高,但均是宁杞0702株高降低的影响因素,渗透胁迫、渗透胁迫和盐处理互作对宁杞0702株高的影响大于盐处理。在扁果枸杞中,盐处理、渗透胁迫和盐处理互作是影响根长的主要因素,50mmol·L-1NaCl能消除由-0.5 MPa渗透胁迫引起的根长降低作用。在宁杞0702中,渗透胁迫和盐处理的互作是影响根长的主要因素。
2.2渗透胁迫和盐处理对扁果枸杞和宁杞0702叶组织含水量的影响

图1 渗透胁迫和盐处理对扁果枸杞和宁杞0702生长的影响
注:不同小写字母表示同一品种不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters for the same cultivar indicate significant difference among different treatments at 0.05 level. The same below.

表1 渗透胁迫和盐处理对扁果枸杞和宁杞0702生长的析因分析
注:“*”表示显著(P<0.05),“**”表示极显著(P<0.01)。下同。
Note: “*” and “**” indicate significant effect at 0.05 and 0.01 level, respectively. The same below.
与对照相比,渗透胁迫下扁果枸杞叶组织含水量维持稳定,而宁杞0702显著降低了12% (P<0.05,图2)。但是,在盐处理下,扁果枸杞和宁杞0702叶组织含水量分别显著增加了25%和18%(P<0.05),在渗透胁迫+盐处理下均维持稳定。

图2 渗透胁迫和盐处理对扁果枸杞和
50 mmol·L-1NaCl是促进扁果枸杞叶组织含水量增加的主要因素。-0.5 MPa渗透胁迫和50 mmol·L-1NaCl均影响宁杞0702叶组织含水量,且渗透胁迫的影响大于盐处理(表2)。扁果枸杞叶组织含水量与鲜重呈显著正相关(表3)。
2.3渗透胁迫和盐处理下扁果枸杞和宁杞0702器官中Na+、K+积累的差异
与对照相比,扁果枸杞和宁杞0702叶Na+浓度在渗透胁迫下分别显著增加14%和21%(P<0.05),在盐处理下分别显著增加62%和94%,在渗透胁迫+盐处理下分别显著增加62%和52%(图3);扁果枸杞茎Na+浓度在渗透胁迫下显著降低63%,在盐处理和渗透胁迫+盐处理下分别显著增加202%和199%;宁杞0702茎Na+浓度在渗透胁迫、盐处理和渗透胁迫+盐处理下分别显著增加152%、421%和545%(图3);扁果枸杞根Na+浓度在盐处理下显著增加71%,宁杞0702根Na+浓度在盐处理和渗透胁迫+盐处理下分别显著增加53%和39%(图3)。扁果枸杞渗透胁迫+盐处理下其叶Na+浓度的增幅是渗透胁迫增幅的4.3倍,而宁杞0702仅为2.4倍;扁果枸杞渗透胁迫+盐处理下茎Na+浓度与对照相比增加了199%,渗透胁迫比对照降低了63%,而宁杞0702在渗透胁迫+盐处理下比对照增加了545%,渗透胁迫降低了152%。可见,在渗透胁迫+盐处理下,扁果枸杞将根部吸收的Na+运至地上部并主要积累在叶中,而宁杞0702则将根部吸收的Na+运至地上部并主要积累在茎中。
与对照相比,扁果枸杞叶K+浓度在盐处理下显著增加8%(P<0.05),而宁杞0702则在渗透胁迫、盐处理和渗透胁迫+盐处理下分别显著降低46%、37%和11%(图3);扁果枸杞茎K+浓度在渗透胁迫、盐处理和渗透胁迫+盐处理下分别显著增加10%、18%和26%,宁杞0702则在渗透胁迫和盐处理下分别显著降低20%和18%,在渗透胁迫+盐处理下显著增加11%(图3);扁果枸杞根K+浓度在渗透胁迫、盐处理和渗透胁迫+盐处理下分别显著降低39%、28%和42%,宁杞0702则在盐处理和渗透胁迫+盐处理下分别显著降低21%和36%(图3)。可见,扁果枸杞在渗透胁迫、盐处理和渗透胁迫+盐处理下维持地上部K+浓度稳定,而宁杞0702则出现叶K+浓度显著降低的现象。

表2 渗透胁迫和盐处理对扁果枸杞和宁杞0702叶组织含水量的主效应分析
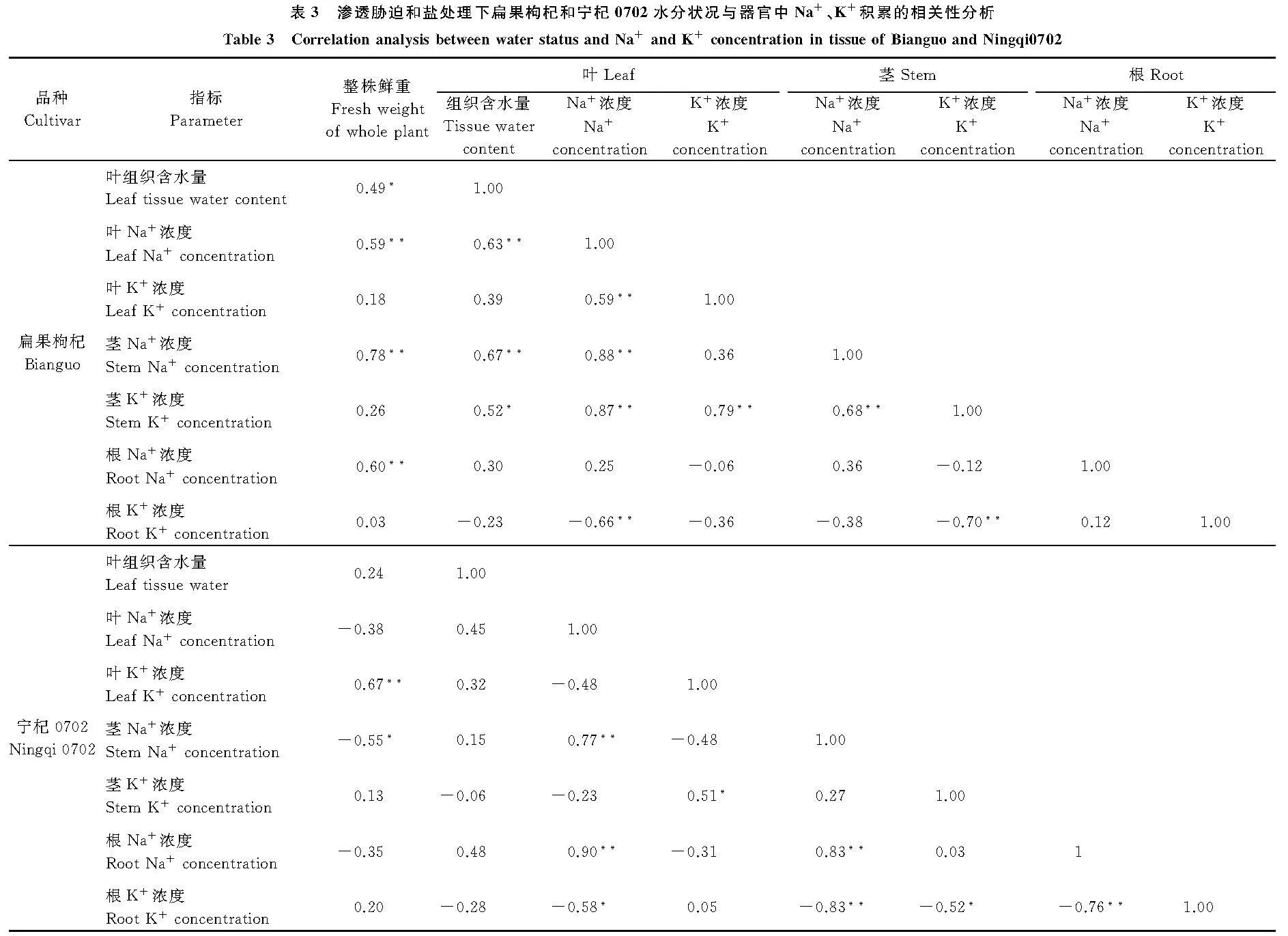

图3 渗透胁迫和盐处理对扁果枸杞和宁杞0702器官中Na+、K+含量的影响
对渗透胁迫和盐处理下2个宁夏枸杞品种鲜重、叶含组织水量和器官中Na+、K+浓度间进行相关性分析表明,在扁果枸杞中,鲜重与叶、茎、根中的Na+浓度均极显著正相关(P<0.01),叶组织含水量不仅与叶、茎中的Na+浓度极显著正相关,还与茎中的K+浓度显著正相关(P<0.05)(表3);而在宁杞0702中,鲜重仅与叶中的K+浓度极显著相关,与茎中的Na+则呈显著负相关,而叶组织含水量则与各器官中的Na+、K+浓度均不相关(表3)。
2.4扁果枸杞和宁杞0702根系K+、Na+选择性运输能力的差异
与对照相比,扁果枸杞在渗透胁迫和盐处理下ST值分别显著(P<0.05)增加84%和43%,而宁杞0702则分别显著降低63%和47%,说明扁果枸杞能通过提高K+/Na+选择性运输能力来适应盐或渗透胁迫(图4)。
3讨论与结论
3.1适量的NaCl能改善扁果枸杞的水分状况,缓解渗透胁迫对植株的伤害
渗透胁迫和盐胁迫均引起植物体内水分亏缺和细胞内离子平衡失调,导致细胞膜功能受损和代谢衰减,最终引起生长抑制甚至死亡[27-28]。本研究中,渗透胁迫下,扁果枸杞和宁杞0702均出现显著的生长抑制(图1),同时还引起宁杞0702叶组织含水量显著降低(图2),但50 mmol·L-1NaCl使扁果枸杞叶组织含水量增加的同时促进其鲜重和干重增加(图1,2),表明扁果枸杞可以通过自身调节叶的水分状况,进而缓解渗透胁迫对植株的伤害作用,促进植株生长。然而,宁杞0702的生长却显著受盐处理的抑制(图1)。

图4 渗透胁迫和盐处理对扁果枸杞和
3.2扁果枸杞具有盐生植物的特点
生活在盐碱环境中的盐生植物在漫长的进化过程中形成了有效的渗透调节机制,能通过在体内积累适量的Na+,降低叶肉细胞水势,提高细胞吸水能力,抵御盐胁迫,维持正常的生长[4,24-25,29-32]。本研究中,50mmol·L-1NaCl不仅促进扁果枸杞的生长和叶组织含水量的增加,还能消除-0.5 MPa渗透胁迫引起的生长抑制,这些都伴随着叶和茎Na+浓度的显著增加(图3);而在宁杞0702中,50 mmol·L-1NaCl不仅不能消除渗透胁迫引起的生长抑制,还引起了显著的生长抑制,虽然同时也伴随着叶Na+浓度的显著增加,但茎Na+浓度的增幅远远大于叶的(图3)。上述结果表明,在扁果枸杞中,当-0.5 MPa渗透胁迫下加入50 mmol·L-1NaCl时,Na+能从根部有效运输至叶中,提高细胞的吸水能力,改善植物体内水分状况,维持正常生长;而在宁杞0702中,虽然植株也能由根部吸收一些Na+进入体内,但这些Na+主要积累在茎中,渗透调节作用较弱,而Na+进入引起的毒害和水分亏缺促使植物出现生长抑制。
在多数甜土植物中,由于Na+和K+具有相似的离子半径和离子水合能,Na+能取代K+的结合位点,干扰K+的吸收,造成植物K+亏缺,进而抑制植物生长[22,33-35]。本研究中,与对照相比,在渗透胁迫、盐处理和渗透胁迫与盐处理互作的条件下,尽管扁果枸杞叶中Na+浓度增加,但叶K+浓度却维持稳定,甚至在盐处理下显著增加(图3),在渗透胁迫和盐处理下ST 值均显著增加(图4),而宁杞0702在同样条件下叶K+浓度却都显著下降(图3),在渗透胁迫和盐处理下ST 值均显著降低(图4),表明扁果枸杞在渗透胁迫或盐胁迫下具有强大的调控体内Na+、K+平衡的能力,进而维持植物正常的生长,宁杞0702根部向地上部选择性运输K+、Na+的能力较弱,因此,在渗透胁迫和盐处理下调控体内Na+、K+平衡的能力也较差,K+的吸收收到干扰。
综上所述,扁果枸杞具有盐生植物的特点,而宁杞0702与其不同。
参考文献(References)
[1]Chaves M M,Flexas J,Pinheiro C.Photosynthesis under drought and salt stress:Regulation mechanisms from whole plant to cell.Annals of Botany,2009,103(4):551-560.
[2]Peleg Z,Apse M P,Blumwald E.Engineering salinity and water-stress tolerance in crop plants:Getting gloser to the field.Advances in Botanical Research,2011,57:405-443.
[3]防灾网.全球范围内土地荒漠化现状.(2014-06-18)[2015-08-18].http://www.cibeicn.com/a/201406/20140618161448.html.
[4]Shabala S.Learning from halophytes:Physiological basis and strategies to improve abiotic stress tolerance in crops.Annals of Botany,2013,112:1209-1221.
[5]郑国光.科学应对全球气候变暖,提高粮食安全保障能力.求是,2009(23):47-49.
[6]张建锋.盐碱地的生态修复研究.水土保持研究,2008,15(4):74-78.
Zhang J F.Discussion on ecological rehabilitation of salt-affected soils.Research of Soil and Water Conservation,2008,15(4):74-78.(in Chinese)
[7]王秀丽,张凤荣,王跃朋,奉婷,廉晓娟,王艳.农田水利工程治理天津市土壤盐渍化的效果.农业工程学报,2013,29(20):82-88.
Wang X L,Zhang F R,Wang Y P,Feng T,Lian X J,Wang Y.Effect of irrigation and drainage engineering control on improvement of soil salinity in Tianjin.Transactions of the Chinese Society of Agricultural Engineering,2013,29(20):82-88.(in Chinese)
[8]刘静,王连喜,马力文,李凤霞,张小煜,苏占胜,周慧琴,李剑萍.枸杞的生理因子与外环境气象因子的日变化规律研究.干旱地区农业研究,2003,21(1):77-82.
Liu J,Wang L X,Ma L W,Li F X,Zhang X Y,Su Z S,Zhou H Q,Li J P.An experimental study on daily variations of environment factors and physiological parameters ofLyciumbarbarumL. Agricultural Research in the Arid Areas,2003,21(1):77-82.(in Chinese)
[9]陈艳瑞,尹林克.人工防风固沙林演替中群落组成和优势种群生态位变化特征.植物生态学报,2008,32(5):1126-1133.
Chen Y R,Yin L K.Community composition and niche change characteristics of dominant species in the wind-breaking and sand-fixing forest,Xinjiang,China.Journal of Plant Ecology(Chinese Version),2008,32(5):1126-1133. (in Chinese)
[10]阎宏,任万哲,刘红霞.枸杞生产加工废弃物饲用价值评价.饲料工业,2009,30(23):45-47.
Yan H,Ren W Z,Liu H X.The forage value evaluation of wolfberry waste in process.Feed Industry,2009,30(23):45-47.(in Chinese)
[11]申元村,景可.关于加快黄土高原水保生态建设的研究.中国水土保持,2002(12):22-24.
Shen Y C,Jing K.Study on speeding up ecological building of soil and water conservation in the loess plateau.Soil and Water Conservation in China,2002(12):22-24.(in Chinese)
[12]宋丽华,高彬.持续干旱胁迫对中宁枸杞水分生理的影响.西北林学院学报,2010,5(3):15-19.
Song L H,Gao B.Effect of drought stress on water physiology inLyciumbarbarum.Journal of Northwest Forestry University,2010,5(3):15-19.(in Chinese)
[13]许兴,郑国琦,周涛,惠红霞.宁夏枸杞耐盐性与生理生化特征研究.中国生态农业学报,2002,10(3):70-73.
Xu X,Zheng G Q,Zhou T,Hui H X.Research on character of physiology and biochemistry and salt-tolerance of wolfberry in Ochr-Sierozems soil of Ningxia.Chinese Journal of Eco-Agriculture,2002,10(3):70-73.(in Chinese)
[14]陈清华,王朝良.宁夏枸杞产业发展优势和提升出口竞争力的对策.农业现代化研究, 2008,29(2):151-154.
Chen Q H,Wang C L.Advantage of Ningxia wolfberry industry and strategy of improving its export competitive power.Research of Agricultural Modernization,2008,29(2):151-154.(in Chinese)
[15]董静洲,杨俊军,王瑛.我国枸杞属物种资源及国内外研究进展.中国中药杂志,2008,33(18):2020-2027.
Dong J Z,Yang J J,Wang Y.Resources ofLyciumspecies and related research progress.China Journal of Chinese Meteria Medica,,2008,33(18):2020-2027.(in Chinese)
[16]秦垦,王兵,焦恩宁,李云祥,王俊.宁夏枸杞繁育系统初步研究.广西植物,2009,29(5):587-591,606.
Qin K,Wang B,Jiao E N,Li Y X,Wang J.Preliminary study on the breeding system ofLyciumbarbarum.Guihaia,2009,29(5):587-591,606.(in Chinese)
[17]袁惠君,马清,未丽,胡静,王沛,王锁民.液泡膜Na+/H+逆向转运蛋白基因沉默对霸王叶气孔特征的影响.草业科学,2015,32(6):902-907.
Yuan H J,Ma Q,Wei L,Hu J,Wang P,Wang S M.Effects of tonoplast Na+/H+antiporters gene silence on leaf stomata characteristics ofZygophyllumxanthoxylum.Pratacultural Science,2015,32(6):902-907.(in Chinese)
[18]杨海霞,徐萌,刘宁,郭绍霞.丛枝菌根真菌对两种草坪草耐盐性的影响.草业科学,2014,31(7):1261-1268.
Yang H X,Xu M,Liu N,Guo S X.Effects of arbuscular mycorrhizal fungi on salinity tolerance of two turfgrass.Pratacultural Science,2014,31(7):1261-1268.(in Chinese)
[19]Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyteSuaedamaritima.Plant Physiology,2007,45:559-571.
[20]Guo Q,Wang P,Ma Q,Zhang J L,Bao A K,Wang S M.Selective transport capacity for K+over Na+is linked to the expression levels of PtSOS1 in halophytePuccinelliatenuiflora.Functional Plant Biology,2012,39(12):1047-1057.
[21]Wang S M,Zhao G Q,Gao Y S,Tang Z C,Zhang C L.Puccinelliatenuifloraexhibits stronger selectivity for K+over Na+than wheat.Journal of Plant Nutrition,2004,27(10):1841-1857.
[22]Wang C M,Zhang J L,Liu X S,Li Z,Wu G Q,Cai J Y,Flowers T M,Wang S M.Puccinelliatenuifloramaintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+.Plant,Cell and Environment,2009,32(5):486-496.
[23]Ma Q,Li Y X,Yuan H J,Hu J,Wei L,Bao A K,Zhang J L,Wang S M.ZxSOS1 is essential for long-distance transport and spatial distribution of Na+and K+in the xerophyteZygophyllumxanthoxylum.Plant and Soil,2014,374(1):661-676.
[24]Yuan H J,Ma Q,Wu G Q,Wang P,Hu J,Wang S M.ZxNHX controls Na+and K+homeostasis at the whole-plant level inZygophyllumxanthoxylumthrough feedback regulation of the expression of genes involved in their transport.Annals of Botany,2015,115(3):495-507.
[25]Wang S M,Wan C G,Wang Y R,Chen H,Zhou Z Y,Fu H,Sosebee R E.The characteristics of Na+,K+and free proline distribution in several drought-resistant plants of the Alxa Desert,China.Journal of Arid Environments,2004,56:525-539.
[26]Wang S M,Zheng W J,Ren J Z,Zhang C L.Selectivity of various types of salt-resistant plants for K+over Na+.Journal of Arid Environments,2002,52(4):457-472.
[27]Munns R,Tester M.Mechanisms of salinity tolerance.Annual Review of Plant Biology,2008,59:651-681.
[28]Zhang J L,Flowers T J,Wang S M.Differentiation of low-affinity Na+uptake pathways and kinetics of the effects of K+on Na+uptake in the halophyteSuaedamaritima.Precision Engineering,2013,24(1):70-76.
[29]Flowers T J,Colmer T D.Salinity tolerance in halophytes.New Phytologist,2008,179(4):945-963.
[30]Zhang J L,Flowers T J,Wang S M.Mechanisms of sodium uptake by roots of higher plants.Plant and Soil,2010,326(1):45-60.
[31]Kronzucker H J,Britto D T.Sodium transport in plants:A critical review.New Phytologist,2011,189(1):54-81.
[32]Janz D,Polle A.Harnessing salt for woody biomass production.Tree Physiology,2012,32(1):1-3.
[33]Shabala S,Cuin T A.Potassium transport and plant salt tolerance.Physiologia Plantarum,2008,133(4):651-669.
[34]Horie T,Hauser F,Schroeder J.HKT transporter-mediated salinity resistance mechanisms inArabidopsisand monocot crop plants.Trends in Plant Science,2009,14:660-668.
[35]Zhang J L,Flowers T J,Wang S M.Differentiation of low-affinity Na+uptake pathways and kinetics of the effects of K+on Na+uptake in the halophyteSuaedamaritima.Precision Engineering,2013,4(1):70-76.
The differences between two cultivars ofLyciumbarbarumin osmotic stress tolerance and salt tolerance
Yuan Hui-jun1, Liu Ke1, Wang Chun-mei2, Xie Hui-can1, Li Hu-jun1, Jia Hong-zhen
(1.School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China;2.Lanzhou Institute of Husbandry and Pharmaceutical Sciences of CAAS, Lanzhou 730050, China)
Abstract:Growth, leaf tissue water content, Na+, K+ accumulation in plant tissues were studied under -0.5 MPa osmotic stress, 50 mmol·L-1NaCl and salt-osmotic intercross stress in Bianguo and Ningqi0702, two cultivars of Lycium barbarum. The results showed that both the growth of Bianguo and Ningqi0702 was inhibited under -0.5 MPa osmotic stress. Compared with the control, fresh weigh (FW) and root height of Bianguo and Ningqi0702 decreased by 34%, 38%, 32% and 17%, respectively. The addition of 50 mmol·L-1NaCl significantly increased FW of Bianguo by 38%, and no effect on dry weight (DW), plant height and root height of Bianguo. However, FW, DW, plant height and root height of Ningqi0702 significantly decreased by 27%, 34%, 44% and 14% under 50 mmol·L-1NaCl conditions, respectively. The growth of Bianguo remained unaffected when plants were exposed to salt-osmotic intercross stress, whereas FW, DW, plant height and root height of Ningqi0702 significantly decreased by 37%, 28%, 44% and 13% under salt-osmotic intercross stress, respectively. Compared with the control, leaf tissue water content of Bianguo remained unaffected under osmotic stress, whereas that of Ningqi0702 significantly decreased by 12%. Both the leaf tissue water content of Bianguo and Ningqi0702 increased by 25% and 18% under 50 mmol·L-1NaCl conditions, meanwhile, and remained unaffected under salt-osmotic intercross stress. Moreover, FW and leaf tissue water content were positively correlated with Na+ concentration in leaves and stems of Bianguo. However, for Ningqi0702, FW was positively correlated with K+ concentration in leaves and negative relation with Na+ concentration in stems. Both Na+ and K+ concentration had no correlation with leaf tissue water content in Ningqi0702. Compared with the control, the net selective transport capacity for K+ over Na+ (ST value) of Bianguo increased by 84% and 43% under osmotic stress and 50 mmol·L-1NaCl conditions, respectively, whereas that of Ningqi0702 decreased by 63% and 47%. These findings suggested that, Bianguo is able to accumulate a moderate concentration of Na+ in its leaves and have a strong ability to regulate Na+ and K+ homeostasis to improve water status, thus maintaining plant growth when subjected to drought and salinity. Bianguo possesses some characteristics of halophytes. Ningqi0702 haven’t these characteristics.
Key words:Lycium barbarum; Bianguo; Ningqi0702; osmotic stress tolerance; salt tolerance
Corresponding author:Yuan Hui-junE-mail: gsyhj@163.com
中图分类号:S567.1+9;Q945.78
文献标识码:A
文章编号:1001-0629(2016)4-0681-10*
通信作者:袁惠君(1974- ),女,甘肃天水人,副教授,硕导,博士,研究方向为植物逆境生理与分子生物学。E-mail: gsyhj@163.com
基金项目:国家自然科学基金(31460629);兰州市科技发展计划项目(2012-2-161);中国农业科学院科技创新工程项目(CAAS-ASTIP-2014-LIHPS-08)
收稿日期:2015-09-19接受日期:2015-12-08
DOI:10.11829/j.issn.1001-0629.2015-0526
袁惠君,刘轲,王春梅,谢辉灿,李虎军,贾鸿震.两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较.草业科学,2016,33(4):681-690.
Yuan H J,Liu K,Wang C M,Xie H C,Li H J,Jia H Z.The differences between two cultivars ofLyciumbarbarumin osmotic stress tolerance and salt tolerance.Pratacultural Science,2016,33(4):681-690.

