功能性残肝体积比联合ICG R15对选择性出入肝血流阻断肝切除术肝储备功能评估分析
万春 戴兵 万品文
·论 著·(临床实践)
功能性残肝体积比联合ICG R15对选择性出入肝血流阻断肝切除术肝储备功能评估分析
万春 戴兵 万品文
目的 探讨功能性残肝体积比联合吲哚氰绿15 min内滞留率(indocyanine green retention rate at 15 minute,ICG R15)评估选择性出入肝血流阻断肝切除术肝储备功能。方法 回顾分析2012年8月至2015年7月对83例合并乙型肝炎后肝硬化行区域性出入肝血流阻断肝切除术的肝细胞癌病人资料。检测术前Child-Pugh分级评分、ICG R15和术后肝功能不全程度,行术前CT和术中排水法计算功能性残肝体积比(ratio of functional remnant liver volume ,%RLV)。Child-Pugh评分分为A级、B级二组,ICG R15分为<10%、10%~20%、>20%三组,%RLV分为40%~60%、60%~80%、>80%三组,术后肝功能不全程度分为轻度、中度、重度三组。在Child-Pugh评分基础上,%RLV联合ICG R15对比分析肝储备功能,χ2检验和t检验分析差异性。结果 不同肝功能不全组ICG R15组内差异有统计学意义(P<0.05),%RLV组内差异有统计学意义(P<0.01)。随着ICG R15递增和%RLV下降术后肝功能不全程度渐加重,差异有统计学意义(P<0.05)。重度肝功能不全均发生于Child-Pugh B级。平均阻断时间为(17±12) min,阻断1次62例,间歇5 min阻断2次11例,阻断3次10例。术中平均出血量为(437±316) ml,围手术期无死亡病例。结论 功能性残肝体积比联合ICG R15较Child-Pugh分级更精确预测选择性出入肝血流阻断肝切除术肝功能不全程度。
肝细胞癌;肝切除术;肝体积比;吲哚氰绿清除试验
手术切除是肝细胞癌获得根治性疗效的首选方法。我国肝癌病人多合并乙型肝炎后肝硬化,术前准确量化评估肝储备功能对围手术期处理具有重要意义。我们于2012年8月至2015年7月对83例肝细胞癌合并乙型肝炎后肝硬化病人行区域性出入肝血流阻断肝切除术,尝试在Child-Pugh评分基础上,采用功能性残肝体积比(ratio of functional remnant liver volume,%RLV)联合吲哚氰绿15 min滞留率(indocyanine green retention rate at 15 minute, ICG R15)术前评估肝储备功能,报告如下。
资料与方法
一、一般资料
本组83例,男性58例,女性25例,平均年龄(46.3±15.2)岁,无梗阻性黄疸、门体分流手术史及损害肝脏药物应用。术前Child-Pugh评分A级48例,B级35例。均为大或巨大肝癌,肿瘤直径5~10 cm 57例,10~21 cm 26例。按Couinaud分段,行1个肝段切除32例,2个肝段切除23例,3个肝段切除16例,4个肝段切除12例。术后病理均证实为肝细胞癌合并肝硬化。
二、手术方法
全组均行区域性出入肝血流阻断肝切除术,依据肿瘤不同位置游离区域出入肝脉管并预置阻断带。术中仔细游离第一、二、三肝门。下拉肝门板,分离右肝门、右前区、右后区、左肝门Glisson鞘,分别预置肝血流阻断带;切断腔静脉韧带,游离肝上静脉隐窝,切断、结扎Arantius管上端,于肝左、中静脉共干根部、肝右静脉和肝上、肝下下腔静脉部预置出肝血流阻断带;沿肝后下腔静脉前间隙向上游离预置绕肝提拉阻断带;距肿瘤所属区、段收紧出入肝血流阻断带,必要时间歇5 min再次阻断,尽量减少因阻断引起的残肝缺血体积和阻断时间。距肿瘤边缘1 cm电刀标记切缘离断肝脏,用北京恒福思特公司“自速封”微波止血分离器(MS7-9)切开肝脏,固化创面以止血,仔细、快速、准确分离、暴露脉管和胆管组织后止血夹钳夹、切断,完整区域性切除肝叶肿瘤,在此基础上尽量多保留有功能肝组织。排水法量取切除肝体积、肿瘤体积。
三、实验室检查和ICG R15试验
术前及术后第1、3、7天行肝功能、血凝常规、血氨检查和Child-Pugh评分分级。术后肝功能不全程度判定标准见表1[1]。术前2 d用DDG-3300K分析仪(日本光电工业株式会社制造)按系统软件检测ICG R15。吲哚氰绿(ICG)购自沈阳济世制药有限公司(25 mg/安瓿),加灭菌用水配置为5 mg/dl溶液,按0.5 mg/kg静脉注射检测ICG R15。

表1 肝功能不全程度标准
注:5项指标中有3项以上同时出现视为肝功能不全;ALT.丙氨酸转氨酶;TBIL.血清总胆红素;PT.凝血酶原时间
四、%RLV测定
术前用美国GE公司LightSpeed 64排螺旋CT进行常规肝脏三期扫描,将获得的影像数据导入MyrianXP-Liver医学影像分析系统计算全肝体积。残余肝体积=全肝体积-切除肝体积,功能性肝体积=全肝体积-肿瘤体积,%RLV=残余肝体积/功能性肝体积[2-5]。
五、统计学分析
结 果
本研究显示,术前用Child-Pugh分级评为A级病人术后肝功能轻度不全率为54.2%(26/48),中度功能不全率为45.8%(22/48),无重度肝功能不全;B级病人术后肝功能轻度不全率为31.4%(11/35),中度不全率为51.4%(18/35),重度不全率为17.2%(6/35)。A级轻度不全率高于B级,差异有统计学意义(P<0.05),B级中度不全率高于A级,差异有统计学意义(P<0.05),重度不全均发生于Child-Pugh B级。
术前ICG R15分为<10%、10%~20%、>20%三组,术后肝功能轻、中、重度功能不全组术前ICG R15渐升高,轻度组与中度组差异有统计学意义(P<0.05),中度组与重度组差异有统计学意义(P<0.01)。中度组中ICG R15 10%~20%组病例数高于<10%组,分别为22例(55%)、16例(40%),重度功能不全组中ICG R15 10%~20%组2例和ICG R15>20%组4例病人均为Child-Pugh B级,与Child-Pugh 分级对比差异有统计学意义(P<0.05),见表2。
%RLV分为40%~60%、60%~80%、>80%三组,术后肝损伤程度随%RLV降低渐加重,重度肝功能不全%RLV 40%~60%组占83.3%(5/6),60%~80%组占16.7%(1/6)。轻度和中度肝功能不全、中度和重度肝功能不全%RLV值差异均有统计学意义(P<0.01)。
本组83例平均阻断时间为(17±12) min,其中只阻断1次62例,间歇5 min 2次阻断11例,3次阻断10例。术中平均出血量为(437±316) ml,术后胆漏3例,无胆汁性腹膜炎,2例自愈,1例超声引导下穿刺引流愈合;全组无死亡病例。
讨 论
我国肝细胞癌病人多合并乙型肝炎后肝硬化,因肝脏储备功能差致手术风险增大。肝脏储备功能是肝脏应对生理负荷增加时可动员的额外代偿潜能,直接关系到手术创伤的耐受能力,决定于肝脏生化指标、解剖结构、有效体积、手术方式和创伤程度。术前较为全面准确地量化评估肝储备功能对预测、降低手术并发症发生显得尤为重要。合并乙型肝炎后肝硬化需肝叶切除手术病人术前肝功能正常仍不能代表其代偿能力良好,因此评估要求更精细、敏感,目前尚无一种全面、简洁、有效的针对此类病人的肝功能储备评价系统[6]。
Child-Pugh评分是临床常用肝功能评价方法,由于其存在着一些主观性较强的项目如肝性脑病、腹水程度分级等,且也与病人近期是否接受治疗等外源性因素有关。短期有效的治疗可以改善病人的生化指标、减少腹水量及降低肝性脑病分级,从而使Child-Pugh评分增加,但实际上并不能反映机体在受到麻醉、手术打击、感染等因素时是否有足够的代偿能力[7]。
ICG由于无毒、高选择性被肝细胞摄取、以原形排出、不参与肝肠循环、无淋巴逆流等优点,可以敏感地反映出肝脏功能和灌注情况。ICG R15可作为衡量肝储备功能的指标,其测定结果与Child-Pugh分级结果呈正相关性,ICG R15分值随Child-Pugh分值升高逐渐升高[8-10]。本研究发现Child-Pugh B级部分病人术后为重度肝功能不全,而ICG R15高于正常,已体现ICG R15对肝功能功能不全预测的敏感性,为手术指征和禁忌提供重要依据。
肝脏体积大小可直观地反映肝脏容量和肝细胞数量的变化,与肝切除术耐受性、风险度密切相关。目前检测方法很多,尚无精确的体积检测方法[11]。CT测量肝脏体积由于其准确性、可重复性在临床中广泛应用。Schindl等[12]报告残肝体积比与术后严重并发症发生率有关,当%RLV<26.6%时,术后感染、肝衰竭等发生率明显增高。但肝炎后肝硬化纤维组织增生,肝细胞密度下降,同时因肿瘤压迫使单位体积肝组织功能部分丧失,肝脏不同病损使单位体积内肝代偿能力差距较大,残肝体积不能准确地反映储备功能,使单纯用剩余肝体积难以量化评价储备功能。功能性残肝体积比更能准确地反映病人肝细胞容量变化情况[13-15]。本研究采用功能性残肝体积比联合ICG R15评估术后肝储备功能较Child-Pugh评分更精确预测术后肝功能不全程度。
随着肝脏外科手术技巧的进步及对肝脏解剖、生理的进一步认识,肝切除术中肝血流阻断方法经历了较大的演变。手术方式是减少肝脏损伤、加强残肝储备的重要方法。区域性出入肝血流阻断在出血和创伤达到最小且可控使肝脏手术创伤显著降低,如何尽最大可能减少大肿瘤切除中相邻残肝阻断体积和时间,达到有效控制出血量、增加残肝体积和代偿能力显得尤其重要,要求有更高的解剖准确性、可控性、低损性[16]。肝脏切面尤其肝硬化使血管交通支丰富,使单独行区域性血流阻断出血量控制技巧更具个体化。不同手术方式对术后残肝体积和肝功能不全程度影响不同,其术前ICG R15和Child-Pugh分级对术后肝储备功能评估不同,区域性出入肝血流阻断肝切除更加有利于对手术安全性的有效评估。本组病例均行肿瘤所属区、段出入肝血流阻断,32例附加绕肝提拉阻断,未行Pringer法和下腔静脉阻断。本研究发现区域性出入肝血流阻断下术后肝功能不全程度在Child-Pugh A级病人轻度概率大于中度,B级则相反,且重度肝功能不全均发生于B级,肝功能不全率为17.1%(6/35);术后轻度肝功能不全高于中度的概率随ICG R15值的增高显著降低,而ICG R15大于10%后相反,出现重度肝功能不全概率随之更加显著增加,ICG R15 10%~20%者重度肝功能不全率为6.1%(2/31),大于20%者重度肝功能不全率的66.7%(4/6);随着%RLV减少,术后轻度肝功能不全高于中度的概率显著降低,出现重度肝功能不全概率随之更加显著增加。
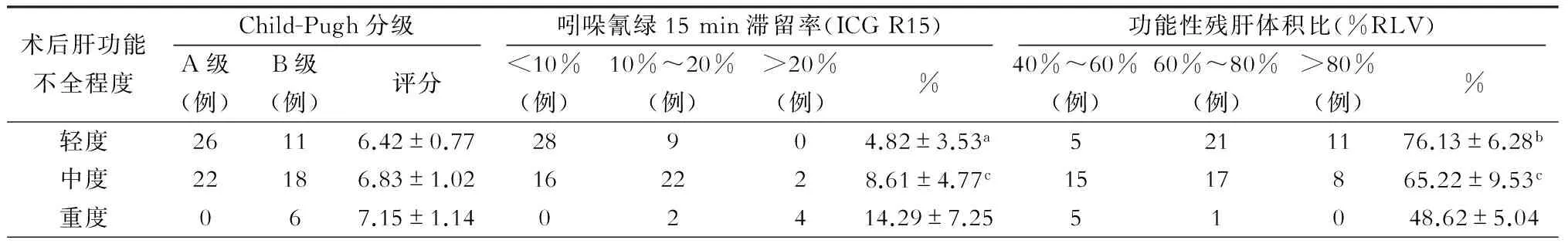
表2 ICG R15、%RLV与Child-Pugh分级对比术后肝功能不全程度
注:与中度比较,aP<0.05,bP<0.01;与重度比较,cP<0.01
总之,肝细胞癌合并乙型肝炎后肝硬化病人病情和手术方式的复杂性使术前肝储备功能评估量化复杂、困难。区域性出入肝血流阻断使肝损伤减轻,出血减少,在Child-Pugh分级基础上运用功能性残肝体积比联合ICG R15显著提高了肝脏功能恢复能力评估的准确性,但仍需引进更多新的评价指标以全面、准确地预测肝储备功能。
1 潘华锋,陈孝平,邹明丽,等.CT检查预测肝癌手术切除安全性的价值.肝胆外科杂志,2000,8:185-187.DOI:10.3969/j.issn.1006-4761.2000.03.013.
2 Bliznakova K, Kolev N, Buliev I, et al.Computer aided preoperative evaluation of the residual liver volume using computed tomography images. J Digit Imaging,2015,28:231-239. DOI: 10.1007/s10278-014-9737-5.
3 Yigitler C, Farges O, Kianmanesh R,et al.The small remnant liver after major liver resection: how common and how relevant?. Liver Transpl,2003,9:S18-S25.DOI:10.1053/jlts.2003.50194.
4 Schiano TD,Bodian C,Schwartz ME,et al.Accuracy and significance of computed tomographic scan assessment of hepatic volume in patients undergoing liver transplantation.Transplantation,2000,69:545-550.DOI:10.1097/00007890-200002270-00014.
5 Pomposelli JJ, Tongyoo A,Christoph Wald,et al.Variability of standard liver volume estimation versus software-assisted total liver volume measurement.Liver transpl,2012,18:1083-1092. DOI: 10.1002/lt.23461.6 Schreckenbach T,Liese J, Bechstein WO,et al.Posthepatectomy Liver Failure.Dig Surg,2012,29:79-85.DOI:10.1159/000335741.
7 Nagashima I,Takada T,Okinaga K,et al.A scoring system for the assessment of the risk of mortality after partial hepatectomy in patients with chronic liver dysfunction.J Hepatobiliary Pancreat Surg, 2005, 12:44-48.DOI:10.1007/s00534-004-0953-0.
8 Kim HJ, Kim CY, Park EK,et al.Volumetric analysis and indocyanine green retention rate at 15 min as predictors of post-hepatectomy liver failure. HPB (Oxford),2015,17:159-167.DOI:10.1111/hpb.12295.
9 Faybik P,Hetz H.Plasma disappearance rate of indocyanine green in liver dysfuntion.Transplant Proe,2006,38:801-802.DOI:10.1016/j.transproceed.2006.01.049
10 董家鸿,郑树森,陈孝平,等. 肝切除术前肝脏储备功能评估的专家共识(2011版). 中华消化外科杂志,2011,10:20-25.DOI:10.3760/cma.j.issn.1673-9752.2011.01.006.
11 Kim HJ, Kim CY, Hur YH, et al.Comparison of remnant to total functional liver volume ratio and remnant to standard liver volume ratio as a predictor of postoperative liver function after liver resection.Korean J Hepatobiliary Pancreat Surg,2013,17:143-151.DOI;10.14701/kjhbps.2013.17.4.143.
12 Schindl MJ, Redhead DN, Fearon KC,et al.The value of residual liver volume as a predictor of hepatic dysfunction and infection after major liver resection.Gut,2005,54:289-296.DOI:10.1136/gut.2004.046524.
13 Dinant S, de Graaf W, Verwer BJ,et al.Risk assessment of posthepatectomy liver failure using hepatobiliary scintigraphy and CT volumetry.J Nucl Med.2007,48:685-692.DOI:10.2967/jnumed.106.038430.
14 Lock JF, Malinowski M, Seehofer D, et al.Function and volume recovery after partial hepatectomy: influence of preoperative liver function, residual liver volume, and obesity.Langenbecks Arch Surg, 2012,397:1297-1304. DOI:10.1007/s00423-012-0972-2.
15 Dunkelberg JC,Feranchak AP,Fitz JG,et al.Liver cell volume regulation:size matters.Hepatology,2001,33:1349-1352.DOI: 10.1053/jhep.2001.24750.
16 Otsubo T. Control of the inflow and outflow system during liver resection. J Hepatobiliary Pancreat Sci,2012,19:15-18.DOI 10.1007/s00534-011-0451-0.
Evaluation of hepatic reserve function by ratio of functional remnant liver volume combined with ICG R15 for indication of hepatectomy by selective hepatic vascular occlusion
WanChun,DaiBing,WanPinwen.
DepartmentofHepaticSurgery,NanyangCentralHospital,Nanyang473009,China
WanChun,Email:mdchunwan@163.com
Objective To evaluate hepatic reserve function by ratio of functional remnant liver volume (%RLV) combined with ICG R15 for indication of hepatectomy by selective hepatic vascular occlusion (SHVO).Methods A retrospective analysis of hepatic reserve function was performed by %RLV combined with ICG R15 for hepatectomy by SHVO. Eighty-three patients with hepatocellular carcinoma and posthapatitic B cirrhosis were hospitalized from Aug. 2012 to July 2015. The data of pre-hepatectomy Child-Pugh score, ICG R15 and the extent of post-hepatectomy liver dysfunction were tested. %RLV was computed by CT before operation and drainage method during operation. The patients were divided into 2 groups of Child-Pugh A and B. The patients were divided into 3 groups of ICG R15<10%, ICG R15 10%-20% and ICG R15>20%. The patients were divided into 3 groups of %RLV 40%-60%, 60%-80% and >80%. The patients were divided into mild, moderate and severe groups according to post-hepatectomy liver dysfunction. The hepatic reserve function was evaluated by %RLV combined with ICG R15 on the basis of Child-Pugh score. The data were analyzed by T test or Chi-square test.Results The differences among the groups of ICG R15 were significant in different groups of post-hepatectomy liver dysfunction (P<0.05). The differences among the groups of %RLV were very significant (P<0.01). As ICG R15 increased and %RLV decreased, the extent of post-hepatectomy liver dysfunction aggravated gradually (P<0.05). Severe post-hepatectomy liver dysfunction occurred in group of Child-Pugh B. The average blocking time was (17±12) min. Sixty-two patients were subjected to continuous occlusion. Eleven and 10 patients respectively underwent 2 and 3 times of intermittent occlusion with an interval of 5 min. Average amount of blood loss was (437±316) mL. There were no perioperative deaths.Conclusions %RLV combined with ICG R15 may more accurately predict the extent of post-hepatectomy liver dysfunction by SHVO than Child-Pugh classification.
Hepatocellular carcinoma; Hepatectomy; Liver volume ratio; Indocyanine green retention test
473009 河南南阳,南阳市中心医院肝脏外科
万春,Email:mdchunwan@163.com
R735.7
A
10.3969/j.issn.1003-5591.2016.03.015
2015-12-28)

