射频消融治疗BCLC分期A期合并门静脉高压脾功能亢进的肝细胞癌(≤3.0 cm)较长期疗效分析
何跃明 张中林 刘权焰 袁玉峰 刘志苏
·论 著·(门静脉高压症外科专题)
射频消融治疗BCLC分期A期合并门静脉高压脾功能亢进的肝细胞癌(≤3.0 cm)较长期疗效分析
何跃明 张中林 刘权焰 袁玉峰 刘志苏
目的 探讨采用射频消融术治疗巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer,BCLC)A期合并门静脉高压脾功能亢进肝细胞癌(≤3 cm)的安全性及较长期疗效分析。方法 选取2008年1月至2011年1月期间武汉大学中南医院符合下列条件病人进行回顾性总结:①初次诊断肝细胞癌(≤3 cm)伴门静脉高压脾功能亢进;②初次治疗是采用射频消融术;③至2016年1月获得完整随访的临床资料。结果 共39例符合纳入标准,术后无死亡。随访时间平均53个月(10~95个月)。1、3、5、7年总生存率分别是94.8%(37/39)、51.5%(20/39)、25.6%(10/39)、17.9%(7/39);无瘤生存率分别是84.1%(34/39)、33.3%(10/39)、17.9%(7/39)、5.1%(2/39)。共32例死亡,其中21例(53.8%)死于肝癌复发转移,7例(17.9%)死于上消化道出血和肝衰竭,2例(6.2%)死于脑血管意外,1例(3.1%)死于心血管意外,1例(3.1%)死于车祸。影响预后的主要因素有肝功能B或C级,多发肿瘤或肿瘤位于特殊部位以及消融后肿瘤是否残留。结论 对于合并门静脉高压脾功能亢进的小肝癌,射频消融是一种安全有效的治疗方法,部分可获得较长期的生存效果。
肝肿瘤;射频消融;门静脉高压
虽肝移植是治疗合并门静脉高压脾功能亢进早期肝细胞癌(原发性肝癌,hepatocellular carcinoma,HCC)的最佳选择[1-2],但由于供体严重短缺以及较高的治疗费用,仅少数病人有机会接受肝移植治疗。肝功能储备较好的病人可以选择肝部分切除,但有多数该类病人由于肝功能储备较差,或并存严重的心脑血管疾病难以耐受肝切除的手术;还有部分病人由于恐惧而拒绝手术治疗。从而将超声或CT引导下经皮肝穿刺肝癌射频消融术(radiofrequency ablation,RFA),经皮肝穿刺无水酒精注射(percutaneous ethanol injectiontherapy,PEI),经肝动脉插管栓塞化疗(transarterial chemoembolization,TACE)等创伤小的方法作为其主要的治疗手段。由于RFA对小肝癌可以达到与手术切除相似的治疗结果[1,3-5],更好的肝实质保留及治疗安全性高等特点,越来越得到大家认同,但关于RFA对于合并门静脉高压脾功能亢进HCC治疗效果的报道并不多。本研究旨在通过回顾性的总结我院初次诊断为HCC,同时合并门静脉高压脾功能亢进、直径≤3.0 cm的小肝癌[按巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer,BCLC)为A期],采用射频消融治疗39例的临床资料及随访结果,探讨其安全性及较长期的疗效。
资料与方法
一、临床资料
入选条件:2008年1月至2011年1月武汉大学中南医院收治初次诊断为HCC,首次治疗是采用RFA。
1.HCC诊断标准[6]同时满足以下条件中的①+②a两项或者①+②b+③三项。①具有肝硬化以及HBV和(或)HCV感染[HBV抗原和(或)HCV抗体阳性]的证据。②典型的HCC影像学特征:同期多排CT扫描和(或)动态对比增强MRI检查显示肝脏占位在动脉期快速不均质血管强化(anerial hypervascularity),而静脉期或延迟期快速洗脱(venous or delayed phase washout)。a.如果肝脏占位直径≥2 cm,CT和MRI两项影像学检查中有一项显示肝脏占位具有上述肝癌的特征,即可诊断HCC;b.如果肝脏占位直径为1~2 cm,则需要CT和MRI两项影像学检查都显示肝脏占位具有上述肝癌的特征,方可诊断HCC。③血清甲胎蛋白(AFP)≥400 μg/L持续1个月或≥200 μg/L持续2个月。并能排除其他原因引起的AFP升高。以上标准不能明确需肝穿活检证实为HCC。
2.肝癌的分期 按BCLC分期提出的肝癌临床分期为A期[7],肿瘤直径≤3.0 cm,肝癌结节不超过3个。
3.肝功能分级和门静脉高压脾功能亢进的诊断标准[8]存在肝硬化,钡餐或内镜、加强CT示食管下端静脉曲张,超声或加强CT、MRI显示门静脉直径超过1.4 cm,脾长度≥10 cm(或大于5个肋单元)或厚度≥5 cm,血常规白细胞计数≤4.0×109/L,血小板计数≤10×109/L。肝功能的分级采用Child-Pugh评分法。
根据入选标准,共39例符合,男性29例,女性10例;年龄34~79岁,平均年龄(56.2±14.3)岁。Child-Pugh评分为A级12例,B级24例,C级3例。合并肝硬化门静脉高压脾功能亢进的病因中,乙型肝炎30例,丙型肝炎5例,血吸虫性2例,酒精性1例,自身免疫性1例。30例为单发病灶,2个病灶7例,3个病灶2例,共50个病灶。13例血浆AFP<20 μg/L,26例血浆AFP≥20 μg/L。肝右叶有43个病灶(35例),左叶7个(4例),左右叶均有病灶者5例。其中特殊部位(指邻近重要器官≤5 mm),邻近胆囊2例,膈顶3例,下腔静脉2例,其中3例为多发肿瘤。
二、射频治疗方法
术前血小板计数≥5×109/L,凝血酶原时间不超过正常值的50%。射频治疗前,对于AFP正常的病人先行肝穿刺活检。
射频消融治疗是采用RITA射频肿瘤消融系统1500型主机(RITA Medical Systems, Mountain View, CA, USA),功率150 W,射频发生器的频率为460 kHz。电极针为15G套针,内套针顶端有9根分布均匀的多极细针在肿瘤内呈伞状展开,可形成3.0~5.0 cm的类球形凝固区,细针的温度感应可实时监测消融区域的温度。
病人静脉给药镇痛,B超引导下穿刺电极针到达肿瘤边缘后向瘤内逐级展针(从2 cm开始,根据肿瘤大小,最后展针3~4 cm,其最大可展针至5 cm),保证消融范围的直径超过肿瘤直径1 cm,设定温度105 ℃,达到设定温度后持续10~12 min。退针时严格针道消融,避免针道种植和出血。
三、观察及随访项目[9]
1.主要的术后严重并发症及死亡情况 术后2周复查肝功能、AFP变化,加强CT或超声造影了解消融是否完全,消融残留者再次RFA或PEI。
2.随访 出院后半年内每2个月、半年后每3个月、1年后4~6个月复查肝功能、血常规、AFP、肝脏的加强CT或MRI。原消融病灶增大或病灶旁局部出现活性肿瘤,为局部复发,距离消融病灶2 cm以上出现肿瘤结节,为新发肿瘤复发。复发病人根据情况选择再次射频,PEI或TACE,以及手术,肝移植治疗。死亡病人记录死亡时间和原因。
四、统计学分析
结 果
一、围手术情况及消融效果
39例50个病灶均一次穿刺成功完成治疗。围手术期间无死亡。5例腹水轻度增加,3例出现胸腔少量积液,经加强支持及利尿治疗缓解;1例术后出现肝前积血(100 ml),1例出现肝内消融部位积血(15 ml),经穿刺引流,保守治疗痊愈。
5例6个结节发生消融残留,3例为单发结节,位于特殊部位(邻近胆囊、下腔静脉和膈顶各1例)再行RFA加PEI补充治疗;2例为多发结节者,其中有病灶靠近胆囊和下腔静脉。发现残留后给予PEI补充治疗。
二、生存率及死亡原因
本组病人均获得随访,随访至2016年1月止。随访时间为10~95个月,平均随访(53±18)月。随访结束时,死亡发生率为82.1%(32/39),其中21例死于肝癌复发转移(53.8%),7例死于(非肝癌复发)上消化道出血和肝衰竭(17.9%),其他原因(脑血管意外2例、心血管意外1例、车祸1例)4例(10.3%)。按不同时间其死亡原因及肝癌复发情况为:1年内2例死于肝衰竭及上消化道大出血(为Child-Pugh评分C级者);1~3年期间15例死于肝癌复发转移或上消化道大出血及肝衰竭,2例死于脑血管意外;3~5年期间8例死于肝癌复发转移或上消化道出血及肝衰竭,死于车祸和心血管意外各1例者有肝癌复发;5~7年期间仅剩5例无复发,死于肝癌复发2例,上消化道出血1例。Child-Pugh评分C级者,1例RFA术后6个月接受肝移植存活37个月(最终死于肝癌复发)。Child-Pugh评分B级者仅3例存活超过5年。
射频消融治疗后1、3、5、7年总生存率分别是94.8%(37/39)、51.5%(20/39)、25.6%(10/39)、17.9(7/39)%;无瘤生存率分别是84.1%(34/39)、33.3%(10/39)、17.9%(7/39)、5.1%(2/39)。生存曲线见图1。
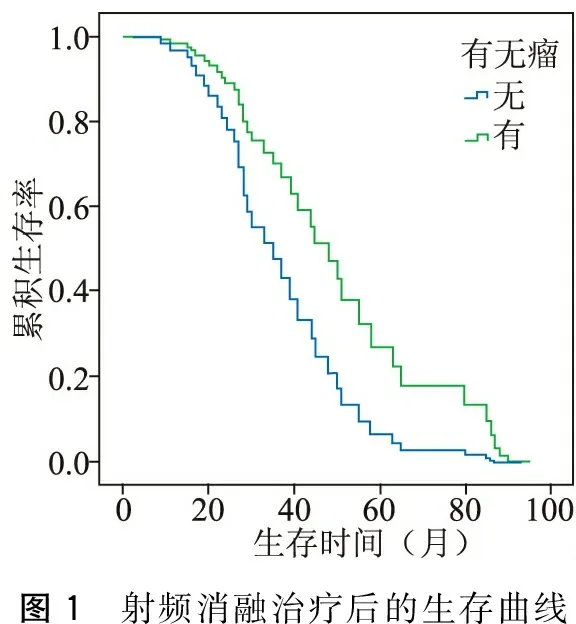
图1 射频消融治疗后的生存曲线
三、影响HCC射频治疗预后的因素分析
为了总结可能影响RFA治疗预后的高危因素,根据病人的肝功能Child-Pugh分级和病灶特点(肿瘤个数、特殊部位、肿瘤灭活情况)统计分析结果详见表1。
四、肝癌复发情况
1~3年期间39例病人中有15例(38.5%)肿瘤复发,特殊部位肿瘤57.1%(4/7)复发,多发者55.6%(5/9)复发,单发者23.3%(7/30),其中有1例既是特殊部位结节又是多发结节。特殊部位及多发者复发率与单发者比较,经Fisher精确检验,χ2=3.92,P=0.038。3~5年期间增加8例复发者,复发率为58.9%(23/39),5~7年期间新增复发4例,复发率为69.2%(27/39),存活7年以上者仅5例无复发。
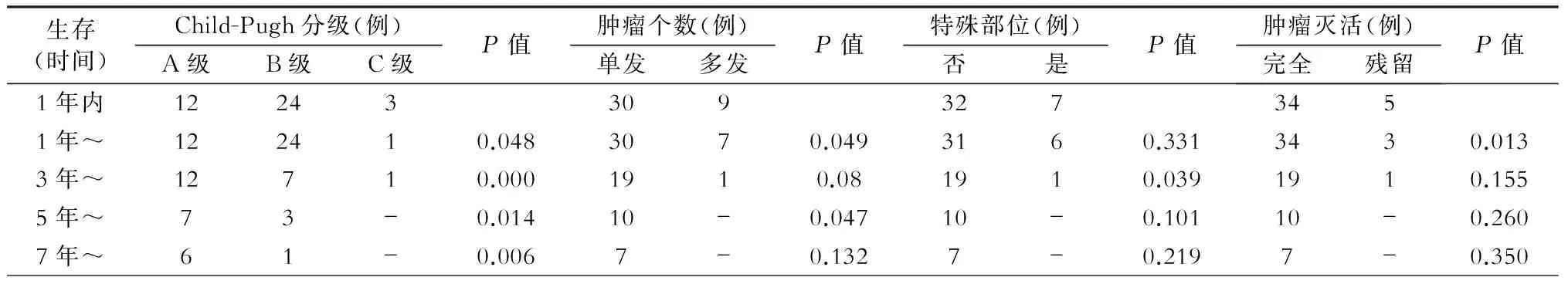
表1 不同因素对生存时间的影响
讨 论
HCC病人的治疗和预后与多种因素有关,包括肿瘤负荷、残余肝功能状况以及病人的体力状态。1999年[8]提出的BCLC分期系统纳入了这三个评判指标,并将HCC临床分期和推荐的治疗方法、病人的生存时间结合起来。目前的临床研究证实了BCLC分期系统的临床应用价值,欧洲肝病协会(EASL)和美国肝病协会(AASLD)均推荐临床医生使用这个分期系统[5],也被东方学者接受[10-11]。
肝硬化的主要表现是门静脉高压、脾功能亢进、腹水。肝硬化病人一旦发生肝癌,可以促进门静脉高压的发展,肝癌合并门静脉高压脾功能亢进约为11%~33%[12]。最近一个Meta分析[13]显示门静脉高压显著影响肝癌切除术后3年和5年的生存率。肝癌合并门静脉高压脾功能亢进的治疗,临床存在较大争议,BCLC以及AASLD[2,7]不管是早期还是中晚期肝癌均将其列为外科切除的禁忌证,早期肝癌则推荐肝移植或RFA、PEI、TACE等治疗手段。随着医疗水平的进步,我国提出的肝癌诊治规范认为早中期肝癌合并门静脉高压,通过肝功能评估,部分病人也可手术治疗,这个观点应该更适合我国国情[6]。而一旦肝功能分级在B级以上,外科手术应慎重[11],没有肝移植条件时,射频消融是一个较好的选择。
本组资料中的部分小肝癌能及时发现,可能与病人本身具有肝硬化门静脉高压脾功能亢进背景、更注意进行健康体检有关。本组资料中肝功能Child-Pugh分级在B级以上接近70%,这也是由于肝切除手术风险较大而选择RFA的主要原因之一,部分病人是合并心肺功能不全,手术风险较大,还有是因为拒绝外科肝切除手术而选择RFA。由于肝硬化门静脉高压脾功能亢进的存在,往往提示肝功能可能处于失代偿阶段,增加了肝癌治疗的复杂性及风险性。医生往往在肝癌这个“主要矛盾”和消化道出血这个“紧急矛盾”之间难以选择;正确的方法应该是对危及病人生命的情况消化道出血等“紧急矛盾”优先处理,在保证病人生命安全的情况下,争取对肝癌“主要矛盾”进行根治治疗。本组病人接受射频消融治疗时没有明显的消化道出血表现。当严重肝硬化病人发生肝癌,肝功能允许的情况下也可行脾切除和(或)贲门周围血管离断手术的同时,进行肝癌射频消融,可以明显减少围手术期并发症及死亡率,延长病人的生存时间。
局部消融治疗的特点:一是直接作用于肿瘤,具有高效快速的优势;二是治疗范围局限于肿瘤及其周围组织,更好的正常肝实质保留,对机体影响小,还可以根据病情的需要多次应用。本组病人采用RFA治疗没有发生严重并发症及围手术期死亡,证明了其安全性,对于小肝癌的射频治疗,有良好的影像学引导,一次完成消融并不困难,但肿瘤位于特殊部位易导致消融的不完全,本组均一次完成消融,完全消融率接近90%,残留均为特殊部位的肿瘤。通过7年以上的随访显示其取得了较满意的生存效果,1、3、5、7年的总生存率分别是94.8%、51.5%、25.6%、17.9%,无瘤生存率分别是87.1%、33.3%、17.9%、5.1%。与文献[3-5]比较,1年期的效果相似,但3年及5年以后的效果不及文献的报道,其1、3、5、10年总生存率是91%、71%、54%和33%;1、3、5、10年无瘤生存率是74%、44%、30%和15%,可能与本组病人均合并门静脉高压脾功能亢进有关。另一方面可能与资料收集的时间及跨度有关,本组资料收集时间跨度是3年间,截止于5年前,而上述作者的资料收集时间跨度在10年以上,截止于文章发表前1年左右。资料显示特别是肝功能评级在B级以上的病人,生存时间明显降低。本组资料肝功能B级者仅3例存活超过5年,均没有超过7年;统计分析在每个时间段肝功能分级对预后的因素均有显著差异,说明肝功能分级是影响预后的危险因素之一,与Feng、Yang、Rossi等[3-5]的结论一致。本组病人中多发结节的病人复发率更高,生存时间也更低,这也支持HCC可能存在多中心发生。HCC治疗后的高复发率明显影响其预后,本组资料中除肝衰竭或上消化道大出血以及其他原因死亡者,7年复发率达69.2%。位于特殊部位的肿瘤,由于热消融的不彻底性,导致病人的预后不佳,本组资料显示特殊部位肿瘤和消融后肿瘤残留均显著影响其早期(1~3年)的预后,对于这类病人可以选择腹腔镜下[14]或开腹射频,或通过人工腹水、胸水提高彻底消融效果,也可联合PEI及TACE提高RFA的效果[15]。
总之,通过以上资料的分析,合并门静脉高压脾功能亢进的HCC(≤3 cm)符合BCLC分期A期,没有肝移植机会,且肝切除手术风险相对较大时,可以选择RFA治疗,其一方面安全易行,并可使绝大多数病人的肿瘤完全灭活,获得较长期的生存效果,另一方面可以为下一步的肝移植治疗提供机会。
1 Jarnagin WR. Management of small hepatocellular carcinoma: a review of transplantation, resection, and ablation. Ann Surg Oncol, 2010,17:1226-1233.DOI: 10.1245/s10434-010-0978-3.
2 Bruix J, Sherman M. American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology, 2011,53:1020-1022.DOI:10.1002/hep.24199.
3 Feng K, Yan J, Li X W, et al.A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma. J Hepato,2012,57:794-802.DOI:10.1016/j.jhep.2012.05.007
4 Yang W,Yan K,Goldberg SN,et al.Ten-year survival of hepatocellular carcinoma patients undergoing radiofrequency ablation as a first-line treatment. World J Gastroenterol,2016,14,22:2993-3005.DOI: 10.3748/wjg.v22.i10.2993.
5 Rossi S, Ravetta V, Rosa L, et al. Repeated radiofrequency ablation for management of patients with cirrhosis with small hepatocellular carcinomas: a long-term cohort study. Hepatology, 2011,53:136-47.DOI: 10.1002/hep.23965.
6 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版).临床肿瘤学杂志,2011,16:929-946.
7 Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis, 1999, 19:329-338.
8 Santambrogio R, Kluger MD, Costa M, et al. Hepatic resection for hepatocellular carcinoma in patients with Child-Pugh's A cirrhosis: is clinical evidence of portal hypertension a contraindication?. HPB (Oxford), 2013,15:78-84.DOI: 10.1111/j.1477-2574.2012.00594.x.
9 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中国医学会肝病学分会肝癌学组.肝癌局部消融治疗规范的专家共识.中华肝病学杂志,2011,19:257-259. DOI:10.3760/cma.j.issn.1007-3418.2011. 04.007.
10 Omata M, Lesmana LA, Tateishi R, et al. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int, 2010, 4:439-474.DOI: 10.1007/s 12072-010- 9165-7.
11 樊嘉,潘奇,史颖弘.美国、亚太和中国肝癌共识比较.临床肝胆病杂志,2011,27:346-347,364.
12 黎东明,汪谦,胡文杰,等.肝癌合并门静脉高压脾功能亢进105例的外科个体化治疗.中华普通外科学文献:电子版,2013,7:110-113. DOI:10. 3877/cma.j.issn.1647-0793.2013.02.003.
13 Berzigotti A, Reig M, Abraldes JG, et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: a systematic review and meta-analysis. Hepatology, 2015,61:526-536. DOI: 10.1002/hep.27431.
Longer-term efficacy of radiofrequency ablation treatment for hepatocellular carcinoma (≤3.0 cm) in BCLC stage A complicated with portal hypertension and hypersplenism
HeYueming,ZhangZhonglin,LiuQuanyan,YuanYufeng,LiuZhisu.
DepartmentofHepatobiliary&PancreaticSurgery,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China
HeYueming,Email:heym@medmail.com.cn
Objective To explore the safety and longer-term efficacy of radiofrequency ablation treatment for hepatocellular carcinoma (≤3.0 cm) in BCLC stage A complicated with portal hypertension and hypersplenism. Methods Retrospective study was conducted on cases that met the following conditions in Zhongnan Hospital of Wuhan University from January 2008 to January 2011: (1) The initial diagnosis was primary hepatocellular carcinoma (less than or equal to 3 cm) complicated with portal hypertension and hypersplenism; (2) Initial treatment was radiofrequency ablation, and (3) the follow-up clinical data were obtained before January 2016. Results Thirty-nine patients with initial diagnosis of hepatocellular carcinoma (less than or equal to 3 cm) complicated with portal hypertension and hypersplenism accepted radiofrequency ablation, and the average follow-up time was 53 months (10-95 months). Overall survival rate of 1-, 3-, 5-, 7-year was 94.8% (37/39), 51.5% (20/39), 25.6% (10/39), and 17.9% (7/39) respectively; tumor free survival rate was 84.1% (34/39), 33.3% (10/39), 17.9% (7/39), and 5.1% (2/39) respectively. There were 32 deaths, including 21 (53.8%) deaths due to cancer recurrence and metastasis, 7 (17.9%) due to upper gastrointestinal bleeding and liver failure, 2 (6.2%) due to cerebrovascular accident, 1 (3.1%) due to cardiovascular accident, and 1 (3.1%) due to traffic accident. Main factors affecting the prognosis were liver function level B or C, multiple tumors or tumors in special location, and residual tumor after ablation. Conclusions Radiofrequency ablation is a safe and effective method for the treatment of small hepatocellular carcinoma with portal hypertension. Some patients can obtain a longer-term survival effect.
Liver neoplasms; Radiofrequency ablation; Portal hypertension
430071 武汉,武汉大学中南医院肝胆胰外科
何跃明,Email:heym@medmail.com.cn
R735.7
A [DOI] 10.3969/j.issn.1003-5591.2016.03.004
刘景丰.腹腔镜下经皮肝穿刺射频消融治疗肝癌.腹部外科,2012,25:70-71.
10.3969/j.issn.1003-5591.2012.02.004.
15 孙居仙,郭卫星,程树群.射频消融在小肝癌中的应用.腹部外科,2012,25:68-69.DOI:10.3969/j.issn.1003-5591.2012.02.003.
2016-04-27)

