复发性肝癌再切除手术
王文静 赵龙 冯贤松 陈庆
·论 著·(临床实践)
复发性肝癌再切除手术
王文静 赵龙 冯贤松 陈庆
目的 探讨肝内复发性肝细胞癌(肝癌)的治疗方法和再手术切除的疗效。方法 对1995年1月至2010年6月收治的124例肝癌术后肝内复发病例的临床资料进行回顾性分析。结果 1、3、5年生存率再手术组分别为73.3%、33.6%、18.3%,局部治疗组分别为44.1%、11.6%、7.0%,保守治疗组仅5例存活超过1年。早期复发病例1、3、5年生存率分别为46.3%、14.7%、7.4%,晚期复发病例1、3、5年生存率分别为69.0%、37.9%、24.1%。结论 肝癌术后肝内复发应采取积极的治疗,再手术切除是最有效的治疗方法;对不能再手术的病例,介入为主的综合治疗可提高生存率。
肝细胞癌;复发;再手术
肝细胞癌(hepatocellular carcinoma,以下简称肝癌)是我国常见恶性肿瘤之一,手术切除是最有效的治疗方法,但术后复发和转移仍是限制其远期疗效最重要的原因[1-2]。国外文献报道肝癌术后5年复发率可高达77%或以上[3]。杨甲梅等[4]研究发现近期(2年内)复发率高达68.3%,远期(2年以上)复发率为29.4%。对于复发性肝癌的治疗手段包括手术治疗、经导管肝动脉栓塞化疗、局部治疗(射频或微波等)、放化疗等,目前认为再手术切除仍是复发性肝癌最有效的治疗方法之一,其5年生存率为19%~56%[5-8]。本文就我院1995年1月至2010年6月收治的124例肝癌术后肝内复发病人的临床和随访资料进行回顾性分析,探讨肝内复发性肝癌的治疗方法和再手术切除的疗效。
资料与方法
一、一般资料
所有124例病人均为初次肝癌根治手术后肝内复发,排除肝外转移。肝癌根治性切除术标准[9]:术后病理为肝细胞癌,术中肿瘤全部切除,切缘无肿瘤细胞残留,术后1个月复查未见肿瘤复发。其中男性104例、女性20例;年龄29~83岁,平均54.2岁;合并肝炎肝硬化93例(75.0%),甲胎蛋白(AFP)阳性75例(60.50%)。肝功能Child-Pugh分级:A级91例(占73.39%),B级25例(占20.16%),C级8例(占6.45%)。
二、复发类型
根据肝内复发病灶数目分型[10],将病灶在4个以内的称为局限复发型,4个及4个以上病灶的称为弥漫复发型。 根据肝内复发时间分型[11],以距初次手术2年为界限划分,2年内复发为早期复发,2年后为晚期复发。术后复发时间最短2个月,最长108个月,早期复发95例(占76.61%),其中局限复发型54例,弥漫复发型41例,分别占56.84%、43.16%;29例晚期复发(占23.39%)中局限复发型25例,弥漫复发型4例,分别占86.20%、13.80%。
三、治疗方式
采用肝内肿瘤局部切除或者肝部分切除病例为再手术组,共60例,其中45例行单个肝段切除,9例病人切除2个或2个以上肝段,其余6例病人行肿瘤局部切除;采用经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)或射频消融术(radiofrequency ablation,RFA)治疗病例为局部治疗组,共43例;其余因各种原因未接受上述特殊治疗的21例为保守治疗组。
四、随访情况
多数病例采用门诊复查随访,少数病例采用电话和信件方式随访观察。术后半年内每月复查一次,半年至2年内每2个月复查1次,2年后每3个月复查1次,复查项目包括AFP、生化指标、影像学检查(B超、胸片、CT或MRI)。
结 果
再手术组和局部治疗组无围手术期死亡或二次手术病例。再手术组有3例术后腹腔出血,经输血等保守治疗好转;9例术后出现持续性黄疸,经护肝等支持治疗好转出院;5例出现肺部感染,经抗感染治疗治愈;15例病人出现不同程度的右侧胸腔积液,其中5例需要在B超引导下穿刺引流,其余病例均自行吸收。局部治疗组有6例出现右侧胸腔积液,均自行吸收。
本研究随访截至2015年6月,124例病人中失访5例,平均随访时间(42.0±4.2)月(9~94个月)。各组病人1、3、5年生存率见表1,各组Kaplan-Meier生存曲线见图1、图2。1、3、5年生存率再手术组与局部治疗组分别为73.3%、33.6%、18.3%与44.1%、11.6%、7.0%,中位生存时间分别为40.3个月与21.4个月。保守治疗组仅5例存活超过1年,中位生存时间为4.3个月。总体1、3、5年生存率早期复发病例组与晚期复发病例组分别为46.3%、14.7%、7.4%与69.0%、37.9%、24.1%,中位生存时间分别为19.4个月与30.4个月。

表1 各组1、3、5年生存率和中位生存时间

图1 再手术组、局部治疗组与保守治疗组的生存曲线
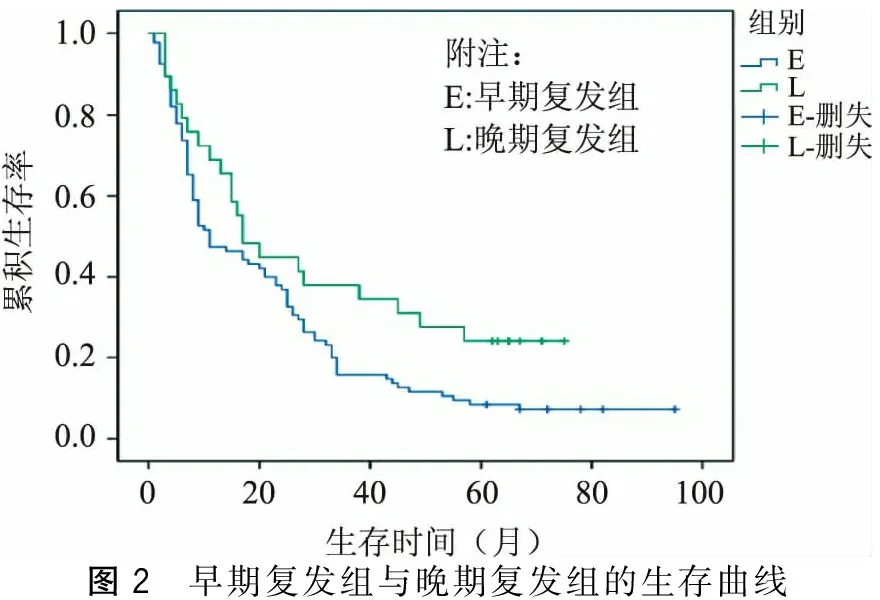
图2 早期复发组与晚期复发组的生存曲线
讨 论
一、肝癌术后复发的预防及监测
近年来外科技术的发展使得肝癌的治疗效果有了显著的提高,但其远期疗效仍不理想,术后复发转移仍是导致病人死亡的主要原因,且多数复发出现在根治性手术后2年内,目前尚无有效的方法来预防[3,12-13]。有作者报道术中预置肝动脉或门静脉泵,术后定期行区域化疗或者术后TACE可降低复发率[14], 但这些措施是真的降低了复发率抑或仅仅推迟了复发时间尚有待更长的时间来观察,术前TACE也不能延长可切除肝癌病人的生存期[15]。
密切的术后随访至关重要,早发现、早治疗是提高亚临床复发性肝癌疗效的关键[16-17]。我们一般建议病人术后半年内每月复查一次,半年至2年内每2个月复查一次,以后逐步延长,至少持续5年,复查项目包括B超、肝功能、胸片、AFP。肝炎病人需行肝炎病毒滴度检测。对于可疑复发病人行CT、MRI、数字减影血管造影(DSA)或者超声造影等检查。本组124例病人随访过程中,术后复发的表现为:AFP首次术后下降后再度升高65例、B超发现肝脏肿块98例、CT显示肝占位病变120例,有4例AFP升高,B超、CT及MRI均未发现肿瘤,最后经DSA确诊复发。对于AFP阳性的病人,肝癌根治手术后4~8周AFP明显降低,甚至转阴,其动态变化有助于了解肿瘤是否治愈、残留或复发,有较高的敏感性和特异性。对于亚临床复发病例,常可在病人未出现明显症状甚至影像学可见的复发前即可检测出AFP升高[18]。
二、肝癌术后复发类型对预后的影响
一般认为,从机制上分析将肝癌术后肝内复发分为两种类型[19-21]:肝内播散和非同步多中心癌变,前者与门静脉微癌栓或术中挤压导致门静脉播散有关,后者是指在慢性肝病基础上发展的一个新病灶,成为多中心起源的复发。术前可以从多个方面来区分判断复发来源:包括肝病背景、肿瘤的大体形态、大小、部位、组织病理学特征、复发的时间、遗传学标志物等[22],但是并非所有病例都能在术前做出准确的判断。
大量研究发现肝癌术后复发的时间是影响再切除术后预后的重要因素,鉴于术后2年内为复发高峰期,多数作者从时间上划分,将术后2年内复发称为早期复发,2年后的复发称为晚期复发。单中心复发癌的平均复发时间远短于多中心复发癌,推测早期复发者可能与肝内播散有关,而晚期复发则多为肿瘤多中心生长所致[23]。本研究中早期复发95例,占76.61%,其总体1、3、5年生存率明显低于晚期复发病例,2年后复发肝癌病人的预后明显优于2年内复发者。
从病理类型分析,肝内复发可分为局限型、多发型及弥漫型,其中多发型及弥漫型病人多在2年内复发,而局限型复发病例在2年内与2年后的复发率上无显著差别。本研究中早期复发病人弥漫型所占比例(占43.16%)高于晚期复发者(占13.80%),致使再手术切除率低,预后不佳,而晚期复发局限型相对较多(占86.20%),多可接受比较有效的治疗,总体预后相对较好。
三、再手术的适应证及手术方法
再手术的适应证应根据复发的部位、时间、肿瘤大小、肝硬化程度以及病人全身情况决定[23-24]。一般来说复发时间长、单个、位于肝表面复发灶及肝硬化程度轻者再手术效果好,反之效果较差。再手术的指征和初次手术基本相同:①全身情况好,心肺肾功能及出凝血时间无明显异常;②肝功能Child-Pugh A级或B级;③肿瘤局限,残肝内复发灶在4个以下,无肝内外广泛转移,无门静脉癌栓,术前影像学评估能完整切除且有足够的残肝代偿;④复发时间距首次术后1年以上为佳。前次手术为极量肝切除或者发现门静脉一、二级分支有癌栓者应视为禁忌证[25]。
由于肝硬化背景和残肝量的限制,再次手术通常不采用大范围肝叶切除,而多采用限量的肝段、亚肝段、肝局部切除或肿瘤剜除术,以免造成术后肝衰竭,同时为日后可能的再次手术留有余地。再手术时因肝周广泛粘连、术后多次肝动脉或门静脉栓塞化疗等造成的大量肝周侧支循环形成、肝硬化导致的凝血功能障碍等因素,致使手术难点明显增大,风险较高。本研究的60例再手术病例中,有45例行单个肝段切除,仅9例病人切除2个或2个以上肝段,其余6例病人行肿瘤局部切除,无围手术期死亡或二次手术病例。我们总结经验如下:①术前应全面评估病人的全身情况和肝脏的局部情况,根据影像学和吲哚氰绿15 min清除率决定切肝量;②术中尽量不阻断肝门或采用半肝阻断法,以保护残肝功能;③先解剖第一肝门,预置肝门阻断,断肝前充分游离肝脏和显露病灶,以免断肝时延长肝门阻断时间,同时可以随时解除阻断采用压迫或缝合等方法止血;④粘连是造成再手术术中、术后出血和副损伤的主要原因,因此从开腹时就应精细分离并仔细止血,以免累积大量的创面导致术中术后出血;⑤初次手术后残肝再生可致肝内解剖结构发生改变,必要时可采用术中B超明确肿瘤位置、与肝内血管、胆管的关系,做到精准手术;⑥对于切缘小于1 cm的断面,加用微波固化或者射频消融可提高手术的疗效。如果术中探查无法切除 肝动脉插管术、门静脉插管术、微波固化或者射频消融等方法,亦能达到延长生存期的目的。
四、再手术的疗效分析
国内外大量研究表明复发性肝癌再手术切除的疗效是肯定的,5年生存率为19.4%~56%,且再切除疗效明显优于介入等治疗[5-8,26]。本研究中再手术组1、3、5年的总体生存率分别为73.3%、33.6%、18.3%,与国内文献报道相仿[5],但明显低于国外报道[2-3],这可能与国外复发肝癌多无肝硬化,规则性肝切除比率较高、切缘相对较宽有关。本文中再手术组的疗效明显优于其他治疗方法,我们认为再手术切除是复发性肝癌最有效的治疗方法。
影响复发性肝癌再手术预后的因素[27-28]:①病理学因素:肿瘤大小、数目、分化程度、血管侵犯和淋巴结转移等;②肝脏情况:肝功能状况、肝硬化程度、肝炎活动度等;③病人的全身状况:病人的性别、年龄、免疫及营养状况等。一般认为复发时间短(≤2年)、肿瘤直径>5 cm、TNM分期晚等是再手术预后不良的危险因素;而首次手术和复发再切除时均为单个肿瘤,无血管侵犯,复发时间大于2年的病例再切除的预后良好,对于这类病人应积极再手术治疗,可望获得长期生存。
五、其他治疗方法的选择
本文研究中TACE和RFA等局部治疗较再手术切除的疗效差,但远优于保守治疗组。这些治疗方法具有操作简便、可反复进行、对肝功能影响小、并发症少等优点,扩大了复发性肝癌治疗的适应证并减少了再手术的风险[29]。对于复杂性多发癌、大肝癌、无法手术治疗的病人,TACE虽不能完全控制肿瘤,仍可适当缓解病情,延长生存期[30]。RFA对于单发复发小肝癌(<5 cm)的疗效与手术切除相似, 但对于肿瘤直径大于5 cm的病人疗效较差[31]。
六、补救性肝移植术
由于复发性肝癌病人多伴有肝硬化,或有多个肝内复发病灶,再次手术极易出现残肝功能代偿不全而无法实施,肝移植不失为一种有效的治疗方法[32-33]。有别于未经肝切除即采取的肝移植,此类肝移植称为补救性肝移植(salvage liver transplantation,SLT),目前被广泛接受的定义是指对肝功能代偿良好的可切除肝癌首先采取肝切除治疗,术后出现肝内复发或者肝衰竭时再行肝移植的治疗策略,同时要求初发和复发肿瘤符合以下标准:单个肿瘤直径≤5 cm;多个肿瘤数目≤3个、单个肿瘤直径≤3 cm。SLT最初用于治疗复发性肝癌存在较大的争议,近年来随着肝移植手术的推广、国内外研究的深入以及对肝癌治疗的进一步探索,SLT被越来越多的人所接受。但供肝的短缺、等待时间长、高昂的费用等因素极大地限制了其发展,使得肝移植治疗复发性肝癌在我国尚未得到普遍应用,术后如何预防肿瘤复发和肝炎的活动仍是目前的难题之一,对于其远期疗效的评价尚需在更长时间进行多中心的研究[33]。
再手术治疗复发性肝癌是安全的,其疗效已得到公认,对于肝功能代偿较好、可切除的肝内复发性肝癌,再手术切除是最有效的方法。对不能再切除的病例,可施行以介入为主的综合治疗。严格的长期随访、早发现、早治疗是提高复发性肝癌疗效的关键,合理的手术指征、充分的术前评估、限量的肝切除、个体化综合治疗可提高再手术的疗效。
1 杨秉辉,夏景林,黄力文,等.我国肝癌“临床相”30年的变迁—原发性肝癌3250例的对比研究.中华医学杂志, 2003,83:1053-1057. DOI: 10. 3760/j:issn:0376-2491.2003.12.014.
2 Tabrizian P, Jibara G, Shrager B, et al. Recurrence of hepatocellular cancer after resection: patterns, treatments, and prognosis. Ann Surg,2015,261:947-955.DOI:10.1097/SLA.0000000000000710.
3 Yamashita Y, Tsuijita E, Takeishi K, et al. Trends in surgical results of hepatic resection for hepatocellular carcinoma:1,000 consecutive cases over 20 years in a single institution.Am J Surg, 2014,207:890-896.DOI: 10.1016/j.amjsurg.2013.07.028.
4 杨甲梅.重视复发性原发性肝癌的外科治疗.临床外科杂志, 2005, 13:129-130.
5 吴飞翔,王方为, 马良, 等.原发性肝癌术后复发246例再治疗的近期疗效.中国癌症防治杂志, 2012,4:167-170.DOI: 10. 3969/ j.issn.1674-5671.2012.02.17.
6 杨林, 秦建民.原发性肝癌术后复发与转移的非手术治疗现状与进展.肝胆胰外科杂志,2011,23:170-173.DOI:10.3969/j.issn.1007 -1954. 2011.02.034.
7 Zhou YM,Sui CJ, Li B, et al. Repeat hepatectomy for recurrent hepato-cellular carcinoma: a local experience and a systematic review. World J Surg Oncol,2010,8:55.DOI:10.1186/1477-7819-8-55.
8 Jin YJ, Lee JW, Lee OH, et al. Transarterial chemoembolization versus surgery/radiofrequency ablation for recurrent hepatocellular carcinoma with or without microvascular invasion. J Gastroenterol Hepatol,2014,29:1056-1064.DOI:10.1111/jgh.12507.
9 中华人民共和国卫生部. 原发性肝癌诊疗规范 (2011 年版). 临床肝胆病杂志, 2011,27:1141-1159.
10 Goh BK, Chow PK, Teo JY, et al. Number of nodules, Child-Pugh status, margin positivity, and microvascular invasion, but not tumor size, are prognostic factors of survival after liver resection for multifocal hepatocellular carcinoma. J Gastrointest Surg, 2014,18: 1477-1485. DOI: 10.1007/s11605-014-2542-0.
11 Li SH, Guo ZX, Xiao CZ, et al. Risk factors for early and late intrahepatic recurrence in patients with single hepatocellular carcinoma without macrovascular invasion after curative resection.Asian Pac J Cancer Prev, 2013,14:4759-4763.
12 Jeng WJ, Lin CC, Chen WT, et al. Adjuvant therapy for hepatocellular carcinoma after curative treatment.Dig Dis, 2014,32:747-754. DOI: 10.1159/000368017.
13 Zu QQ, Liu S, Zhou CG, et al. Chemoembolization of recurrent hepatoma after curative resection: prognostic Factors. AJR Am J Roentgenol, 2015,204:1322-1328. DOI: 10.2214/AJR.14.13343.
14 Huang SX, Wu YL, Tang CW, et al. Prophylactic hepatic artery infusion chemotherapy improved survival after curative resection in patients with hepatocellular carcinoma. Hepatogastroenterology,2015, 62:122-125.
15 Yeh ML, Huang CI, Huang CF, et al. Neoadjuvant transcatheter arterial chemoembolization does not provide survival benefit compared to curative therapy alone in single hepatocellular carcinoma. Kaohsiung J Med Sci, 2015,31:77-82. DOI: 10.1016/j.kjms. 2014. 11. 003.
16 Liu D, Fong DY, Chan A C, et al. Hepatocellular carcinoma: surveillance CT schedule after hepatectomy based on risk stratification. Radiology, 2015,274:133-140. DOI: 10.1148/radiol.14132343.
17 Kitzing B, Kitzing YX. Imaging of hepatocellular carcinoma recurrence post liver resection: a pictorial essay. J Med Imaging Radiat Oncol,2013,57:337-344. DOI:10.1111/j.1754-9485.2012.02468.x.
18 Allard MA, Sa Cunha A, Ruiz A, et al .The postresection alpha fetoprotein in cirrhotic patients with hepatocellular carcinoma. An independent predictor of outcome. J Gastrointest Surg, 2014,18:701-708. DOI: 10.1007/s11605-013-2433-9.
19 Wang B, Xia CY, Lau WY, et al. Determination of clonal origin of recurrent hepatocellular carcinoma for personalized therapy and outcomes evaluation: a new strategy for hepatic surgery. J Am Coll Surg, 2013,217:1054-1062. DOI: 10.1016/j.jamcollsurg.2013.07.402.
20 Du ZG, Wei YG, Chen KF, et al. Risk factors associated with early and late recurrence after curative resection of hepatocellular carcinoma: a single institution's experience with 398 consecutive patients. Hepatobiliary Pancreat Dis Int, 2014,13:153-161.
21 Pinyol R, Nault JC, Quetglas IM, et al. Molecular profiling of liver tumors: classification and clinical translation for decision making. Semin Liver Dis, 2014,34:363-375. DOI: 10.1055/s-0034-1394137.
22 Zhou L, Rui JA, Wang SB, et al. Early recurrence in large hepatocellular carcinoma after curative hepatic resection: prognostic significance and risk factors. Hepatogastroenterology, 2014,61:2035-2041.
23 沈正荣,周慧江,彭淑牖. 复发性肝癌再切除手术适应证及术式选择. 实用肿瘤杂志, 2003,18:473-475.DOI: 10.3969/j.issn. 1001-1692. 2003.06.019.
24 Minagawa M, Makuuchi M, Takayama T, et al. Selection criteria for repeat hepatectomy in patients with recurrent hepatocellular carcinoma. Ann Surg, 2003,238:703-710.
25 Meniconi RL, Komatsu S, Perdigao F, et al. Recurrent hepatocellular carcinoma: a Western strategy that emphasizes the impact of pathologic profile of the first resection.Surgery, 2015,157:454-462. DOI: 10.1016/j.surg.2014.10.011.
26 Wang K, Liu G, Li J, et al. Early intrahepatic recurrence of hepatocellular carcinoma after hepatectomy treated with re- hepatectomy, ablation or chemo- embolization: a prospective cohort study. Eur J Surg Oncol, 2015,41:236-242.
27 邵子力,梁惠宏,曹良,等.COX模型多因素分析影响复发性肝癌再切除的预后因素. 国际外科学杂志, 2011, 38:451-455.DOI:10.3760/ cma.j.issn.1673-4203.2011.07.007.
28 Han JH, Kim DG, Na GH, et al, Evaluation of prognostic factors on recurrence after curative resections for hepatocellular carcinoma. World J Gastroenterol, 2014,20:17132-17140. DOI: 10.3748/wjg. v20.i45.17132.
29 Zhang CS, Zhang JL, Li XH, et al. Is radiofrequency ablation equal to surgical re-resection for recurrent hepatocellular carcinoma meeting the Milan criteria? A meta-analysis. J Buon, 2015,20:223-230.
30 Hirano G, Iwata K, Anan A, et al.Why is radiofrequency ablation therapy applied for hepatocellular carcinoma up to 3 nodules and smaller than 3 cm in tumor size?. Hepatogastroenterology, 2014, 61: 2305-2310.
31 Cheng YC, Chen TW, Fan HL, et al. Transarterial chemoembolization for intrahepatic multiple recurrent HCC after liver resection or transplantation. Ann Transplant, 2014, 19:309-316. DOI: 10. 12659 /AOT.890505.
32 Guerrini GP, Gerunda GE, Montalti R, et al. Results of salvage liver transplantation. Liver Int, 2014,34:e96-e104. DOI: 10.1111/liv.12497.
33 Lee HS, Choi GH, Joo DJ, et al. The clinical behavior of transplan-table recurrent hepatocellular carcinoma after curative resection: impli- cations for salvage liver transplantation. Ann Surg Oncol, 2014,21: 2717-2724. DOI: 10.1245/s10434-014-3597-6.
Analysis of re-resection for recurrent hepatocellular carcinoma
WangWenjing,ZhaoLong,FengXiansong,ChenQing.
DepartmentofHepatobiliarySurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
ChenQing,Email:chenqinga@126.com
Objective To investigate techniques and efficacy of re-resection for intrahepatic recurrent hepatocellular carcinoma (HCC).Methods From Jan. 1995 to June 2010, the clinical and follow-up data of 124 patients with intrahepatic recurrent HCC were analyzed retrospectively.Results The overall 1-, 3-, and 5-year survival rate in re-resection group was 73.3%, 33.6%, and 18.3% respectively, and 44.1%, 11.6%, and 7.0% respectively in local treatment group. Only 5 cases survived over one year in conservative treatment group. The overall 1-, 3-, and 5-year survival rate in early recurrent group was 46.3%, 14.7%, and 7.4% respectively, and 69.0%, 37.9%, and 24.1% respectively in later recurrenct group.Conclusions For patients with intrahepatic recurrent HCC, active treatment should be adopted, and re-resection is the most effective treatment. For unresectable cases, comprehensive treatment based on interventional therapy could improve survival rate.
Hepatocellular carcinoma; Recurrence; Re-resection
430022 武汉,华中科技大学同济医学院附属协和医院肝胆外科
陈庆,Email:chenqinga@126.com
R657.3
A
10.3969/j.issn.1003-5591.2016.03.014
2015-12-12)

