美国豆芋不同部位生化特征成分分析
戚利潮,杨芸芸,郑子桓,郑晓冬*
(1.杭州市富阳区农林局,浙江杭州 311400; 2.浙江大学生物系统与食品科学学院,浙江杭州 310058)
美国豆芋不同部位生化特征成分分析
戚利潮1,杨芸芸2,郑子桓2,郑晓冬2*
(1.杭州市富阳区农林局,浙江杭州 311400; 2.浙江大学生物系统与食品科学学院,浙江杭州 310058)
摘 要:通过测定美国豆芋花、茎、叶和块茎中的游离氨基酸、可溶性蛋白、总糖、总皂苷、总黄酮、异黄酮、Vc、VE和矿物质的含量表明,美国豆芋不同部位均含有丰富的游离氨基酸、可溶性蛋白、多糖、皂苷、黄酮、异黄酮、Vc、VE和矿物质等生化特征成分,但是美国豆芋不同部位的特征成分含量存在差异。该分析结果为新引进食品美国豆芋的综合利用提供依据,有利于进一步充分有效地利用其花、茎、叶和块茎开发功能性食品和医药中间体等产品。
关键词:美国豆芋;游离氨基酸;可溶性蛋白;总糖;总皂苷;总黄酮;异黄酮
文献著录格式:戚利潮,杨芸芸,郑子桓,等.美国豆芋不同部位生化特征成分分析[J].浙江农业科学,2016,57 (4):529-534.
我国是世界上最大的蔬菜生产国和消费国,随着种植业结构调整步伐的加快,全国蔬菜生产快速发展,产量和品种大幅增长。未来十年我国人口数量仍处在上升期,随着城乡居民生活水平的不断提高和农村人口向城镇转移加快,商品蔬菜需求量将呈现刚性增长趋势。2010年,我国人均蔬菜占有量为370 kg。据测算,到2020年将新增人口近1亿人,人均蔬菜占有量在现有基础上增加30 kg,蔬菜加工品增加1 000万t。届时我国蔬菜总需求量为58 950万t,比2010年增加8 950万t,市场前景广阔。
美国豆芋(Apiosamericana Medikus),自然生长于北美洲,抗寒性和抗涝性佳,主要集中生长在加拿大安大略至美国佛罗里达之间,目前在欧美及日本已有广泛的种植与应用。美国豆芋是一种多年生豆科土圞儿属植物,地下块茎作为无性繁殖或食用,是天然的高蛋白、高钙食品[1-2]。20世纪80年代,美国对美国豆芋作为一种潜在的新作物开展了育种工作。2009年,安家炜等[3]将美国豆芋成功引种至中国。目前,美国豆芋在浙江省杭州地区、宁波地区、温州地区、金华地区均有栽培和利用。作者于2012年引进美国豆芋,并在杭州市富阳区东洲街道新沙岛村、红旗村分别进行栽培试种,取得了较好的栽培效果。
美国豆芋对高血压、糖尿病和高脂血症等现代生活习惯病具有明显改善效果[4-5]。日本在20世纪80年底成功将美国豆芋开发成为家喻户晓的保健食品,每667 m2产值达25万元。本文对新引进栽培的美国豆芋全植株进行了不同部位生化特征成分的综合分析,分别对美国豆芋花、藤、叶、块茎中主要有效成分的含量及生代谢物进行了综合分析,为综合利用美国豆芋花、茎、叶和块茎,开发功能性食品和医药中间体提供理论依据。
1 材料与方法
1.1供试材料、试剂与仪器
1.1.1供试材料
试材为美国豆芋样品,美国豆芋的花、藤、叶、块茎于2014年采收自富阳区东洲街道新沙岛村美国豆芋栽培基地。
1.1.2试剂
染料木苷(分析标准品,≥98%)、Vc (分析标准品)、( + ) -γ-VE(96%)均购自阿拉丁试剂有限公司;大豆苷(分析标准品)、熊果酸(分析标准品)购自成都曼斯特生物科技有限公司;液相用试剂均为色谱级,其他试剂均为分析纯。
1.1.3仪器设备
UV-20102 PC型紫外可见分光光度计;岛津LC-20AT高效液相色谱仪; Denver instrument分析天平; Sartorius水分测定仪; RE-52AAA型旋转蒸发器; HH-6数显恒温水浴锅; ICP-MS/G3271A电感耦合等离子质谱(ICP-MS)仪。
1.2检测方法
1.2.1不同部位生化特征成分待测样品的制备
测量游离氨基酸、可溶性蛋白和总糖含量的样品制备。采收美国豆芋后,把茎、叶、花和块茎分离,清洗、去杂后自然(冷冻)干燥,粉碎后过0.42 mm筛。各取适量,按3∶500 (m/V)加入100℃蒸馏水,放入100℃恒温水浴45 min,每隔15 min晃动1次。趁热减压过滤,得浸提液,作为测量游离氨基酸、可溶性蛋白和总糖含量的样品。
制备测量总皂苷、总黄酮和异黄酮含量的样品。分别称取美国豆芋花、藤、叶、块茎适量,按1∶100 (m/V)加入无水乙醇,放入60℃恒温水浴3 h,每隔30 min晃动1次。趁热减压过滤,得浸提液,作为总皂苷、总黄酮和异黄酮的测定物。
制备测量Vc含量的样品。精确称取磨碎的美国豆芋花、藤、叶、块茎样品1.000 0 g,用40 mL 0.01 mol·L-1HCl浸泡于60℃超声40 min,离心,取上清液,过0.45 μm膜,待测。
制备测量VE含量的样品。准确称取3 g美国豆芋花、藤、叶、块茎样品于150 mL三角瓶中,加入20 mL无水乙醇,50℃气浴恒温震荡50 min。取下冷却,移至50 mL离心管中,离心15 min,上清液转移至分液漏斗,残渣用无水乙醇洗3遍,每次10 mL,分别离心15 min。合并上清液;加入5 mL 10%氯化钠溶液、20 mL正己烷,混匀2 min,静置分层。取其正己烷相,剩余液体加入10 mL正己烷。再次萃取:合并正己烷相于磨口瓶中,旋转蒸干。流动相溶解转移并定容至50 mL,离心10 min,上清液过0.22 μm膜,待测。
特征成分含量的计算。提取前用快速水分测定仪测定各样品中的实际水分含量,美国豆芋花、藤、叶、块茎分别为115.6,109.4,112.1,96.1 g· kg-1,美国豆芋不同部位有效成分含量按样品浓度均折合成干基计算。
1.2.2美国豆芋不同部位生化特征的检测方法
游离氨基酸含量的测定。采用茚三酮法测定[6]。称取0.8 g谷氨酸,用蒸馏水定容至100 mL。分别取1.0,2.0,4.0,5.0,6.0,7.0,8.0 mL于100 mL容量瓶中,加水定容至100 mL。吸取1 mL样品液,注入25 mL容量瓶,加入0.5 mL的pH 值8.04的磷酸缓冲液和0.5 mL的2%茚三酮溶液,置沸水浴中加热15 min,冷却后加水定容至25 mL。10 min后于570 nm处测吸光度(A)。以A为纵坐标(Y),氨基酸浓度为横坐标(X),绘制标准曲线,得回归方程Y =0.001 9 X -0.173 0 (r2= 0.989 4)。
吸取1 mL已制备的样品浸提液,注入25 mL容量瓶,加0.5 mL的pH值8.04的磷酸缓冲液和0.5 mL的2%茚三酮溶液,置沸水浴中加热15 min,冷却后加水定容至25 mL。10 min后于570 nm处测吸光度。根据游离氨基酸标准曲线,计算各试样中的游离氨基酸含量。
可溶性蛋白含量的测定。采用考马斯亮蓝G-250染色法[7]。称取考马斯亮蓝G-250 100 mg溶于50 mL 95%乙醇中,加100 mL 85%磷酸,加水稀释至1 L;取牛血清白蛋白(BSA) 10 mg溶于100 mL蒸馏水中,制成100 μg·mL-1标准蛋白溶液。称取0.2,0.4,0.6,0.8,1.0标准蛋白溶液,加蒸馏水补至1 mL,加入考马斯亮蓝溶液5 mL摇匀,放置2~5 min后,在595 nm下测定吸光度。以A为纵坐标(Y),蛋白质浓度为横坐标(X),绘制标准曲线,得回归方程Y =0.006 1 X + 0.089 1 (r2=0.991 9)。准确吸取0.1 mL已制备的美国豆芋样品浸提液,加蒸馏水补至1 mL,加入考马斯亮蓝溶液5 mL,摇匀,放置2~5 min后在吸光度595 nm下测定吸光度。根据蛋白质标准曲线,计算各试样中的可溶性蛋白质含量。
总糖含量的测定。苯酚-硫酸法测定样品的总糖含量[8]。准确称取葡萄糖20 mg于500 mL容量瓶中,加水至刻度,分别吸取0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mL,各以蒸馏水补至2.0 mL,然后加入6%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却,室温放置20 min后于490 nm测光密度,以2.0 mL水按同样显色操作为空白。以A为纵坐标,葡萄糖微克数为横坐标,绘制标准曲线,得回归方程Y =0.013 3 X -0.051 0 (r2= 0.998 5)。吸取2.0 mL已制备的美国豆芋样品浸提液,加入6%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却室温放置20 min以后于490 nm测光密度。根据葡萄糖标准品,计算美国豆芋花、藤、叶、块茎中的总糖含量。
总皂苷含量的测定。香草醛-冰醋酸比色法测定样品的总皂苷含量[9]。配制0.02,0.04,0.08,0.10,0.25,0.50 mg·mL-1的熊果酸溶液,分别吸取以上浓度熊果酸溶液各0.4 mL于5.0 mL试管中,加入0.2 mL香草醛-乙酸,加入0.8 mL高氯酸,60℃水浴15 min,冷却后用乙酸定容至5.0 mL,在545 nm波长下测定吸光度。以A值为纵坐标(Y),熊果酸为对照品的总皂苷量为横坐标(X),绘制标准曲线,得回归方程为Y = 1.007 9 X +0.089 0 (r2= 0.994 5)。吸取已制备的美国豆芋样品浸提液各0.4 mL于5.0 mL试管中,按标准曲线制作法操作,在545 nm波长下测定吸光度。以熊果酸标准曲线计算美国豆芋花、藤、叶、块茎中的总皂苷含量。
总黄酮含量的测定。采用硝酸-亚硝酸钠比色法[10]。准确称取1 mg芦丁于50 mL容量瓶中,用无水乙醇定容至50 mL,配制0.2 mg·mL-1的芦丁溶液。分别吸取0.5,1.0,1.5,2.0,2.5,3.0及3.5 mL于10 mL试管中,用无水乙醇定容至5.0 mL,加入5%NaNO20.3 mL,混匀,室温下静置6 min后加入10% Al (NO3)30.3 mL,混匀,室温下静置6 min,加入1 mol·L-1NaOH溶液4 mL,用无水乙醇定容至10 mL,于510 nm处测量吸光度。以A为纵坐标,芦丁对照品的总黄酮浓度为横坐标(X),绘制标准曲线,得回归方程Y =0.9474X +0.004 9 (r2= 0.997 3)。吸取1 mL已制备的美国豆芋样品浸提液于10 mL试管中,按上述方法操作,于510 nm处测量吸光度。根据芦丁为标准品制作的标准曲线计算美国豆芋花、藤、叶、块茎中的总黄酮含量。
异黄酮含量的测定。采用紫外分光光度法[11]。准确称量大豆异黄酮标准品(丙二酰基黄豆苷、丙二酰基染料木苷) 5.0 mg,95%乙醇定容到25 mL。分别将0.02,0.03 mL标准品溶液于10 mL容量瓶中,并各加入95%的乙醇1 mL,加蒸馏水稀释到刻度,以1 mL 95%乙醇溶液加水至10 mL做空白溶液,在268 nm波长下测定吸光值,以A为纵坐标,异黄酮浓度为横坐标(X),得回归方程Y = 0.002 9 X - 0.002 4 (r2= 0.997 9)。取0.5 mL美国豆芋提取液,加入95%的乙醇1 mL,加蒸馏水稀释到10 mL,在260 nm波长下测定吸光值,以大豆异黄酮(丙二酰基黄豆苷、丙二酰基染料木苷)为标准品制作的标准曲线计算美国豆芋花、藤、叶、块茎中的异黄酮含量。
Vc含量的测定。测定采用高效液相色谱法[12]。精确称取一定量维生素标准品,用0.01 mol·L-1HCl定容配制标准液。色谱条件:色谱柱为ODS,C18 (250 mm×4.6 mm,5 μm);流动相A为0.05 mol·L-1KH2PO4;流动相B为甲醇;梯度洗脱,B相在13 min内由3%变为60%;流速1.0 mL·min-1;检测波长266 nm;温度35℃;进样量10 μL。
VE含量的测定。采用高效液相色谱法[13]。精确称取VE,分别用甲醇和乙醇溶解定容配制标准液。色谱条件:色谱柱为ODS,C18 (250 mm× 4.6 mm,5 μm);流动相为甲醇/高纯水(98/2,V/V);流速1.0 mL·min-1;检测波长290 nm (VE);温度40℃;进样量50 μL。
矿质元素含量的测定。按照电感耦合等离子体质谱(ICP-MS)的仪器操作规程,调整仪器至最佳工作状态,依次对空白液、标准液和待测液进行测定。
2 结果与分析
2.1不同部位游离氨基酸、可溶性蛋白和总糖的含量
从表1可以看出,(1)豆芋叶中游离氨基酸含量在4个样品中最高,其余3个部位中游离氨基酸的含量较接近。绿茶中游离氨基酸含量约为5%,豆芋叶中氨基酸含量与绿茶中的游离氨基酸含量相近。游离氨基酸不仅在调节机体功能方面起着重要的作用,且其含有的鲜味氨基酸也决定着作物的味道品质,从而影响作物的经济价值。结果表明,美国豆芋的花和块茎都具有较高的氨基酸含量,因此味道良好,食用价值佳。(2)美国豆芋
块茎中可溶性蛋白含量在4个样品中最高。茶叶中可溶性蛋白含量约为5~10 mg·g-1,相比茶叶中的可溶性蛋白含量更胜一筹。马铃薯中的可溶性蛋白含量约为20~30 mg·g-1,而美国豆芋块茎中的可溶性蛋白含量接近15 mg·g-1,与马铃薯中含量相近,可见豆芋的块茎是一种良好的蛋白质来源。(3)美国豆芋中含有丰富的可溶性糖。傅博强等[14]测定,信阳毛尖茶叶中的总糖含量为0.8%~4.0%,豆芋花中的可溶性总糖含量为3.95%,与一级信阳毛尖茶叶的总糖含量相近。姜先刚等[15]
研究发现,人参在果后参根生长期时,根中可溶性糖含量最高值为13.23%。美国豆芋中的总糖含量接近于这个值,说明豆芋块茎含有非常丰富的可溶性糖,具有多种生理功效,而且美国豆芋的总糖中又包含一类由单糖缩合成的活性物质多糖。

表1 美国豆芋样品中游离氨基酸、可溶性蛋白和总糖含量
2.2不同部位总皂苷、总黄酮和异黄酮含量
试验中美国豆芋总皂苷和总黄酮的测定结果高于安家炜等[16]测定的美国豆芋地上部位(藤、叶、花)含量,这可能是样品栽培地域差异所致。从表2可以看出:(1)美国豆芋的各部位均具有很高的皂苷含量,其叶中的总皂苷含量约为大豆的16倍,干豌豆中的2倍;花中总皂苷含量约为大豆中皂苷含量的10倍。(2)根据孙军明等[17]的测试分析,大豆中的黄酮含量最高为0.62%。可见美国豆芋中的黄酮含量在豆科植物中的含量是位居前列的。美国豆芋各部分中均含有较高含量的总黄酮,尤其是豆芋叶,其总黄酮含量约为豌豆黄酮含量的2.5倍,大豆中黄酮含量的8.6倍。(3)美国豆芋中含有丰富的异黄酮,其花中的异黄酮含量约为大豆中的10倍,叶中异黄酮约为大豆中的20倍。与美国豆芋同为豆科的红三叶草,其异黄酮含量为5~35 mg·g-1,而红三叶草异黄酮已经在保健食品、医药等行业得到广泛应用,美国豆芋是一种极佳的异黄酮来源。
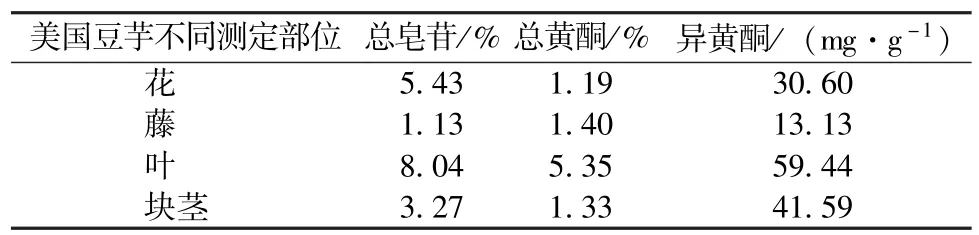
表2 美国豆芋样品中总皂苷含量
2.3不同部位Vc与VE含量测定
从表3可以看出,美国豆芋各部分中均含有不同含量的Vc和VE。与茶叶作比较,豆芋花中的Vc含量与茶叶中的Vc含量相当,而其花、叶、块茎中的VE含量远高于茶叶,约为茶叶中的10~40倍。大豆中VE的含量大致为130~250 mg·kg-1,豆芋块茎中的VE含量与大豆中相近,而豆芋叶中的VE含量约为大豆中的2倍。
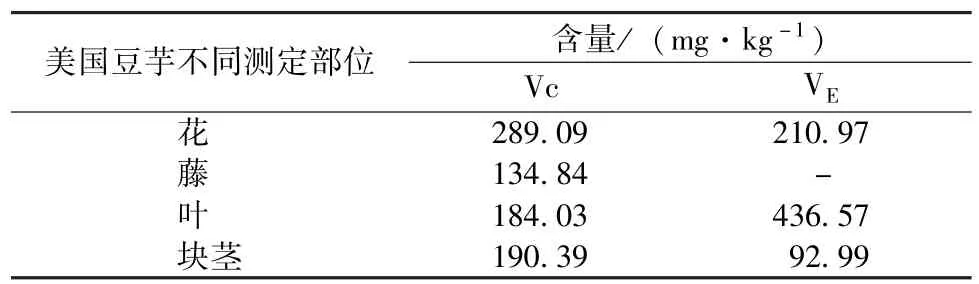
表3 不同部位美国豆芋样品中Vc与VE含量
2.4不同部位矿质元素含量
人体必需的矿物质有钙、磷、镁、钾、钠、硫、氯7种,而铁、锌、铜、钴、钼、硒、碘、铬8种为必需的微量元素。表4表明,美国豆芋中不仅含有上述各种微量元素,且含量丰富,若将豆芋开发成保健产品,这些物质可以发挥协同作用,营养能更好地吸收。

表4 美国豆芋样品中矿质元素含量
3 美国豆芋生化特征成分综合分析
通过对美国豆芋块茎、藤、叶、花的生化特征成分综合分析表明,(1)豆芋叶中游离氨基酸含量在4个样品中最高,为5.10%。植物氨基酸以谷氨酸、天门冬氨酸、脯氨酸等为主,其中还包含多种人体必需氨基酸。美国豆芋的花和块茎同样具有较高的氨基酸含量,因此味道良好,食用价值佳。(2)美国豆芋块茎中可溶性蛋白含量在4个样品中最高。美国豆芋的块茎是一种良好的蛋白质来源,可溶性蛋白含量接近15 mg·g-1,与马铃薯中含量(20~30 mg·g-1)相近。(3)豆芋中含有丰富的可溶性糖。豆芋花中的可溶性总糖含量为3.95%,与一级信阳毛尖茶叶的可溶性总糖含量(0.8%~4.0%)相近。美国豆芋块茎总糖含量接近人参在果后参根生长期时根中可溶性糖含量最高值13.23%。植物多糖具有免疫调节、抗肿瘤、抗衰老、降血糖等多种生物活性、毒副作用小和不易造成残留等优点,所以近年来对植物多糖的研究呈现逐渐增多的趋势。(4)美国豆芋的各部位均具有很高的皂苷含量,其叶中的总皂苷含量为8.04%,约为大豆的16倍,花中总皂苷含量约为大豆中皂苷含量的10倍。皂苷是苷元为三萜或螺旋甾烷类化合物的一类糖苷,其生理功能及药用价值已被医学界和营养学界所证实。王储炎等[18]研究发现,大豆皂苷是一种具有潜在应用价值的天然生理活性物质,具有抗癌、调节免疫功能、防治心血管疾病、抗菌、抗病毒、护肝等多重生理功效。美国豆芋与大豆同属于豆科植物,其皂苷的生理活性具有很高的研究价值。(5)美国豆芋各部分中均含有较高含量的总黄酮,豆芋叶总黄酮含量为5.35%,约为豌豆的2.5倍,大豆(0.62%)的8.6倍。黄酮类化合物(flavonoids compounds)是植物次生代谢产物,能防治心脑血管系统的疾病和呼吸系统的疾病,具有抗炎抑菌、降血糖、抗氧化、抗辐射、抗癌、抗肿瘤以及增强免疫能力等药理作用。(6)美国豆芋中含有丰富的异黄酮,花中的异黄酮含量为59.44 mg·g-1,约为大豆中的10倍,叶中异黄酮约为大豆中的20倍。研究表明,人体摄入动物性激素可诱发或加剧癌症的发生,但若补充植物性激素则可以抑制癌细胞的繁殖并可消灭癌细胞。(7)美国豆芋各部分中均含有不同含量的Vc、VE。豆芋花中的Vc含量为289.09 mg·kg-1,约为茶叶中的10~40倍;豆芋叶中的VE含量为436.57 mg·kg-1,约为大豆中的2倍(130~250 mg·kg-1)。(8)公认的仅有二十几种为构成人体组织、参与机体代谢和维持生理功能所必需的矿物质,通过测定磷、铁、锌、硒、钙、锰、铜等矿物质含量分析结果表明,a.几乎所有食物中均含有磷,磷缺乏是比较少见的。b.植物铁蛋白是人类通过饮食获取铁的主要来源。美国豆芋叶中铁含量为282.7 mg·kg-1,约为小麦、大豆(50 mg·kg-1)中的5.6倍,是一种富铁食品。c.美国豆芋各部分中富含锌,尤其是豆芋叶,其锌含量达61.2 mg·g-1,豆芋各部分都是可供给人体补充锌的良好来源。d.硒是人体和动物必需的微量元素,兼具营养、疾病治疗和致毒等多种生物学效应,硒在植物中主要以有机硒形态存在,含硒蛋白是植物体内最主要的有机大分子硒,具有抗肿瘤、抗氧化等多种生物活性。e.豆芋中富含钙元素,豆芋花、藤、叶中的钙含量均大于2.5 g·kg-1(与豆芋同属豆科的大豆钙含量)。f.美国豆芋的各部分中中富含锰,尤其是豆芋叶,其含锰量为186.1 mg·kg-1是大豆(35.2 mg· kg-1)的4.3倍。g.美国豆芋中含有较丰富的铜,若直接食用或者用豆芋制成花茶,可补充人体所需铜元素。
4 小结
通过检测美国豆芋不同部位生化特征成分,分析结果表明,美国豆芋不同部位均含有丰富的游离氨基酸、可溶性蛋白、多糖、皂苷、黄酮、异黄酮、Vc、VE和矿物质等生化特征成分。其中,豆芋叶中游离氨基酸、矿物质、VE、总皂苷、总黄酮和异黄酮含量最高;豆芋藤中各种有效成分的含量相对较低;豆芋花中Vc含量最高,同时还含有较高含量的VE、总皂苷和异黄酮;作为可食用部分的豆芋块茎中,可溶性蛋白和总糖含量最高,同时还含有较高量的Vc、总皂苷和异黄酮。分析结果表明:美国豆芋叶、藤、花、块茎虽然都来自于美国豆芋植株,但不同部位的特征成分含量和次生代谢产物种类存在差异。分析结果为新引进食品美国豆芋的综合利用提供依据,有利于进一步充分有效地利用其花、茎、叶和块茎开发功能性食品和医药中间体等产品。
参考文献:
[1]ZHANG Y,ZHOU C,TANG S,et al.Effect of AATI,a Bowman-Birk type inhibitor from Apios Americana on proliferation of cancer cell lines[J].Food Chemistry,2011,128 (4):909-915.
[2]TAKASHIMA M,NARA K,NIKI E,et al.Evaluation of biological actives of a groundnut ( Apios americana Medik) extrat containing a novel isoflavone[J].Food Chemistry,2013,138 (1):298-305.
[3]安家炜,张有做,高前欣,等美国豆芋地上部位有效成分及α-葡萄糖苷酶抑制活性研究[J].核农学报,2014,28 (12):2275-2282.
[4]JUULIARNI,HOSHIKAWA K.Characteristics of dry matter production and yield of Apios (Apios americana Medik)[J].Japanese Journal of Crop Science,1996,65 (1):98-102.
[5]JLIARNI,HOSHIKAWA K.The growth of Apios ( Apios americana Medik),a new crop,under field Conditions[J].Japanese Journal of Crop Science,1995,64 (2):323-327.
[6]曾俊,苏俊黎.一种比较实用的氨基酸定量测定方法:茚三酮法[J].饲料工业,2009,23 (3):40-41.
[7]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化学,2009,23 (3):40-41.
[8]孙芸,刘杰,刘佳佳,等.苯酚-硫酸法测定菊苣根中总糖的含量[J].中国民族民间医药,2008 (4):12-13.
[9]CHEN Y,XIE G,GONG X.Microwave-assisted extraction used for the isolation of total triterpenoid saponins,from Ganoderma atrun[J].Journal of Food Engineering,2007,81 (1):162-170.
[10]蒋娅萍.保健食品中总黄酮的测定.理化检验(化学分册)[J],2003,39 (5):307.
[11]程珍,阿依古力·阿不列孜,马庆玲,等.紫外分光光度法测定鹰嘴豆和豆芽中异黄酮含量的研究[J].时珍国医国药,2008,19 (11):2612-2613.
[12]王爱月,张向兵,李发生.高效液相色谱法测定食品及保健品中维生素C含量的研究[J].中国卫生检验杂志,2006,16 (10):1175-1176.
[13]商军,潘娟,华贤辉.高效液相色谱法测定维生素E原料含量[J].饲料工业,2009,30 (14):51-54.
[14]傅博强,谢明勇,聂少平,等.茶叶中多糖含量的测定[J].食品科学,2011,22 (11):69-72.
[15]姜先刚,刘海龙,张惠,等.不同生长时期人参中总糖、还原糖和可溶性多糖含量变化[J].中国实验方剂学杂志,2013,19 (16):142-144.
[16]安家炜,张有做,高前欣,等.美国豆芋地上部位有效成分及α-葡萄糖苷酶抑制活性研究[J].核农学报,2014,28 (12):2275-2282.
[17]孙军明,丁安林,常汝镇,等.中国大豆异黄酮含量的初步分析[J].中国粮油学报,1995,10 (4):51-54.
[18]王储炎,艾启俊,阚建全,等.大豆皂苷的研究进展[J].粮食与食品工业,2005,12 (6):31-34.
(责任编辑:张瑞麟)
中图分类号:S567.239
文献标志码:A
文章编号:0528-9017(2016)04-0529-05
DOI10.16178/j.issn.0528-9017.20160425
收稿日期:2015-12-30
作者简介:戚利潮,男,浙江杭州人,农艺师,主要从事果蔬栽培技术研究及农技推广工作,E-mail:qilichao@163.com。
通信作者:郑晓冬,E-mail:dzheng@zju.edu.cn。

