循环血microRNA对辐射和辐射防护药物的敏感性研究
危文俊,李朋飞,林素兰,王菊芳
(1.中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室,兰州730000;2.中国科学院大学,北京100049)
循环血microRNA对辐射和辐射防护药物的敏感性研究
危文俊1, 2,李朋飞1, 2,林素兰1, 2,王菊芳1
(1.中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室,兰州730000;2.中国科学院大学,北京100049)
摘要:循环血microRNA(miRNA)具有很好的特异性和稳定性,并且参与多种生物过程。通过表达谱筛选循环血中对辐射及辐射防护药物敏感的miRNA,可以为循环血miRNA作为辐射标志物及辐射防护药靶提供依据和参考。利用X射线和碳离子束对昆明小鼠进行全身照射,采用实时定量PCR的方法研究了循环血中miRNA对辐射的敏感性,发现循环血中多种miRNA对辐射有响应,并且这些miRNA大多与免疫系统和造血系统密切相关,其中的let-7a,miR-223和miR-574呈现出较强的辐射敏感性和较明显的剂量效应关系,具有作为辐射生物标志物的潜能;并利用当归多糖对小鼠进行灌胃,研究了其辐射防护特性,并且对给药组和未给药组小鼠在辐射处理后循环血中的miRNA表达水平进行了比较。结果表明,当归多糖对辐射处理小鼠的免疫系统和造血系统具有显著的保护作用,给药组循环血中部分miRNA表达变化趋势与未给药组明显不同,循环血中不同的miRNA对辐射防护药物有不同的敏感性,或可作为辐射防护药物药靶使用。
关键词:循环血microRNA;辐射;敏感性;药靶
1 引言
随着载人航天事业的发展,未来航天员在太空的驻留时间将越来越长。空间辐射环境复杂,主要由质子、电子及少量重离子组成,它们具有能量高、剂量率低、随机性强并可能与其它环境因素相互作用的特点[1]。重离子(包括铁离子、碳离子等)射线所占的比例虽然不多,但由于其相对生物学效应明显,正越来越受到人们的重视。研究表明,空间辐射可造成人体器官和系统的损伤,导致各种疾病如眼底病变、再生障碍性贫血、各种肿瘤的产生,已成为影响航天员长期驻留太空的主要因素之一[2]。美国国家航空航天局的研究表明,近地轨道的国际空间站内受到的辐射剂量约为2 mSv/ day,而好奇号火星车搭载的RAD辐射系统监测飞船在巡航途中受到的银河系宇宙射线剂量约为1.8 mSv/ day[3]。国际放射防护委员会建议的职业照射限值是平均每年不超过20 mSv[3],在未来的载人航天活动中,航天员接受到的辐射剂量将远远超过这个限值[4],不仅可能增加潜在的致癌风险,而且可能导致辐射中毒症状的产生。
microRNA(miRNA)是一种长度约为18~24 nt的内源性非编码RNA,它通过与特异的mRNA3'非编码区(UTR)互补配对来抑制mRNA的翻译,是一种非常重要的转录后调控因子,参与生物体内大部分生物过程的调控[5]。由于miRNA长度较短,并且在循环血中常被囊泡包裹,所以miRNA可以稳定存在于循环系统当中。近年来,已有大量研究尝试将血液系统中的miRNA作为疾病标志物[6-8]。循环血中的miRNA是否可以作为辐射生物标志物来反映个体所受到的辐射损伤情况呢?Jacob等人的研究发现,在受到4 Gy的X射线辐照后,小鼠循环血中的miR-200b和miR-762显示出较明显的上升趋势,而miR-150表达则随辐照剂量的增加呈现降低趋势[9]。但是,以上这些研究选取的辐照剂量较大(1~12 Gy),射线种类比较单一,很难真实反映空间辐射对循环血miRNA的影响。本研究选取X射线和碳离子束对小鼠进行全身照射,通过寻找小鼠循环血中辐射敏感的miRNA并进行验证,以期得到可以用来评估空间辐射风险的理想的生物标志物。
除了物理屏蔽手段以外,采取高效、低毒的辐射防护药物降低空间辐射可能造成的危害也是有效的措施之一。当归多糖( Angelicasinensispolysaccharide,ASP)是一种从传统中药当归中提取的多糖,其主要成分为一类二糖聚合物,能明显促进动物的造血机能,有效对抗辐射引起的血细胞减少,激活免疫系统的淋巴细胞、巨噬细胞,并且具有抗自由基,抗癌等功效,是比较理想的天然防辐射药物[10-11]。本文进一步研究了当归多糖对辐射处理小鼠的免疫系统和造血系统的保护作用,并且检测了给药组和未给药组小鼠在照射前后循环血中miRNA的表达变化,探究miRNA作为辐射防护药物药靶的可能性,为寻找对抗空间辐射的新药靶奠定基础。
2 实验材料及方法
2.1 实验动物及照射方案
实验动物选取6~7周的清洁级雄性昆明小鼠(兰州大学医学院提供),初始体重约为20±2 g,饲养一周后,挑选体重约为24±2 g的健康小鼠,利用Faxitron RX-650射线仪产生的X射线和近代物理研究所重离子加速器浅层治疗终端提供的碳(12C6+)离子束对小鼠进行全身照射。由于X射线的线性传能密度(linear energy transfer,LET)和相对生物学效应(Relative biological effectiveness, RBE)低于重离子射线,所以选取的X射线的照射剂量要高于碳离子射线。X射线照射的小鼠分为4个组,照射剂量分别为0 Gy、0.5 Gy、2 Gy和4 Gy,剂量率为0.5 Gy/ min,碳离子束照射的小鼠分为3个组,照射剂量分别为0 Gy、0.25 Gy和0.5 Gy,剂量率为0.5 Gy/ min。每个处理组6只小鼠,并以未照射小鼠(0 Gy组)作为对照。
2.2 血清的提取和RNA的纯化
照射结束24 h后,采用眼眶取血的方法,将全血采集到无RNA酶的EP管中,整个过程避免剧烈晃动EP管,并且不要让鼠毛等杂质落入管中,防止溶血。将全血在室温下放置2 h,3000 r/ min离心10 min,吸取上层澄清的血清,放入新的无RNA酶管中,10 000 r/ min离心10 min,即可分离得到实验所需血清样品。由于血清样品中RNA的丰度较低,所以采用QIAGENE公司的miRNeasy Serum/ Plasma Kit提取总的RNA,提取之前,在血清样品中加入外源的cel-miR-39作为内参用于归一化。
2.3 miRNA PCR芯片的检测及数据分析
得到的总RNA利用miScript II RT Kit(QIAGENE)进行反转录,使总RNA中的miRNA形成特异的cDNA聚合体。将cDNA聚合体和miS-cript SYBR Green PCR Kit(QIAGENE)充分混合,加入miScript miRNA PCR Arrays(QIAGENE)芯片的反应孔中。将加入反应体系的PCR芯片放入实时定量PCR仪CFX96TM Real-time System(Bio-RAD)中,进行PCR扩增及定量。miRNA芯片所得原始数据利用在线工具miScript miRNA PCR Array Date Analysis(http:/ / pcrdataanalysis.sabiosciences.com/ mirna/ arrayanalysis.php)进行分析。数据分析工具采用的是2-ΔΔCt法,利用每组中外源cel-miR-39的Ct值对本组其它miRNA的Ct值进行归一化,然后进行变化倍数、P值(与对照组进行t检验)的分析。
2.4 差异表达miRNA的筛选
miRNA芯片检测了86种miRNA的变化情况,通过以下两个条件对芯片结果进行筛选:(1)为保证miRNA在循环血中的丰度较高,其平均Ct小于32;(2)至少在一个照射剂量下,miRNA的变化倍数大于等于2,并且其P值小于0.1。
2.5 miRNA芯片结果的PCR定量验证
同2.2步骤,从经过照射的小鼠血清样本中提取得到总RNA,利用All-in-one First-stand cDNA Sythesis Kit(Gene Copoeia)反转录试剂盒进行反转录,得到cDNA聚合物。将从PCR芯片中筛选得到的几种miRNA的引物分别与cDNA混合,再与All-in-oneTM miRNA qRT-PCR Detection Kit (Gene Copoeia)反应体系混合,上机进行实时定量PCR反应。
2.6 PCR定量数据分析
PCR定量数据分析采用2-ΔΔCt法。相同处理组中,分别利用每种miRNA的Ct值减去外加内参cel-miR-39的Ct值,得到ΔCt,此步骤为归一化。处理组与对照组中相同miRNA的ΔCt相减,得到ΔΔCt值。然后求2-ΔΔCt的值,即为此miRNA处理组与对照组的相对变化量。实验组与对照组的差异性分析采用t检验,P<0.05即为具有显著性差异。
2.7 小鼠当归多糖灌胃及给药后照射
为验证当归多糖的辐射防护作用,选取清洁级雄性昆明小鼠于每天早上10:00进行当归多糖溶液灌胃,持续7天。每次灌胃的当归多糖溶液体积为200 uL,溶液浓度为1 mg/ mL,对照组灌胃等量的去离子水,给药组和对照组各54只小鼠,灌胃2 h后小鼠正常进水进食。在第7次灌胃结束4 h 后,随机将给药组和对照组的小鼠各分成6个小组(X射线照射3个小组,碳离子束照射3个小组),每组9只。分别利用X射线和碳离子束对给药组和对照组小鼠进行全身照射。X射线照射剂量为0 Gy、2 Gy和4 Gy,剂量率为0.5 Gy/ min。碳离子束照射剂量为0 Gy、0.1 Gy和0.5 Gy,剂量率为0.5 Gy / min。
2.8 免疫系统及造血系统的分析
照射结束后24 h,分别取小鼠的血液、脾脏、骨髓进行分析。免疫及造血系统的分析包括血象分析,脾脏指数分析,股骨有核细胞分析及T细胞CD4+/ CD8+分析。以上各个指标的组间差异性分析均由实验组与对照组进行t检验分析,不同组间P<0.05即为具有显著性差异。
2.8.1 血象分析
由兰州大学医学院利用XFA6000Intelligent血常规分析仪分析完成。
2.8.2 脾脏指数
脾脏指数为每只小鼠脾脏质量和体重的比值。
2.8.3 股骨有核细胞计数
取小鼠左侧后腿股骨,将上面附着的肌肉剔净,剪掉股骨两端,用1 mLPBS反复冲洗4次, 200 r/ min离心3 min,吸取上清,吹打混匀后,吸取200 uL细胞悬液,加入9.8 mL去离子水中,颠倒混匀,利用Z2双门槛细胞计数仪(Beckman Coulter)进行骨髓有核细胞计数。
2.8.4 脾脏CD4+/ CD8+细胞比值
将脾脏反复剪碎,加入PBS摇匀,100目滤网过滤掉组织碎片,2000 r/ min离心,弃上清,加入2 mL红细胞裂解液,低温下裂解5 min,2000 r/ min离心5 min,弃掉上清。反复裂解2~3次,直至离心管内细胞沉淀无红色。500 mL PBS重悬,调整细胞浓度至1~3×106个/ mL。加入CD3+、CD4+、CD8+抗体,避光条件下孵育20 min。利用FlowSight流式细胞仪(amnis)进行检测,实验结果利用FlowJo软件进行分析。
2.9给药照射后循环血miRNA的分析
2.7步骤中给药组和对照组小鼠在照射结束24 h后取血,同2.2步骤提取总RNA,并同2.5步骤进行RNA的反转录和qRT-PCR定量检测,同样利用2-ΔΔCt法分析目标miRNA的变化趋势。
3 结果与分析
3.1 可作为辐射生物标志物的miRNA的确定
前期芯片结果表明表明,小鼠循环血中与辐射相关的miRNA有几十种。本研究分别利用X射线和碳离子束对小鼠进行全身照射,于照射后24 h取血,提取血清后分离总RNA并进行反转录,用miRNA PCR array检测了循环血中常见的86种miRNA表达水平,并通过Ct值、变化倍数及统计学条件(P<0.1)分别在X射线组和碳离子射线组筛选得出了6个(表1)和10个(表2)符合条件的miRNA。
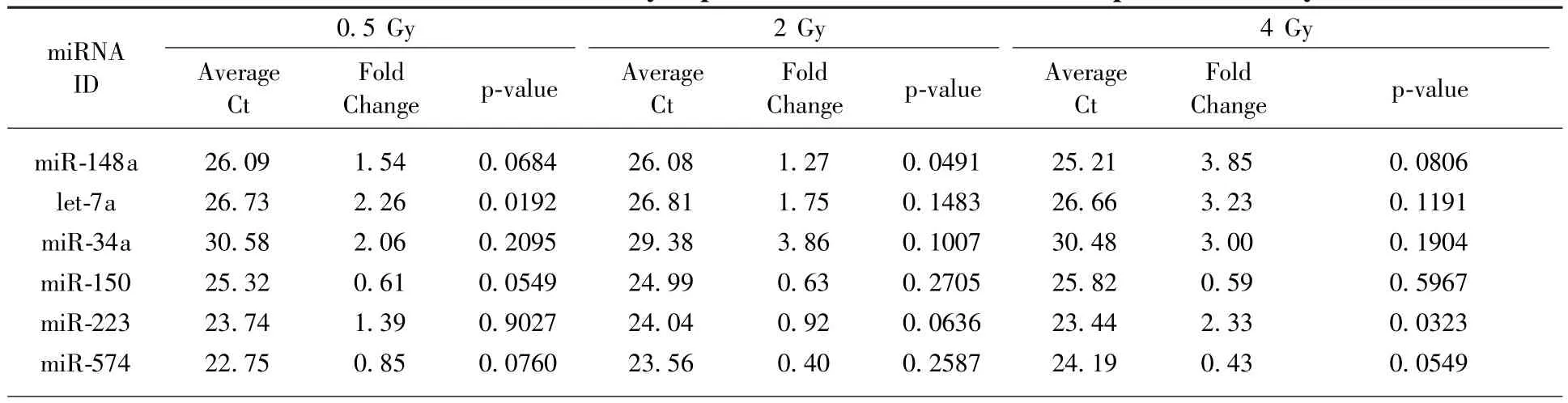
表1 小鼠循环血中对X射线敏感的miRNATable 1 miRNAs differentially expressed in mouse blood after exposure to X-ray
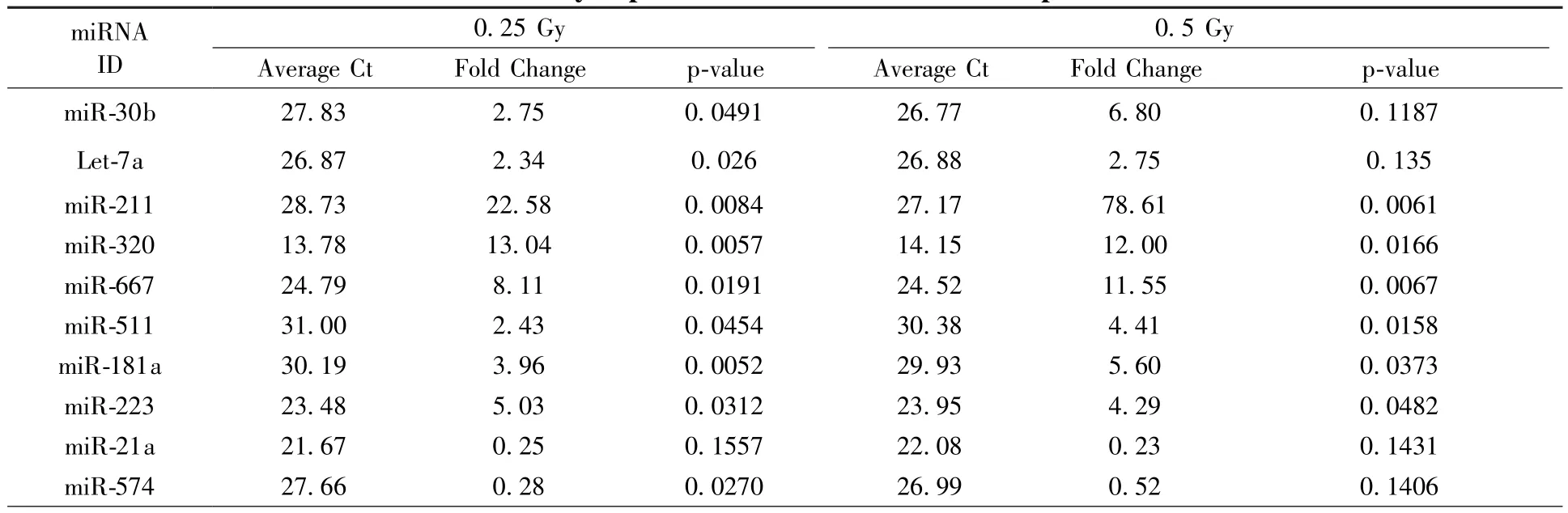
表2 小鼠循环血中对重离子射线敏感的miRNATable 2 miRNAs differentially expressed in mouse blood after exposure to carbon ion beam
通过文献查阅,这些miRNA大多与免疫系统和造血系统密切相关,如let-7a、miR-223和miR-574与骨髓细胞分化有关,miR-146a、miR-181a、miR-155、miR-125b、miR-150、miR-320和miR-21a与淋巴细胞有关[12-15]。对这两组miRNA集合求交集(图1),可以得出let-7a、miR-223和miR-574三种miRNA在X射线及碳离子射线照射下都有显著变化,具有作为辐射生物标志物的潜能。
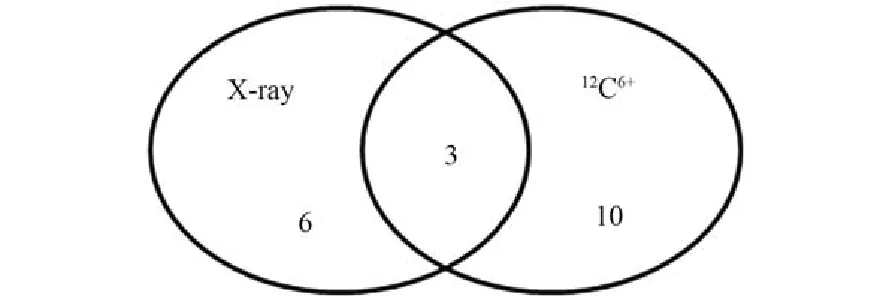
图1 同时对X射线和碳离子射线敏感的3种miRNAFig.1 Three kinds of miRNAs are sensitive to both X-ray and carbon ion beam
3.2 辐射敏感miRNA表达水平的验证
为了验证芯片结果的准确性,分别利用X射线和碳离子束对小鼠进行照射,24 h后取血并分离血清,然后利用实时定量PCR技术对从芯片结果中筛选出来的对两种辐射都敏感的let-7a、miR-223、miR-574进行验证。从X射线(图2)和碳离子(图3)的验证结果可以看出,qRT-PCR结果与芯片结果一致。小鼠循环血中let-7a和miR-223在受到照射后表达水平随剂量增加逐渐升高,而miR-574则呈下降趋势,并且对X射线和重离子的响应具有一致性,具有作为辐射生物标志物的潜能。
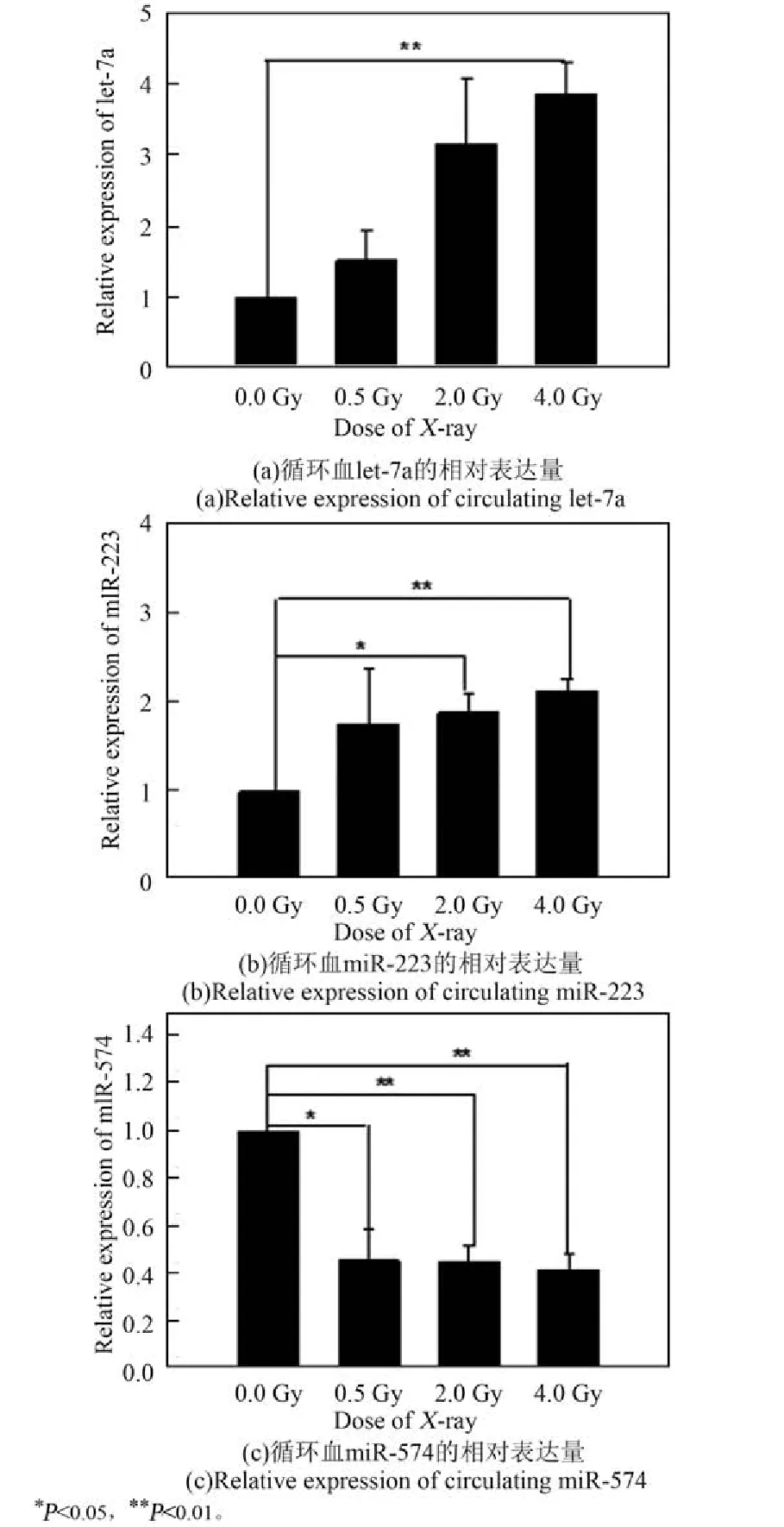
图2 qRT-PCR技术验证X-ray照射后3种候选miRNA的变化趋势Fig.2 Validation of 3 deregulated miRNAs after exposure to X-ray by qRT-PCR
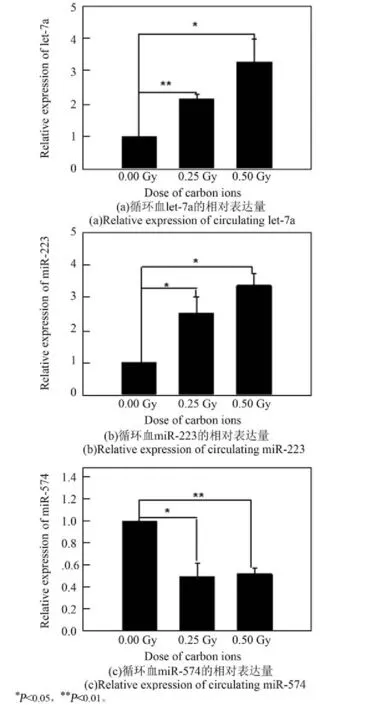
图3 qRT-PCR技术验证碳离子照射后3种候选miRNA的变化趋势Fig.3 Validation of 3 deregulated miRNAs after exposure to carbon ions by qRT-PCR
3.3 当归多糖的辐射防护作用
选取6~7周的小鼠,利用当归多糖给小鼠(n=9)连续灌胃7天,每次灌胃的给药量为0.2 mg,对照组灌胃等体积的水。灌胃结束后,挑选体重及状态相近的小鼠,分别利用X射线及碳离子束进行全身照射。照射24 h后,检测循环血白细胞数、脾脏指数、股骨骨髓有核细胞数和脾脏T细胞CD4+/ CD8+细胞比值,结果如图4及图5所示。可以看出,在未给药组,X射线和重离子射线都会使小鼠的骨髓造血细胞、循环血白细胞以及免疫器官淋巴细胞数量显著下降,免疫器官脾脏也出现萎缩,说明辐射确实会对小鼠的免疫及造血系统产生显著影响。而用当归多糖灌胃之后,小鼠的免疫及造血细胞数量有所上升,表明当归多糖促进了小鼠免疫及造血细胞的生成。在受到照射后,给药组的各项指标都显著高于未给药组,证实当归多糖具有明显的辐射防护作用。
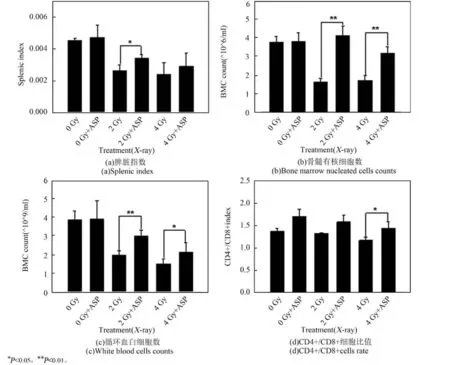
图4 当归多糖对X射线照射后的小鼠免疫及造血系统的保护作用Fig.4 Protection of ASP on the immune and hematopoietic system of mice after X-ray irradiation
3.4 当归多糖给药条件下循环血中辐射敏感miRNA的变化
利用X射线对当归多糖给药组和未给药组的小鼠进行全身照射。照射结束24 h后取血,利用qRT-PCR技术检测小鼠循环血中辐射敏感的let-7a、miR-223和miR-574的表达水平(图6)。可以看出,原来在辐射处理后表达上升的let-7a 及miR-223在给药组中没有明显的变化,而辐射处理后表达下降的miR-574在给药组中的表达水平则随照射剂量上升呈现上升趋势。这些变化说明,循环血中不同的miRNA对辐射防护药物具有不同的响应。
4 结论
miRNA作为一种重要的转录后调控因子,积极响应各种外界胁迫条件。在生物体受到辐射损伤时,身体各个器官的miRNA分子会进入循环血,所以循环血miRNA水平能反映机体受到的辐射损伤程度[6]。研究结果表明,小鼠循环血中多种miRNA在受到包括X射线和碳离子射线的照射后,其表达水平在照射后24 h都会出现显著变化,甚至在较低剂量如0.5 Gy X射线和0.25 Gy碳离子的照射条件下,部分miRNA的表达水平都会出现显著变化(表1、表2),表明循环血miRNA分子对各种剂量和类型的射线都具有较高的敏感性。由于miRNA是一类短链的小RNA分子,在不同物种间具有较好的保守性[16],并且不容易被酶类分解,在提取和储存的过程中具有较好的稳定性[17]。miRNA具有灵敏度高,反应时间短,稳定性好等特点,可以作为理想的辐射生物标志物。通过对小鼠进行全身照射处理,发现多种循环血miRNA对辐射有响应,其中let-7a,miR-223和miR-574呈现出较强的辐射敏感性和较明显的剂量效应关系。如果将辐射敏感的miRNA制成生物芯片,将会成为一种简便有效的辐射检测方法,有望在未来的辐射损伤评估中发挥巨大的作用。
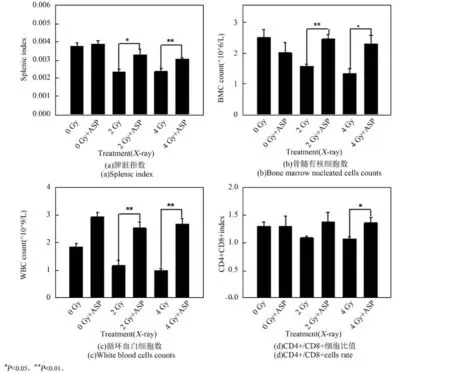
图5 当归多糖对碳离子照射后的小鼠免疫及造血系统的保护作用Fig.5 Protection of ASP on the immune and hematopoietic system of mice after carbon ions irradiation
通过当归多糖对小鼠辐射防护效果的评估,可以看出当归多糖对辐射处理小鼠的免疫系统和造血系统具有显著的保护作用(图4、图5),是一种有效的天然抗辐射药物。通过检测给药组和未给药组小鼠辐射后循环血中的miRNA表达水平,发现给药组部分miRNA表达变化趋势与未给药组显著不同(图6),表明循环血miRNA对辐射防护药物具有敏感性,并可能是作为药物靶基因的次级产物而出现表达水平的差异。而miRNA作为一种转录后调控因子,有可能通过循环系统的转移和细胞间的旁效应对其它细胞甚至是器官产生作用,具有成为防辐射药物药靶的可能。通过进一步探索这些miRNA分子的功能以及它们对免疫系统和造血系统的影响,将有助于新辐射生物标志物和新药靶的研发,对我国载人航天的发展具有重要的实际意义和广阔的应用前景。
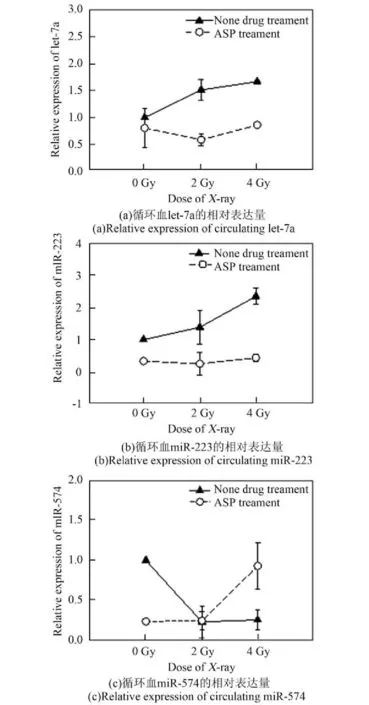
图6 当归多糖给药和未给药条件下X射线辐照后循环血miRNA的不同表达情况Fig.6 The different expression of circulating miRNAs after exposure to X-ray in ASP treated and non-treated groups
参考文献(References)
[1] Barth J L, Dyer C S, Stassinopoulos E G.Space, atmospheric, and terrestrial radiation environments[J].Nuclear Science, IEEE Transactions on, 2003, 50(3):466-482.
[2] 夏寿萱.放射生物学[M].北京:军事医学科学出版社, 1998:138-346.Xia Shouxuan.Radiation biology[M].Beijing:Military Medical Science Press,1998:138-346.(in Chinese)
[3] ICRP 1990 Recommendations of the International Commission on Radiological Protection[S].ICRP Publication 60, 1991.
[4] Zeitlin C, Hassler D M, Cucinotta F A, et al.Measurements of energetic particle radiation in transit to Mars on the Mars Science Laboratory[J].Science, 2013, 340(6136):1080-1084.
[5] Bartel D P.MicroRNAs:genomics, biogenesis, mechanism, and function[J].Cell, 2004, 116(2):281-297.
[6] Chen X, Hu Z, Wang W, et al.Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis[J].International Journal of Cancer, 2012, 130(7):1620-1628.
[7] Tavallaie R, De Almeida S R M, Gooding J J.Toward biosensors for the detection of circulating microRNA as a cancer biomarker:an overview of the challenges and successes[J].Wiley Interdisciplinary Reviews:Nanomedicine and Nanobiotechnology, 2015, 7(4):580-592.
[8] Salendo J, Spitzner M, Kramer F, et al.Identification of a microRNA expression signature for chemoradiosensitivity of colorectal cancer cells, involving miRNAs-320a,-224,-132 and let7g[J].Radiotherapy and Oncology, 2013, 108(3):451-457.
[9] Jacob N K, Cooley J V, Yee T N, et al.Identification of sensitive serum microRNA biomarkers for radiation biodosimetry [J].PLoS One, 2013, 8(2):e57603.
[10] Liu S P, Dong W G, Wu D F, et al.Protective effect of angelica sinensis polysaccharide on experimental immunological colon injury in rats[J].World journal of gastroenterology:WJG, 2003, 9(12):2786-2790.
[11] Wang K, Cao P, Shui W, et al.Angelica sinensis polysaccharide regulates glucose and lipid metabolism disorder in prediabetic and streptozotocin-induced diabetic mice through the elevation of glycogen levels and reduction of inflammatory factors[J].Food&function, 2015, 6(3):902-909.
[12] Contreras J, Rao D S.MicroRNAs in inflammation and immune responses[J].Leukemia, 2012, 26(3):404-413.
[13] El Gazzar M, McCall C E.MicroRNAs regulatory networks in myeloid lineage development and differentiation:regulators of the regulators[J].Immunology and cell biology, 2012, 90 (6):587-593.
[14] Havelange V, Garzon R.MicroRNAs:emerging key regulators of hematopoiesis[J].American journal of hematology, 2010, 85(12):935-942.
[15] Merkerova M, Vasikova A, Belickova M, et al.MicroRNA expression profiles in umbilical cord blood cell lineages[J].Stem cells and development, 2010, 19(1):17-26.
[16] Du J F, Wu Y J, Zhang Y X, et al.Large-scale information entropy analysis of important sites in mature and precursor miRNA sequences[J].Science in China Series C:Life Sciences, 2009, 52(8):771-779.
[17] Sourvinou I S, Markou A, Lianidou E S.Quantification of circulating miRNAs in plasma:effect of preanalytical and analytical parameters on their isolation and stability[J].The Journal of Molecular Diagnostics, 2013, 15(6):827-834.
Study on Sensitivity of Circulating microRNA to Radiation and Radioprotective Drug
WEI Wenjun1,2, LI Pengfei1,2, LIN Sulan1,2, WANG Jufang1
(1.Gansu Key Laboratory of Space Radiobiology, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China;2.University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract:Circulating microRNA (miRNA) in blood has good specificity and stability, which involved in many biological processes.Screening miRNAs in blood responded to radiation and radioprotector by global expression profile could provide reference to utilize circulating miRNA as biomarkers of radiation and targets of radioprotector.Kunming mice were whole-body exposed to X rays and carbon ions, then, radiosensitivity of circulating miRNA were detected by qRT-PCR analysis.It was found that many kinds of circulating miRNAs responded to radiation, and most of them were closely associated with immune system and hematopoietic system.Among these radiation related miRNAs, let-7a, miR-223 and miR-574 showed obvious radiosensitivity and dose-effect, which demonstrated that they were potential biomarkers of radiation.Then, mice were treated with Angelica sinensis polysaccharide (ASP) by gavage.The authors studied the radiation protection features of ASP and compared the expression levels of circulating miRNAs between ASP treatedgroup and control group after irradiation.The results showed that ASP significantly protected the immune system and hemato-book=247,ebook=109poietic system of irradiated mice, meanwhile, the expression pattern of some miRNAs was distinctively different between the ASP treated group and the control group.Those findings indicate that different circulating miRNA has different sensitivity to radioprotector, and they could be possible targets of radioprotector against radiation damage.
Key words:circulating microRNA;radiation;sensitivity;drug target
作者简介:危文俊(1990-),男,博士研究生,研究方向为空间辐射防护及生物学效应。E-mial:wwwweiwenjun@163.com
基金项目:载人航天预先研究项目(040101)
收稿日期:2015-06-30;修回日期:2016-02-14
中图分类号:R852.7;Q691.7
文献标识码:A
文章编号:1674-5825(2016)02-0246-08

