灵芝多糖乙酰化及其抗氧化活性研究
叶颖霞,赵菊香,陈盛强,孙卫文
(1.广州医科大学附属第一医院,广东 广州 510120;2.广州医科大学神经科学研究所,广东 广州 510260)
灵芝多糖乙酰化及其抗氧化活性研究
叶颖霞1,赵菊香1,陈盛强2,孙卫文2
(1.广州医科大学附属第一医院,广东 广州510120;2.广州医科大学神经科学研究所,广东 广州510260)
[摘要]目的通过化学修饰改变灵芝多糖分子结构,并研究其体内抗氧化活性。方法乙酰化修饰灵芝多糖(Ganoderma lucidum polysaccharide,GLP),得到GLP乙酰化衍生物(GLP acetyl derivatives,GLPa);将昆明种小鼠随机分成空白对照组,阳性对照组,GLP高、低剂量组及GLPa高、低剂量组,测定小鼠血清和肝脏丙二醛(malondialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,T-AOC)和过氧化氢酶(catalase,CAT);建立高脂血症大鼠抗氧化损伤模型,考察GLP及GLPa的抗氧化能力。结果GLPa及GLP均可以显著提高正常小鼠肝组织CAT活力及T-AOC,降低小鼠血清及肝脏MDA含量,GLPa抗氧化活性明显优于GLP,且与给药剂量相关。此外,GLPa及GLP还可以显著降低四氧嘧啶致高脂大鼠的氧化损伤程度,提高其血清超氧化物歧化酶活力及肝脏T-AOC,并降低其血清MDA含量。结论乙酰化修饰可显著提高灵芝多糖的抗氧化活性。
[关键词]灵芝多糖;乙酰化;抗氧化
灵芝多糖(Ganodermalucidumpolysaccharide,GLP)为多孔菌科真菌赤芝Ganodermalucidum(Leyss. ex Fr.)Karst.菌丝体的次生代谢产物,存在于其菌丝体及子实体中[1]。GLP具有抗肿瘤[2]、提高免疫力[3]、抗氧化[1]及抗辐射[4]等作用。天然来源的多糖具有低毒、无不良反应的优势,但也存在一些不足:天然多糖并不都具有生物学活性[5];一些多糖因为其理化性质或空间结构等问题从而限制其药理活性;某些多糖活性较弱,还需要进一步改善[6]。当前已有大量关于分子修饰多糖从而获得理想的活性多糖的文献报道。分子修饰方法主要分为化学修饰、物理修饰及生物修饰,以化学修饰运用最为广泛。化学修饰方法主要通过嫁接硫酸基、甲基、乙酰基等基团或者元素,以改变多糖理化性质及活性[7]。研究[8-9]表明,分子修饰后的多糖不仅可以提高原有的生物学活性,有些甚至可以产生新的药理作用。
目前已有关于对GLP硫酸化修饰的研究报道,经硫酸化修饰使GLP具有显著的抗肿瘤、抗癌活性[10]。而对于GLP乙酰化修饰尚无研究报道,从其他关于多糖乙酰化的研究报道可以推测,乙酰化可使多糖改变定向性及横向次序,从而改变多糖的空间排布,增加其水溶性,改善其活性。因此本研究采用乙酰化修饰GLP,通过体内抗氧化实验检测乙酰化GLP抗氧化活性,为GLP相关药品及功能保健品的开发奠定理论基础。
1材料与仪器
1.1材料与试剂灵芝:多孔菌科真菌赤芝Ganodermalucidum(Leyss. ex Fr.)Karst的干燥子实体,购自于广州清平药材市场,经水体醇沉法[11]获得粗多糖后,采用Superdex-G200分离得到纯化GLP;过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、超氧化物歧化酶(super oxide dismutase,SOD)试剂盒:江苏省南京建成生物工程研究所;三氯乙酸、吡啶、甲酰胺、乙酸酐、无水乙醇均为分析纯。
1.2实验动物SPF级昆明种小鼠及SD大鼠,购自广州中医药大学实验动物中心,生产许可证号为SCXK(粤)2008-0001。
1.3仪器DL-5000B离心机:上海飞鸽科学仪器厂;FA2004电子天平:上海菁华仪器有限公司;501-A型超级恒温器:上海实验仪器厂有限公司;UV-360紫外可见分光光度计:日本岛津公司;RE52-4旋转蒸发仪:常州金坛仪器有限公司。
2方法
2.1GLP乙酰化衍生物(GLP acetyl derivatives,GLPa)制备按文献[12]方法,称取400 mg GLP溶于10 mL蒸馏水中,充分溶解,用NaOH调节溶液pH值至9.0,然后缓慢滴加5 mL甲酰胺,同时滴加NaOH溶液以维持反应体系的pH值在8.2左右,反应过程中持续搅拌,反应结束后再缓慢滴加盐酸至溶液呈中性,后用乙醇沉淀反应体系,沉淀物用95%乙醇洗涤3次,沉淀物冷冻干燥后溶于100 mL蒸馏水中,3 000 Da透析袋透析72 h,浓缩,醇沉,冷冻干燥即得GLPa。采用红外线检测乙酰化成功与否[13]。
2.2GLPa对正常小鼠抗氧化能力的影响将60只昆明种小鼠随机分成6组(雌雄各半)。分别为空白对照组:每天灌胃0.9%生理盐水;阳性对照组:维生素C(vitamin C,Vc),500 mg/kg,用前新鲜配制;GLP低剂量组:100 mg/kg;GLP高剂量组:300 mg/kg;GLPa低剂量组:100 mg/kg;GLPa高剂量组:300 mg/kg,连续灌胃给药15 d。末次给药后眼眶取血,收集后离心取血清。麻醉处死小鼠,剖取肝脏,按试剂盒指导方法检测血清和肝脏MDA、肝脏T-AOC和CAT。
2.3GLPa对高脂血症大鼠抗氧化损伤能力的影响取雌性SD大鼠,灌胃给予实验室配制的高脂饮食(猪油∶胆固醇∶胆盐3号∶丙基硫氧嘧啶为50∶40∶8∶2),每只2 mL,连续20 d。根据血清三酰甘油含量,取48只雌性SD大鼠,随机分为6组。阳性对照组:血脂康200 mg/kg;阴性对照组:0.9%生理盐水;GLP低剂量组:100 mg/kg;GLP高剂量组:300 mg/kg;GLPa低剂量组:100 mg/kg;GLPa高剂量组:300 mg/kg;另取8只正常饮食的雌性SD大鼠作为正常对照组:灌胃给予生理盐水。各组通过腹腔注射连续给药40 d。于第37天,除正常对照组外,其余6组SD大鼠均腹腔注射四氧嘧啶,200 mg/kg。72 h后,麻醉处死,腹腔主动脉取血,离心(20 000 r/min,15 min),取血清,按试剂盒指示方法检测血清MDA与SOD以及肝脏的T-AOC。

3结果
3.1GLPa对正常小鼠抗氧化能力的影响
3.1.1GLPa量效关系考察以空白对照组和GLPa高、低剂量组为实验组合进行单因素方差分析,结果显示,空白对照组和GLPa高低剂量组血清MDA、肝脏MDA、肝脏T-AOC和肝脏CAT活力比较,差异均具有统计学意义(血清MDA:F(2,27)=102.264,P=0.000;肝脏MDA:F(2,27)=238.222,P=0.000;肝脏T-AOC:F(2, 27)=190.601,P=0.000;肝脏CAT活力:F(2,27)=164.862,P=0.000),以GLPa高剂量组降低血清和肝脏MDA及升高肝脏T-AOC和CAT活力的效应最为显著(P<0.05)。见表1。
3.1.2GLPa与阳性对照药Vc抗氧化能力比较以GLPa高、低剂量组和阳性对照组为组合进行单因素方差分析,结果显示,阳性对照组和GLPa高、低剂量组血清MDA、肝脏MDA、肝脏T-AOC和肝脏CAT活力比较,差异均具有统计学意义(血清MDA:F(2,27)=37.84,P=0.000;肝脏MDA:F(2,27)=57.78,P=0.000;肝脏T-AOC:F(2,27)=59.37,P=0.000;肝脏CAT活力:F(2,27)=75.61,P=0.000),GLPa高、低剂量组降低血清和肝脏MDA及升高肝脏T-AOC和CAT活力的效应均明显优于Vc(P<0.05)。见表1。
3.1.3乙酰化修饰因素和剂量因素对正常小鼠抗氧能力影响的两因素析因设计方差分析以GLP高、低剂量组和GLPa高、低剂量组为实验组合进行两因素析因设计的方差分析,结果显示,乙酰化修饰因素和剂量因素对血清MDA、肝脏MDA、肝脏T-AOC和肝脏CAT活力的主效应均具有统计学意义(P<0.05),两个因素的交互作用均无统计学意义(P>0.05)。结果提示,乙酰化修饰可明显提高GLP对正常大鼠的抗氧化能力。见表2。

表1 GLPa对正常小鼠抗氧化能力的影响±s)
注:与空白对照组比较,*P<0.05;与GLPa低剂量组比较,#P<0.05;与阳性对照组比较,△P<0.05;与GLP低剂量组比较,◇P<0.05;与GLP高剂量组比较,▲P<0.05。

表2 乙酰化修饰因素和剂量因素对正常小鼠抗氧化能力影响的两因素析因设计方差分析结果
3.2GLPa对高脂血症大鼠抗氧化损伤能力的影响
3.2.1高脂血症大鼠抗氧化能力的变化以空白对照组和阴性对照组为实验组合进行两个独立样本t检验,结果显示,阴性对照组血清SOD和肝脏T-AOC水平较空白对照组明显降低(P<0.05),血清MDA水平较空白对照组显著升高(P<0.05)。结果提示,高脂血症大鼠抗氧化能力较正常大鼠明显降低。见表3。
3.2.2GLPa对高脂血症大鼠抗氧化能力影响的量效关系考察以阴性对照组和GLPa高、低剂量组为实验组合进行单因素方差分析,结果显示,3组血清SOD、MDA和肝脏T-AOC水平比较,差异均具有统计学意义(血清SOD:F(2,21)=230.5,P=0.000;血清MDA:F(2,21)=1 656.7,P=0.000;肝脏T-AOC:F(2,21)=490.2,P=0.000),以GLPa高剂量升高血清SOD、肝脏T-AOC及降低血清MDA的作用为最优。见表3。
3.2.3GLPa与阳性对照组血脂康抗氧化能力比较以阳性对照组和GLPa高、低剂量组为实验组合进行单因素方差分析,结果显示,3组血清SOD、MDA和肝脏T-AOC水平比较,差异均具有统计学意义(血清SOD:F(2,21)=111.8,P=0.000;血清MDA:F(2,21)=292.3,P=0.000;肝脏T-AOC:F(2,21)=297.6,P=0.000),GLPa高、低剂量降低血清MDA及升高血清SOD和肝脏T-AOC的效应均明显优于血脂康(P<0.05)。见表3。
3.2.4乙酰化修饰因素和剂量因素对高脂血症大鼠抗氧化能力影响的两因素析因设计的方差分析以GLP高、低剂量组和GLPa高、低剂量组为实验组合进行两因素析因设计的方差分析,结果显示,乙酰化修饰因素和剂量因素对血清SOD、血清MDA和肝脏T-AOC的主效应均具有统计学意义(P<0.05),两个因素对血清MDA的交互作用具有统计学意义(P<0.05)。结果提示,GLPa提高高脂血症大鼠体内抗氧化能力的效应明显优于GLP。见表4。

表3 GLPa对高脂血症大鼠体内抗氧化能力的影响±s)
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05;与阳性对照组比较,△P<0.05;与GLP低剂量组比较,◇P<0.05;与GLPa低剂量组比较,▲P<0.05;与GLP高剂量组比较,□P<0.05。
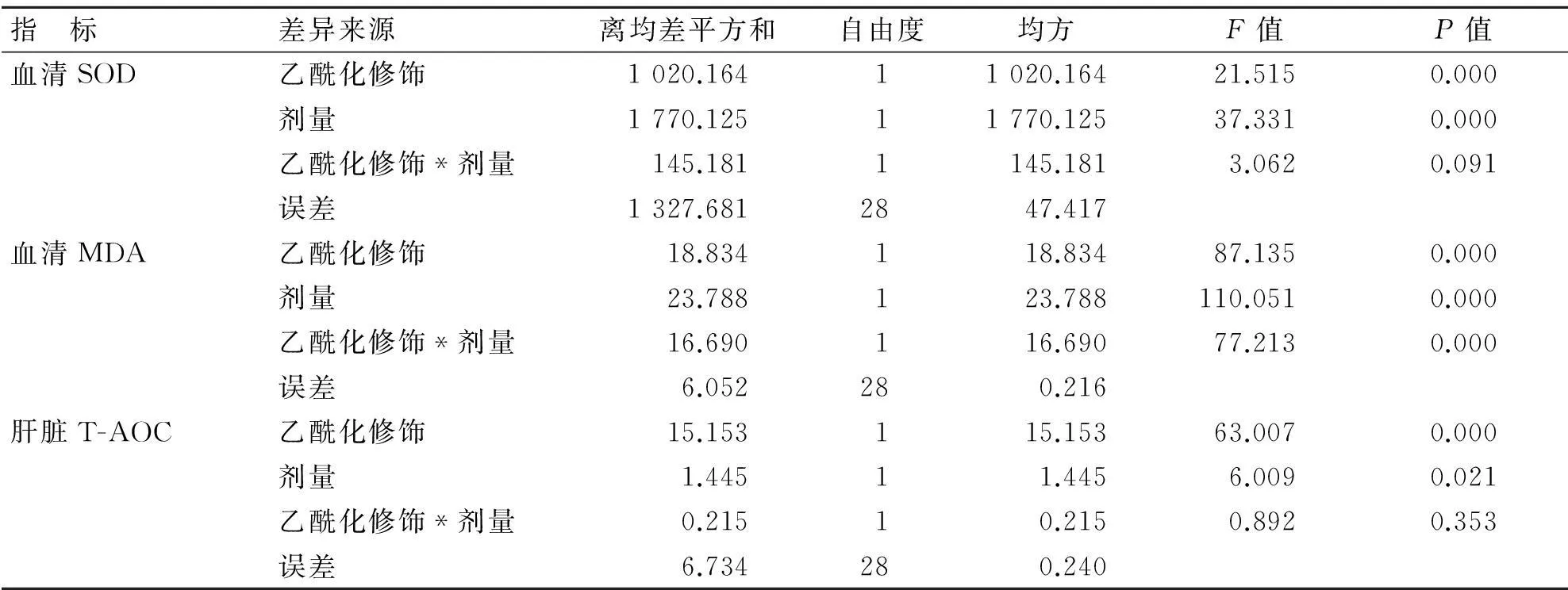
表4 乙酰化修饰因素和剂量因素对高脂血症大鼠体内抗氧化能力影响的两因素析因设计方差分析结果
4讨论
生物体内MDA是自由基作用于脂质过氧化所产生的代谢产物,因此MDA浓度越低,则脂质过氧化程度越低,表明机体抗氧化能力就越强[15]。因此,本研究选取MDA含量为其中的考察指标。多糖具有清除自由基、抗衰老等作用的机制是:①羟基与多糖碳链末端的氢原子结合而生成H2O;②多糖通过提高SOD、CAT等抗氧化酶的活性,从而发挥抗氧化、防衰老的作用;③改善机体免疫力以抗氧化及防衰老。因此,可以通过测定机体内SOD及MDA活力来评价受试药的抗氧化活性[16-17]。
GLPa及GLP均可以显著改善正常小鼠肝组织CAT活力及总抗氧化能力,降低小鼠血清及肝脏中MDA含量,GLPa的抗氧化活性明显优于GLP,且两者抗氧化活力与给药剂量均具有一定相关性,高剂量效果更优。此外,GLPa及GLP对四氧嘧啶所致高脂大鼠的氧化损伤具有显著改善能力,其作用机制为提高其血清SOD活力及肝脏T-AOC,并降低MDA含量。以上结果表明,GLPa的抗氧化活性显著优于未经修饰的天然灵芝多糖,可能是因为乙酰化修饰改变灵芝多糖的空间排布及结构,进而增加其亲水性,从而提高了GLPa活性。
参考文献:
[1]张志军,李淑芳,魏雪生,等.灵芝多糖体外抗氧化活性的研究[J]. 化学与生物工程,2011,28(3): 63-65.
[2]刘高强,王晓玲.灵芝多糖的抗癌构效关系及其抗癌作用机制[J].菌物学报,2006,25(3):430-438.
[3]吴旋,白东清,杨广,等.灵芝多糖对黄颡鱼免疫细胞活性的影响[J].华北农学报,2011,26(3):195-198.
[4]吴京燕,程光宇,江海涛,等.灵芝多糖合剂抗辐射保健功能的研究[J].南京师范大学学报(自然科学版),2003,26(3):79.
[5]Qiu S,Chen J,Chen X,et al.Optimization of selenylation conditions forlyciumbarbarumpolysaccharide based on antioxidant activity[J].Carbohydrate Polymers,2014,103:148-153.
[6]Shao P,Chen X,Sun P.Chemical characterization,antioxidant and antitumor activity of sulfated polysaccharide fromSargassumhorneri[J].Carbohydrate Polymers,2014,105:260-269.
[7]Sinha S,Astani A,Ghosh T,et al.Polysaccharides fromSargassumtenerrimum:structural features,chemical modification and anti-viral activity[J].Phytochemistry,2010,71(2/3):235-242.
[8]Song Y,Yang Y,Zhang Y,et al.Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin(Cucurbitapepo,ladygodiva)[J].Carbohydrate Polymers,2013,98(1):686-691.
[9]Barud HS,de Araújo Júnior AM,Santos DB,et al.Thermal behavior of cellulose acetate produced from homogeneous acetylation of bacterial cellulose[J].Thermochimica Acta,2008,471(1):61-69.
[10]张珏.灵芝多糖的硫酸化修饰及其衍生物抗肿瘤活性的初步研究[D].无锡:江南大学,2005.
[11]李世杰,张丹雁,严娅娟,等.响应面法优化阳春砂多糖的超声辅助提取工艺[J].中国实验方剂学杂志,2013,19(22):47-51.
[12]周林,郭祀远,郑必胜,等.裂褶多糖的乙酰化及光谱分析[J].华南理工大学学报(自然科学版),2006,34(12):88-91.
[13]Chen Y,Zhang H,Wang Y,et al.Acetylation and carboxymethylation of the polysaccharide fromGanodermaatrumand their antioxidant and immunomodulating activities[J].Food Chem,2014,156:279-288.
[14]Du X,Zhang J,Lv Z,et al.Chemical modification of an acidic polysaccharide(TAPA1) fromTremellaaurantialbaand potential biological activities[J].Food Chem,2014,143:336-340.
[15]Jung HY,Bae IY,Lee S,et al.Effect of the degree of sulfation on the physicochemical and biological properties ofPleurotuseryngiipolysaccharides[J].Food Hydrocolloids,2011,25:1291-1295.
[16]Li SQ,Shah NP.Antioxidant and antibacterial activities of sulphated polysaccharides fromPleurotuseryngiiandStreptococcusthermophilusASCC 1275[J].Food Chem,2014,165:262-270.
[17]Wang Z,Luo D.Antioxidant activities of different fractions of polysaccharide purified fromGynostemmapentaphyllumMakino[J].Carbohydrate Polymers,2007,68(1):54-58.
Acetylation ofGanodermalucidumPolysaccharide and Its Antioxidant Activities
YEYing-xia1,ZHAOJu-xiang1,CHENSheng-qiang2,SUNWei-wen2
(1.TheFirstAffiliatedHospitalofGuangzhouMedicalUniversity,GuangdongGuangzhou510120,China; 2.InstituteofNeuroscience,GuangzhouMedicalUniversity,GuangdongGuangzhou510260,China)
[Abstract]ObjectiveTo change the molecular structure of Ganoderma lucidum polysaccharide (GLP) through chemical modification, and to investigate its antioxidant activities in vivo. MethodsGLP was modified by acetylation to obtain the acetyl derivative GLPa. Kunming mice were randomly divided into blank control group, positive control group, high- and low-dose GLP groups, and high- and low-dose GLPa groups. The malondialdehyde (MDA), total antioxidant capacity (T-AOC), and catalase (CAT) in the serum and liver were measured; the model of anti-oxidative damage was established in hyperlipidemic rats to investigate the antioxidant capacity of GLP and GLPa. ResultsGLPa and GLP significantly increased the activity of CAT and T-AOC in the liver tissue of normal mice and reduced the levels of MDA in the serum and liver; the antioxidant activity of GLPa was better than that of GLP and was dose-dependent. In addition, GLPa and GLP significantly reduced the degree of oxidative damage induced by alloxan in the hyperlipidemic rats, increased the activity of serum superoxide dismutase and liver T-AOC, and reduced the serum level of MDA. ConclusionAcetylation can significantly improve the antioxidant activities of GLP.
[Key words]Ganoderma lucidum polysaccharide; Acetylation; Antioxidant
(收稿日期:2015-07-13;编辑:曹健)
[中图分类号]R285.5[DOI]10.3969/j.issn.2095-7246.2016.02.024
作者简介:叶颖霞(1974-),女,主管中药师

