红花多糖对H22荷瘤小鼠的免疫调节和抗氧化功能的影响
万亚菲(江苏省连云港市中医院 连云港 222000)
红花多糖对H22荷瘤小鼠的免疫调节和抗氧化功能的影响
万亚菲(江苏省连云港市中医院连云港222000)
摘要:目的:探讨红花多糖的抗肿瘤作用及其机制。方法:采用移植H22荷瘤小鼠模型,分别设置阴性对照组、阳性对照组和红花多糖低、中、高三个剂量组(15mg/kg、45mg/kg和135mg/kg),对模型小鼠进行效果处理,观察各组的抑瘤效果、碳廓清能力、耳肿胀度,并对血清GR、GSH-PX、CAT、SOD和MDA含量等进行检测。结果:红花多糖高剂量可明显抑制小鼠H22实体瘤生长(P<0.05),抑瘤率为66.8%;高剂量组小鼠血清MDA水平明显降低(P<0.05),GR、GSH-PX、CAT、SOD活性较阴性对照组明显升高,还可降低肿瘤细胞中ROS水平(P<0.05)。结论:红花多糖可明显增强H22荷瘤小鼠的免疫功能,清除自由基、减轻活性氧造成的损伤,从而起到抗肿瘤的作用。
关键词:红花多糖H22荷瘤免疫调节抗氧化
红花又称为草红花、红蓝花,为菊科植物红花(Carthamus tinctorius L)的干燥花。红花性温、味辛,具有活血通经和散瘀止痛之效,其药用始载于《开宝本草》,至今各版药典均有收载[1]。现代药理学研究表明[2~3],红花中的主要成分包括红花多糖、红花黄色素、红花苷、黄酮类、有机酸以及红花红色素等,具有抗氧化、抗凝血、降血压以及抗肿瘤和免疫调节等多种药理活性。另外,红花在我国各省市、自治区均有种植,资源丰富,具有药理毒性低、易于工业化制备和生产等特点。近年来人们对于红花的药用价值尤其是在抗肿瘤等方面的作用的研究越来越深入。在本文中,我们从分子药理学角度对红花多糖对H22荷瘤小鼠的抑瘤作用及可能的机制进行研究,现将相关结果总结和报道如下:
1 材料和仪器
1.1实验材料
1.1.1实验动物:清洁级昆明种小鼠50只,雌雄各半,体重18~22g,购自南京青龙山动物实验中心。动物饲养环境,恒温22℃~25℃,(恒湿55±5)%,所有食物与水经灭菌处理后使用。
1.1.2实验材料和仪器:H22荷瘤细胞由江苏省中医院临床研究所提供;环磷酰胺购自浙江海正药业有限公司;谷胱甘肽过氧化物酶试剂盒、超氧化物歧化酶试剂盒、丙二醛试剂盒以及2’,7’-一二氯氢化荧光素二脂探针均购自南京凯基生物技术有限公司;酶标仪、培养箱为美国Thermo公司产品,FACS Calibur型流式细胞仪为美国BD公司产品。
1.1.3药物:红花多糖为本单位通过水提醇沉法粗提并经冻融除杂,再经无水乙醇、丙酮、无水乙醚脱化后精制所得,为淡黄色粉末,纯度为76.8%,批号为20140301。
1.2实验方法:将50只小鼠随机分为5组,分别为:阴性对照组,阳性对照组,红花多糖低、中、高剂量组,每组10只。在无菌环境下,取H22荷瘤细胞,以D-Hanks液稀释成107/mL浓度的瘤细胞液,于每只小鼠右前肢腋部皮下注射0.1mL瘤细胞液。阴性对照组灌服0.9% Nacl溶液,10mL/kg;阳性对照组以环磷酰胺25mg/kg腹腔注射;红花多糖给药组,分别以低、中、高剂量(15mg/kg、45mg/kg和135mg/kg)灌服,给药频次均为1次/d。
1.2.1抑瘤作用:荷瘤细胞接种成功的标志为接种5d后,阴性对照组80%的小鼠于腋下长出肿瘤,各组于接种d16后处死动物,对动物体重及肿瘤进行称重,肿瘤的抑制率=(C-T)/C× 100%,其中C味阴性组肿瘤的平均重量,T为各给药组肿瘤的平均重量。
1.2.2碳廓清能力测定:于末次给药后,给小鼠尾静脉注射印度墨汁(0.1mL/10g),注射后即刻开始计时,分别于注射后2min和10min于眼底静脉丛取血,迅速以0.1%碳酸钠溶液稀释并摇匀,以酶标仪测定各组样品的OD值。碳廓清指数K=(logOD1-logOD2)/(T10-T2),OD1和OD2分别为注射印度墨汁后2min 和10min的OD值。
1.2.3迟发型超敏反应耳肿胀度的测定:每只小鼠腹部以硫酸钡溶液去毛后,以含二硝基氯苯的丙酮橄榄油溶液涂抹腹部致敏,致敏后d7,于右耳内外两面均匀涂抹10μL溶液进行攻击,24h后将小鼠处死,以打孔器分别于左右耳取直径7mm的耳片,左右耳片的重量差即为耳肿胀度。
1.2.4抗氧化酶的测定:小鼠于末次给药后眼球取血,血样静置1h后于室温下以3000rpm离心5min,将血清分离后按照试剂盒中的操作步骤对GR、GSH-PX、CAT、SOD和MDA等指标进行检测;肿瘤细胞中活性氧(ROS)采用流式细胞仪检测,激发波长为488nm,发射波长为525nm。
2 结果
2.1抑瘤作用:研究结果显示,红花多糖高剂量(135mg/kg)可明显抑制小鼠H22实体瘤生长,抑瘤率为66.8%,与环磷酰胺作用相当,与其余各组比较,差异有统计学意义(P<0.05),详见表1。
表1 红花多糖对H22实体瘤的抑制作用(n=10,±s)

表1 红花多糖对H22实体瘤的抑制作用(n=10,±s)
*表示与高剂量组比较差异有统计学意义(P<0.05)。
组别 剂量(mg/kg) 肿瘤重量(g) 抑瘤率(%)阴性对照组阳性对照组低剂量中剂量高剂量-2.23±0.64*0.69±0.31 1.73±0.24*1.30±0.53*0.74±0.47 -25 15 45 135 69.1 22.4*41.7*66.8
2.2免疫调节作用及对肿瘤细胞ROS的影响:高剂量组小鼠肿瘤细胞中ROS的含量明显低于阴性对照组和其余剂量组,碳廓清能力以及对耳廓肿胀的抑制明显优于其余各剂量组,差异均具有统计学意义(P<0.05),详见表2。
表2 红花多糖的免疫调节作用及对肿瘤细胞ROS的影响(n=10,±s)
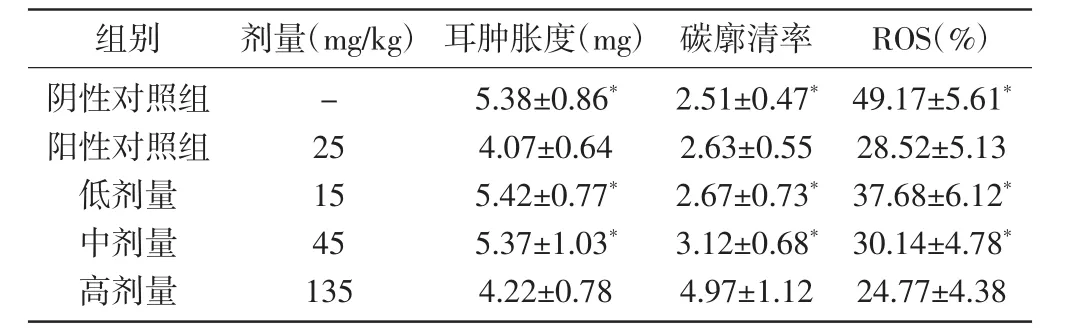
表2 红花多糖的免疫调节作用及对肿瘤细胞ROS的影响(n=10,±s)
*表示与高剂量组比较差异有统计学意义(P<0.05)。
组别 剂量(mg/kg)耳肿胀度(mg)碳廓清率 ROS(%)阴性对照组阳性对照组低剂量中剂量高剂量-25 15 45 135 5.38±0.86*4.07±0.64 5.42±0.77*5.37±1.03*4.22±0.78 2.51±0.47*2.63±0.55 2.67±0.73*3.12±0.68*4.97±1.12 49.17±5.61*28.52±5.13 37.68±6.12*30.14±4.78*24.77±4.38
2.3对抗氧化酶的影响:红花多糖高剂量可明显升高GR、GSHPX、CAT、SOD活性,降低MDA水平,与阴性对照组比较,差异均具有统计学意义(P<0.05),详见表3。
表3 红花多糖对抗氧化酶的影响(n=10,±s)
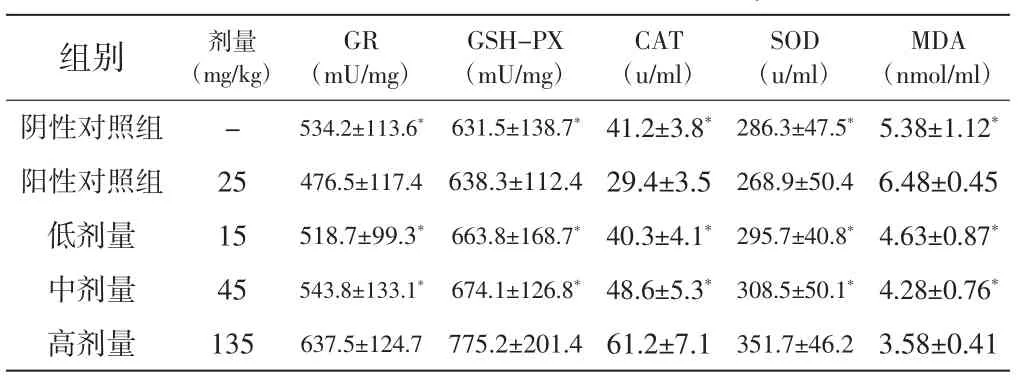
表3 红花多糖对抗氧化酶的影响(n=10,±s)
*表示与高剂量组比较差异有统计学意义(P<0.05)。
MDA (nmol/ml)阴性对照组 - 534.2±113.6*631.5±138.7*41.2±3.8*286.3±47.5*5.38±1.12*阳性对照组 25 476.5±117.4 638.3±112.4 29.4±3.5 268.9±50.4 6.48±0.45低剂量 15 518.7±99.3*663.8±168.7*40.3±4.1*295.7±40.8*4.63±0.87*中剂量 45 543.8±133.1*674.1±126.8*48.6±5.3*308.5±50.1*4.28±0.76*高剂量 135 637.5±124.7 775.2±201.4 61.2±7.1 351.7±46.2 3.58±0.41组别 剂量(mg/kg)GR (mU/mg)GSH-PX (mU/mg)CAT (u/ml)SOD (u/ml)
3 讨论
肿瘤的病因学、发病机制及防治研究一直是我国肿瘤研究的重点,寻找高效、低毒的抗肿瘤药物及抗肿瘤辅助药物是当前肿瘤研究的重要内容之一。研究资料显示[4~5],肿瘤的发生和发展与人体的机体免疫机能密切相关,免疫机能下降有利于肿瘤微环境的发展,大部分肿瘤患者的免疫力低下;传统中医学理论认为肿瘤的侵袭与患者脏腑功能衰退以及阴阳气血失调有关。中药多糖作为抗肿瘤的热门药物近年来得到越来越广泛的研究,抗肿瘤作用可通过免疫增强、抑制肿瘤细胞增殖、诱导细胞分化和凋亡以及直接杀伤肿瘤细胞等多种途径和环节实现。
在本研究中我们以H22荷瘤小鼠模型,研究红花多糖对肿瘤的抑制作用,并对可能涉及的机制进行探讨。结果显示,红花多糖高剂量可明显抑制肿瘤的生长,抑瘤率与环磷酰胺相当。红花多糖高剂量组可明显升高荷瘤小鼠的碳廓清指数。碳廓清指数是体现体内巨噬细胞吞噬能力的重要标志,巨噬细胞是机体免疫应答中最早对抗原产生反应的细胞之一。由此可见,红花多糖可促进小鼠网状内皮系统的吞噬功能,提高非特异性免疫功能。
自由基可参与体内的能量产生,调节细胞内信号的传递及部分内源性复合物的形成。有研究显示[6~7],若体内自由基累积到一定程度,可通过损伤细胞膜中不饱和脂肪酸诱发脂质过氧化,从而破坏组织的正常形态和功能的完整性;ROS可加速机体的氧化损伤,从而促进细胞的衰老,降低免疫力,是体内肿瘤发生和发展的重要环节。本研究的结果显示,小鼠灌服高剂量红花多糖后,血清中GR、GSH-PX、CAT和SOD的活性水平较阴性对照组明显升高,ROS和MDA水平明显降低,差异均具有统计学意义。这表明,红花多糖可在一定程度上抑制ROS产生,减缓机体内的SOD消耗,从而起到抗脂质过氧化作用。
总之,红花多糖可明显增强H22荷瘤小鼠的免疫功能,清除自由基、减轻活性氧造成的损伤,从而起到抗肿瘤的作用。
参考文献
[1]李循,孔繁智,朱婉萍.中药多糖抗肿瘤作用研究进展[J].浙江中医杂志,2006,41(2):131.
[2]宫汝飞,周丹,马新博.红花、柿叶等抗癌中药药理研究进展[J].齐齐哈尔医学院学报,2012,33(14):1915-1916.
[3]梁颖,张晓莉,陶冀,等.红花多糖对人肝癌SMMC-7721细胞增殖的抑制作用[J].中医药学报,2011,39(5):32-35.
[4]程樱,张立.中药抗肿瘤机制及药物研究进展[J].中国药业,2013,22(17):103-104.
[5]张秀云.抗肿瘤中药有效部位及化学成分研究进展[J].科技视界,2012,7:177-178.
[6]白岩.槐耳清膏抑制结肠癌切除后肿瘤复发机制探讨[J].山东医药,2013,53(38):34-35.
[7]马新博,赵鸿鹰,李媛媛,等.红花多糖对荷S180肉瘤小鼠血清IL-10和IL-12及TNF-α的影响[J].广东医学,2013,34(13):1984.
Effects of Carthamus tinctorius polysaccharides on the immunity function and antioxidant function of H22 tumor-bearing mice
Abstract:Objective:To observe the effects of Carthamus tinctorius polysaccharides on the immunity function and antioxidant function of H22 tumor-bearing mice. Method:50 H22 tumor-bearing mice were selected and divided into five groups as negative control group,positive group,Carthamus tinctorius polysaccharides groups(15 mg/kg,45 mg/kg and 135 mg/kg). The model animals were treated and the effects were observed and compared. Results:The high dose of Carthamus tinctorius polysaccharides can obviously inhibit the growth of tumor(P<0.05),the inhibitory rate was 66.8%. The MDA level of high dose group was significantly decreased(P<0.05)and the GR,GSH-PX,CAT,SOD activities were increased significantly. Also,ROS in high dose group was decreased(P<0.05). Conclusion:Carthamus tinctorius polysaccharides can obviously increase the immunity function of H22 tumor -bearing mice scavenging ROS,alleviate the damage caused by reactive oxygen species which are all benefit for anti-tumor.
Key words:Carthamus tinctorius polysaccharides H22 tumor-bearing mice Immunity function Antioxidation
中图分类号:R285
文献标识码:B
文章编号:1672-8351(2016)04-0111-02

