新型吲哚类衍生物的合成及体外免疫抑制活性的初步研究
赵阳,王翼腾,李楠,,陈诗雅,李覃,陈虹,,刘艳霞
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.中国人民武装警察部队后勤学院生药与药剂学教研室,天津300309)
论著
新型吲哚类衍生物的合成及体外免疫抑制活性的初步研究
赵阳1,王翼腾2,李楠1,2,陈诗雅2,李覃2,陈虹1,2,刘艳霞1
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.中国人民武装警察部队后勤学院生药与药剂学教研室,天津300309)
目的:以土槿乙酸结构特征为模板,吲哚为母核合成类土槿乙酸化合物,以期得到有更高免疫抑制活性的吲哚类衍生物。方法:对5-醛基吲哚和5-羧基吲哚的1,3,5位进行改造。1位进行烷基化改造,3位通过维尔斯迈尔-哈克反应与醛胺缩合反应进行延长,5位通过克脑文格尔反应与缩合酰化反应进行延长,得到吲哚类衍生物。经氢谱和高分辨质谱对其进行结构表征。采用噻唑蓝(MTT)法检测目标化合物对小鼠T、B淋巴细胞增殖的抑制作用。结果:合成得到两个系列共7个化合物,所有的化合物都经过HR-ESI-MS和1H-NMR验证,其中化合物5c对T细胞和B细胞有一定的增殖抑制活性,化合物9a,9b对B细胞有一定增殖抑制活性。结论:通过模拟土槿乙酸的两个长链结构合成了新的吲哚的类似物,发现了具有一定的免疫抑制活性的先导化合物。
5-醛基吲哚;5-羧基吲哚;土槿乙酸;免疫抑制活性
土槿皮是松科植物金钱松的根皮及近根皮,其在我国作为抗真菌的中药已有悠久的历史[1]。土槿乙酸(pseudolaric acid B)是从土槿皮中分离得到的新型二萜酸化合物,本课题组系列研究显示土槿乙酸具有良好的抑制淋巴细胞增殖的作用,作用机制新颖[2-3]。金钱松为我国特有松科植物,生长周期较长使土槿乙酸来源受限导致其进一步的研究受阻。其次,土槿乙酸全合成步骤繁琐,产率低,无实用价值[4-5]。所以亟需探索它的类似结构的新化合物。非甾体抗炎药吲哚美辛(indomethacin)通过对环氧合酶的抑制而起到抗炎作用,除了用于解热、镇痛、抗炎外,还广泛地应用于泌尿生殖系统、消化系统、神经系统以及眼科、小儿科疾病的治疗,吲哚母核为人体内源性物质,具有良好的生物兼容性[6-8]。此外,与吲哚环相似的其它类型的苯并五元环结构如苯并咪唑也被发现具有一定的免疫抑制活性[9-10]。因此,基于土槿乙酸结构特征,探索与土槿乙酸结构类似的且有一定免疫抑制活性的吲哚母核类似物,具有重要的意义。本文根据土槿乙酸和吲哚美辛结构特点对5-醛基吲哚和5-羧基吲哚的1、3、5位进行结构改造,设计合成了两个系列共7个化合物,以期得到具有一定免疫抑制活性的吲哚类衍生物。
1 材料与方法
1.1 仪器与试剂 核磁共振仪:Bruker Advance 2B/400M;XT显微熔点仪;高分辨质谱仪:Agilent 6210 LC-TOF;酶标仪:美国,BIORAD 550;土槿乙酸系武警后勤学院生药学实验室从金钱松根皮中提取分离得到;霉酚酸酯、1-羟基苯并三唑(HOBT)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDCI)盐酸盐、N,N-二甲基甲酰胺(DMF)(分子筛干燥)、CH2Cl2(钠块回流干燥)、CH3OH(镁粉回流干燥)等所用药品及化学合成溶剂均购自天津康科德科技有限公司。
1.2 合成方法
1.2.1 合成路线 见图1、2。
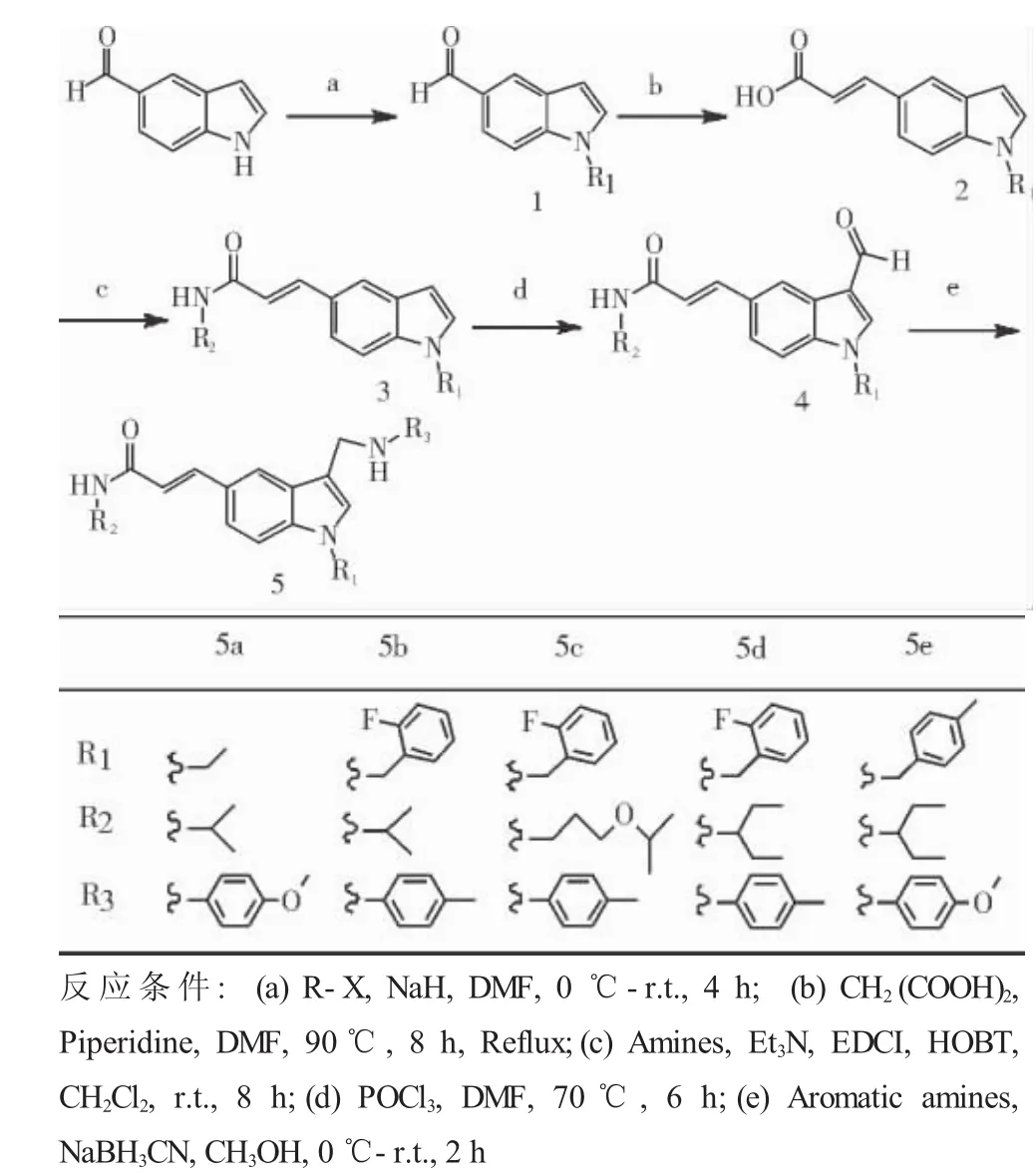
图1 化合物5a-5e的合成路线Fig 1 Schematic route of 5a-5e compound
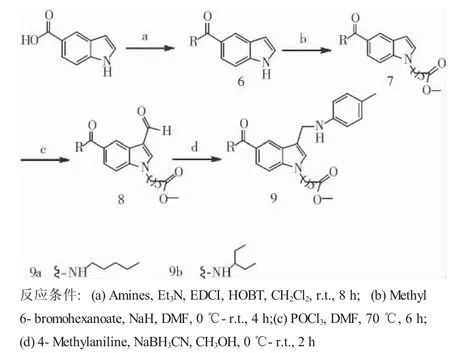
图2 化合物9a、9b的合成路线Fig 2 Schematic route of 9a,9b compound
1.2.2 化合物5a-5e的合成通法 将5-醛基吲哚(0.145 g,1 mmol)溶于10 mL DMF中,冰浴下缓慢加入NaH(0.048 g,2 mmol),冰浴搅拌2 h,然后逐滴加入卤代烃(1.2 mmol),0.5 h后移至室温条件下反应2 h,TLC检测反应完全。在冰浴条件下向反应液中滴加蒸馏水,不断搅拌,直至析出固体不再增加,抽滤得固体即化合物1,40℃减压干燥24 h。
将化合物1(1 mmol)溶于10 mL DMF中,加入CH2(COOH)2(0.312 g,3 mmol)、哌啶(0.043 g,0.5 mmol)后于90℃条件下不断搅拌,回流反应8 h,TLC检测反应完全。于冰浴条件下向反应液中滴加蒸馏水,不断搅拌,直至析出固体不再增加,抽滤得固体即化合物2,40℃减压干燥24 h。
将化合物2(1 mmol)溶于10 mL无水CH2Cl2中,冰浴下加入1.2倍量的HOBT和EDCI盐酸盐,滴加两滴三乙胺溶液,反应0.5 h后加入脂肪胺(1.2 mmol)置于常温反应8 h,TLC检测反应完全,依次用5%的盐酸溶液、饱和碳酸氢钠溶液、蒸馏水以及饱和食盐水洗涤1次,减压蒸干,经柱层析分离,得化合物3。
将POCl3(1.615 g,10 mmol)逐滴滴入DMF(0.731 g,10 mmol)中,15℃混合搅拌0.5 h,将化合物3(1 mmol)溶于DMF中,然后逐滴滴加POCl3和DMF的混合溶液,加热70°C反应6 h,TLC检测反应完全。反应液稀释于冰水中,40%NaOH中和,搅拌3 h后静置于冰箱,直至固体析出,抽滤得固体即化合物4,40℃减压干燥24 h。
将化合物4(1 mmol)和芳香胺(1.2 mmol)溶于10 mL无水CH3OH中,滴加两滴冰醋酸,冰浴下缓慢加入NaBH3CN(1.5 mmol,0.095 g),0.5 h后移至常温反应2 h,TLC检测反应完全,向反应液中逐滴滴加蒸馏水,直至析出固体不再增加,抽滤得固体即终产物5,40℃减压干燥24 h。
1.2.3 化合物9a、9b的合成通法 将5-羧基吲哚(0.161 g,1 mmol)溶于10 mL无水CH2Cl2中,冰浴下加入1.2倍量的HOBT和EDCI盐酸盐,滴加两滴三乙胺溶液,反应0.5 h后加入正戊胺(此为化合物11a,11b则加入2-乙基丙胺)(1.2 mmol)置于常温反应8 h,TLC检测反应完全,依次用5%的盐酸溶液、饱和碳酸氢钠溶液、蒸馏水以及饱和食盐水洗涤1次,减压蒸干,经柱层析分离,得化合物6。
将化合物6溶于10 mL DMF中,冰浴下缓慢加入NaH(0.048 g,2 mmol),冰浴搅拌2 h,然后逐滴加入6-溴己酸甲酯(1.2 mmol),0.5 h后移至室温条件下反应2 h,TLC检测反应完全。于冰浴条件下向反应液中滴加蒸馏水,不断搅拌,直至析出固体不再增加,抽滤得固体即化合物7,40℃减压干燥24 h。
将POCl3(1.615 g,10 mmol)逐滴滴入DMF(0.731 g,10 mmol)中,15℃混合搅拌0.5 h,将化合物7(1 mmol)溶于DMF中,然后逐滴滴加POCl3和DMF的混合溶液,加热70℃反应6 h,TLC检测反应完全。反应液稀释于冰水中,40%NaOH中和,搅拌3 h后静置于冰箱,直至固体析出,抽滤得固体即化合物8,40℃减压干燥24 h。
将化合物8(1 mmol)和对甲基苯胺(1.2 mmol)溶于10 mL无水CH3OH中,滴加两滴冰醋酸,冰浴下缓慢加入NaBH3CN(0.095 g,1.5 mmol),0.5 h后移至常温反应2 h,TLC检测反应完全,向反应液中逐滴滴加蒸馏水,直至析出固体不再增加,抽滤得固体即终产物9,40℃减压干燥24 h。
1.3 MTT法检测化合物对小鼠T细胞和B细胞增殖的抑制作用活性 无菌条件下取小鼠脾脏并制备淋巴细胞悬液,调整细胞浓度为1×106~5×106/mL,加入ConA(B细胞则为LPS)至终浓度为10 μg/mL。以每孔100 μL培养于96孔板中,每个药物设置4个浓度(10 μg/mL、1 μg/mL、0.1 μg/mL、0.01 μg/mL),每个浓度3个平行复孔,以土槿乙酸和霉酚酸酯为阳性药,并以RPMI1640培养液代替细胞为调零孔。阴性对照组加入与给药组等体积的培养基,置于37℃,5%CO2温箱中,孵育48 h。48 h后,每孔加20 μL 5 mg/mL MTT溶液(PBS配制)。37℃继续孵育4 h,吸弃上清,每孔加入三联液100 μL溶解甲簪颗粒,轻度振荡溶解,放置过夜。用酶标仪检测,以波长490 nm测定光密度值(OD),以ConA(B细胞则为LPS)处理的细胞为阴性对照组,以RPMI1640培养液为空白对照组,用以下公式计算抑制率:
抑制率=(阴性对照组OD值-加药组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。
2 结果
2.1 化合物的表征数据
5a:黄色固体,产率27%,m.p.165℃-166℃;1H NMR(400 MHz,CDCl3)δ 7.73(s,1H,H-1′),7.72–7.67(m,1H,H-3),7.32(m,J=26.1,9.6,1.6 Hz,2H, H-2,2′),7.11 (s,1H,H-4),6.83 (m,J=8.8,2.9 Hz, 2H,H-3″,4″),6.76-6.71(m,2H,H-2″,5″),6.26(dd, J=13.7,6.4 Hz,1H,H-1),4.43(d,J=9.6 Hz,2H,HCH2-1″),4.22(m,J=13.7,7.2 Hz,1H,H-3′),4.12(q, J=7.3 Hz,2H,H-CH2-1‴),3.79-3.76 (s,3H,HOCH3),1.44 (dd,J=9.4,5.2 Hz,3H,H-CH3-2‴), 1.25-1.19(s,6H,H-CH3-4′,5′)。HR-ESI-MS:m/z414.214 4 for[M+Na]+(calcd for C24H29N3O2Na+,414.215 2)。
5b:黄色固体,产率23%,m.p.155℃-156℃;1H NMR(400 MHz,CDCl3)δ 7.79(s,J=10.7 Hz,1H,H-1'),7.71(d,J=15.5 Hz,1H,H-3),7.38-7.17(m,3H, H-4,4‴,5‴),7.11 (s,1H,H-2),7.09-7.03 (m,1H, H-2‴),7.00(t,J=8.7 Hz,3H,H-2′,3″,4″),6.85(m, J=22.1,11.1,4.3 Hz,1H,H-3‴),6.61(t,J=9.9 Hz, 2H,H-2″,5″),6.32(d,J=15.5 Hz,1H,H-1),5.25(s, 2H,H-CH2-1‴),4.39(s,2H,H-CH2-1″),4.26-4.15 (m,1H,H-3′),2.24(d,J=10.0 Hz,3H,H-CH3-5″), 1.20(d,J=6.5 Hz,6H,H-CH3-4′,5′)。HR-ESI-MS: m/z 478.226 5 for[M+Na]+(calcd for C29H30FN3ONa+, 478.226 1)。
5c:黄色固体,产率21%,m.p.143℃-144℃;1H NMR (400 MHz,CDCl3)δ 7.78(d,J=14.6 Hz,1H, H-1′),7.75-7.62(m,1H,H-3),7.33(m,J=13.3,8.5, 3.1 Hz,3H,H-2,4,4‴),7.16 (s,1H,H-2‴),7.11-7.05(m,1H,H-2′),7.01(dd,J=6.7,6.0 Hz,2H,H-4, 3‴),6.91-6.83(m,1H,H-5‴),6.64(dd,J=17.9,7.7 Hz,2H,H-3″,4″),6.36-6.26(m,2H,H-2″,5″),5.30(s, 2H,H-CH2-1‴),4.43(s,J=7.8 Hz,2H,H-CH2-1″), 3.63-3.52(m,3H,H-6,H-CH2-5),3.49(dd,J=12.1, 5.9 Hz,2H,H-CH2-3″),2.30-2.20(s,3H,H-CH3-6″), 1.82(dt,J=11.9,5.9 Hz,2H,H-CH2-4′),1.20-1.14 (m,6H,H-CH3-7′,8′)。HR-ESI-MS:m/z 536.267 8 for[M+Na]+(calcd for C32H36FN3O2Na+,536.268 4)。
5d:黄色固体,产率25%,m.p.166℃-167℃;1H NMR (400 MHz,CDCl3)δ 7.80(s,1H,H-1′),7.75-7.66(m,1H,H-3),7.37-7.31 (m,1H,H-2),7.27-7.25(m,2H,H-4,4‴),7.18-7.14(s,1H,H-2′),7.11 -7.04(m,2H,H-2‴,3‴),7.02(d,J=8.6 Hz,3H,H-3″,4″,4‴),6.72(t,J=9.4 Hz,2H,H-2″,5″),6.41(d,J =15.5 Hz,1H,H-1),5.26(d,J=9.8 Hz,2H,H-CH2-1‴),4.49-4.40(m,2H,H-CH2-1″),4.01-3.88(m,1H, H-3′),2.24(d,J=8.2 Hz,3H,H-CH3-6″),1.66-1.54 (m,2H,H-CH2-6′),1.44(td,J=14.4,7.3 Hz,2H,HCH2-4′),0.93(t,J=7.4 Hz,6H,H-CH3-5′,7′)。HRESI-MS:m/z 506.255 4 for[M+Na]+(calcd for C31H34N3ONa+,506.257 8)。
5e:黄色固体,产率19%,m.p.171℃-172℃;1H NMR(400 MHz,CDCl3)δ 7.93(s,1H,H-1′),7.87(d,J=15.3 Hz,1H,H-3),7.38 (dt,J=11.3,5.6 Hz,1H, H-4),7.31-7.26(m,1H,H-2),7.14-7.06(m,3H,H-2′,3″,4″),6.96(dd,J=12.3,6.3 Hz,3H,H-1,3″,5″), 6.81-6.77(m,4H,H-2‴,3‴,4‴,5‴),5.21 (d,J= 7.0 Hz,2H,H-CH2-1‴),4.48(s,2H,H-CH2-1″),4.41 -4.32 (m,1H,H-3′),3.75 (d,J=3.0 Hz,3H,HOCH3),2.30 (d,J=12.1 Hz,3H,H-CH3-6‴),2.07-1.92(m,2H,H-CH2-6′),1.81-1.69(m,2H,H-CH2-4′), 0.87(t,J=7.4 Hz,6H,H-CH3-5′,7′)。HR-ESI-MS: m/z 518.277 3 for[M+Na]+(calcd for C32H37N3O2Na+, 518.277 8)。
9a:黄色固体,产率30%,m.p.122℃-123℃;1H NMR(400 MHz,CDCl3)δ 8.06(t,J=4.4 Hz,1H,H-2),7.71 (m,J=6.9,3.5 Hz,1H,H-3),7.36-7.29(m, 1H,H-3),7.11(s,J=3.3 Hz,1H,H-4),7.02 (d,J= 8.2 Hz,2H,H-3″,4″),6.66(d,J=8.4 Hz,2H,H-2″, 5″),4.46(s,2H,H-CH2-1″),4.09(m,J=7.0 Hz,2H, H-CH2-1‴),4.05-3.99(m,1H,H-1′),3.67-3.62(m, 3H,H-CH3-6‴),2.30 (m,J=14.9,6.4 Hz,2H,HCH2-5‴),2.26(s,3H,H-CH3-6″),1.87-1.77(m,2H, H-CH2-2‴),1.69-1.60(m,4H,H-CH2-2′,4′),1.51 (m,J=14.4,7.4 Hz,2H,H-CH2-4‴),1.34-1.25(m, 2H,H-CH2-3‴),0.96(m,J=7.4 Hz,6H,H-CH3-3′, 5′)。HR-ESI-MS:m/z 500.288 0 for[M+Na]+(calcd for C29H39N3O3Na+,500.288 4)。
9b:黄色固体,产率32%,m.p.128℃-129℃;1H NMR(400 MHz,CDCl3)δ 8.05(d,J=1.4 Hz,1H,H-2),7.71(dd,J=8.6,1.6 Hz,1H,H-1),7.30(t,J=8.2 Hz,1H,H-3),7.11 (s,1H,H-4),7.01 (d,J=8.1 Hz, 2H,H-3′,4′),6.64(d,J=8.4 Hz,2H,H-2′,5′),4.44 (s,2H,H-CH2-1″),4.07(t,J=7.0 Hz,2H,H-CH2-1‴), 3.64(s,J=3.7 Hz,3H,H-CH3-6‴),3.45(dd,J=13.1, 7.2 Hz,2H,H-CH2-1′),2.28(dd,J=12.1,4.7 Hz,2H, H-CH2-5‴),2.25(s,3H,H-CH3-6″),1.82(dt,J= 14.8,7.2 Hz,2H,H-CH2-2‴),1.66-1.59(m,4H,HCH2-2′,4‴),1.40-1.31(m,6H,H-CH2-2′,3′,3″), 0.92-0.88(m,3H,H-CH3-5′)。HR-ESI-MS:m/z 500.288 1 for[M+Na]+(calcd for C29H39N3O3Na+, 500.288 4)。
2.2 目标化合物体外免疫抑制活性测定 表1是合成化合物与阳性对照药霉酚酸酯(MMF)和土槿乙酸(PB)对T细胞和B细胞的药理活性结果,可以看出化合物5c对T细胞和B细胞增殖有一定的抑制活性,化合物9a、9b对B细胞增殖有一定抑制活性。
表1 化合物对T、B细胞增殖的体外增殖抑制活性(s,n=3)Tab1 In vitro inhibitoryeffectsofnovelindolederivatives(s,n=3 )

表1 化合物对T、B细胞增殖的体外增殖抑制活性(s,n=3)Tab1 In vitro inhibitoryeffectsofnovelindolederivatives(s,n=3 )
抑制率(10-5μmol/L)化合物 T Cell B Cell 5a -2.593±0.204 -9.820±0.587 5b 21.453±1.246 -6.757±0.254 5c 37.417±1.822 38.568±0.651 5d 24.393±0.843 10.000±0.472 5e 14.018±0.756 0.905±0.045 9a 7.187±0.367 43.455±1.309 9b 25.365±1.114 44.909±0.884 PB 50.773±1.965 43.604±1.449 MMF 60.241±1.624 55.128±1.804
3 讨论
3.1 合成方法 由5-醛基吲哚得到目标化合物5a-5e共经过了5步化学反应,5-羧基吲哚得到目标化合物9a、9b共经过4步化学反应,它们的反应类型是基本一致的,区别在于吲哚环1位进行烷基化的顺序不一样。对于5-醛基吲哚来说,其应该首先进行烷基化反应,原因在于5位的醛基需要在高温条件下进行克脑文格尔反应,而吲哚环是不稳定的,1位经过烷基化后吲哚母核会有较好的稳定性。对于5-羧基吲哚来说,烷基化反应必须在羧基经过缩合酰化后才能进行,如果首先进行烷基化反应,活化1位所用的氢化钠会与羧基反应,从而导致氢化钠用量的增加,产率的降低。这两条合成路线的缺点在于反应步数较多,产物难处理,有的反应还需在高温条件下进行,以至于产率降低、副产物增多以及分离难度加大。
3.2 药理活性 药理活性结果显示:通过与化合物5b、5d相比较可以看出,化合物5c 3位的异丙氧基丙烷长链结构可能是其产生T细胞抑制活性的原因;与化合物5d相比较可知9a、9b 1位的己酸甲酯长链结构可能是其产生B细胞抑制活性的原因。因此,可以考虑在接下来的试验中尝试将异丙氧基丙烷和己酸甲酯长链结构同时引入吲哚环结构中。
本文通过两种不同的反应路线模拟土槿乙酸的两个长臂结构合成了7个目标化合物,其中5c、9a、9b分别对T细胞和B细胞产生了一定的增殖抑制活性,虽然与霉酚酸酯还有差距,但是吲哚类衍生物显示出了很好的研究前景。
[1]李晓翠,苗爱东,张洪峰,等.土荆皮的研究进展[J].现代中西医结合杂志,2014,23(29):3301
[2] Li T,Chen H,Yang Z,et al.Topical application of Pseudolaric acidB improve DNFB-induced contact hypersensitivity via regulating the balance of Th1/Th17/Treg cell subsets[J].Eur J Pharm Sci,2012, 45(5):668
[3] Wei N,Li T,Chen H,et al.The immunosuppressive activity of pseudolaric acid B on T lymphocytes in vitro[J].Phytother Res, 2013,27(7):980
[4] Padwa A.Intramolecular cycloaddition of carbonyl ylides as a strategy for natural product synthesis[J].Tetrahedron,2011,67(42): 8057.
[5]Pan B C,Chang H Y,Cai G L,et al.Synthetic studies on pseudolaric acid A[J].Pure Appl Chem,1989,61(3):389
[6]孔令春.吲哚美辛的临床应用进展[J].海峡药学,2006,18(2):116
[7] Busbee P B,Nagarkatti M,Nagarkatti P S.Natural indoles,indole-3-carbinol and 3,3'-diindolymethane,inhibit T cell activation by staphylococcal enterotoxin B through epigenetic regulation involving HDAC expression[J].Toxicol Appl Pharmacol,2014,274(1):7
[8] Carbonnelle D,Lardic M,Dassonville A,et al.Synthetic N-pyridinyl(methyl)-indol-3-ylpropanamides as new potential immunosuppressive agents[J].Eur J Med Chem,2007,42(5):686
[9] Rajasekaran S,Rao G A.Chatterjee,synthesis,anti-inflammatory and antioxidantactivity ofsome substituted benzimidazole derivatives[J].Int J Drug Dev Res,2012,4(3):303
[10]MohammedAF,Abdel-MotySG,HusseinMA,etal.Design,synthesis and molecular docking of some new 1,2,4-triazolobenzimidazol-3-yl acetohydrazidederivativeswith anti-inflammatory-analgesic activities[J].Arch Pharm Res,2013,36(12):1465
(2015-12-18收稿)
Synthesis and evaluation of novel indole derivatives as potential immunosuppressive drugs
ZHAO Yang1,WANG Yi-teng2,LI Nan1,2,CHEN Shi-ya2,LI Tan2,CHEN Hong1,2,LIU Yan-xia1
(1.School of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics,Tianjin 300070,China;2.Department of Pharmacognosy,Logistic University of PAP,Tianjin 300309,China)
Objective:To obtain indole derivatives with higher immunosuppressive activity,by synthesizing indole derivatives.Methods:Structural modifications of indole-5-carbox-aldehyde and 5-carboxy-indole were obtained through alkylation on N-1,Vilsmeier-Haack reaction and aldehyde-amine condensation on C-3,Knoevenagel reaction and acylated condensation on C-5.All the compounds were characterized by1H-NMR and HR-MS.Meanwhile,MTT assay was used to test their inhibiting activities on murine T and B cells.Results:Seven compounds of the two series were obtained;all of them were confirmed by HR-ESI-MS and1H-NMR validation.Compound 5c showed a certain degree of inhibiting activity against T cells and B cells.Compounds 9a and 9b showed a certain degree of inhibitory activity against B cells.Conclusion:By simulating the structures of two long chains of pseudolaric acid B,new indole analogues are synthesized and some of them may show a certain degree of immunosuppressive activity.
indole-5-carboxaldehyde;5-carboxy-indole;pseudolaric acid B;immuno suprressive activity
R9
A
1006-8147(2016)03-0195-04
国家自然科学基金资助项目(30873363);天津市应用基础项目基金资助(08JCYBJC070000)
赵阳(1993-),男,硕士在读,研究方向:天然产物结构改造;通信作者:刘艳霞,E-mail:liu_yanxia126@126.com。

