环氧合酶2通过上皮间质转换促进胃癌的侵袭与转移
李 静,孙保存,2,孙 冉,赵秀兰,2,董学易,2,赵 楠,2,古 强,2,张丹芳,2,刘铁菊,2
(1.天津医科大学病理学教研室,天津300070;2.天津医科大学总医院病理科,天津300052;3.天津市南开医院外科,天津300100)
论著
环氧合酶2通过上皮间质转换促进胃癌的侵袭与转移
李 静1,孙保存1,2,孙 冉3,赵秀兰1,2,董学易1,2,赵 楠1,2,古 强1,2,张丹芳1,2,刘铁菊1,2
(1.天津医科大学病理学教研室,天津300070;2.天津医科大学总医院病理科,天津300052;3.天津市南开医院外科,天津300100)
目的:探讨环氧合酶2(COX-2)及Snail在胃癌组织中的表达及临床意义,研究COX-2转染对人胃癌细胞侵袭迁移能力的影响并探讨其机制。方法:免疫组化检测COX-2及Snail在100例胃癌组织中的表达情况,分析其与临床资料的关系;筛选构建COX-2稳定表达的MKN74、MKN45细胞系;观察转染前后细胞的形态、功能及相关蛋白的改变。结果:COX-2的表达与远处转移、淋巴结转移、不良预后密切相关(P<0.05);Snail的表达与分期、淋巴结转移、远处转移相关(P<0.05);COX-2的表达与Snail之间存在相关性(P<0.01)。与对照组相比,MKN74/COX-2细胞形态呈现EMT形态学改变,E-cadherin表达下调、Vimentin表达上调,迁移侵袭能力明显增强;MKN45/shCOX-2细胞形态由长梭形变为铺路石样,E-cadherin表达上调、Vimentin表达下调,迁移侵袭能力减弱。结论:COX-2可以通过EMT促进胃癌细胞的侵袭和转移。
胃癌;环氧合酶2;上皮间质转换;细胞迁移;细胞侵袭
胃癌是我国常见的消化道肿瘤,临床就诊时大都已属于中晚期,术后5年生存率在20%左右,而肿瘤的侵袭和转移是导致患者预后较差的重要原因。环氧合酶(Cyclooxygenase,COX)是前列腺素合成过程中的一个重要的限速酶,其有两种同工酶:COX-1和COX-2。COX-1属于管家酶,主要存在于人正常组织中,催化产生前列腺素E2,在调节外周血管阻力、维持肾脏和胃的正常功能中起重要作用,COX-1不存在于炎症部位。COX-2是诱导酶,在正常生理状态下几乎不表达或很少表达,在各种炎症因子、肿瘤因子的刺激下迅速产生,并且在炎症演变成肿瘤的过程中扮演着重要角色[1]。流行病学研究表明,规律且长期的服用COX-2抑制剂减少了结肠癌的发病率,进一步的研究发现COX-2的表达与多种肿瘤的发生都有密切的关系[2-3]。为了探讨COX-2在胃癌中的表达及其与胃癌细胞生物学行为的关系,本研究采用免疫组化检测胃癌组织中COX-2、Snail的表达与临床病理资料的关系,并利用细胞实验进一步阐释了COX-2促进胃癌细胞侵袭和转移的相关机制,为采用COX-2抑制剂应用于胃癌的预防与临床治疗提供借鉴意义。
1 材料和方法
1.1 材料
1.1.1 组织标本 选取天津医科大学肿瘤医院和天津医科大学总医院2004-2008年经手术切除随访资料完整的100例胃癌患者的癌组织标本作为研究对象,100例胃癌患者年龄为31~82岁,其中男性69例,女性31例。肿瘤最大者为20cm×6cm×3cm,最小者1 cm×1 cm×0.8 cm。根据Lauren分型将胃癌组织分为肠型和弥漫型,其中肠型52例(52%),弥漫型48例(48%)。根据国际抗癌联盟、美国癌症联合委员会(UICC/AJCC)2010年分期标准,将胃癌组织分为Ⅳ期,其中Ⅰ/Ⅱ期51例(51%),Ⅲ/Ⅳ期49例(49%)。入组患者术前均未接受化疗和放疗。
1.1.2 细胞株 人胃癌细胞株MKN74购于广州吉妮欧有限公司;人胃癌细胞MKN45购自中国医学科学院肿瘤细胞库,人肾癌293T细胞株由天津医科大学病理实验室自存。
1.1.3 实验试剂 DMED购自美国Neuronbc公司,胎牛血清购自Ggibco公司。PReceiver-Lv/COX-2慢病毒表达载体购自GeneCopoeia公司;Transwell小室购自FALCON公司。羊抗人多克隆抗体COX-2、兔抗山羊IgG抗体均购自北京中杉金桥生物技术有限公司。兔抗人多克隆抗体Snail、兔抗人单克隆抗体E-cadherin、兔抗人单克隆抗体Vimentin均购自美国Abcom公司。兔抗人单克隆抗体β-actin购自美国SantaCruz公司,PCR引物购自中国广州复能基因公司,RNA提取试剂Trizol、反转录试剂盒、PCR反应试剂盒均购自北京Tiangen公司。
1.2 实验方法
1.2.1 免疫组织化学染色 胃癌组织石蜡包块4 μm连续切片;脱蜡水化后3%过氧化氢封闭内源性过氧化物酶,枸橼酸盐缓冲液微波修复10 min,血清封闭液室温下封闭30 min,滴加一抗,4℃过夜,次日滴加二抗,DAB显色,苏木复染核,中性树胶封片。PBS代替一抗作为阴性对照。采用Mattern[4]积分法评定染色结果:每例标本选择10个含有阳细胞的高倍视野(400×)分别计数100个肿瘤细胞,取其平均值计算阳性细胞百分率。<5%为0分,5%~25%为1分,26% ~50%为2分,>50%为3分。染色强度无着色、浅黄、深黄、棕黄分别记为0、1、2、3分。阳细胞比例得分和染色强度得分相加,结果>3为阳性,≤3为阴性。
1.2.2 细胞培养 人胃癌细胞系MKN74、MKN45在含10%FBS的完全培养基中培养,放入37℃、5%CO2孵化箱中孵育,待细胞融合约90%时,胰酶消化传代以保持细胞活力。
1.2.3 慢病毒包装 PReceiverLv/COX-2慢病毒表达载体的构建由GeneCopoeia公司协助完成,使用Stable-3感受态细胞扩增质粒,对COX-2表达质粒、包装质粒分别进行高纯度无内毒素质粒抽提,并通过紫外分光光度仪检测质粒浓度,转染293T细胞,48 h后收获上清液,1 000 r/min离心10 min,并用0.45 μm滤器过滤,收获病毒液。
1.2.4 细胞感染和稳转细胞筛选 将细胞以1×105个的密度接种于6孔板中,待细胞达到70%~80%融合时,换为1 mL含5%灭活血清无双抗的DMEM培养基,并加入1 mL病毒液,37℃,5%CO2培养过夜。吸除含病毒液的培养基,加入完全培养基,并根据预实验测定的最佳浓度进行puromycin筛选,MKN74最佳筛选浓度为0.4 μg/mL,MKN45最佳浓度为0.6 μg/mL,每3 d换液,并每日荧光显微镜下观察荧光分布情况。
1.2.5 细胞形态检测 在细胞培养状态下,将稳转后的细胞与对照组在倒置显微镜下观察,比较两者形态变化。
1.2.6 Western blot法检测 用细胞裂解液RIPASDS裂解细胞,提取其总蛋白,使用12%聚丙烯酰胺凝胶80 V电泳2 h,250 mA恒流压1.5 h,将目的蛋白转至PVDF膜,5%脱脂奶粉室温封闭1 h,加入相应一抗,4℃孵育过夜,次日室温恢复1 h,TBST洗膜3次,用相应二抗室温孵育2h。TBST洗膜3次,加入发光液,显影,拍照。
1.2.7 PCR检测 按照Trizol提取试剂盒,对每组细胞分别提取总RNA,经分光光度计定量后,按照cDNA试剂盒说明反转录为cDNA并进行PCR反应。将产物进行1%琼脂糖凝胶电泳,凝胶成像系统扫描结果,用Photoshop软件进行条带灰度分析,分别计算与内参的灰度值比。人COX-2的引物序列为F:5′-CTATGGGCAGAGAGAAGGAG-3′,R:5′-AGCTTGCA TGACCAGAACCC-3′;人E-cadherin的引物序列为F:5′-GTCACTGACACCAACGATAATCCT-3′,R:5′-GT CACTGACACCAACGATAATCCT-3′;Vimentin的引物序列为F:5′-TGGCACGTCTTGACCTTGAA-3′,R:5′-G GTCATCGTGATGCTGAGAA-3′;Snail的引物序列为F:5′-TTCTTCGCTACTGCTGCG-3′,R:5′-GGGCAG GTATGGAGA GGAAGA-3′;内参GAPDH的引物序列为F:5′-CCTGGCCAAGGTCATCCATGAC-3′,R:5′-T GTCATACCAGGAAATGAGCTTG-3′。
1.2.8 细胞划痕实验 以适当的密度将细胞接种于6孔板,用100 μL移液枪头对细胞表面划一条痕迹,拍照,继续培养24 h和48 h后,在显微镜下观察胃癌细胞的迁移变化情况并拍照测量划痕距离,计算迁移率。
1.2.9 细胞侵袭实验 每个Transwell小室上表面加入稀释过的Matrigel(Mstrigel与DMEM体积比1∶3)35 μL,并在培养箱中过夜,次日消化细胞,上室内接种无血清培养的细胞,下室使用常规培养基,48 h后取出小室,用预冷的甲醇固定细胞,结晶紫染色,棉签拭去上室内细胞,倒置显微镜下随机计数5个视野中细胞的数目,计算平均值。
1.3 统计学方法 采用SPSS17.0软件进行分析,计量资料采用t检验。计数资料采用χ2检验,生存率采用Kaplan-Meier法计算、Log rank检验,相关检验采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 COX-2、Snail的表达与胃癌临床病理资料特征的关系 COX-2的阳性染色表现为癌细胞胞浆内棕黄色颗粒,而癌组织间质呈现阴性。100例胃癌标本中有60例为阳性表达(60%),胃癌组织中COX-2的表达与患者年龄、性别、肿瘤大小、肿瘤组织学类型无关,差异无统计学意义(P>0.05)。COX-2在有淋巴结转移的胃癌中的阳性率为68.18%,而在无淋巴结转移的胃癌组织中阳性表达率为44.12%,差异有统计学意义(P<0.05);COX-2在有远处转移的组织中阳性率为75.00%,而在无远处转移的胃癌组织中阳性率为51.56%,差异具有统计学意义(P<0.05)。生存分析结果显示,COX-2阳性组较COX-2阴性组的生存时间短,差异亦具有统计学意义(P<0.01)(图1)。Snail的阳性染色主要定位于细胞核,100例胃癌组织中有 70例为阳性表达(70%),其表达与患者年龄、性别、肿瘤的大小、组织学类型不相关,差异无统计学意义(P>0.05),与肿瘤的分期、淋巴结转移和远处转移均具有统计学意义(P<0.05)。Spearman相关分析显示,COX-2的表达与Snail之间存在相关性(表1、2)。
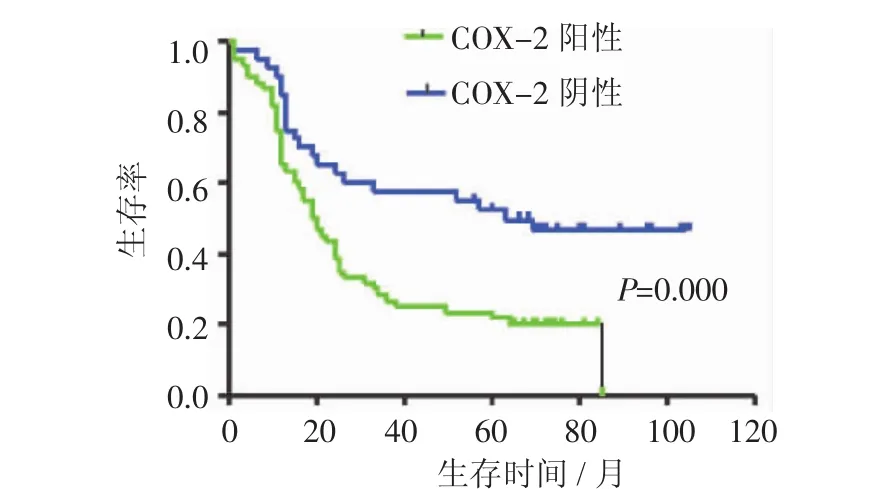
图1 COX-2(+)患者与COX-2(-)患者生存时间比较Fig 1 Comparison of survival time in patients of COX-2(+)and patients of COX-2(-)

表1 COX-2、Snail与胃癌临床病理资料的关系Tab 1 Correlation between the expression of COX-2,Snail and clinicopathology in patients with gastric cancer
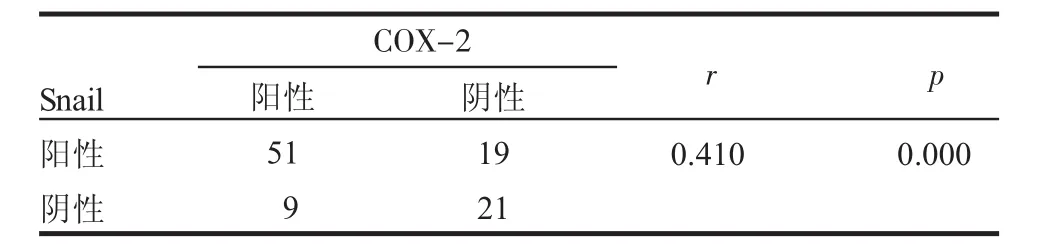
表2 COX-2、Snail的相关性分析Tab 2 Spearman analysis of the COX-2 and Snail
2.2 MKN74/control和MKN74/COX-2、MKN45/control和MKN45/shCOX-2细胞形态的改变 MKN74细胞转染COX-2慢病毒载体后,与对照组比较,细胞形态发生明显的变化,倒置相差显微镜观察显示,MKN74/control的细胞呈现典型上皮细胞形态,细胞排列紧密,而MKN74/COX-2的细胞连接更加疏松,细胞拉长,呈现间质细胞样形态。MKN45/shCOX-2细胞由原来的短梭形转变为铺路石样形态(图2)。
2.3 MKN74细胞和MKN45细胞转染前后COX-2、Snail、E-cadherin、Vimentin蛋白、mRNA的表达变化 利用Western blot、PCR检测MKN74/control和MKN74/COX-2细胞COX-2、Snail、E-cadherin、Vimentin蛋白、mRNA的表达变化情况发现,MKN74/COX-2细胞相比较MKN74/control细胞而言,COX-2表达上调,Snial表达上调,上皮性标志物E-cadherin表达下调,而间质性标志物Vimentin表达上调。在MKN45细胞中,转染shCOX-2后,Snail、Vimentin蛋白及mRNA表达下调,COX-2、E-cadherin表达上调(图3)。
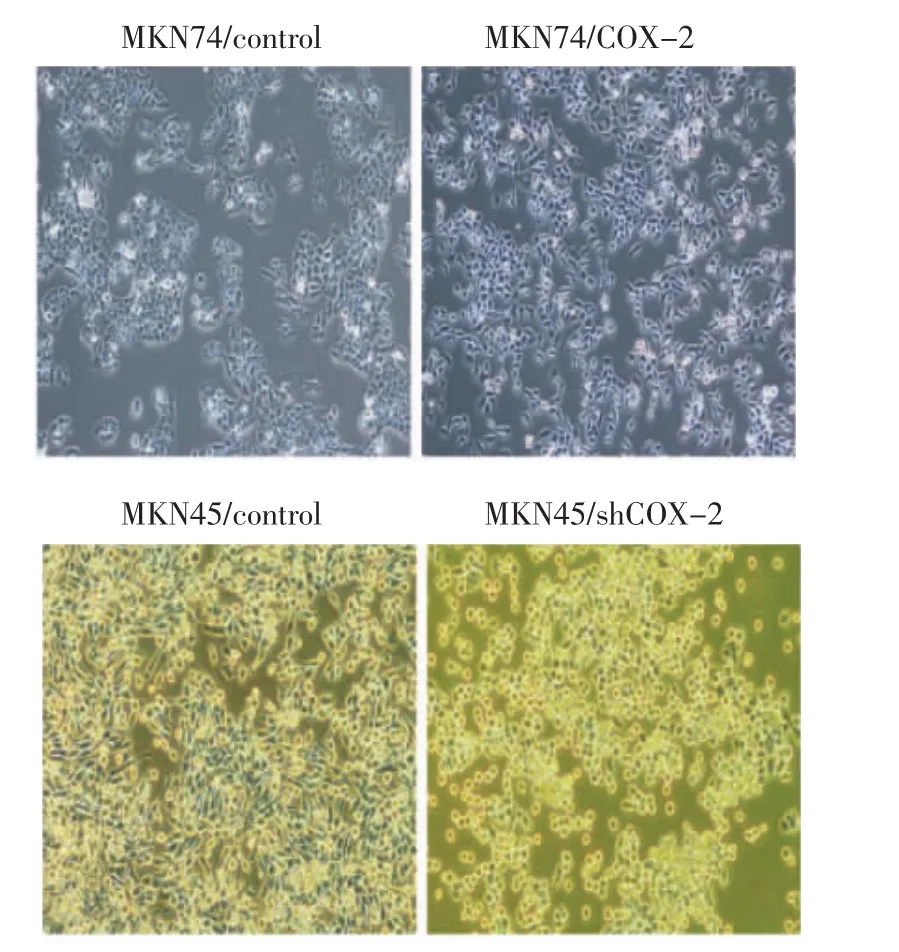
图2 MKN74/control、MKN74/COX-2及MKN45/control、MKN45/shCOX-2细胞形态学改变(×200)Fig 2 The cells morphology showed significant changes among MKN74/control cells and MKN74/COX-2 cells,MKN45/ control cells and MKN45/shCOX-2 cells(×200)

图3 MKN74细胞、MKN45细胞中COX-2、EMT相关蛋白、mRNA(E-cadherin、Vimentin以及Snail)的表达变化Fig 3 The changes in the expression of COX-2 and EMT-related protein,mRNA(E-cadherin,VimentinandSnail)expressionin MKN74 cells and MKN45 cells were detected by Western blot andPCR
2.4 转染前后细胞迁移能力的比较 采用划痕实验评价COX-2过表达后对MKN74、MKN45细胞迁移能力的影响,实验表明,与对照细胞相比,MKN74/ COX-2细胞的迁移率显著高于MKN74细胞,迁移能力显著增强,差异具有统计学意义(P<0.05)。MKN45/shCOX-2细胞的迁移率低于转染对照组细胞,差异亦具有统计学意义(P<0.05)(图4)。
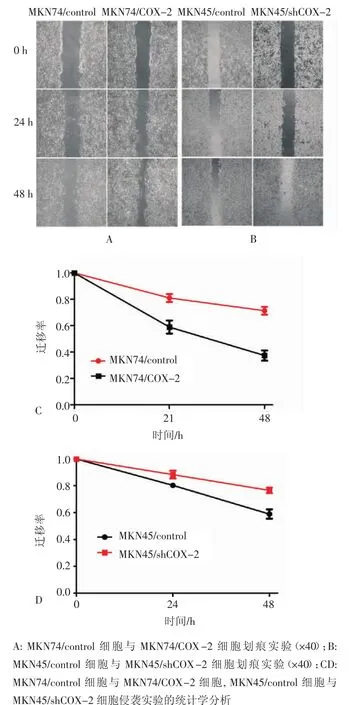
图4 划痕实验定量分析比较MKN74/control与MKN74/COX-2细胞,MKN45/control与MKN45/shCOX-2细胞迁移能力变化Fig 4 The changes of migaration ability in MKN74/control and MKN74/COX-2 cells,MKN45/control and MKN45/shCOX-2cells were detected by wound healing assay
2.5 转染前后细胞侵袭能力的比较 经视野计数统计显示,MKN74/COX-2细胞穿过Matrigel胶和滤膜的细胞数量明显多于MKN74/control细胞,差异具有统计学意义(P<0.05),MKN74/COX-2细胞的侵袭能力明显强于MKN74/control细胞。MKN45/ shCOX-2细胞穿过Matrigel胶和滤膜的细胞数量明显少于MKN45/control细胞,差异具有统计学意义(P<0.05)(图5)。
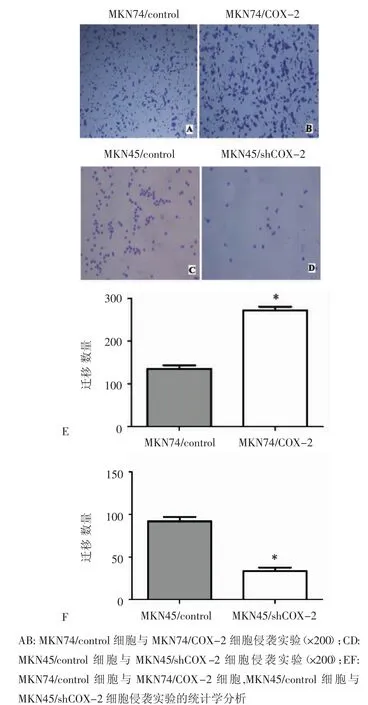
图5 比较MKN74/control与MKN74/COX-2细胞,MKN45/control与MKN45/shCOX-2细胞侵袭能力的变化Fig 5 ThechangesofinvasionabilityinMKN74/controlandMKN74/ COX-2 cells,MKN45/control and MKN45/shCOX-2 cells were detected by Transwell assay
3 讨论
据2010年统计,中国约有404 565名胃癌患者,男性287 844例,女性116 721例,287 851例死亡,发病率居肿瘤发病率第3位,死亡率排第3位[5]。由此可见,胃癌仍是威胁人类健康的恶性疾病之一,胃癌的高发病率、高死亡率给个人和社会造成了沉重的经济负担。
COX-2是一种炎性介质,COX-2在胃癌组织中高表达,并成为判断胃癌预后的独立因素[6]。有研究表明,长期且规律的服用阿司匹林或非甾体类抗炎药可以减低胃癌的发生率、转移率和死亡率[7-8]。长期服用COX-2抑制剂虽然增加了患心脑血管疾病的危险,在萎缩性胃炎、肠上皮化生和胃癌癌前病变中,其心脑血管疾病的发生率却并没有上升[9]。因此,COX-2抑制剂在预防、治疗胃癌的应用中被寄予很高的期望。本研究结果表明,胃癌组织中COX-2蛋白表达与淋巴结转移及远处转移有关,差异均具有统计学意义(P<0.05)。在Snail的免疫组化实验中,其表达与淋巴结转移、远处转移及临床分期有关,差异均具有统计学意义(P<0.05)。Spearman相关分析显示,COX-2蛋白的表达与Snail蛋白的表达呈现正相关关系。熊正文等[10]在乳腺癌的研究中发现Snail mRNA及COX-2 mRNA表达均与乳腺浸润性导管癌淋巴结转移有关,乳腺浸润性导管癌组织中Snail mRNA及COX-2 mRNA表达呈显著正相关。以上结果提示,COX-2与Snail之间可能存在某种关系。
上皮间质转换是恶性肿瘤发生发展的中心环节,它指上皮细胞向间质细胞表型转变,促使静止的上皮细胞失去极性,细胞-细胞及细胞-间质之间的黏附性发生改变,细胞内的肌动蛋白重新排列,使细胞获得更强迁移和侵袭能力[11]。其最主要的标志是上皮标志E-cadherin表达的降低。E-cadherin属于Ⅰ型跨膜糖蛋白,对维持细胞形态、运动及粘附有重要作用[12]。Vimentin是中间丝蛋白家族的主要成员,几乎表达于所有正常的间质细胞,在维持细胞完整性和抵御外界应急的损伤起了重要的作用[13]。Vimentin已经成为发生EMT的重要标志。在本实验中,上调COX-2表达后,MKN74细胞变为短梭形,E-cadherin表达显著降低,而Vimentin表达升高。细胞发生EMT,细胞间黏附连接和紧密连接破坏,最主要的标志是上皮标志E-cadherin表达的减少或丢失,并且细胞形态发生变化。因此,我们认为转染COX-2后的MKN74细胞发生了EMT。在恶性肿瘤中,E-cadherin介导的细胞间粘附功能减弱或丢失,使恶性肿瘤细胞更容易脱离原发灶向周围组织侵袭并向远处器官转移,这是肿瘤细胞获得侵袭和转移能力的第一步。在划痕实验及侵袭实验中也证明了MKN74/COX-2细胞迁移运动和侵袭能力增强,更进一步说明上调COX-2的表达能增强胃癌细胞迁移和侵袭能力。而MKN45细胞下调COX-2表达后,E-cadherin表达增多,Vimentin表达减少,细胞由原来的短梭形转变为铺路石样结构。说明下调COX-2后的MKN45细胞间的黏附能力增强。划痕及侵袭实验结果也表明MKN45/shCOX-2细胞迁移运动及侵袭能力减弱。以上结果说明,COX-2表达增高能抑制E-cadherin的表达,促进EMT的发生,COX-2表达降低能促进E-cadherin的表达,从而抑制胃癌细胞EMT的发生。
EMT相关因子主要指影响表征蛋白表达的转录因子,主要包括锌指蛋白家族的Snail、Slug、ZEB1、E12/E47以及SIP1。本实验前部分的免疫组化实验也初步证实了COX-2、Snail与胃癌的侵袭、转移相关,并且COX-2与Snail之间存在一定的关联性,为了进一步说明COX-2诱导胃癌EMT的相关机制,笔者检测了Snail蛋白的表达量。Snail是一种锌指蛋白结合因子,主要通过识别并结合E-cadherin基因启动子序列中的E-box元件,直接抑制E-cadherin的转录,导致E-cadherin分泌降低,从而影响了上皮间的粘连,促成EMT的发生[14]。在MKN74细胞中,上调COX-2表达后,Snail的表达也随之上调,而在MKN45/shCOX-2细胞中,Snail的表达下降,在PCR实验中我们也发现了相同的结果。这说明COX-2的表达促进了Snail的生成,COX-2可以通过Snail通路诱导胃癌EMT的发生。Dohadwala等[15]在非小细胞肺癌(NSCLC)的研究中发现,在非小细胞肺癌细胞系中阻断COX-2表达后,Snail的表达降低,激活COX-2表达后,Snail的表达升高。应用PGE2对非小细胞肺癌细胞系进行干预,Snail的表达随着PGE2剂量的增大而增高,两者具有明显相关性。结果提示COX-2可能通过前列腺素(PGE2)直接上调Snail的表达,从而调控E-cadherin的表达。COX-2是否还通过其它机制影响Snail仍不清楚,需要进一步的研究。
本实验的研究表明,COX-2与胃癌的远处转移和淋巴结转移有密切关系,并且预示着较差的预后。在人结肠癌[16]、肝癌[17]、乳腺癌[18]中,COX-2参与了EMT的发生,进而促进肿瘤细胞的迁移侵袭能力。COX-2可以通过Snai/E-cadherin途径诱导EMT的发生,进一步促进胃癌细胞的迁移和侵袭,这可能为胃癌的诊断、治疗和COX-2抑制剂应用于胃癌的预防与治疗提供新的思路和启示。
[1] Harris R E,Casto B C,Harris Z M.Cyclooxygenase-2 and the inflammogenesis of breast cancer[J].World J Clin Oncol,2014,5(4): 677
[2] Tsioulias G J,Go M F,Rigas B.NSAIDs and colorectal cancer control:promise and challenges[J].Current Pharmacol Reports, 2015,1(5):295
[3] Bosetti C,Rosato V,Gallus S,et al.Aspirin and cancer risk:a quantitative review to 2011[J].Ann Oncol,2012,23(6):1403
[4] Bittner M,Meltzer P,Chen Y,et al.Molecular classification of cutaneous malignant melanoma by gene expression profiling[J]. Nature,2000,406(6795):536
[5] Chen W Q,Zheng R S,Zhang S W,et al.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26(1):48
[6] Ugra N,Özgün G,Ocakoĝlu G,et al.Relationship between HER-2, COX-2,p53andclinicopathologicfeaturesingastricadenocarcinoma. Do these biomarkers have any prognostic significance[J].Turk J Gastroenterol,2014,25(Suppl 1):176
[7] Wang Z,Chen J Q,Liu J L.COX-2 inhibitors and gastric cancer [J].Gastroenterol Res Pract,2014,2014:132320
[8] Ye X H,Fu J J,Yang Y,et al.Frequency-risk and duration-risk relationships between aspirin use and gastric cancer:a systematic review and meta-analysis[J].PLoS One,2013,8(7):e71522
[9]Feng G S,Ma J L,Wong B C,et al.Celecoxib-related gastroduodenal ulcer and cardiovascular events in a randomized trial for g astric cancer prevention[J].World J Gastroenterol,2008,14(28):4535
[10]熊正文,李永申,李伟,等.Snail mRNA与环氧化酶-2mRNA在乳腺癌中的表达及临床意义[J].解放军医药杂志,2011,23(2):1
[11]Ye X,Weinberg R A.Epithelial-Mesenchymal plasticity:a central regulatorofcancerprogression[J].TrendsCellBiol,2015,25(11):675
[12]王洪涛,周清华.E-钙粘蛋白复合体与肺癌的侵袭转移[J].中国肺癌杂志,2010,13(3):254
[13]McinroyL,MäättäA.Down-regulationofvimentinexpressioninhibits carcinoma cell migration and adhesion[J].Biochem Biophys Res Commun,2007,360(1):109
[14]Bao B,Azmi A S,Ali S D,et al.The biological kinship of hypoxia with CSC and EMT and their relationship with deregulated expression of miRNAs and tumor aggressiveness[J].Biochim Biophys Acta,2012,1826(2):272
[15]Dohadwala M,Yang S C,Luo J,et al.Cyclooxygenase-2-dependent regulation of E-cadherin:prostaglandin E(2)induces transcriptional repressors ZEB1 and snail in non-small cell lung cancer[J].Cancer Res,2006,66(10):5338
[16]Jang T J,Jeon K H,Jung K H.Cyclooxygenase-2 expression is related to the epithelial-to-mesenchymal transition in human colon cancers[J].Yonsei Med J,2009,50(6):818
[17]Ogunwobi O O,Wang T,Zhang L,et al.Cyclooxygenase-2 and Akt mediate multiple growth-factor-induced epithelial-mesenchymal transition in human hepatocellular carcinoma[J].J Gastroenterol Hepatol,2012,27(3):566
[18]Cao J,Yang X,Li W T,et al.Silencing of COX-2 by RNAi modulates epithelial-mesenchymal transition in breast cancer cells partiallydependentonthePGE2cascade[J].Asian Pac J Cancer Prev, 2014,15(22):9967
(2016-01-25收稿)
Cyclooxygenase-2 promotes gastric cancer invasion and metastasis by inducing epithelial to mesenchymal transition
LI Jing1,SUN Bao-cun1,2,SUN Ran3,ZHAO Xiu-lan1,2,DONG Xue-yi1,2,ZHAO Nan1,2,GU Qiang1,2,ZHANG Dan-fang1,2,LIU Tie-ju1,2
(1.Department of Pathology,Tianjin Medical University,Tianjin 300070,China;2.Department of Pathology,General Hospital,Tianjin Medical University Tianjin 300052,China;3.Department of Surgery,Tianjin Nankai Hospital,Tianjin 300100,China)
Objective:To determine the expressions of Cyclooxygenase-2(COX-2)and Snail in gastric cancer,investigate the effect of COX-2 transduction on invasion and migration of gastric cancer cell lines of MKN74 and MKN45,and explore its related mechanism.Methods:The expressions of COX-2 and Snail were examined by immunohistochemical technique.Lentiviruses carrying COX-2 gene were constructed and transducted into MKN74 and MKN45.The changes in morphology,migration,invasion and protein were detected.Results:The expression of COX-2 was positively correlated with metastasis in lymph node and metastasis in distance(P<0.05).Snail expression was related to stage,lymph node metastasis and distant metastasis in human gastric cancer(P<0.05).There was a positive correlation between COX-2 and Snail expressions(P<0.01).The MKN74/COX-2 cells showed EMT changes.The migration and invasion abilities were significantly enhanced.Knockdown of COX-2 resulted in inhibited EMT in MKN45 cells.Migration and invasion abilities were significantly receded in MKN45/shCOX-2 cells.Conclusion:COX-2 plays an important role in the origin and development of gastric cancer,COX-2 through EMT promotes the migration and invasion abilities in gastric cancer cells.
gastric cancer;COX-2;epithelial to mesenchymal transition;migration;invasion
R735.2
A
1006-8147(2016)03-0185-06
国家自然科学基金重点项目基金资助(81230050);国家自然科学基金面上项目基金资助(81572872)
李静(1986-),女,硕士在读,研究方向:肿瘤血管生成;通信作者:孙保存,E-mail:Sunbaocun@aliyun.com。

