硫代CpG ODN对CEF增殖能力的影响
刘伟杰 张琳 许传田 杨少华 黄艳艳 黄庆华 张秀美 吴家强

摘 要:为了明确硫代CpG ODN对CEF增殖能力的影响,将CpG ODN2006进行硫代修饰,与CEF共孵育,测定了不同浓度和时间条件下细胞的增殖率。结果表明: CEF对硫代CpG ODN的耐受值为80 μg/mL;20 μg/mL硫代CpG ODN作用24~120 h,CEF均能够增殖,且48~72 h增殖效果最为显著。该结果为进一步研究CpG ODN激发CEF免疫应答效果和体外筛选体系的建立奠定了基础。
关键词:CpG ODN;硫代修饰;CEF;增殖
中图分类号:S852.5+2文献标识号:A文章编号:1001-4942(2016)05-0108-03
Abstract In order to confirm the influence of phosphorthioate CpG ODN on proliferation of CEF, the cell proliferation rates were measured at different concentrations and times as CEF was treated with phosphorthioate CpG ODN2006. As a result, the tolerance value of CEF to phosphorthioate CpG ODN was 80 μg/mL. When incubated with phosphorthioate CpG ODN of 20 μg/mL for 24 to 120 hours, the CEF all was in proliferation condition, among which, the effect between 48 to 72 hours was significant. The results would provide a basis for further studies on CEF immune response stimulated by CpG ODN and the screening of CpG ODN in vitro.
Key words CpG ODN; Phosphorthioate; CEF; Proliferation
CpG寡脱氧核苷酸(CpG oligonucleotide,CpG ODN)是含有未甲基化的CpG二核苷酸基序的核苷酸序列,能够在机体内诱生强烈的免疫反应[1],配合常规和新型疫苗使用能显著增强疫苗免疫效果,是目前新型免疫佐剂研究热点之一[2]。CpG ODN的硫代修饰能够增强对细胞的刺激效果[3],防止水解酶的降解,但相关研究表明,硫代修饰会产生一定的非特异性细胞毒性作用,对细胞产生损伤,超过一定浓度时细胞表现为免疫抑制[4,5]。因此,以细胞模型研究硫代CpG ODN功能时,首先要明确其对培养细胞增殖和存活能力的影响,筛选合适的工作浓度。
鸡胚成纤维细胞(Chicken embryo fibroblast , CEF)具有容易获得、增殖能力强、适应性强、耐受性良好、性状稳定的特点,广泛应用于分子和细胞生物学的研究[6]。CEF与鸡体的免疫应答模式类似,能够最大化模拟鸡体的反应,可作为研究动物机体反应的起点[7]。为了建立利用CEF体外筛选鸡特异性CpG ODN活性分子的体系,本研究将硫代CpG ODN与CEF共培养,明确其对CEF增殖能力的影响,为体外筛选体系的建立提供研究基础和数据支持。
1 材料与方法
1.1 材料与试剂
9日龄SPF鸡胚购自山东省农业科学院家禽研究所SPF鸡研究中心;CpG ODN选择对鸡有良好刺激效果的CpG ODN2006(5′-TCGTCGTTTTGTCGTTTTGTCGTT-3′),由上海生工合成,全链硫代修饰。
胎牛血清、DMEM细胞培养液、MTT、DMSO购自Gibico;胰酶购自Sigma;96孔细胞培养板购自Coster;青链霉素双抗购自TaKaRa。
1.2 试验方法
1.2.1 CEF的制备 取9日龄SPF鸡胚1枚,去掉胚体的头、四肢、内脏等,无血清DMEM培养液清洗后剪成碎块,然后再次清洗并弃去洗涤液。加入胰酶进行消化,待组织块变松后加入含10%血清的DMEM反复吹打,使组织均匀。取上清经100目细胞筛过滤,滤液即细胞悬液,细胞计数板计数后加入细胞培养液进行培养。
1.2.2 硫代CpG ODN浓度对CEF毒性的测定 将制备的CEF密度调整为5×106个/mL,加入96孔细胞板,每孔100 μL,置于37℃、5% CO2细胞培养箱中培养24 h,使CEF贴壁并生长成单层细胞。将硫代CpG ODN用细胞培养液稀释成不同浓度后加入不同细胞孔中,工作浓度分别为400、200、150、100、80、50、30、20、10、5、2.5 μg/mL,每个浓度重复6孔,每孔终体积200 μL,同时添加PBS替代硫代CpG ODN的阴性对照。轻轻混匀后放入细胞培养箱继续培养72 h。在培养终止前4 h,每个细胞孔加入MTT 10 μL,继续孵育4 h,取出后弃上层营养液,按100 μL/孔加入DMSO,置于摇床上晃动10 min,使结晶紫完全溶解。然后酶标仪上测定各孔OD570的值。各硫代CpG ODN浓度对CEF的毒性以细胞增殖率来衡量,其计算方法为:增殖率(%)=(OD试验组-OD对照组)/OD对照组×100,以阴性对照值为参照,低于阴性对照值表示产生细胞毒性。
1.2.3 硫代CpG ODN作用时间对CEF增殖能力的影响 根据不同浓度硫代CpG ODN作用下CEF增殖率的结果,选取最优刺激浓度进行作用时间对CEF增殖能力影响的确定。CEF铺板后24 h,与硫代CpG ODN分别共培养24、48、72、96、120 h,然后采用MTT法测定各时间段细胞OD570的值,通过计算增殖率来衡量CEF的增殖状况。
2 结果与分析
2.1 硫代CpG ODN作用浓度对CEF增殖的影响
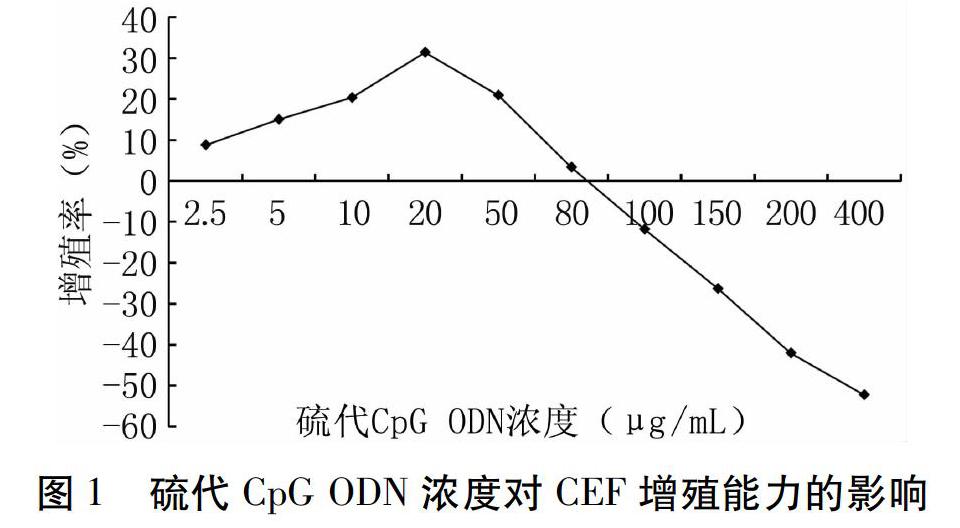
通过计算各浓度硫代CpG ODN作用下CEF的增殖率可知,随着浓度的增大,增值率先上升后下降,当浓度处于2.5~20 μg/mL之间时,对CEF刺激效果良好,增殖率持续上升,至20 μg/mL时达到最高值;当浓度大于20 μg/mL时,增殖率呈下降趋势,达到80 μg/mL时,细胞增殖率为3.32%;当浓度增加至100 μg/mL时,增殖率为负数,表明在此浓度下CEF未增殖,表现出一定程度的细胞毒性作用,浓度继续增大时,增殖率进一步降低。结果显示, CEF对硫代CpG ODN的耐受浓度为80 μg/mL(图1)。
2.2 硫代CpG ODN作用时间对CEF增殖的影响
选取浓度为20 μg/mL的硫代CpG ODN与CEF共孵育,在24~120 h的时间段内,CEF始终处于增殖状态(图2)。24 h增殖率较低,仅为6.72%,48 h和72 h时增殖效果上升明显,分别达到33.67%和31.38%,培养至96 h时,细胞增殖率又下降至16.53%。结果表明,最佳刺激浓度的硫代CpG ODN未对CEF产生明显毒性,但为了得到最佳刺激效果,最佳孵育时间为48 h,最长应避免超过72 h。
3 结论与讨论
CpG ODN的免疫刺激作用具有种属特异性。已有研究表明,小鼠免疫细胞的最佳刺激基序为GACGTT,而人免疫细胞的最佳刺激基序为GTCGTT,鸡的最佳刺激基序与人相同也是GTCGTT[8,9]。CpG ODN2006含有3个GTCGTT基序,能够有效刺激淋巴细胞增殖,提高免疫应答效果[10]。本研究选择全硫代的CpG ODN2006作用于CEF,进行CEF模型耐受浓度和时间的摸索,以便同鸡淋巴细胞的相关试验结果进行比较,从而为建立以CEF替代淋巴细胞进行体外筛选鸡特异性CpG ODN活性分子的体系提供依据。
天然的CpG ODN进入体内和细胞后极不稳定,序列内的磷酸二酯键是核酸水解酶的敏感位点,易受细胞内和血清中核酸水解酶的降解,半衰期短(B型CpG ODN仅5 min左右)[11],因此在人工合成时多将CpG ODN进行部分或者全链的硫代修饰以防止序列的降解。然而,序列的硫代修饰往往会产生非特异性的细胞毒性作用,影响细胞存活率[4,5],干扰试验结果。前期研究结果表明,当CpG ODN达到20 μg/mL(鸡脾脏细胞浓度为5×106个/mL)时即出现细胞毒性抑制作用,极大限制了CpG ODN最优工作浓度的筛选上限。而在本研究中,CEF在CpG ODN刺激浓度为80 μg/mL时依然呈现增殖状态,表明在相同条件下CEF对细胞毒性的耐受阈值比淋巴细胞高出4倍,一定程度上避免了细胞毒性对试验的干扰,同时使得CpG ODN的工作浓度筛选范围更广。
20 μg/mL的硫代CpG ODN对CEF的刺激效果最强,通过不同的作用时间发现,该浓度对细胞的刺激作用大于毒性作用而使细胞呈现增殖状态,并未表现出明显的细胞毒性。但各时间点细胞的增殖率差别明显,48 h时最高,72 h略有降低,96 h时又下降至一半左右,24 h和120 h因刺激时间短和细胞死亡数增加而较低。所以,20 μg/mL硫代CpG ODN作用于CEF的各个时间点均能刺激细胞增殖,而最佳刺激时间在48~72 h。
本研究对CEF模型耐受硫代CpG ODN的浓度和时间进行了测定,明确了刺激浓度和时间对细胞增殖能力的影响,为建立利用CEF体外筛选鸡特异性CpG ODN活性分子的体系奠定了基础。
参 考 文 献:
[1] Tokunaga T, Yamamoto H, Shimada S, et al. Antitumer activity of deoxynucleic acid fraction from Mycobacterium bovis BCG 1. isolation physicohemical characterization, and antitumor activity[J]. Journal of the National Cancer Institute, 1984, 72: 955-962.
[2] 朱建中, 朱鸿飞, 卢春, 等. 免疫佐剂 CpG DNA 的研究进展[J]. 生命的化学, 2002,22(2):155-157.
[3] Jason D M, Karen F, Christi A, et al. Identification of a novel CpG DNA class and motif that optimally stimulate B cell and plasmacytoid dendritic cell functions[J]. Journal of Leukocyte Biology, 2003, 73: 781-792.
[4] 何凤田, 黄云辉, 朱锡华. 反义bcl-2寡脱氧核苷酸对U937细胞增殖和存活能力的影响[J].免疫学杂志, 1998, 14(2): 91-93.
[5] 刘晓波, 余学清, 李晓艳, 等. 硫代反义寡核苷酸及脂质体对培养细胞的毒性作用[J]. 临床检验杂志, 2003, 21(3): 143-145.
[6] 朱国坡, 周晓丽, 郭延锋, 等. 鸡胚成纤维细胞原代培养及应用[J]. 动物医学进展, 2010, 31(3):112-114.
[7] Liang Q L, Luo J, Zhou K, et al. Immune-related gene expression in response to H5N1 avian influenza virus infection in chicken and duck embryonic fibroblasts[J]. Molecular Immunology, 2011, 48: 924-930.
[8] He H, Crippen T L, Farnell M B, et al. Identification of CpG oligodeoxynucleotide motifs that stimulate nitric oxide and cytokine production in avian macrophage and peripheral blood mononuclear cells[J]. Developmental and Comparative Immunology, 2003, 27(6): 621-627.
[9] Dalloul R, Lillehoj H S, Okamuar M, et al. In vivo effects of CpG oligodeoxynucleotide on Eimeria infection in chickens[J]. Avian Disease, 2004, 48: 783-790.
[10]李杰,杨汉春,郭鑫,等. CpG ODN对新城疫LaSota活疫苗的免疫增强效应[J].畜牧兽医学报, 2006, 37(1): 44-49.
[11]Wang X, Bao M, Wan M, et al. A CpG oligodexynucleotide acts as a potent adjuvant for inactivated rabies virus vaccine[J]. Vaccine, 2008, 26(15):1893-1901.

