金黄色葡萄球菌诱导型乳腺炎对中国荷斯坦奶牛乳中脂肪酸组成的影响
李 蕊 张成龙 耿晓晗 李 锐 蒲俊华 毛永江
冀德君1 杨章平1* 吴苏红2 徐向前2 陆春兵2 任湘莲2
(1.扬州大学动物科学与技术学院,扬州225009;2.江苏省江阴市动物疫病预防控制中心,江阴214400)
金黄色葡萄球菌诱导型乳腺炎对中国荷斯坦奶牛乳中脂肪酸组成的影响
李蕊1张成龙1耿晓晗1李锐1蒲俊华1毛永江1
冀德君1杨章平1*吴苏红2徐向前2陆春兵2任湘莲2
(1.扬州大学动物科学与技术学院,扬州225009;2.江苏省江阴市动物疫病预防控制中心,江阴214400)
摘要:本文旨在研究金黄色葡萄球菌诱导型乳腺炎对中国荷斯坦奶牛乳中脂肪酸组成及其绝对含量的影响。根据奶牛乳房结构,试验组利用通乳针将金黄色葡萄球菌细菌悬液经乳头管注射入奶牛乳房内,建立诱导型金黄色葡萄球菌型乳腺炎模型,对照组灌注磷酸盐缓冲液,采用气相色谱法测定乳中的脂肪酸绝对含量。结果表明:乳中共检出34种脂肪酸,金黄色葡萄球菌诱导对感染乳区脂肪酸合成产生直接影响。按不饱和度和碳链长度划分的6大类脂肪酸中,试验组在感染后11 h与感染前24 h相比,短链脂肪酸、中链脂肪酸和饱和脂肪酸的绝对含量均显著降低(P<0.05);对照组有相同变化趋势,但除短链脂肪酸外均未达到显著水平(P>0.05)。感染后23 h试验组6大类脂肪酸的绝对含量均低于对照组。结果提示:金黄色葡萄球菌诱导型乳腺炎影响了奶牛脂肪酸的合成过程,降低了脂肪酸各组分的绝对含量。
关键词:中国荷斯坦奶牛;脂肪酸;金黄色葡萄球菌;乳腺炎
奶牛乳腺炎是由微生物、物理、化学等因素刺激奶牛乳腺所引发的一种炎症反应[1]。因为其发病率高,危害性大,现已成为影响世界奶牛业发展的最主要疾病之一。乳腺炎的病因复杂,但病原微生物感染是引起乳腺炎最主要的病因[2]。在病原菌感染中,金黄色葡萄球菌(S.aureus)居多,其次是大肠杆菌和链球菌,三者可占到奶牛乳腺炎病原菌的90%以上[3]。因此,对金黄色葡萄球菌引起的奶牛乳腺炎防御机制及对乳腺合成代谢影响研究成为当前研究奶牛乳腺炎防控的一个热点。目前,随着对金黄色葡萄球菌研究的深入,国内外许多研究者利用人工诱导金黄色葡萄球菌型乳腺炎模型来探索其发病机理。Chandler[4]于1970年首次成功建立人工诱导金黄色葡萄球菌型乳腺炎的小鼠模型,且于1971年利用该小鼠模型进行了青霉素疗效试验。Bramley等[5]研究发现,向乳房内灌葡萄球菌素可预防及治疗小鼠金黄色葡萄球菌型乳腺炎。Hu等[6]研究结果表明,金黄色葡萄球菌型小鼠乳腺炎模型中,乳铁蛋白结合蛋白(lFnBP)的配体结合域对金黄色葡萄球菌有免疫抗性。Guo等[7]建立了金黄色葡萄球菌型小鼠乳腺炎模型,经研究发现在该模型中,黄芩素能下调p38及核转录因子κB(NF-κB)的磷酸化,进而降低促炎症因子的表达。国内多项研究先后对人工诱导金黄色葡萄球菌型乳腺炎的小鼠模型进行了多方面的探索研究[8-11]。杨峰等[12]利用从牛奶中分离得到的金黄色葡萄球菌侵染小鼠,进而构建诱导性金黄色葡萄球菌型小鼠模型,研究侵染前后小鼠内脏(肝脏、肾脏和脾脏)组织的氧化损伤,并进行了抗药性研究。尽管可选用小鼠作为试验动物研究金黄色葡萄球菌型乳腺炎,甚至可以利用该模型准确了解金黄色葡萄球菌的表面蛋白及毒力因子,从而进一步研究乳腺炎的发病机理,但小鼠与奶牛的乳腺导管存在较大差异,因此该模型无法完全模拟金黄色葡萄球菌侵染奶牛乳房致使发病的整个过程。为此,袁峥嵘[13]利用金黄色葡萄球菌诱导建立奶牛乳腺炎进行研究。刘利等[14]建立了人工诱导的金黄色葡萄球菌型奶牛乳腺炎模型,研究牛αs1-酪蛋白(CSN1S1)基因启动子区上游的甲基化程度及其mRNA的表达。崔新洁[15]利用金黄色葡萄球菌成功诱导牛乳腺上皮细胞凋亡,并对其信号通路进行了研究。这一系列的研究表明,用金黄色葡萄球菌进行诱导乳腺炎试验已经成为研究奶牛乳腺炎的有效手段和方法。
然而,利用人工诱导型金黄色葡萄球菌型乳腺炎模型研究乳腺炎对乳汁中主要营养成份的合成影响、尤其是对脂肪酸合成代谢的影响未见报道。本试验旨在人工诱导建立金黄色葡萄球菌型奶牛乳腺炎模型,探讨金黄色葡萄球菌感染对乳中脂肪酸合成代谢的影响,为提高乳品质提供理论参考。
1材料与方法
1.1材料
1.1.1试验动物
选择3头健康、头胎且无病史的中国荷斯坦奶牛,3头牛体况相近、乳房发育良好、乳汁细菌培养均为阴性[体细胞数(SCC)<10×104个/mL],处于泌乳中期[(175±31) d],平均日产奶量为19.20 kg,隔离观察7 d后进行试验。
1.1.2饲养管理
对所选中国荷斯坦奶牛,采用全混合日粮(TMR)饲喂奶牛。配方:精料19%,玉米青贮50%,干草10%,干酒糟及其可溶物21%。精料组成:玉米52%,小麦麸8%,次粉10%,大豆粕13%,棉籽粕5%,菜籽粕5%,骨粉1%,食盐1%,预混料5%(含微量元素、维生素、酵母培养物等)。按干物质计算TMR的精粗比大约为40∶60,按每头奶牛每天35 kg TMR投料,并保证奶牛每天至少20 h能采食到饲料。
1.1.3菌种
金黄色葡萄球菌(菌种编号ATCC2913),扬州大学兽医学院从患乳腺炎疾病牛乳腺中分离提供。
1.2金黄色葡萄球菌诱导型乳腺炎模型的建立
根据奶牛乳房结构,试验组利用通乳针将浓度为1×107CFU/mL的金黄色葡萄球菌细菌悬液经乳头管注射入奶牛乳房内,注射剂量为5 mL,对照组注射等量的灭菌磷酸盐缓冲液(PBS)。注射乳区分布状况见表1。
1.3乳样的采集
分别于接种感染前24 h及接种感染后11、23 h,采集新鲜乳样50 mL,置于保温箱中送回实验室,立即对乳样进行乳腺炎检测和SCC测定。剩余样品置于-20 ℃保存,并于10 d内分析乳中脂肪酸(fatty acids,FA)组成及其绝对含量。

表1 奶牛注射乳区分布情况
A1、A2分别表示试验牛1左前和右前乳区;B1、B3分别代表试验牛2左前和右后乳区;C1、C4分别代表试验牛3左前和左后乳区。下表同。
A1 and A2 represented left front and right rear breast areas of experimental cow 1, respectively; B1 and B3 represented left front and right rear breast areas of experimental cow 2, respectively; C1 and C4 represented left front and left rear breast areas of experimental cow 3. The same as below.
1.4乳样脂肪酸的检测
脂肪酸的检测依据《乳与乳制品脂肪酸的测定气相色谱法》(GB/T 21676—2008)[16]。待测液上机检测前使用有机相针式过滤器进行过滤,气相色谱仪使用程序升温进行检测[17-18]。
采用相同的条件测定标准品和样品中的各种脂肪酸,对照标准品,根据峰的保留时间和峰面积定性和定量。定量公式如下:
C样品(mg/mL)=C标品×A样品/A标品。
式中:C样品与A样品分别表示样品中某脂肪酸的浓度与峰面积;C标品与A标品分别表示标准品中该脂肪酸的浓度与峰面积。
标准品选择美国Sigma公司的37种脂肪酸甲酯的混标,在设定的气相色谱检测条件下,采用自动进样器进样,先对标准品进行检测,标准品图谱如图1所示。

图1 37 种脂肪酸混标色谱图
1.5奶牛乳腺炎检测
奶牛乳腺炎检测采用BMT(Beijingmastitis test)法[17],取乳样2 mL放入检验盘中,加入2 mL诊断液(用定量加液器或刻度吸管),轻轻旋转检验盘,随着摇动进行判定(在奶与诊断液混合10~25 s内判定),记录判定结果。
1.6乳中SCC的检测
现场测定采用丹麦Chemometec公司产SCC-100型便携式牛奶体细胞快速检测仪。首先,用移液器加0.5 mL Reagent C于2 mL离心管中,再加入乳样0.5 mL摇匀混合(10~20 s),最后用采样器吸取充分溶解混合的乳样后,立即放入检测仪卡槽,盖好按下“RUN”键,开始测定,读数得到分析结果并记录。
1.7统计方法
运用Excel软件整理数据,利用生物统计学处理软件SPSS 17.0进行单因素方差分析。
2结果与分析
2.1感染后奶牛临床表现变化
用金黄色葡萄球菌人工感染奶牛乳腺一段时间后,奶牛开始出现临床症状,接种感染乳区出现轻微红肿,按压乳房奶牛伴有轻微疼痛感。随着时间的延长,症状加剧,奶牛乳房变硬,红肿、胀痛严重,乳汁出现异常,有凝块、絮状物、水样乳,牛表现精神抑郁,食欲废绝,可判定为临床型乳腺炎诱导成功。
2.2感染前后奶牛BMT检测结果
由表2可知,金黄色葡萄球菌人工感染后11 h,试验组乳区(A2、B3、C4)均呈现弱阳性反应,对照组呈阴性。细菌接种感染后23 h,试验组均呈现强阳性反应,对照组检测仅C1乳区呈弱阳性,另2个乳区均呈阴性。
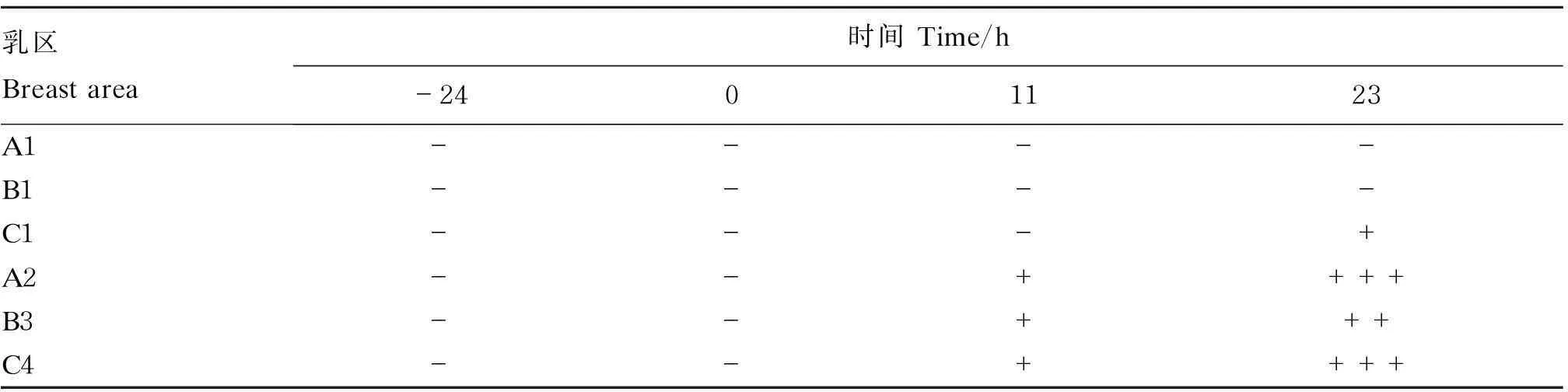
表2 奶牛BMT检测结果
-:阴性,+:阳性。时间负值表示感染前,正值表示感染后。下表同。
-: negative. +: positive. Negative values indicated time before infection. Positive values indicated time after infection. The same as below.
2.3乳中SCC测定
乳中SCC测定结果见表3,人工感染金黄色葡萄球菌后,被感染乳区的乳中SCC急剧上升。3头试验牛6个乳区在感染前乳中的SCC均低于10×104个/mL,感染后试验组的3个感染乳区SCC均大幅度上升,在感染后23 h均超过100×104个/mL,个别乳区达到200×104个/mL,为临床型乳腺炎。(3个对照乳区SCC虽有小幅度上升,除C1乳区在感染后23 h超过50×104个/mL外,其他乳区均未曾超50×104个/mL)。
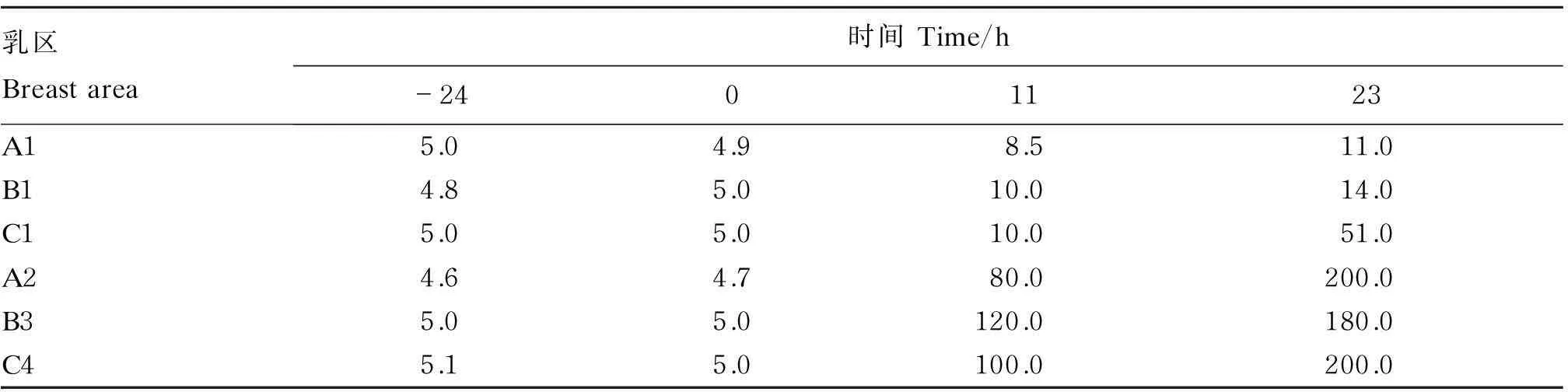
表3 奶牛乳中SCC检测结果
2.4乳中脂肪酸的色谱检测结果
在与标准品同样的条件下检测待测乳样中的脂肪酸,根据标准图谱每种峰的保留时间和面积百分比定性和定量。图2表示样品牛奶检测图谱,共测定出34种脂肪酸,其中饱和脂肪酸(saturated fatty acids,SFA)17种,单不饱和脂肪酸(monounsaturated fatty acids,MUFA)7种,多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)10种。短链脂肪酸(short-chain fatty acids,sc-FA)1种,中链脂肪酸(medium-chain fatty acids,mc-FA)9种,长链脂肪酸(long-chain fatty acids,lc-FA)24种。
2.5感染前后乳中各脂肪酸绝对含量的变化
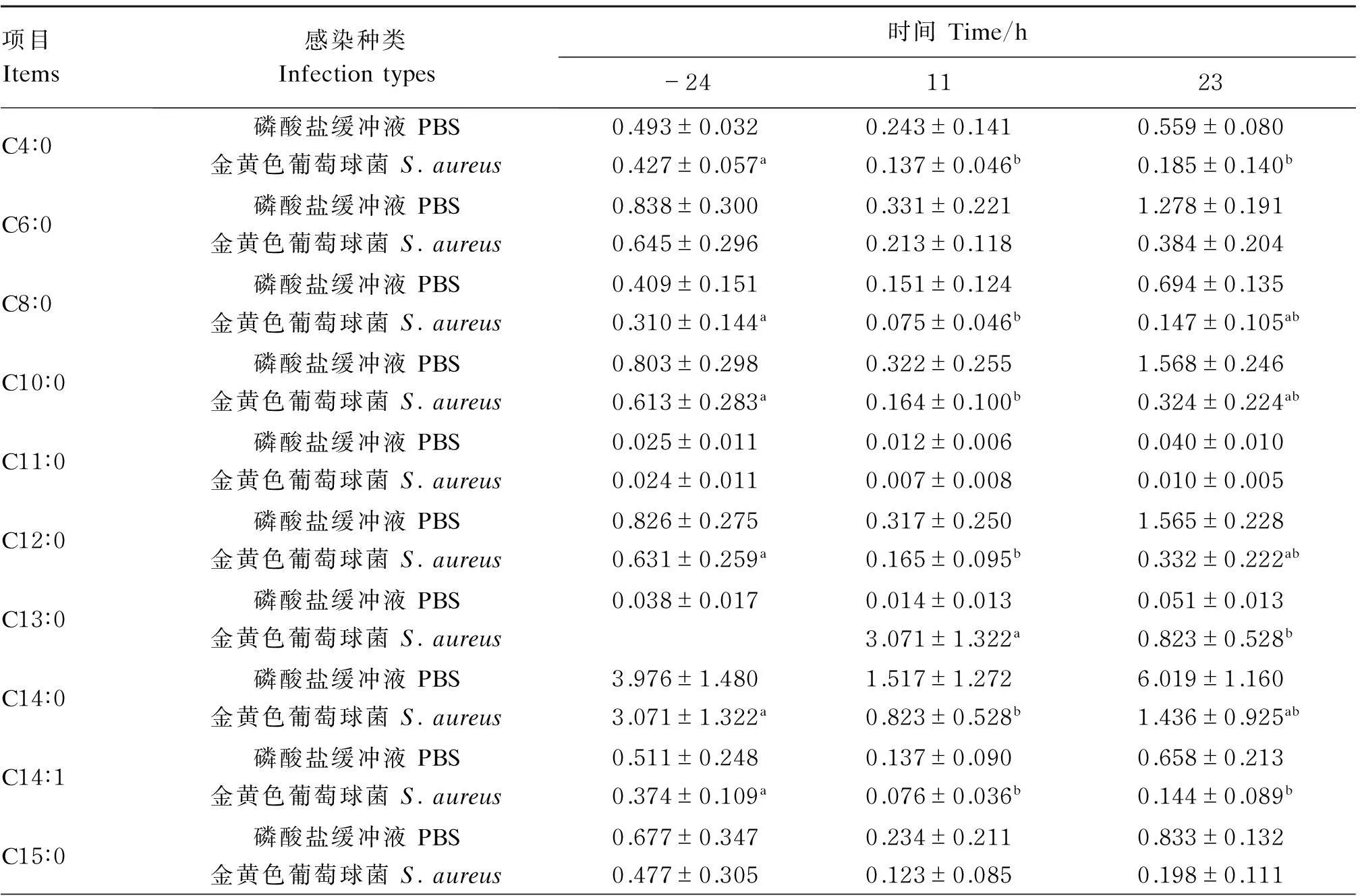
如表4所示,试验组所有的脂肪酸除C4∶0、C13∶0、C20∶3n6、C20∶4、C22∶6、C24∶1外,在感染前后的3个时间点均呈先降低后升高的趋势,且大部分以感染前24 h绝对含量最高。sc-FA C4∶0绝对含量在感染前24 h未检出,感染后11 h显著高于24 h(P<0.05);在mc-FA(C6~C15)中,在接种感染后11 h,除C6∶0、C11∶0、C13∶0、C15∶0外,其他脂肪酸的绝对含量均显著低于感染前24 h(P<0.05);lc-FA(C16~C24)中,C16∶0、C18∶3n3在感染前24 h和感染后11 h之间差异显著(P<0.05),C20∶1感染前24 h的绝对含量与感染后2个时间点之间差异显著(P<0.05),其他脂肪酸感染前后差异不显著(P>0.05);C24∶1在感染前后绝对含量升高后又降低,C20∶3n3在感染后11 h、C22∶6在感染后11和23 h无法检出。对照组脂肪酸(除C4∶0、C21∶0、C22∶6、C24∶0)也呈先降低后升高的趋势,与试验组一致,但绝对含量总体上在感染后23 h最高,含量极少的C20∶3n3、C22∶6在感染前后也很难检测出、感染前后的3个时间点各脂肪酸绝对含量无显著差异(P>0.05)。总体上,试验组各脂肪酸绝对含量在感染前后的3个时间点均低于对照组。
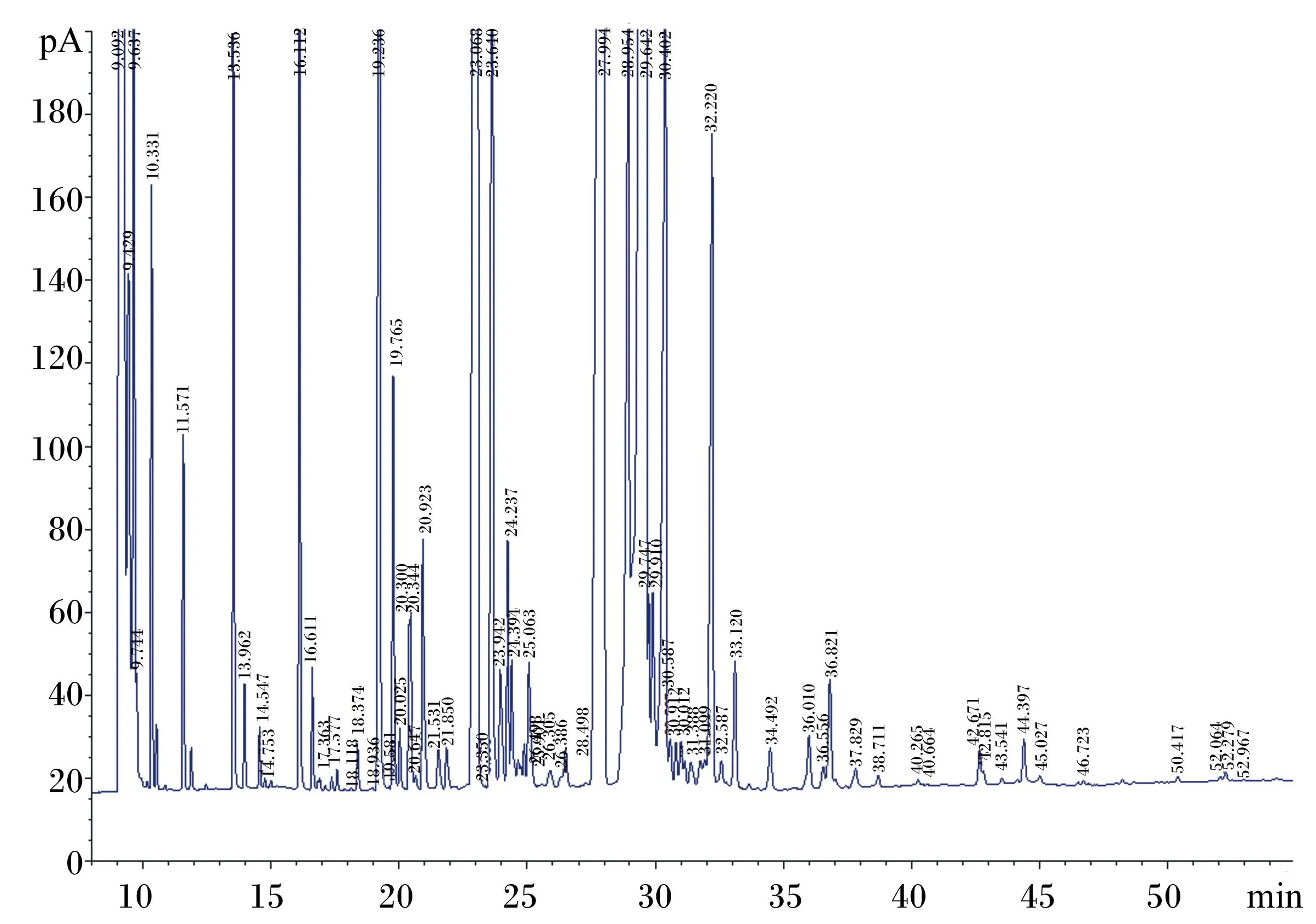
图2 奶牛乳中脂肪酸色谱图
mg/mL

续表4项目Items感染种类Infectiontypes时间Time/h-241123C16∶0磷酸盐缓冲液PBS16.464±7.4145.990±5.39623.039±3.971金黄色葡萄球菌S.aureus12.364±6.468a3.211±2.210b5.754±3.272abC16∶1磷酸盐缓冲液PBS1.018±0.6170.306±0.1901.078±0.225金黄色葡萄球菌S.aureus0.791±0.6640.238±0.1400.286±0.159C17∶0磷酸盐缓冲液PBS0.353±0.1680.144±0.1340.573±0.010金黄色葡萄球菌S.aureus0.281±0.1500.093±0.0430.156±0.119C17∶1磷酸盐缓冲液PBS0.125±0.0590.046±0.0440.251±0.073金黄色葡萄球菌S.aureus0.108±0.0710.036±0.0300.064±0.052C18∶0磷酸盐缓冲液PBS6.122±2.2152.722±2.6098.870±2.017金黄色葡萄球菌S.aureus4.790±2.1941.447±1.0282.594±1.636C18∶1c磷酸盐缓冲液PBS13.831±6.6694.836±4.36319.072±3.505金黄色葡萄球菌S.aureus10.659±6.2782.757±1.9074.909±2.956C18∶2t磷酸盐缓冲液PBS0.234±0.1430.108±0.0680.141±0.058金黄色葡萄球菌S.aureus0.196±0.0960.071±0.0400.118±0.063C18∶2c磷酸盐缓冲液PBS1.262±0.5370.493±0.3322.149±0.530金黄色葡萄球菌S.aureus0.923±0.4410.414±0.1880.973±0.296C18∶3n3磷酸盐缓冲液PBS0.094±0.0430.028±0.0280.122±0.028金黄色葡萄球菌S.aureus0.068±0.032a0.014±0.007b0.031±0.019abC18∶3n6磷酸盐缓冲液PBS0.056±0.0230.027±0.0310.079±0.013金黄色葡萄球菌S.aureus0.045±0.0300.011±0.0100.020±0.012C20∶0磷酸盐缓冲液PBS0.045±0.0170.023±0.0190.057±0.006金黄色葡萄球菌S.aureus0.026±0.0150.011±0.0070.021±0.006C20∶1磷酸盐缓冲液PBS0.712±0.3960.167±0.1730.720±0.201金黄色葡萄球菌S.aureus0.518±0.281a0.079±0.054b0.152±0.069bC20∶2磷酸盐缓冲液PBS0.022±0.0060.012±0.0040.046±0.009金黄色葡萄球菌S.aureus0.015±0.0060.007±0.0010.017±0.008C20∶3n3磷酸盐缓冲液PBS0.012±0.0020.0110.012±0.008金黄色葡萄球菌S.aureus0.0080.003C20∶3n6磷酸盐缓冲液PBS0.013±0.0050.008±0.0060.024±0.006金黄色葡萄球菌S.aureus0.010±0.0060.005±0.0030.005±0.001C20∶4磷酸盐缓冲液PBS0.017±0.0070.0090.020±0.004金黄色葡萄球菌S.aureus0.014±0.0060.007±0.0010.007±0.002C20∶5磷酸盐缓冲液PBS0.016±0.0060.009±0.0030.025±0.002金黄色葡萄球菌S.aureus0.013±0.0050.0050.011±0.008C21∶0磷酸盐缓冲液PBS0.015±0.0080.050±0.0600.027±0.009金黄色葡萄球菌S.aureus0.011±0.0030.0040.008C22∶0磷酸盐缓冲液PBS0.114±0.0700.062±0.0560.226±0.060金黄色葡萄球菌S.aureus0.083±0.0550.047±0.0320.112±0.030C22∶1磷酸盐缓冲液PBS0.117±0.0600.052±0.0550.250±0.029金黄色葡萄球菌S.aureus0.084±0.0560.035±0.0290.117±0.013C22∶6磷酸盐缓冲液PBS0.012金黄色葡萄球菌S.aureus0.006

续表4项目Items感染种类Infectiontypes时间Time/h-241123C23∶0磷酸盐缓冲液PBS0.014±0.0030.0120.016±0.000金黄色葡萄球菌S.aureus0.012±0.0040.0050.008±0.005C24∶0磷酸盐缓冲液PBS0.024±0.0090.030±0.0230.071±0.009金黄色葡萄球菌S.aureus0.020±0.0120.0110.044±0.006C24∶1磷酸盐缓冲液PBS0.014±0.0070.008±0.0010.012±0.003金黄色葡萄球菌S.aureus0.009±0.0080.0140.005±0.003
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01). The same as below.
2.6感染前后不同种类脂肪酸组成的变化
按照碳链长度和饱和度,将测得的34种脂肪酸分为6大类,分别为sc-FA、mc-FA、lc-FA、SFA、MUFA、PUFA,对其结果进行统计并进行单因素方差分析,结果如表5所示。可以看出,对照组的6大类脂肪酸在感染后11 h的绝对含量低于与其他时间2个时间点的含量,其中显著或极显著低于感染后23 h(P<0.05或P<0.01)。试验组在感染后11 h与感染前24 h相比,sc-FA、mc-FA和SFA的绝对含量显著降低(P<0.05),其他3类脂肪酸含量也降低,但差异不显著(P>0.05)。感染后23 h试验组6大类脂肪酸的绝对含量均低于对照组。
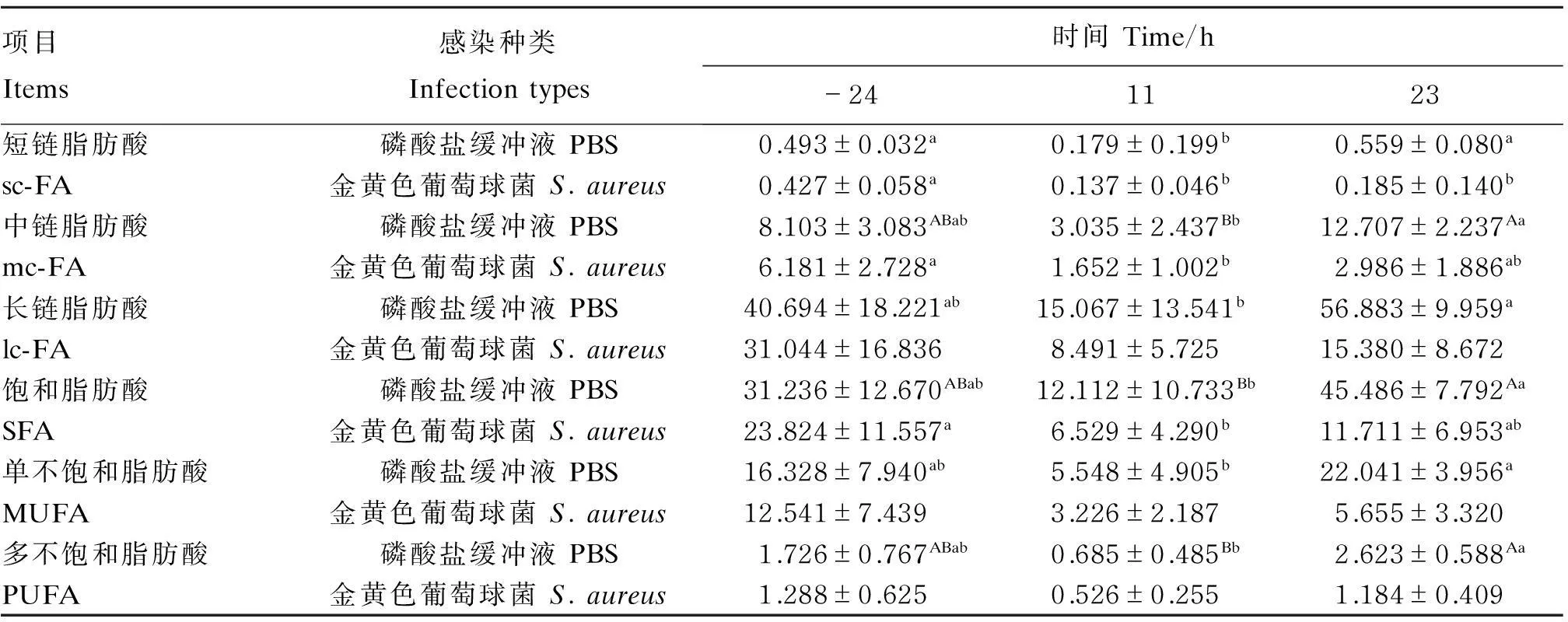
表5 奶牛感染前后乳中不同种类脂肪酸绝对含量的变化
3讨论
3.1人工诱导金黄色葡萄球菌型乳腺炎模型的建立与应用
奶牛乳腺炎病因复杂、病程长、根除难,因此被认为奶牛养殖产业链提高经济效益的最大阻碍[19-20]。疾病模型对于研究疾病病理学、病因学、治疗学等研究领域来说是一种非常重要的工具。随着对乳腺炎研究的不断深入,近年来,人工感染模型被大量研究者所推崇,国内外许多研究者利用人工诱导金黄色葡萄球菌型乳腺炎模型来探索其发病机理,取得了显著成果[4-15]。一系列的研究也表明,用金黄色葡萄球菌进行诱导乳腺炎试验已经成为研究奶牛乳腺炎的病因、机理和治疗效果有效手段和方法。然而金黄色葡萄球菌型乳腺炎如何影响乳成分的合成与分泌、乳腺中脂肪的合成代谢是否发生变化等研究未见报道。本研究旨在人工诱导建立金黄色葡萄球菌型奶牛乳腺炎模型,探讨金黄色葡萄球菌型奶牛乳腺炎乳中脂肪酸的变化,在一定程度上弥补这方面研究的不足。
3.2金黄色葡萄球菌感染前后乳中各种脂肪酸组分绝对含量的变化
杨德英等[21]研究认为,乳脂肪酸含量与乳脂率有直接的相关性,奶牛在患乳腺炎后,乳脂率会有明显地降低,乳脂率的降低必然表现为相应脂肪酸含量的减少。本研究对检测到的34种脂肪酸的绝对含量的研究发现,有31种脂肪酸在牛乳感染金黄色葡萄球菌后降低,这应该与奶牛染菌后产生的炎症反应有关。因为本试验BMT检测结果显示试验组乳区在细菌感染后11 h均出现弱阳性反应,随着时间的延长炎症加重,最终为临床型乳腺炎,乳脂是在乳腺泡的上皮细胞内合成,而乳腺炎降低了乳腺的合成能力,引起乳脂含量下降,从而导致乳中脂肪酸的含量降低,然而这31种脂肪酸绝对含量在降低后又升高,这与常玲玲[22]的研究结果有一定的差异,主要原因应该是因为本试验为人工诱导性试验,由金黄色葡萄球菌感染引起的乳腺炎,而金黄色葡萄球菌的致病性极强,入侵的金黄色葡萄球菌严重地破坏了乳腺组织上皮细胞,减少了乳腺细胞合成乳脂的量,降低了乳脂率,从而导致相应脂肪酸绝对含量的降低,但是奶牛免疫系统具有对乳腺内部感染的免疫应答功能,当乳腺被感染时,免疫系统启动以消除感染[23],所以奶牛通过自身的免疫作用,脂肪酸合成能力逐步恢复,故脂肪酸含量又升高。注射PBS的对照组大部分脂肪酸也出现了相同的变化趋势,是因为随着时间的延长乳腺炎程度加深,患牛表现出体温升高等全身性反应,此时血乳屏障作用难以阻挡试验组病原菌的全身性扩散,因此对照组乳区虽没有表现典型的临床症状,其乳腺细胞脂肪的合成代谢已经受到影响。由于对照组属于轻微感染,乳腺的免疫应答足以消除感染,乳腺则恢复到正常的非感染状态,试验组乳腺分泌细胞已经遭到一定程度的破坏,无法恢复到非感染状态,脂肪酸绝对含量虽然有所升高,但还是明显低于对照组。
3.3金黄色葡萄球菌感染对不同种类脂肪酸的影响
本研究发现,按照碳链长度及不饱和度分成的6大类脂肪酸,感染后11 h与感染前24 h相比,试验组sc-FA、mc-FA及lc-FA的绝对含量显著降低。这与常玲玲[22]的研究结果一致,健康乳和隐性乳腺炎乳中SFA、MUFA和PUFA的绝对含量没有显著差异,而两者显著高于临床型乳腺炎中脂肪酸的含量,这一观点与本研究大体一致。本研究中感染后23 h各类脂肪酸的绝对含量均高于感染后11 h的含量,表明奶牛乳腺有强大的乳腺修复功能。另外试验组在感染前后的3个时间点的绝对含量与对照组相应的3个时间点相比,均低于对照组,尤其在感染后23 h。这一现象与34种脂肪酸的变化趋势大体一致。入侵的金黄色葡萄球菌严重破坏了奶牛乳腺分泌细胞,阻碍了某些乳汁成分的合成,致使乳脂率严重下降,但牛奶中游离的脂肪酸相对增多,一定程度上抑制细菌的繁殖,保护了乳腺组织。
由于目前关于人工诱导性金黄色葡萄球菌型乳腺炎患牛乳中脂肪酸种类及其绝对含量变化的研究至今未见报道,本研究也只是做了表观上的研究。为了更深入地研究金黄色葡萄球菌引发的乳腺炎对乳汁中脂肪酸的影响,可以在遗传学的基础上做进一步的研究。大量研究表明,表达谱基因芯片和转录组测序技术已广泛应用于奶牛乳腺炎的研究。所以可以利用转录组测序技术及生物信息学方法,通过分析感染前后脂肪酸组成的变化,挖掘脂肪酸代谢通路及相关候选基因,构建并解析基因调控网络,研究奶牛乳腺组织脂肪酸合成、代谢及乳腺自身免疫的调控机制,从而更好地解析金黄色葡萄球菌对乳腺脂肪代谢及其他物质合成的影响。
4结论
金黄色葡萄球菌感染会导致乳腺脂肪酸合成能力大幅下降,尤以sc-FA、mc-FA和SFA最为明显;奶牛乳腺有较强的抗应激及适应功能,感染一段时间后,各类脂肪酸的合成开始大幅提高。
参考文献:
[1]王玲,李宏胜,王正兵,等.规模化奶牛养殖区奶牛乳房炎的调查及病因分析[J].中国乳业,2010(10):50-53.
[2]SINGLA M,SHARMA A K,PARMAR O S,et al.Effect of bedding material of different depths on milk yield and udder health of cross bred cows during the winter months[J].Veterinary Practitioner,2007,8(1):73-77.
[3]尹荣兰,杨正涛,张艳静,等.金黄色葡萄球菌CIfA基因的克隆及在大肠杆菌中的表达[J].中国兽医学报,2009,29(2):150-152.
[4]CHANDLER R L.Experimental bacterial mastitis in the mouse[J].Journal of Medical Microbiology,1970,3(2):273-282.
[5]BRAMLEY A J,FOSTER R.Effects of lysostaphin onStaphylococcusaureusinfections of the mouse mammary gland[J].Research in Veterinary Science,1990,49(1):120-121.
[6]HU C M,GONG R,GUO A Z,et al.Protective effect of ligand-binding domain of fibronectin-binding protein on mastitis induced byStaphylococcusaureusin mice[J].Vaccine,2010,28(24):4038-4044.
[7]GUO M Y,ZHANG N S,LI D P,et al.Baicalin plays an anti-inflammatory role through reducing nuclear factor-κB and p38 phosphorylation inS.aureus-induced mastitis[J].International Immunopharmacology,2013,16(2):125-130.
[8]谢菲,韩旭东,高新志,等.金黄色葡萄球菌诱发小鼠乳腺炎模型的建立[J].现代农业科技,2008(21):18-19.
[9]杨天骄,孙英峰,沈国顺.小鼠模型在奶牛金黄色葡萄球菌乳房炎中的应用[J].中国畜牧兽医,2008,35(12):116-118.
[10]张宝君,崔京春,张献,等.金黄色葡萄球菌乳腺感染模型的建立与评价[J].中国预防兽医学报,2009,31(5):365-369.
[11]战永波,王纯洁,包金荣,等.蒙药对奶牛乳房炎中大肠杆菌和金黄色葡萄球菌的抑制作用[J].黑龙江畜牧兽医,2010(2):134-135.
[12]杨峰,王旭荣,田永刚,等.牛源金黄色葡萄球菌感染小鼠后药物敏感性变化及其诱导的氧化应激[J].动物医学进展,2013,34(12):46-50.
[13]袁峥嵘.金黄色葡萄球菌诱导奶牛实验性乳腺炎研究[D].博士学位论文.北京:中国农业科学院,2011.
[14]刘利,高雪,高会江,等.DNA甲基化在奶牛金黄色葡萄球菌性乳房炎中的调控[J].畜牧兽医学报,2012,43(10):1554-1558.
[15]崔新洁.金黄色葡萄球菌诱导牛乳腺上皮细胞凋亡及其信号通路的研究[D].硕士学位论文.呼和浩特:内蒙古大学,2013.
[16]农业部食品质量监督检验测试中心.GB/T 21676—2008乳与乳制品脂肪酸的测定气相色谱法[S].北京:中国标准出版社,2008.
[17]林秋萍,李瑾,冯书惠.气相色谱法快速测定牛奶中脂肪酸[J].食品科学,2005,26(8):346-348.
[18]李云龙,杨章平,常玲玲,等.气相色谱法检测牛奶中脂肪酸组分方法的改进[J].中国牛业科学,2012,38(3):18-21.
[19]HALASA T,NIELEN M,HUIRNE R B M,et al.Stochastic bio-economic model of bovine intramammary infection[J].Livestock Science,2009,124(1/2/3):295-305.
[20]MARÉChAl C L,THIÉRY R,VAUTOR E,et al.Mastitis impact on technological properties of milk and quality of milk products-a review[J].Dairy Science & Technology,2011,91(3):247-282.
[21]杨德英,曹随忠,余树民,等.奶牛隐性乳房炎对牛奶品质的影响[J].湖北农业科学,2009,48(1):132-134.
[22]常玲玲.中国荷斯坦牛乳中脂肪酸变化规律及其与脂肪酸合成相关基因的关联分析[D].硕士学位论文.扬州:扬州大学,2011.
[23]臧丽,李英俊,张乃生,等.奶牛乳腺的防御机制与乳腺炎病理学[J].动物医学进展,2006,27(11):33-37.
(责任编辑王智航)
Effects ofStaphylococcusaureus-Induced Mastitis on Milk Fatty Acid Composition of Chinese Holstein Cows
LI Rui1ZHANG Chenglong1GENG Xiaohan1LI Rui1PU Junhua1MAO Yongjiang1JI Dejun1YANG Zhangping1*WU Suhong2XU Xiangqian2LU Chunbing2REN Xianglian2
(1. Animal Science and Technology College, Yangzhou University, Yangzhou 225009, China;2. Animal Disease Prevention and Control Center, Jiangsu Province, Jiangyin 214400, China)
Abstract:The aim of this study was to explore the effects of Staphylococcus aureus (S. aureus)-induced mastitis on milk fatty acid composition and their absolute content of Chinese Holstein cows. The bacterial suspension of S. aureus was administered into the udder to establish a S. aureus-induced mastitis model in experimental group, and PBS was administered in control group. Fatty acid absolute contents in milk were determined by gas chromatography. The results showed as follows: thirty four fatty acids were detected in milk, and fatty acid synthesis at breast area was directly affected by S. aureus-induction. The fatty acids were divided into six categories by degree of saturation and carbon chain length, and compared with 24 h before infection, the absolute contents of short chain fatty acids (sc-FA), medium chain fatty acid (mc-FA) and saturated fatty acid (SFA) at 11 h after infection in experimental group were significantly lower (P<0.05); control group had the same changing tendency, but there were no significant differences (P>0.05) except sc-FA. At 23 h after infection, the absolute content of all six categories of fatty acids in experimental group lower than those in control group. The results indicate that the dynamics of fatty acids had the same trend. These results demonstrated that S. aureus-induced mastitis can affect the synthesis of cow fatty acids and lowered the absolute content of each component.[Chinese Journal of Animal Nutrition, 2016, 28(2):426-435]
Key words:Chinese Holstein cows; fatty acids; Staphylococcus aureus; mastitis
*Corresponding author, professor, E-mail: yzp@yzu.edu.cn
中图分类号:S823
文献标识码:A
文章编号:1006-267X(2016)02-0426-10
作者简介:李蕊(1984—),女,河南内乡人,硕士研究生,从事畜产品生产检测研究。E-mail: 1059784926@qq.com*通信作者:杨章平,教授,博士生导师,E-mail: yzp@yzu.edu.cn
基金项目:国家自然科学基金(31272407,31472067);江苏省农业三新工程项目(SXGC[2015]328)
收稿日期:2015-07-26
doi:10.3969/j.issn.1006-267x.2016.02.016

