基于UPC—Q/TOF—MS技术的果糖诱导高尿酸血症大鼠血清脂质代谢组学研究お
张淑丽 王怡萍 杜振霞 薛梦�┱沤开┞砣�

[摘要]利用脂质代谢组学技术,研究果糖诱导高尿酸血症大鼠与正常大鼠血清中脂类代谢物的变化,筛选出与高尿酸血症相关的潜在生物标记物。通过超高效合相色谱四极杆飞行时间质谱联用(UPC2Q/TOFMS)技术分析高尿酸血症大鼠(模型组)和正常大鼠(对照组)血清代谢谱图,采用多元统计分析方法比较2组的代谢谱差异,筛选出差异性代谢物。结果显示,模型组和对照组的代谢谱图存在明显差异,并筛选出11个差异代谢物,利用精确质量数结合二级质谱图初步确定了花生四烯酸、棕榈酸、油酸、亚油酸等8种潜在生物标记物。该文建立了基于UPC2Q/TOFMS技术进行果糖诱导高尿酸血症大鼠血清脂质代谢组学研究的方法,推测脂肪酸代谢异常可能与高尿酸血症的发病机制有关,为高尿酸血症的早期诊断和预防奠定科学基础。
[关键词]果糖;高尿酸血症;脂质代谢组学;生物标记物
近年来随着人们生活水平和饮食结构的改变,高尿酸血症及其相关疾病的发病率也急剧增加[1]。作为世界范围内一般人群中患病率较高的代谢性疾病,高尿酸血症在当前并未引起足够重视[2]。毒理病理学研究证实,脂代谢紊乱与代谢性疾病如糖尿病、肾病等具有相关性[34],例如,尿酸与血脂代谢紊乱之间存在密切关系[58]。脂质代谢组学(lipidomics)作为最重要的代谢组学分支,在脂质代谢疾病的预防和诊断,脂质生物标志物、药物靶点的鉴定以及药物研发等方面都取得了重要进展[910]。
高尿酸血症和痛风患病率的增加与含果糖饮料的消耗增加有关[1112]。动物实验研究也表明,与其他糖类不同,高果糖饮食可引起啮齿类动物血尿酸水平快速升高[1316],因此本实验采用文献造模方法[17]。本文应用建立的UPC2Q/TOFMS脂质代谢组学方法研究果糖诱导高尿酸血症大鼠血清代谢物的改变,确定其潜在的生物标记物,以期为高尿酸血症的早期诊断和预防提供依据。
1材料与方法
11仪器与试剂超高效合相色谱四极杆飞行时间质谱联用仪(UPC2Q/TOFMS,美国Waters公司);ACQUITY UPC2TM HSS C18 SB色谱柱(30 mm×100 mm,18 μm);低温高速离心机(GL21M,上海卢湘仪公司)。
D果糖(AMRESCO);血尿酸试剂盒(南京建成生物工程研究所,批号20150227);甲酸、醋酸铵、异丙醇(色谱纯,美国Thermo Fisher Scientific公司);氯仿、甲醇、乙腈均为分析纯;超纯水(MilliQ纯水机自制,美国Millipore公司)。
12动物分组与造模SD大鼠,雄性,体重(240±20) g,购自北京维通利华实验动物中心,动物合格证号SCXK(京)20120001。
SD雄性大鼠16只,适应性喂养5 d后,按质量随机分为对照组和模型组,每组8只,喂饲普通饲料,同时对照组饮去离子水,模型组饮10%果糖水。2组动物均自由饮食、饮水,饲料和水每天更换1次,并记录饮水量。造模期间,每7 d尾静脉取血一次,连续21 d。
13生化学检查取静脉血1 mL,按尿酸试剂盒说明书操作。
14样本的预处理与UPC2Q/TOFMS分析条件静脉血3 mL,于4 ℃下4 000 r·min-1离心15 min,取上清液放入-20 ℃冰箱待用。取80 μL血清加入15 mL EP管中,加入320 μL氯仿甲醇(3∶1)涡旋2次,每次15 s,10 000 r·min-1常温离心10 min,取上清液10 μL注入液质联用仪进行分析。
色谱条件:ACQUITY UPC2TM HSS C18 SB色谱柱(30 mm×100 mm,18 μm);流动相A为CO2,流动相B为02%甲酸[异丙醇甲醇(6∶1)溶液],梯度洗脱,0~05 min,99%A,05~9 min,99%~60%A,9~10 min,60%A,10~11 min,60%~99%A,11~13 min,99%A,流速15 mL·min-1;柱温40 ℃。
质谱条件:采用Xevo G2S QTOFMS质谱系统,扫描范围m/z 50~1 200,离子化模式电喷雾电离(ESI),采用负离子V模式检测,毛细管电压2 500 V,离子源温度120 ℃,雾化气温度450 ℃,锥孔气流速50 L·h-1。
15数据处理利用Markerlynx V 41软件对原始数据进行校正和归一化处理,应用SIMCAP 1303软件(Umctrics Sweden)对样品进行分组和(正交)偏最小二乘法判别分析(OPLSDA)。分析结果以二维和三维得分图和Splot图表示。以VIP>1的成分作为对模型具有明显值贡献的标记物。组间比较采用t检验,筛选P<005的数据得到有意义的变量。
2结果
21生化指标造模第7天时,2组血清尿酸值开始出现明显差异(P<001)。造模14,21 d后的2组血清尿酸值保持明显差异(P<005),说明在实验期间模型稳定,选择造模7 d的数据进行脂质代谢组学分析,结果见表1。
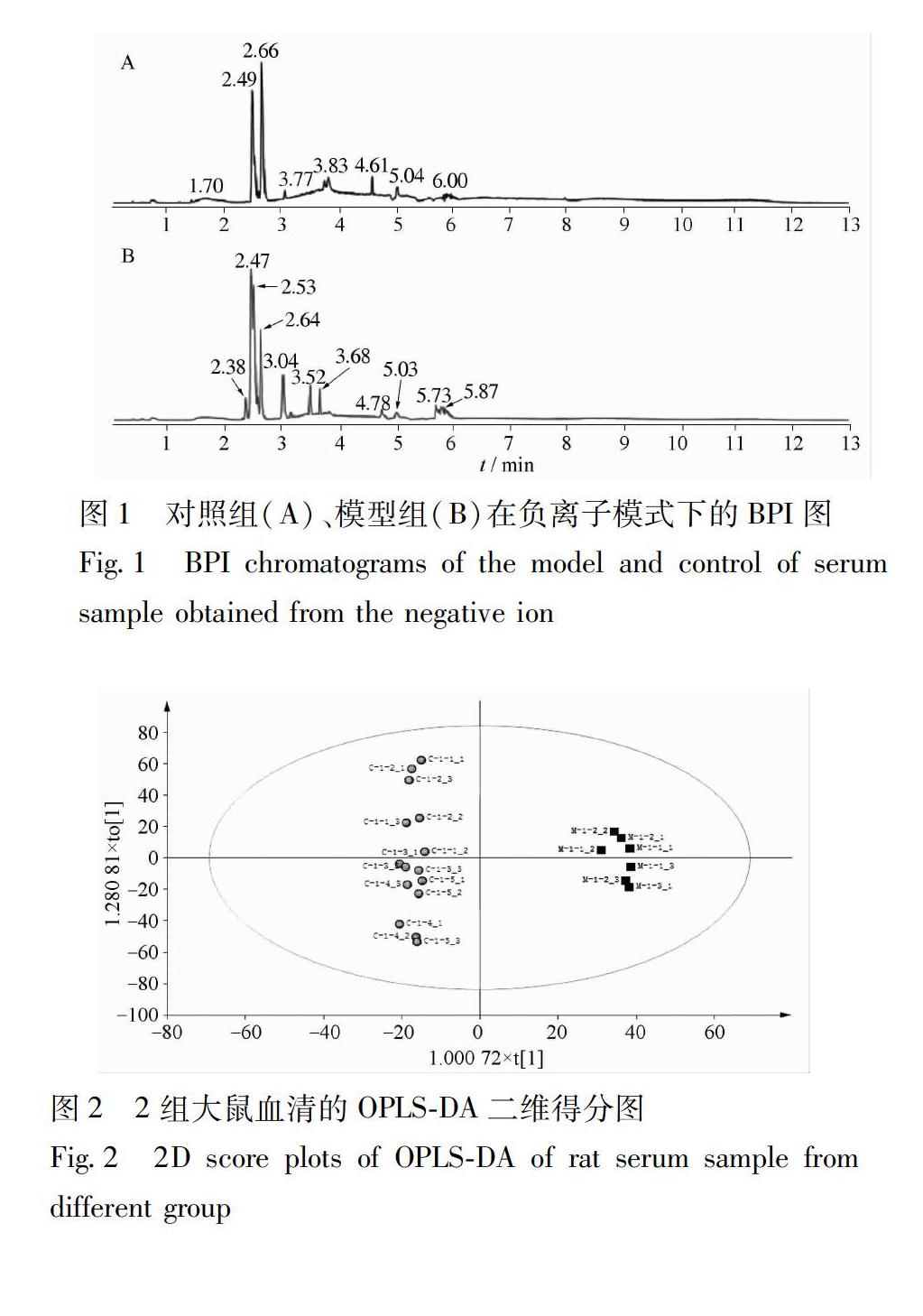
22血清样品的LCMS分析利用ESI负离子模式分别采集对照组和模型组大鼠血清样本数据,得到血清样本的BPI图,见图1。所有代谢物在13 min内就能得到很好的分离,且2组的轮廓明显不同。为保证数据的可靠性,在数据采集过程中,每间隔6个样品,使用质控样品进样1次,以监测采集系统的稳定性。
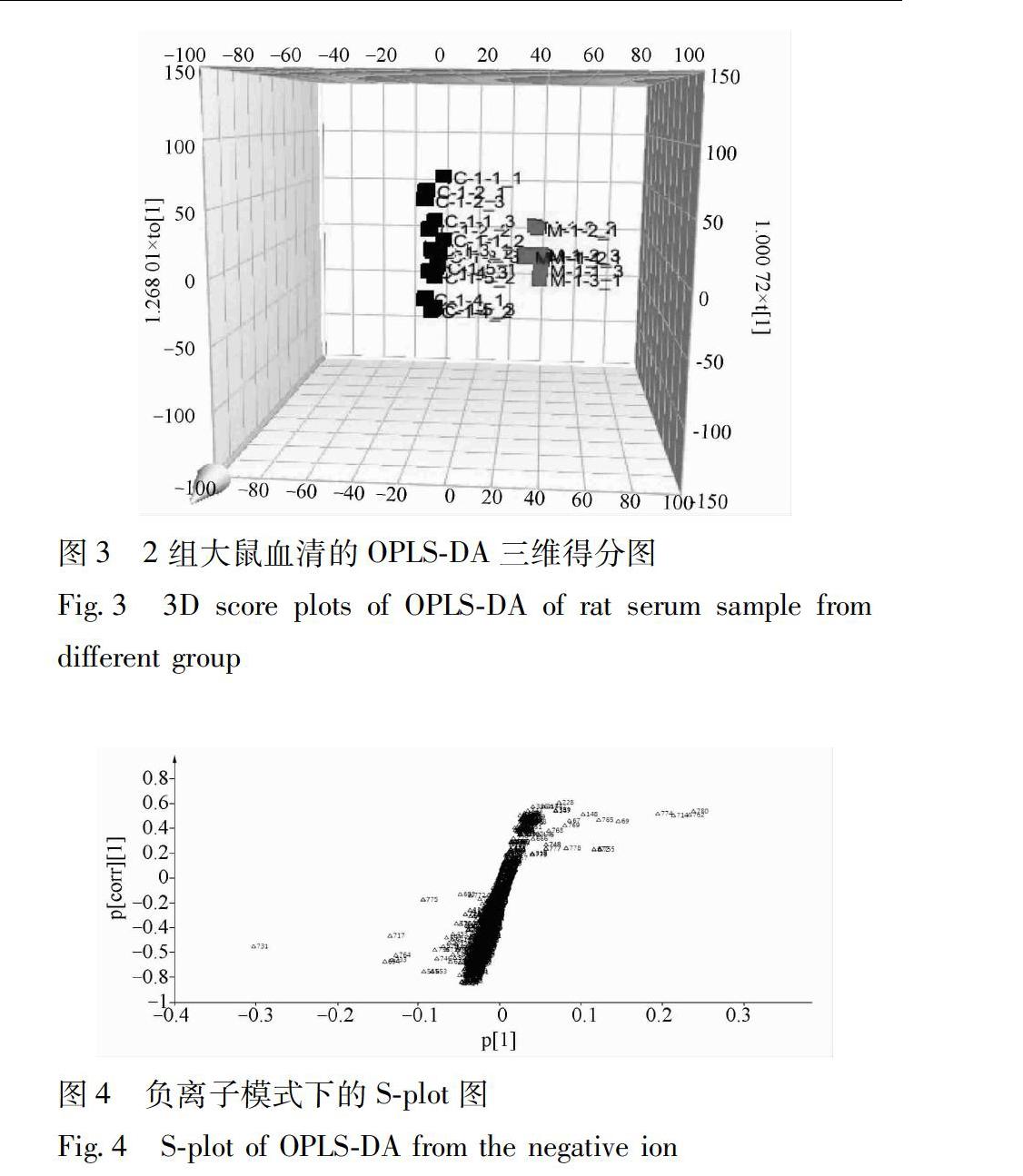
23数据分析采用OPLSDA对Markerlynx导出的数据进行分型,结果见图2,3。各组血清数据分析的Splot图见图4,模型组与对照组分离明显,S型曲线两端的数据对分别代表每个样本组可信度最高的特征离子,即潜在生物标记物。
24生物标记物的发现与鉴定经OPLSDA分析,选取VIP>1的差异变量,采用t检验对筛选的差异变量在对照组与模型组进行验证,只有P<005的变量可作为与高尿酸血症大鼠相关的潜在生物标记物,参照有关文献并根据一级、二级质谱信息,利用HMDB(http://wwwhmdbca/)和LIPID MAPS(http://wwwlipidmapsorg/)等数据库,以m/z 303277 4的离子为例,使用精确相对分子质量数据检索,再通过ESI负模式下的二级碎裂方式推测代谢物结构,碎裂方式为:m/z 303277 4 [M-H]-,25956[M-CH2O3-H]-,5893[C2H3O2]-,见图5。通过LIPID MAPS数据库MS/MS谱图和花生四烯酸对照品对比,m/z 303277 4的离子被鉴定为花生四烯酸,其他10种代谢物使用类似方法鉴别,见表 2。
3讨论与结论
UPC2Q/TOFMS技术在分离能力、分析时间及灵敏度方面较常规液质联用(LCMS)有很大优势,分析鉴定能力强,可实现快速分离,能获得包含更多数目的代谢谱图[18]。其无需对脂质样品进行衍生化处理[19],直接有机相溶解后进样分析,简化了工作流程,同时可快速解析出脂质的结构,因此本实验选择UPC2QTOF/MS的脂质代谢组学技术。
本实验发现脂肪酸FA(C16∶1),FA(C16∶0),FA(C18∶1)含量模型组高于对照组,FA(C20∶4),FA(C24∶0),FA(C24∶1)含量低于对照组。
脂肪酸的合成与利用,加速ATP的分解,使HUA生成增加,从而产生高尿酸血症[20]。饱和脂肪酸摄入过多是导致高胰岛素血症的危险因素[21],尤其是棕榈酸(C16∶0)[6]。另外不饱和脂肪酸花生四烯酸、类花生酸类物质、脂质过氧化物的快速产生和蓄积,而花生四烯酸是体内白三烯生物合成的前体物质,白三烯与许多炎症有关,包括痛风[22]。有研究表明血清脂肪酸在反映机体脂代谢方面比TG,TC敏感,在单纯高尿酸血症阶段,需注意检测血清脂肪酸浓度的变化,尽早纠正血清脂肪酸及脂代谢紊乱,避免动脉粥样硬化的发生[23]。本实验结果表明脂肪酸代谢异常可能与高尿酸血症的发病机制有关,从脂质代谢组学角度为高尿酸血症与代谢综合征的相关性提供了依据。
本研究应用UPC2Q/TOFMS的脂质代谢组学方法分析果糖诱导高尿酸血症大鼠与正常大鼠血清的脂类代谢物变化,并对其进行多元统计分析,发现高尿酸血症大鼠模型血清中脂肪酸类成分发生变化。该方法无需对样品进行衍生化处理,工作流程简化,达到快速区分高尿酸血症大鼠和对照组大鼠的目的,并发现了部分潜在生物标记物,为从代谢通路的角度阐述其发病机制及高尿酸血症的早期诊断和预防奠定了基础。
[参考文献]
[1]苗志敏, 李长贵 高尿酸血症防治中应关注的几个关键问题[J] 中华内分泌代谢杂志,2011,27(7):543
[2]Goncalves J P, Oliveira A, Severo M, et al Crosssectional and longitudinal associations between serum uric acid and metabolic syndrome[J] Endocrine, 2012, 41(3): 450
[3]Nicholson J K, Connelly J, Lindon J C, et al Metabonomics: a platform for studying drug toxicity and gene function[J] Nat Rev Drug Discov, 2002, 2: 153
[4]Fernandis A Z, Wenk M R, Chromatogr J, et al Targeting lipid metabolism to starve and stop cancer cells[J] Eur J Lipid Sci Technol, 2009, 877: 905
[5]Fiehn O Combining genomics, metabolome analysis, and biochemical modeling to understand metabolic networks[J] Comp Funct Genom, 2001, 2(3): 155
[6]马文峰, 马志刚, 王万山, 等 基于液相色谱质谱技术的高尿酸血症血浆代谢组学研究[J] 重庆医学, 2013(2): 176
[7]杨倩春 中老年人群高尿酸血症及常见体质类型的代谢组学特征[D] 广州:广州中医药大学, 2013
[8]徐冬娥 高尿酸血症和血脂紊乱对代谢综合征的影响[J]东南国防医药, 2006, 8(3): 194
[9]陆姝欢, 杨松, 元英进 脂质组学在医药研究中的应用[J] 细胞生物学, 2007, 29(2): 169
[10]Han A, Gross R W Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J] J Lipid Res, 2003, 44(6): 1071
[11]Choi H K, Mount D B, Reginatio A M, et al Pathogenesis of gout[J] Ann Intern Med, 2005, 143: 499
[12]Choi J W, Ford E S, Gao X, et al Sugarsweetened soft drinks, diet soft drinks, and serum uric acid level, the third national health and nutrition examination survey[J] Arthritis Rheum, 2008, 59(1): 109
[13]Nakagawa T, Tuttle K R, Short R A, et al Hypothesis: fructoseincluded hyperuricemia as a causal mechanism for the epidemic of the metabolic syndrome[J] Nat Clin Pract Nephrol, 2005, 1: 80
[14]Tappy L, Le K A Metabolic effects of fructose and the worldwide increase in obesity[J] Physiol Rev, 2010, 90(1): 23
[15]PerezPozo S E, Schold J, Nakagawa T, et al Excessive fructose intake induces the features of metabolic syndrome in healthy adult men: role of uric acid in the hypertensive response[J] Int J Obes, 2010, 34(3): 454
[16]Nakagawa T, Hu H, Zharikov S, et al A causal role for uric acid in fructoseinduced metabolic syndrome[J] Am J Physiol Renal Physiol, 2006, 290(3): 625
[17]Machmound M F, EiNagar M, EiBassossy H M Antiinflammatory effect of atorvastatin on vascular reactivity and insulin resistance in fructose fed rats[J] Arch Pharm Res, 2012, 35(1): 155
[18]徐永威,黄静,孙庆龙,等 超高效合相色谱技术在中药研究和质量控制中的应用[J] 世界科学技术——中医药现代化, 2014, 16(3): 534
[19]Rao G V N, Gnanadev G, Belllam R, et al Supercritical fluid(carbon dioxide) based ultra performance convergence chromatography for the separation and determination of fulvestrant diastereomers[J] Anal Methods, 2013, 18(5): 4832
[20]陈灏珠,林果 实用内科学[M] 北京:人民卫生出版社, 2009: 2766
[21]Dandona P, Aljada A, Bandyopadhyay A Inflammation: the link between insulin resistence, obesity and diabetes[J] Trends Immunol, 2004, 25(1): 47
[22]He H, Ren X, Wang X, et al Therapeutic effect of Yunnan Baiyao on rheumatoid arthritis was partially due to regulating arachidonic acid metabolism in osteoblasts[J] J Pharm Biomed Anal, 2012, 59: 30
[23]袁鹰,王正春,王秀美 血清游离脂肪酸对高尿酸血症代谢的影响[J] 山东医药, 2006, 46(31): 53
[责任编辑曹阳阳]

