酶法辅助提取茶多酚的工艺研究
徐婕,汤韧,吉树臣,姜淑妍,徐楠楠(长春市农业学校,吉林长春130022)
酶法辅助提取茶多酚的工艺研究
徐婕,汤韧,吉树臣,姜淑妍,徐楠楠
(长春市农业学校,吉林长春130022)
摘要:以湖北通城县茶叶产区的绿茶为原料,研究纤维素酶和果胶酶复合辅助提取茶多酚的最佳工艺参数。通过单因素试验和正交试验分析酶用量、浸提时间、浸提温度和pH对茶多酚提取率的影响,进而对茶多酚提取的工艺条件进行优化设计。结果表明:pH和纤维素酶用量对茶多酚提取率影响显著,优化后的提取工艺条件为纤维素酶用量200U/mL、果胶酶用量300U/mL、浸提时间50min、浸提温度为40℃、pH5.0,此最佳条件下的茶多酚提取率为23.54%,DPPH自由基清除率达30%,显示出优异的抗氧化性能。
关键词:茶多酚;酶辅助;工艺参数;提取率;活性
茶多酚(tea-polyphenols,简写TP)是一类由黄烷醇类物质、花色素、酚酸及其缩酚酸等组成的复合物,约占茶叶干重的15 %~30 %[1],主要存在于茶叶细胞液泡中。茶多酚在常温下为浅黄色无定形粉末,有较强的极性和一定的亲水性。溶液显弱酸性,对热和酸较稳定,在碱性介质中易氧化褐变。茶多酚是茶叶中主要的药理成分,是一种理想的天然食品抗氧化剂,其抗氧活性高于一般非酚性或单酚羟基类抗氧剂。大量研究表明,茶多酚具有高效消除体内自由基、抗衰老、防癌抗癌、预防心血管疾病、抗菌消炎、防辐射、除臭等多种生物功能,在食品、医药等各领域都有广阔的应用前景和开发价值[2]。
目前,茶多酚的提取工艺主要分为有机溶剂萃取法、金属离子沉淀法、膜分离法、超临界CO2萃取法、树脂吸附分离法。但上述方法都存在着不足:有机溶剂萃取法提取茶多酚的工序繁琐,蒸馏浓缩时间较长,茶多酚用热水浸提后更容易被氧化,使其生物活性降低;金属离子沉淀法中使用的偏碱性金属离子和调节酸碱度的操作都会降低部分酚类物质的活性[3];膜分离法以选择性透过膜为分离介质,不采用有机溶剂和加热处理,故得到的茶多酚活性较高,但成本太高,难以普及[4];超临界CO2萃取法操作温度低,保证了被提取物不被破坏,产品纯度较高,但因茶多酚提取率过低,难以实现工业化生产[5]。近年来,国外研究者将酶法引入植物组分中有效成分的提取。果胶酶和鞣酸酶配合使用提取苹果皮中的酚类物质[6]、用果胶酶提取橄榄中的橄榄油[7]及对红茶提取物进行酶处理[8]等研究结果表明,酶法可在不同程度上提高有效成分的提取率,证明了酶法辅助提取的可行性。
本试验采用酶法辅助提取茶叶中茶多酚,通过正交设计优化茶多酚提取的工艺参数,为酶法辅助提取茶多酚的试验研究和工业化生产提供理论参考。
1 材料与方法
1.1材料
绿茶叶采自湖北通城县茶叶产区,经通风干燥后采用植物粉碎机粉碎,并用100目标准筛筛分,筛分后的茶粉保存于棕色干燥瓶中,作为提取茶多酚的原料。
1.2仪器
FW177型植物粉碎机:天津市泰斯特仪器有限公司;PH070A型电热鼓风干燥箱:上海一恒科学仪器有限公司;PB-10标准型电化学分析仪:德国Sartorius集团;TU-1810型紫外-可见分光光度计:北京普析通用仪器有限公司。
1.3试剂
纤维素酶、果胶酶:活力均大于15 000 U/g,产自西陇化工股份有限公司;双重蒸馏水、甲醇水溶液(体积比7:3)、10 mmol/L的HCl;碳酸钠、氢氧化钠、无水乙醇、福林酚试剂、1,1-二苯基-2-三硝基苯肼(DPPH)标准品、邻苯三酚、三羟甲基-氨基甲烷(TRIS):均为分析纯。以上试剂均采购自长春市宏宇化工有限公司,生产厂家为北京北化精细化学品有限责任公司、国药集团试剂有限公司。
1.4方法
1.4.1茶多酚的提取
分别采用纤维素酶、果胶酶单独作用和二者复合作用的方法提取茶多酚。首先,对各种反应条件进行优化,然后分别在最佳条件下进行提取,提取过程完成后,将提取物真空抽滤,得茶多酚浸提液,取样测定茶多酚含量。
1.4.2茶多酚提取率的测定
TP的测定按GB/T 8313-2008《茶叶中茶多酚和儿茶素类含量的检测方法》进行[9]。其原理是福林酚试剂氧化茶多酚中-OH基团并显蓝色。
用移液管分别移取没食子酸工作液、双重蒸馏水(作空白对照)及测试液各1.0 mL于刻度试管内,在每个试管内分别加入5.0 mL的福林酚试剂,摇匀。反应3min~8min内,加入4.0 mL 7.5 % Na2CO3溶液,加双重蒸馏水定容至刻度,摇匀,室温下放置60min。用10 mm比色杯,以试剂空白溶液做参比,用紫外-可见分光光度计在波长765 nm处测定吸光度,茶多酚的提取率按式(1)计算。
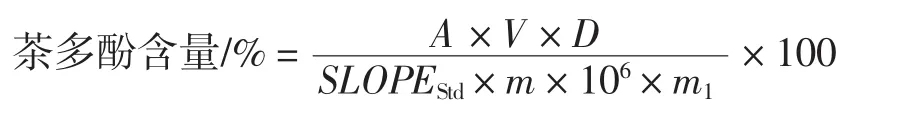
式中:A为样品测试液吸光度;V为样品提取液体积,10 mL;d为稀释因子(通常为1 mL稀释成100 mL,其稀释因子为100);SLOPEStd为没食子酸标准曲线的斜率;m为样品干物质含量,%;m1为样品质量,g。
1.4.3抗氧化性能评价
将1.4.1中得到的茶多酚浸提液在旋转蒸发器上65℃进行真空浓缩,浓缩的样品置于电热鼓风干燥箱50℃烘干至恒重,得到茶多酚粗品,通过测定其对DPPH自由基的清除率,评价其抗氧化性能。
配制质量浓度为2 mg/mL茶多酚待测液。称取10.3 mg DPPH自由基,用无水乙醇定容至250 mL,溶液浓度为0.1 mmoL/L,将其盛于棕色容量瓶中,置于暗处保存。分别取0.2、0.4、0.6、0.8、1.0 mL待测液,加入2 mL DPPH溶液,用无水乙醇将体系均补至4 mL,摇匀,室温放置30min后,以无水乙醇作为参比,测定各体系在517 nm波长处的吸光度Ai;将样品用等体积水代替,即体系中仅含DPPH和无水乙醇,其他同前,测定吸光度Ac。另将DPPH溶液用等体积水代替,即体系中仅含样品和无水乙醇,其他同前,测定吸光度Aj。DPPH自由基的清除率可利用下式(2)进行计算。

式中,K为清除率;Ai为加试样反应后DPPH溶液的吸光度;Aj为不加DPPH,只加试样溶液的吸光度;Ac为不加试样,只加DPPH溶液的吸光度。
2 结果与分析
2.1影响茶多酚提取的单因素试验
2.1.1酶用量对茶多酚提取率的影响
茶多酚提取实质上是茶多酚从茶叶细胞内扩散到溶剂中的非稳态非平衡传质过程。整个过程大致分为3个阶段:溶剂向茶叶内部的渗透和浸润;茶叶内部溶质的溶解;溶质从茶叶内部向周围溶液的扩散。而酶的作用在于使茶叶细胞壁软化、膨胀和崩溃,即破壁,因此,酶用量是酶法辅助提取茶多酚首要考虑的参数。
精确称取1.000 0 g茶粉共5份,以蒸馏水为溶剂,用柠檬酸-柠檬酸钠缓冲液调节提取体系的pH为5.0,按液固比为20:1(mL/g)加入锥形瓶中,分别加入纤维素酶和果胶酶0、100、200、300、400U/mL,在40℃恒温水浴锅中浸提50min,在转速3 500r/min的离心机中离心10min,取上清液,同1.4.2的操作,测得提取出的茶多酚的含量,比较不同酶用量对茶多酚提取率的影响,得到最佳酶用量,试验结果见图1和图2。
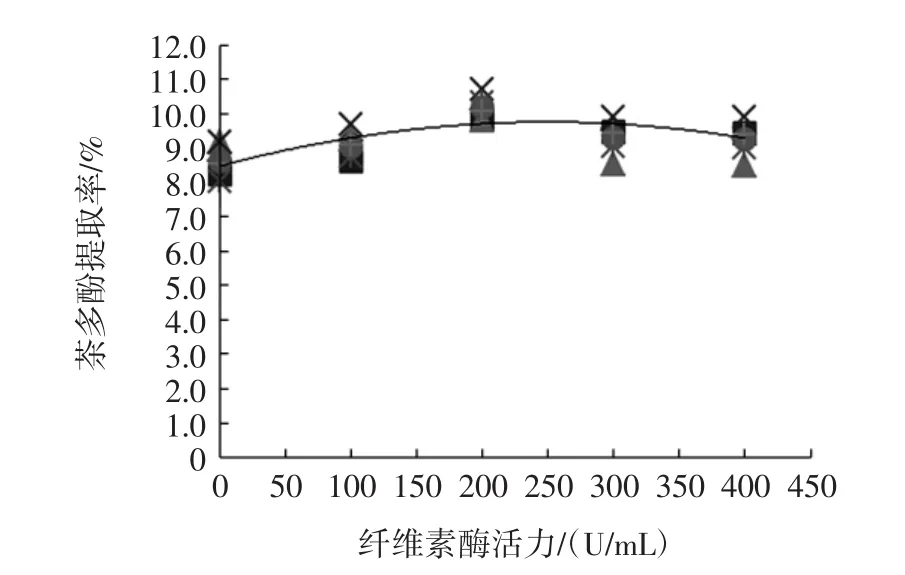
图1 纤维素酶用量对茶多酚提取率的影响Fig.1 Effect of cellulase dosage on TP extraction efficiency

图2 果胶酶用量对茶多酚提取率的影响Fig.2 Effect of pectinase dosage on TP extraction efficiency
从图1和图2可以看出,在试验条件下,纤维素酶和果胶酶的最佳用量分别在200U/mL和300U/mL。随着纤维素酶和果胶酶用量的增加,茶多酚提取率迅速增大,分别在200U/mL和300U/mL时达到最大值,继续增加纤维素酶和果胶酶的用量,茶多酚的提取率增长缓慢并趋向稳定。这是因为,一方面,作为固体底物的茶粉在溶液中不能充分扩散,在较低的酶浓度下,酶尚可与底物较充分地结合,随着酶浓度的升高,底物浓度对酶达到饱和,由于酶与底物的接触面积受限,酶的作用受到抑制,进而影响了茶多酚的提取率。另一方面,虽然适量的酶可以通过破壁改变细胞壁的通透性,使得细胞壁破裂增加有效成分的溶出,提高茶多酚的提取率,但是茶多酚的分子可以与蛋白质和氨基酸发生很强的络合反应[10],而酶是具有催化活性的蛋白质,当酶过量时就会与茶多酚络合,最终影响茶多酚的提取率。因此,酶用量并非越大越好。
2.1.2浸提时间对茶多酚提取率的影响
精确称取1.000 0 g茶粉5份,以蒸馏水为溶剂,用柠檬酸-柠檬酸钠缓冲液调节提取体系的pH为5.0,按液固比为20:1(mL/g)加入锥形瓶中,在40℃恒温水浴锅中分别浸提35、50、65、80、95min,在转速3 500r/min的离心机中离心10min,取上清液,同1.4.2的操作,测定茶多酚提取量,比较不同浸提时间对茶多酚提取率的影响,得到最佳浸提时间,结果见图3。

图3 浸提时间对茶多酚提取率的影响Fig.3 Effect of extraction time on TP extraction efficiency
从图3可以看出,在试验条件下,最佳浸提时间为80min。随着浸提时间的增加,茶多酚提取率逐渐增大,在80min时达到最大值,之后茶多酚的提取率基本维持稳定。这是因为于随着酶解浸提时间的延长,茶叶细胞壁及细胞间层的纤维素和果胶质形成的阻挡层已被有效破解,茶多酚大多已从细胞内扩散到溶液中,细胞内外的茶多酚浓度已达到了一种动态平衡,继续延长提取时间对提高溶液中茶多酚浓度作用有限。
2.1.3浸提温度对茶多酚提取率的影响
精确称取1.000 0 g茶粉共5份,以蒸馏水为溶剂,用柠檬酸-柠檬酸钠缓冲液调节提取体系的pH为5.0,按液固比为20:1(mL/g)加入锥形瓶中,分别在30,40、50、60、70℃下浸泡50min,在转速3500r/min的离心机中离心10min,取上清液,同1.4.2的操作,测得提取出的茶多酚的含量,比较不同浸提温度对茶多酚提取率的影响,得到最佳浸提温度,结果见图4。
从图4可以看出,在试验条件下,最佳浸提温度在40℃。随着浸提温度的增加,茶多酚提取率逐渐增大,在40℃时达到最大值,随着浸提温度的继续增加,茶多酚的提取率反而下降。这是因为茶多酚提取需要适宜的酶解温度,在达到最适温度前,随着温度增加,酶活力逐渐增强,一旦超过最适温度,酶活力开始下降,继续增加温度,会使酶结构遭到破坏,进而导致酶变性失活,彻底失去催化活性。

图4 浸提温度对茶多酚提取率的影响Fig.4 Effect of extraction temperature on TP extraction efficiency
2.1.4pH对茶多酚提取率的影响
精确称取1.000 0 g茶粉共5份,以蒸馏水为溶剂,按液固比为20∶1(mL/g)加入锥形瓶中,分别调节pH至4.6、4.8、5.0、5.2、5.4,在40℃恒温水浴锅中浸提50min,在转速3 500r/min的离心机中离心10min,取上清液,同1.4.2的操作,测得提取出的茶多酚的含量,比较不同pH对茶多酚提取率的影响,得到最佳pH,结果见图5。

图5 pH对茶多酚提取率的影响Fig.5 Effect of pH on TP extraction efficiency
从图5可以看出,在试验条件下,最佳pH为4.8。随着pH逐渐增加到4.8,茶多酚提取率逐渐增大至最大值,继续增大pH,茶多酚的提取率开始下降。这是因为与浸提温度对酶活性的影响类似,酶的活性也受溶液pH影响。在最适pH时,酶具有最大的催化活力;当偏离最适pH时,酶的活性中心或与之有关的基团发生变化,进而影响酶的活力;在严重偏离最适pH时,酶蛋白可能会因自身结构变性而失去活力。
2.2正交试验优化茶多酚提取工艺
2.2.1正交试验设计
按照上述提取工艺,在多次单因素试验基础上,选择酶用量、浸提时间、浸提温度、pH为研究对象,按照L16(45)进行五因素四水平的正交试验,对茶多酚提取的工艺参数进行优化。试验结果如表1所示。
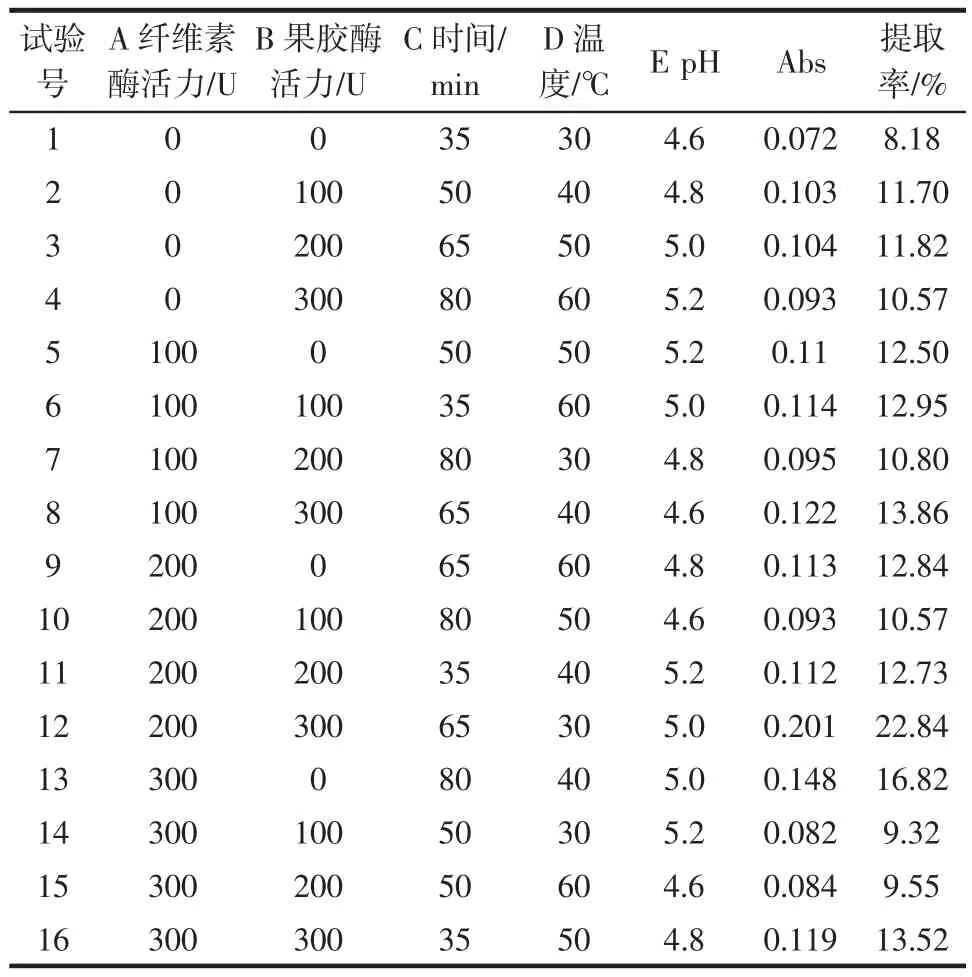
表1 正交试验结果Table 1 Result of orthogonal experiment
2.2.2极差分析
在正交试验中,以茶多酚的提取率为考察指标,对试验结果进行极差分析,分析结果见表2。通过极差分析得到,pH对茶多酚的提取率影响最大,纤维素酶用量次之,果胶酶用量再次之,然后是浸提时间,浸提温度对茶多酚的提取率影响最小,最优组合为A3B4C2D2E3,即纤维素酶用量为200U/mL、果胶酶用量300U/mL、浸提时间50min、浸提温度为40℃、pH 5.0。
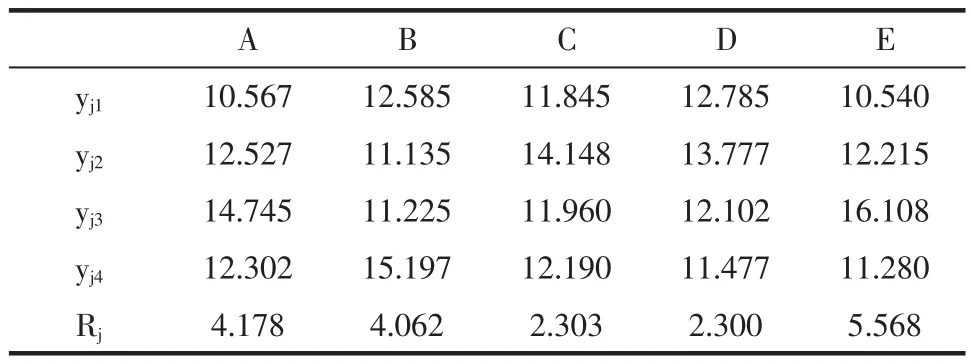
表2 极差分析表Table 2 Range analysis table
2.2.3方差分析
为证实试验数据可行有效,对试验结果进行方差分析,分析结果见表3。
由方差分析表可知,在试验条件下,pH和果胶酶用量是影响茶多酚提取率的显著性因素。根据此优化的条件,精确称取1.000 0 g茶粉,以蒸馏水为溶剂,用柠檬酸-柠檬酸钠缓冲液调节提取体系的pH为5.0,按液固比为20:1(mL/g)加入锥形瓶中,加入酶活力分别为200U/mL和300U/mL的纤维素酶和果胶酶,在温度为40℃的恒温水浴锅中反应50min,然后在转速为3 500r/min的离心机中离心10min,取上清液,同1.4.2的操作,测得提取出的茶多酚的提取率。通过3次重复试验,得到茶多酚的提取率为23.54 %,由此,验证了正交试验所得结果的可靠性。

表3 方差分析表Table 3 Analysis of variance table
2.3茶多酚活性测定试验
儿茶素是茶多酚的主要成分,其结构中的酚性羟基有较强的供氢能力,极易捕获过氧基团,表现出极强的自由基清除能力[11]。DPPH·是一种稳定的有机自由基,通过检测茶多酚对DPPH自由基的清除能力可以表示其抗氧化性的强弱。按照1.4.2操作,用提取后茶多酚对DPPH自由基清除率来表征茶多酚活性的高低,试验结果见表4显示。

表4 茶多酚对DDPH自由基清除率Table 4 TPs on DPPH radical scavenging rate
茶多酚对DPPH自由基清除作用随时间的变化情况见图6。

图6 茶多酚对DPPH自由基清除率随时间的变化Fig.6 TPs on DPPH radical scavenging rate changes over time
由图6可以看出,在试验条件范围内,随着处理时间的延长,提取液对DPPH自由基的清除率呈明显上升趋势,浸提的新鲜样液在45min后,抗自由基活性趋于稳定,DPPH自由基清除率可达30 %,显示了茶多酚较高的抗氧化和清除自由基能力。
3 讨论
1)纤维素酶和果胶酶复合辅助提取茶多酚的最佳工艺条件:对于1.0000g茶粉,纤维素酶活力200U/mL,果胶酶活力300U/mL,浸提时间50min,浸提温度40℃,pH 5.0。
2)正交试验结果的极差分析表明,5个因素对茶多酚提取率的影响顺序为:pH>纤维素酶用量>果胶酶用量>浸提时间>浸提温度。方差分析结果表明,5个因素中pH和果胶酶用量为影响茶多酚提取率的显著性因素。
3)在试验条件下,采用纤维素酶和果胶酶复合辅助提取茶多酚的最大提取率可达22.84 %,高于传统温水浸提取至少10个百分点,并且茶多酚活性测定的试验结果显示,茶多酚在提取后的1 h内DPPH自由基清除率高达30 %,表现出优异的抗氧化性能。
4)此外,酶法可在常压、较低温度条件下破碎茶叶细胞细胞壁,反应温和,易操控,因此在解决茶叶原料粉碎、缩短提取时间、降低能耗等方面也具有一定优势。
参考文献:
[1]赵大洲,石蓓梅,叶主虹.茶多酚水提与醇提的比较研究[J].食品研究与开发,2007,28(8):69-71
[2]朱德文,岳鹏翔,袁弟顺,等.超声波辅助浸提茶鲜叶中茶多酚的工艺研究[J].中国农机化,2011(1):112-115,126
[3]胥佰涛,徐平,沈生荣.茶多酚提取方法研究进展[J].茶叶, 2007,33(3):143-146
[4]肖文军,刘仲华,龚志华.茶叶深加工中膜法浓缩技术研究[J].膜科学与技术,2006,26(1):55-60
[5]张东明,酚酸化学[M].北京:化学工业出版社,2009:303-304
[6] Manuel P,Beatriz Z,Anne S M.Selective release of phenols from apple skin:Mass transfer kinetics during solvent and enzyme-assisted extraction[J].Separation and Purification Technology,2008,63:620-627
[7] Najafian L,Ghodsvali A,Haddad Khodaparast M H,et al.Aqueous extraction of virgin olive oil using industrial enzymes[J].Food Research International,2009,42:171-175
[8] Chandini S K,Jaganmohan Rao L,Gowthaman M K,et al.Enzymatic treatment to improve the quality of black tea extracts[J].Food Chemistry, 2011,127:1039-1045
[9]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 8313—2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008
[10]杨贤强,王岳飞,陈留记.茶多酚化学[M].上海:上海科学技术出版社,2003:42-52
[11]张正竹.茶叶生物化学实验教程[M].北京:中国农业出版社, 2009:139-140
Research of the Extraction Processing of Tea Polyphenols
XU Jie,TANG Ren,JI Shu-chen,JIANG Shu-yan,XU Nan-nan
(Changchun Agricultural School,Changchun 130022,Jilin,China)
Abstract:The green tea,obtained from tea-producing areas of the Tongcheng County of Hubei Province,was chosen as raw material.The optimum conditions were carefully studied in the process of assisted extraction of tea polyphenols from mixture of cellulose and pectinase.The impact of enzyme concentration,extraction time,extraction temperature and pH on tea polyphenols extraction rate was analyzed by single factor and orthogonal experiments,which was used to optimize the design of tea polyphenols extraction process conditions.The results showed that pH and cellulose significant could huge impact on the extraction of tea polyphenols.The optimal extraction conditions were cellulose 200U/mL,the pectinase 300U/mL,extraction time 50min,extraction temperature 40℃,pH 5.0.The polyphenols extracted under optimum conditions was 23.54 % and the DPPH free radical clearance rate was 30 %,which showed excellent antioxidant properties.
Key words:tea polyphenols;enzyme-assisted;process parameters;extraction rate;activity
DOI:10.3969/j.issn.1005-6521.2016.05.021
作者简介:徐婕(1987—),女(满),助理讲师,在读硕士,主要从事食品卫生及安全方面的研究。
收稿日期:2014-12-10

