hTERT反义寡聚核苷酸对子宫内膜癌细胞Bcl-2蛋白含量的影响
杨蓉娟 宋春红 许艳蕾 刘雪芹 李红萍
050011 河北省石家庄市第四医院
·论著·
hTERT反义寡聚核苷酸对子宫内膜癌细胞Bcl-2蛋白含量的影响
杨蓉娟宋春红许艳蕾刘雪芹李红萍
050011河北省石家庄市第四医院
【摘要】目的观察人端粒酶逆转录酶反义寡聚脱氧核苷酸对子宫内膜癌Ishikawa细胞株Bcl-2蛋白表达含量的影响。方法将2.5 μmol/L、5 μmol/L及10 μmol/L人端粒酶逆转录酶反义寡聚脱氧核苷酸与Ishikawa细胞株共同培养,于24、48、72 h采用MTT法检测细胞增殖,于48 h使用流式细胞仪检测细胞凋亡和Bcl-2蛋白表达。结果人端粒酶逆转录酶反义寡聚脱氧核苷酸呈时间和剂量依赖性抑制Ishikawa细胞增殖,并可呈剂量依赖性诱导Ishikawa细胞凋亡、降低Bcl-2蛋白表达量。结论人端粒酶逆转录酶反义寡聚脱氧核苷酸可以诱导Ishikawa细胞凋亡、抑制肿瘤细胞增殖,该作用与降低Bcl-2蛋白表达量有关。
【关键词】子宫内膜肿瘤;人端粒酶逆转录酶;反义寡聚脱氧核苷酸;Bcl-2
子宫内膜癌占女性生殖系统恶性肿瘤的20%~30%,85%以上子宫内膜癌端粒酶阳性[1]。人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)是端粒酶的核心组成部分,是其催化亚单位和激活限速因子。设计互补于hTERT的反义寡聚脱氧核苷酸(antisense oligodeoxynucleotide,ASODN)可抑制端粒酶合成端粒,从而使细胞退出细胞增殖周期、诱导细胞凋亡。Bcl-2蛋白是调控细胞凋亡的重要基因之一,参与了子宫内膜癌的发生、发展或演变[2]。本实验观察hTERT ASODN对子宫内膜癌Ishikawa细胞株Bcl-2蛋白表达含量的影响。
1材料与方法
1.1hTERT ASODN的设计合成针对hTERT的mRNA序列,由起始密码子上游6个碱基及后续的14个碱基作为的靶序列,设计出互补的反义片段。另设计出一组正义寡核苷酸序列(sense oligodeoxynucleotide,SODN)作为对照,并对每一条寡聚核苷酸链进行全硫代修饰。冷藏备用。
1.2子宫内膜癌Ishikawa细胞株培养与转染高分化子宫内膜癌Ishikawa。采用含10%新生牛血清(56℃灭活30 min)、100 U/ml青霉素、100 U/ml链霉素的RPMI-1640培养基,在37℃、5%CO2、95%饱和湿度的恒温培养箱中培养。每周传代2次,实验所用细胞保持在对数生长期。
1.3细胞增殖实验采用MTT法。细胞处理后分为反义组、正义组及空白组。反义组和正义组分别加入不同浓度的ASODN和SODN,终浓度分别为2.5 μmo1/L、5.0 μmol/L、10.0 μmol/L,每孔设3个复孔。空白组加入等量培养液。24 h更换相应浓度的寡核苷酸1次。分别于转染后24、48、72 h,在培养皿中按培养液量的10%加入MTT溶液,继续培养4 h吸尽培养液,加入与培养液等量的二甲基亚砜,震荡10 min 使晶充分溶解。立即于自动酶标仪492 nm波长测定各孔光密度值。细胞增殖抑制率=[(空白组光密度值-实验组光密度值)/空白组光密度值]×100%。MTT购自北京赛百盛基因技术有限公司。
1.4凋亡细胞的观察与检测采用碘化丙啶一步插入性DNA定量荧光染色法。处理细胞,于加入寡聚核苷酸48 h后同时收集反义组、正义组和空白组细胞。细胞浓度为1×106/ml,每份样品中加入DNA染液1 ml,4℃染色30 min,应用FACS-420型流式细胞仪分析细胞凋亡率,每组共检测3个样本,重复3遍。
1.5Bcl-2蛋白定量检测采用间接免疫荧光标记法。处理细胞,于加入寡聚核苷酸48 h后同时收集反义组、正义组和空白组细胞。细胞浓度调整为1×106/ml,一抗为大鼠抗人Bcl-2单克隆抗体(1∶100),二抗为羊抗大鼠IgG(1∶100),空白组以PBS缓冲液代替一抗。一抗和二抗均购自北京中杉金桥生物技术有限公司。应用FACS-420型流式细胞仪检测Bcl-2蛋白。每组共检测3个样本,重复3遍。结果分析以荧光指数(fluorescence index,FI)表达相对含量,用均道值表示FI。计算公式:FI=(X-Mode)×340。
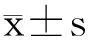
2结果
2.1不同浓度寡聚核苷酸对子宫内膜癌Ishikawa细胞株凋亡的影响ASODN和SODN处理过的Ishikawa细胞在倒置显微镜下观察,发现反义组细胞培养液稍混浊,从形态上看生长无序,漂浮细胞增多,细胞密度减小,胞体变长,细胞之间无明显界限,细胞内颗粒物质增多,存活细胞减少。随作用时间和作用浓度的增加上述现象更为明显。形态上正义组细胞生长有序,细胞液较透明,细胞内颗粒物质较少,核隐约可见,细胞为梭形,复层生长,密度较大,生长良好;作用48 h后,随着ASODN浓度增大,细胞凋亡率上升(P<0.01)。10 μmol/L的ASODN可使细胞凋亡率增至26%以上。经过SODN处理的细胞与空白组细胞相比,凋亡率差异无统计学意义(P>0.05)。见表1,图1。
表1作用48 h后hTERT ASODN对Ishikawa细胞凋亡率的影响
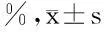

组别2.5μmol/L5.0μmol/L10.0μmol/L空白组6.98±0.496.98±0.496.98±0.49正义组5.45±0.366.44±1.016.03±0.52反义组12.46±0.60*#18.24±0.34*#26.65±3.23*#
注:与空白组比较,*P<0.01;与正义组比较,#P<0.01
2.2不同浓度寡聚核苷酸对子宫内膜癌Ishikawa细胞株增殖的影响ASODN作用24 h,Ishikawa细胞增殖受到抑制,72 h细胞增殖抑制达到高峰。随着ASODN作用浓度增加,细胞增殖抑制率为显著(P<0.01)。正义组与空白组相比细胞增殖抑制率差异无统计学意义(P>0.05)。见表2。
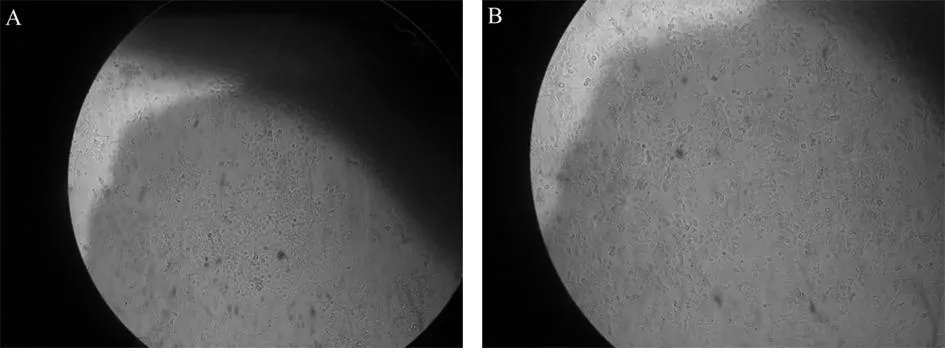
图1正义寡聚脱氧核苷酸(A)和反义寡聚脱氧核苷酸(B)处理48 h后Ishikawa细胞(显微镜×200)
表2hTERT ASODN对Ishikawa细胞增殖抑制率的影响
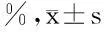
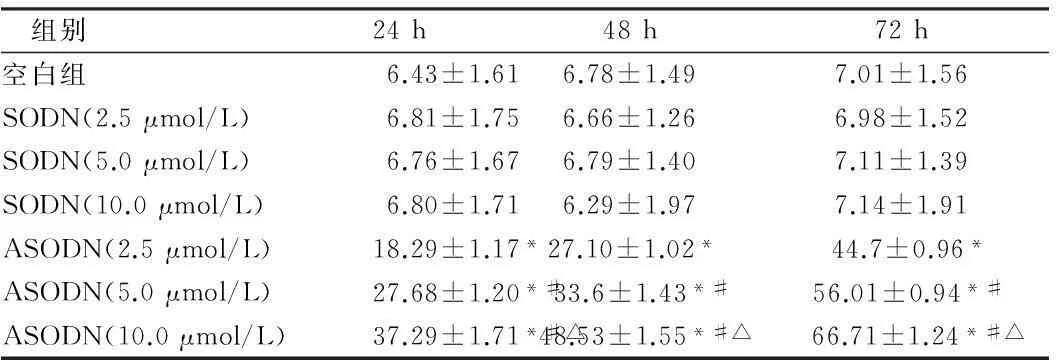
组别24h48h72h空白组6.43±1.616.78±1.497.01±1.56SODN(2.5μmol/L)6.81±1.756.66±1.266.98±1.52SODN(5.0μmol/L)6.76±1.676.79±1.407.11±1.39SODN(10.0μmol/L)6.80±1.716.29±1.977.14±1.91ASODN(2.5μmol/L)18.29±1.17*27.10±1.02*44.7±0.96*ASODN(5.0μmol/L)27.68±1.20*#33.6±1.43*#56.01±0.94*#ASODN(10.0μmol/L)37.29±1.71*#△48.53±1.55*#△66.71±1.24*#△
注:与空白组比较,*P<0.01;与ASODN (2.5 μmol/L)比较,#P<0.01;与ASODN (5.0 μmol/L)比较,△P<0.01
2.3不同浓度寡聚核苷酸对子宫内膜癌Ishikawa细胞株Bcl-2蛋白含量的影响通过流式细胞仪检测Bcl-2蛋白表达可发现,SODN处理的Ishikawa细胞在三种浓度下Bcl-2蛋白表达量与空白组相比差异无统计学意义(P>0.05)。而经过ASODN处理的细胞,Bcl-2蛋白表达量与空白组相比显著下降,并且随着ASODN浓度的增加,蛋白表达量下降(P<0.01)。见表3。
表3Bcl-2蛋白在不同浓度ASODN和SODN处理的
Ishikawa细胞中的表达


组别2.5μmol/L5.0μmol/L10.0μmol/L空白组302.85±9.30302.85±9.30302.85±9.30正义组299.08±12.20290.61±1.20308.69±3.79反义组221.68±1.67*#200.11±5.08*#177.05±1.67*#
注:与空白组比较,*P<0.01;与正义组比较,#P<0.01
3讨论
子宫内膜癌为女性生殖系统常见恶性肿瘤之一,近年来发病率有上升趋势,主要症状包括异常阴道流血、月经失调和不育等。子宫内膜癌可分为Ⅰ型癌和Ⅱ型癌。Ⅰ型癌以子宫内膜样腺癌为代表,为雌激素依赖性,约占子宫内膜癌的80%,主要治疗方法包括手术、放疗和化疗。约90%Ⅰ型癌处于FIGO-Ⅰ期和Ⅱ期,手术是主要治疗方式。但对于年轻未生育女性来说,子宫切除意味着失去生育能力,另外对于晚期子宫内膜癌及复发癌不能手术切除的患者,只能采用放疗或化疗,但治疗效果有限。寻找新的、有效的治疗方法势在必行。
端粒酶由人端粒酶RNA、hTERT、和人端粒酶结合蛋白组成,是一种核糖核蛋白酶。85%以上子宫内膜癌端粒酶阳性,且端粒酶活性增高与子宫内膜癌手术分期、淋巴转移高度相关[1,3]。hTERT是端粒酶的重要组成部分,它以端粒酶自身携带的RNA为模板,逆转录合成DNA,其合成的端粒DNA重复序列添加到端粒末端,从而维持端粒长度和染色体结构稳定。hTERT基因转录水平与端粒酶活性呈正相关,是端粒酶活性限速步骤和决定因素[4]。有研究发现85%以上子宫内膜癌组织hTERT表达强阳性,且与子宫内膜癌肌层浸润及临床分期呈正相关,且在子宫内膜癌中hTERT mRNA表达与端粒酶活性呈正相关[5]。通过抑制hTERT基因表达调控端粒酶活性,对探索子宫内膜癌基因治疗开辟了新方向。
由于ASODN能与特定基因按碱基配对原理结合其mRNA、抑制基因的表达,是具有精确选择性的靶向治疗药物。ASODN不改变细胞基因结构,不需要载体和病毒的介导作用,经全硫代修饰后,硫代寡核苷酸具有良好的水溶性、稳定性,能基本满足临床需求,在动物实验中取得了一定的成功,,已有多种反义药物进入临床前及临床试验[6,7]。有研究发现,ASODN在子宫内膜癌HEC-1-A细胞株中可降低hTRET mRNA的表达、抑制细胞增殖并诱导细胞凋亡[8]。本实验结果亦表明,ASODN呈时间和剂量依赖性抑制Ishikawa细胞增殖,并诱导细胞凋亡,能有效抑制肿瘤细胞的生长。
Bcl-2蛋白主要位于线粒体膜、核膜和内质网,可以抑制多种因素诱导的细胞凋亡。是细胞凋亡过程的关键调节因子。Bcl-2基因家族是目前研究最多的一类细胞凋亡基因,其表达和调控是影响细胞凋亡的关键因素之一。Bcl-2可以抑制凋亡蛋白激酶和核酸内切酶对DNA的降解;另外,可以防止受损的DNA激活凋亡诱导基因。研究表明,Bcl-2基因参与了子宫内膜增殖性病变的发展[2,9];Bcl-2基因多态性与中国女性子宫内膜癌发生有关[10]。雷公藤甲素等药物诱导子宫内膜癌细胞凋亡的作用与降低Bcl-2蛋白表达有关[11]。Bcl-2 基因可通过抑制细胞凋亡而使肿瘤细胞发生堆积来显示出其致癌性[12]。有文献报道证实 Bcl-2 在多种肿瘤细胞组织中的高水平表达使得细胞转化及肿瘤形成的前提条件是基因突变或表达异常[13],现已证明 Bcl-2 是最重要的抑制肿瘤细胞凋亡的基因,有研究表明子宫内膜癌的形成与Bcl-2高表达有关,且主要作用发生在癌前病变的早期[14]。有研究发现Bax/Bcl-2两因子之间的比例决定了细胞凋亡的强弱,Bcl-2过度表达可以抑制程序性细胞死亡,延迟或阻碍正常细胞的分化,使细胞的寿命延长,甚至引起增殖性病变或肿瘤发生[15]。本实验结果表明,ASODN呈剂量依赖性抑制Ishikawa细胞Bcl-2蛋白表达。蛋白表达受转录水平调控,mRNA加工、成熟水平上的调控及翻译水平上的调控。ASODN对Bcl-2表达影响的机制有待于进一步研究。该研究笔者发现国内外鲜有报道。
综上所述,ASODN可以抑制Ishikawa细胞增殖,诱导细胞凋亡,并抑制抗凋亡基因Bcl-2蛋白的表达,有效抑制肿瘤细胞生长。hTERT ASODN是具有精确选择性的靶向治疗药物,有望成为子宫内膜癌预防和治疗的新型药物。
参考文献
1Lehner R,Enomoto T,McGregor JA, et al. Quantitative analysis of telomerase hTERT mRNA and telomerase activity in endometrioid adenocarcinoma and in normal endometrium.Gynecol Oncol,2002,84:120-125.
2石绍兰, 高宝莲. 子宫内膜癌中Bcl-2、PTEN表达的研究.中国妇幼保健,2010,25:1632-1634.
3Ebina Y,Yamada H,Fujino T,et al. Telomerase activity correlates with histo-pathological factors in uterine endometrial carcinoma. Int J Cancer,1999,84:529-532.
4Elkak AE,Meligonis G,Salhab M,et al.hTERT protein expression is independent of clinicopathological parameters and c-Myc protein expression in human breast cancer.J Carcinog,2005,4:17.
5杨艳,滕银成.端粒酶逆转录酶与子宫内膜癌的研究进展.现代妇产科进展,2011,20:58-60.
6Dong H, Xiang HB, Ye DW, et al. Inhibitory effects of intrathecal p38β antisense oligonucleotide on bone cancer pain in rats. Int J Clin Exp Pathol,2014,7:7690-7698.
7肖桂芝, 田苗, 田红,等.FDA加快新药审批程序及突破性治疗药物分析.现代药物与临床,2014,29:447-454.
8Chen XJ,Zheng W,Chen LL,et al. Telomerase antisense inhibition for the proliferation of endometrial cancer in vitro and in vivo. Int J Gynecol Cancer,2006,16:1987-1993.
9文华清, 耿源源, 胡红文.Bcl-2和Ki-67对子宫内膜病变价值的探讨.临床肿瘤学杂志,2009,14:614-618.
10Dorjgochoo T,Xiang YB,Long J,et al. Association of genetic markers in the BCL-2 family of apoptosis-related genes with endometrialcancer risk in a Chinese population. PLoS One,2013,8:e60915.
11Wang XF,Zhao YB,Wu Q,et al. Triptolide induces apoptosis in endometrial cancer via a p53independent mitochondrial pathway.Mol Med Rep,2014,9:39-44.
12魏聪,刘远程,王友强,等.宫颈病变中 PCNA、Ki-67 的表达及其与 HPV 感染的相关性分析.中国妇幼保健,2015,30:3873-3876.
13王婉,黄团明,王滨,等.宫颈鳞癌组织中 HPVE6与野生型 p53 和Pin X1 表达的关系及其临床意义. 第三军医大学学报,2015,37: 782-786.
14成继民,贺占国,陈静.子宫内膜癌中CK-mit 和 bax 表达及相互关系.临床与实验病理学杂志,2004,20: 491-492.
15魏华芳,王浩. Bcl-2和Bax在子宫腺肌病中的表达及意义.现代妇产科进展,2010,19:936-938.
Effects of hTERT antisense oligodeoxynucleotide on the expression levels of Bcl-2 protein in endometrial carcinoma cellsYANGRongjuan,SONGChunhong,XUYanlei,etal.TheFourthHospitalofShijiazhuangCity,Hebei,Shijiazhuang050011,China
【Abstract】ObjectiveTo investigate the effects of hTERT antisense oligodeoxynucleotide (ASODN) on the expression levels of Bcl-2 protein in human endometrial carcinoma Ishikawa cells.Methods Human endometrial carcinoma Ishikawa cells were cultured in the medium with 2.5, 5 and10 umol/L hTERT ASODN for 24h,48h,72h,then the cell proliferation of Ishikawa cells was detected by MTT assay.The apoptosis rate of Ishikawa cells and the expression levels of Bcl-2 protein were detected by flow cytometry on 48h. ResultsThe hTERT ASODN inhibited proliferation of Ishikawa cells in a dose-dependent and time-dependent manner,moreover, which could induce apoptosis of Ishikawa cells in a dose-dependent way and could decrease the expression levels of Bcl-2 protein.ConclusionThe hTERT ASODN can induce apoptosis of Ishikawa cells,inhibit tumor cell proliferation,and its action mechanism may be correlated to decreasing the expression levels of Bcl-2 protein.
【Key words】endometrial carcinoma;human telomerase reverse transcriptase;antisense oligodeoxynucleotide; Bcl-2
(收稿日期:2015-11-27)
【中图分类号】R 711.7
【文献标识码】A
【文章编号】1002-7386(2016)09-1306-03
doi:10.3969/j.issn.1002-7386.2016.09.007

