高血压合并房颤患者外周血SIRT1表达及其与氧化应激的关系
欧阳春,张里克,卢远航,李先林
(湖北省中山医院,武汉430030)
高血压合并房颤患者外周血SIRT1表达及其与氧化应激的关系
欧阳春,张里克,卢远航,李先林
(湖北省中山医院,武汉430030)
目的 探讨高血压合并房颤患者外周血沉默信息调节因子1(SIRT1)mRNA和蛋白表达水平及其与氧化应激的关系。方法 选择高血压合并房颤患者60例,根据房颤类型分为持续房颤组26例和阵发房颤组34例,另选高血压窦性心律患者40例(对照组),分别采用实时荧光定量PCR法和Western blotting法检测各组外周血单核细胞SIRT1 mRNA和蛋白表达;采用硫代巴比妥酸法检测外周血丙二醛(MDA),免疫比浊法检测外周血高敏C反应蛋白(hs-CRP);分析外周血SIRT1表达与MDA、hs-CRP的关系。结果 阵发房颤组SIRT1 mRNA及蛋白表达显著高于持续房颤组、对照组(P均<0.05),而持续房颤组、对照组比较差异均无统计学意义(P均>0.05)。持续房颤组血清MDA、hs-CRP水平均显著高于阵发房颤组和对照组(P均<0.05);阵发性房颤组血清MDA、hs-CRP水平较对照组虽有升高趋势,但两组比较差异均无统计学意义(P均>0.05)。持续房颤组和阵发房颤组SIRT1表达与MDA呈负相关(P均<0.05),与hs-CRP无明显相关性(P均>0.05),对照组SIRT1表达与MDA、hs-CRP均无明显相关性(P均>0.05)。结论 SIRT1是心肌细胞的保护因素,与氧化应激呈负相关关系。
高血压;房颤;氧化应激;沉默信息调节因子1;丙二醛;高敏C反应蛋白
心房颤动(简称房颤)是临床常见的心律失常之一,有研究发现,氧化应激反应所产生的活性氧簇在促进房颤的发生中具有重要作用[1,2]。沉默信息调节因子1(SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸的组蛋白去乙酰化酶,可通过调节心脏活性氧簇,参与对氧化应激的调控[3,4]。因此推测,外周血SIRT1表达变化可能影响房颤的发生、发展过程,但目前鲜见关于SIRT1与房颤及氧化应激关系的报道。本研究观察高血压合并房颤患者外周血SIRT1表达变化,并分析SIRT1与氧化应激的关系,旨在为房颤的预防及治疗提供参考。
1 资料与方法
1.1 临床资料 选择2011年7月~2014年7月在我院住院治疗的高血压合并房颤患者60例。高血压的诊断参照《中国高血压防治指南》(2010年版)[5];房颤的诊断标准:心电图显示P波消失,代之以大小不等、形状各异、间隔不等、不规则的细小f波,频率一般为350~600次/min,f波间无等电位线存在,其发作呈持续(持续时间6~12个月)或阵发性(每次发作时间≤48 h,服用药物后消失或自行消失)。排除标准:①合并冠心病、风湿性心脏病者;②合并严重感染或伴有自身免疫性疾病者;③肝肾功能异常或合并呼吸系统疾病者;④罹患糖尿病、继发性高血压或恶性肿瘤者。根据房颤类型分为持续房颤组26例、阵发房颤组34例。持续房颤组男11例、女15例,年龄(56.8±6.3)岁,合并高血脂23例;阵发房颤组男14例、女20例,年龄(57.6±7.5)岁,合并高血脂29例。同期另选在我院就诊的高血压窦性心律患者40例(对照组),男16例、女24例,年龄(55.9±6.1)岁,合并高血脂33例。三组性别、年龄及合并高血脂情况等具有可比性。
1.2 相关指标观察
1.2.1 外周血SIRT1 mRNA ①总mRNA提取:抽取各组肘静脉血5 mL,置于抗凝管中,2 500 r/min离心10 min,分离单核细胞;抽取单核细胞,置于离心管中,加入5倍生理盐水摇匀,2 500 r/min离心15 min,弃去上清液;再加入1.5 mL TRIzol溶液,充分振荡使细胞完全裂解;分别加入100 μL氯仿、500 μL异丙醇摇匀,静置10 min,2 000 r/min离心10 min,弃去上清液,沉淀用吸水纸吸干,室温干燥5 min。将提取的总RNA加入1 μL溴酚蓝,置于琼脂糖凝胶上样孔内,常规电泳20 min,以紫外分光光度计检测总RNA光密度(OD),OD260/OD280为1.8~2.0为合格。②cDNA合成:采用SYBR Green Assay逆转录反应体系。将提取的总mRNA按照以下条件逆转录为cDNA:总RNA 2 μL,2×buffer 10 μL,Oligo(DT) 0.5 μL,dNTP 10 mmol,逆转录酶22 U/μL,DMSO 44 μL,RNasin 0.25 μL,ddH2O 0.25 μL。上述体系放入PCR扩增仪中反转录。反应条件:60 ℃变性5 min,30 ℃变性1 min,60 ℃退火20 min,95 ℃延伸10 min,最后10 ℃延伸5 min。③SIRT1 mRNA表达检测:采用实时荧光定量PCR法。引物序列由南京金斯瑞生物科技有限公司设计,SIRT1上游引物:5′-ATGTAGAGTCTGATGGTCTAGC-3′,下游引物:5′-CGTTGTGGTGTTAGTTTCTGCG-3′;内参GAPDH上游引物:5′-CACGATCATCATCTCTCAGCTT-3′,下游引物:5′-AAGTCGTTCGGATGGCTGTACA-3′;PCR反应体系20 μL:Taq 10 μL、cDNA 1 μL、上下游引物各0.5 μL、ddH2O 8 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,65 ℃退火45 s,72 ℃延伸1 min,40个循环后72 ℃延伸5 min。根据扩增曲线与溶解曲线计算Ct值,目的基因相对表达量=2-ΔΔCt,ΔCt=目的基因Ct-内参基因Ct;ΔΔCt=试验组ΔCt-对照组ΔCt。
1.2.2 外周血SIRT1蛋白 采用Western blotting法。将外周血用裂解液处理后,按照Bradford蛋白定量试剂盒测定蛋白含量;凝胶蛋白电泳,将电泳凝胶用NC膜转膜后封闭,再置于封闭液稀释的Ⅰ抗孵育,化学发光显影后扫描,White/Ultraviolet Transilluminator凝胶成像分析系统进行分析半定量。以β-actin作为内参照,二者比值为相对表达量。
1.2.3 氧化应激指标 清晨空腹抽取各组肘静脉血2 mL,静置1 h,2 500 r/min分离15 min,取血清,保存备检。采用硫代巴比妥酸法检测血清丙二醛(MDA)、采用免疫比浊法检测血清高敏C反应蛋白(hs-CRP)。

2 结果
2.1 各组外周血SIRT1 mRNA及蛋白表达比较 见表1。
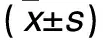
表1 各组外周血SIRT1 mRNA及蛋白相对表达比较
注:与持续房颤组比较,*P<0.05;与阵发房颤组比较,#P<0.05。
2.2 各组血清MDA、hs-CRP水平比较 见表2。
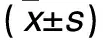
表2 各组血清MDA、hs-CRP水平比较
注:与持续房颤组比较,*P<0.05。
2.3 SIRT1 mRNA表达与MDA、hs-CRP的关系 相关性分析显示,持续房颤组、阵发房颤组SIRT1 mRNA表达与MDA均呈负相关(r分别为-0.589、-0.324,P均<0.05),与hs-CRP均无明显相关性(r分别为0.171、0.198,P均>0.05);对照组SIRT1 mRNA表达与MDA、hs-CRP均无明显相关性(r分别为0.203、0.257,P均>0.05)。
3 讨论
据统计,60岁以上人群房颤的发病率约为1%,其发病率随着年龄增长逐渐升高[6]。研究证实,高血压伴发房颤患者发生栓塞性并发症的风险明显增加。房颤发生时心房肌的氧化应激产物增加、氧化还原基因表达失衡以及线粒体DNA存在氧化损伤,表明氧化应激与房颤的发生有关;氧化应激反应会损伤线粒体和钙泵功能,导致细胞内钙超载,进而激活依赖钙离子蛋白水解酶,促使心肌收缩功能减退,继而导致心房结构重构[7]。因此,对高血压患者给予抗氧化作用药物,可防止心房结构重构,减少房颤的发生。
SIRT是存在于多种生物中的高度保守基因,在人类共有7个同源基因,目前研究较多的是SIRT1。SIRT1在多种疾病中参与氧化应激反应的调控[8]。樊磊等[9]研究发现,SIRT1与先天性心脏病、心肌炎、心力衰竭等心脏疾病密切相关;SIRT1主要参与调节心肌细胞的生长、分化过程,对心脏的发育具有促进和保护作用[10]。Ulas等[11]在动物研究中发现,激活SIRT1能够促进内皮细胞NO合酶的活性,改善内皮功能,进而抑制动脉粥样硬化。赵军等[12]通过建立心室快速起搏所致心力衰竭犬模型发现,心肌SIRT1表达水平显著升高,提示SIRT1能够避免心肌细胞发生凋亡,证实SIRT1能够抑制心脏组织重构所致的心力衰竭。氧化应激反应参与了房颤的发生,其机制可能是氧化应激导致心房组织发生结构和电生理重构。谭含璇等[13]对心房快速起搏房颤犬给予抗氧化剂后,房颤发生率明显降低,房颤持续时间明显缩短,证实活性氧清除剂能够抑制心房发生电生理重构。胡明珠等[14]报道,SIRT1表达上调能够激活FOXO信号途径,导致机体氧化应激水平显著降低,从而避免机体发生氧化应激损伤。邬云斌等[15]也证实,SIRT1能够通过抑制氧化应激水平,阻断p53诱导的细胞凋亡;当机体发生氧化应激反应时,SIRT1能够使p53去乙酰化,调节细胞的代谢;而能量限制会进一步诱导SIRT1表达增加,使细胞氧化应激损伤减轻。推测SIRT1可能参与了房颤的发生。
本研究结果显示,阵发房颤组SIRT1表达水平显著升高,提示在房颤早期SIRT1高表达能够抑制房颤的发展,但随着阵发性房颤发展成持续性房颤,SIRT1表达开始降低。本研究还发现,持续房颤组血清MDA、hs-CRP水平显著高于对照组、阵发房颤组,而阵发房颤组与对照组比较,血清MDA、hs-CRP水平也有升高趋势,提示炎症对房颤的促发和维持可能有一定作用。相关分析显示,无论持续还是阵发房颤,SIRT1 mRNA表达与MDA均呈负相关,而对照组SIRT1 mRNA表达与MDA、hs-CRP无明显相关性,与孙雪林[16]等报道一致。当炎症因子沉积于心房组织中,会导致局部组织发生纤维化,进而诱发房颤;炎症与氧化应激互为因果,共同导致心房结构和功能发生重构[17,18]。房颤患者SIRT1表达与MDA呈负相关,说明SIRT1能够抑制氧化应激,特别对于阵发房颤。SIRT1能够在早期抑制房颤的发展。但随着房颤程度的加重,这种保护作用开始减弱[19,20]。
综上所述,高血压合并房颤患者外周血SIRT1表达增加,SIRT1与氧化应激呈负相关,与hs-CRP无明显相关性,故认为SIRT1是心肌细胞的保护因素,通过降低氧化应激反应可抑制房颤的进展。但本研究未充分考虑持续SIRT1表达对心肌细胞和房颤的不利影响,确切结论还有待于进一步研究证实。
[1] Mohebbi M, Ghassemian H. Predicting termination of paroxysmal atrial fibrillation using empirical mode decomposition of the atrial activity and statistical features of the heart rate variability[J]. Med Biol Eng Comput, 2014,52(5):415-427.
[2] Li J, Song J, Jiang MH, et al. Interleukin-6 promoter polymorphisms and susceptibility to atrial fibrillation in elderly han chinese patients with essential hypertension[J]. J Interferon Cytokine Res, 2012,32(11):542-547.
[3] Takizawa Y, Kosuge Y, Awaji H, et al. Up-regulation of endothelial nitric oxide synthase (eNOS), silent mating type information regulation 2 homologue 1 (SIRT1) and autophagy-related genes by repeated treatments with resveratrol in human umbilical vein endothelial cells[J]. Br J Nutr, 2013,110(12):2150-2155.
[4] 杜月光,柴可夫,钱俊文,等.SIRT1通过降低NF-κB p65乙酰化减轻高糖应激引起的大鼠肾小球系膜细胞损伤[J].中国病理生理杂志,2014,30(4):664-669.
[5] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-616.
[6] Mayyas F, Alzoubi KH, Van Wagoner DR. Impact of aldosterone antagonists on the substrate for atrial fibrillation: aldosterone promotes oxidative stress and atrial structural/electrical remodeling[J]. Int J Cardiol, 2013,168(6):5135-5142.
[7] Goette A, D′Alessandro A, Bukowska A, et al. Rationale for and design of the CREATIVE-AF trial: randomized, double-blind, placebo-controlled, crossover study of the effect of irbesartan on oxidative stress and adhesion molecules in patients with persistent atrial fibrillation[J]. Clin Drug Investig, 2008,28(9):565-572.
[8] 李为民,盛力,李悦,等.氧化应激对心房颤动犬心房病理组织学及超微结构改变的影响[J].中华医学杂志,2008,88(14):985-989.
[9] 樊磊,白晓智,杨龙龙,等.活化沉默信息调节因子1对大鼠严重烫伤早期心肌损害的影响[J].中华烧伤杂志,2014,30(3):194-198.
[10] Toyama K, Yamabe H, Uemura T, et al. Analysis of oxidative stress expressed by urinary level of 8-hydroxy-2′-deoxyguanosine and biopyrrin in atrial fibrillation: effect of sinus rhythm restoration[J]. Int J Cardiol, 2013,168(1):80-85.
[11] Ulas T, Haclbekiroglu T, Sezen H, et al. Comment on: Analysis of oxidative stress expressed by urinary level of 8-hydroxy-2′-deoxyguanosine and biopyrrin in atrial fibrillation: effect of sinus rhythm restoration[J]. Int J Cardiol, 2013,167(4):1643.
[12] 赵军,赵美琴,史长征,等.基于SIRT1轴探讨不同强度有氧运动对NAFLD大鼠脂肪性肝炎的影响[J].体育科学,2014,34(11):50-59,96.
[13] 谭含璇,初红霞,樊静静,等.心力衰竭犬跨室壁心肌复极时间和不应期离散度的致心律失常机制研究[J].中国病理生理杂志,2011,27(3):417-424.
[14] 胡明珠,周波,盛琼,等.PI3 K/Akt/Sirt1信号通路介导硫化氢后处理对大鼠缺血心肌的保护作用[J].中国药理学通报,2016,32(2):268-273.
[15] 邬云斌,刘新伟,何东伟,等.白藜芦醇对大鼠心肌缺血再灌注损伤的保护作用及其与sirt1-p53通路的关系[J].中国老年学杂志,2011,31(24):4822-4825.
[16] 孙雪林,卜培莉,刘军妮,等.房颤患者右心耳组织SIRT1表达以及与氧化应激的相关性[J].细胞与分子免疫学杂志,2012,28(9):972-974.
[17] Ederhy S, Di Angelantonio E, Dufaitre G, et al. C-reactive protein and transesophageal echocardiographic markers of thromboembolism in patients with atrial fibrillation[J]. Int J Cardiol, 2012,159(1):40-46.
[18] 陈莉,程文立,柯元南,等.不同周龄高血压载脂蛋白E基因敲除小鼠主动脉弹力纤维降解和胶原改变与氧化应激和炎症变化的关系[J].中华心血管病杂志,2012,40(6):505-510.
[19] Lübkemeier I, Andrié R, Lickfett L, et al. The Connexin40A96S mutation from a patient with atrial fibrillation causes decreased atrial conduction velocities and sustained episodes of induced atrial fibrillation in mice[J]. J Mol Cell Cardiol, 2013(65):19-32.
[20] Kawashima T, Inuzuka Y, Okuda J, et al. Constitutive SIRT1 overexpression impairs mitochondria and reduces cardiac function in mice[J]. J Mol Cell Cardiol, 2011,51(6):1026-1036.
10.3969/j.issn.1002-266X.2016.24.028
R541.7
B
1002-266X(2016)24-0073-03
2016-03-15)

