人SND1基因慢病毒载体构建及稳定表达SND1蛋白的人卵巢癌SKOV3细胞株筛选
任媛媛,雷静,赵然,辛灵彪,苏超,高星杰,杨洁
(天津医科大学,天津300070)
·论著·
人SND1基因慢病毒载体构建及稳定表达SND1蛋白的人卵巢癌SKOV3细胞株筛选
任媛媛,雷静,赵然,辛灵彪,苏超,高星杰,杨洁
(天津医科大学,天津300070)
目的 构建人SND1基因慢病毒载体,筛选稳定表达SND1蛋白的人卵巢癌SKOV3细胞株,为探讨SND1基因对卵巢癌的调控作用提供细胞系模型。方法 采用PCR法从pCMV-FLAG-SND1质粒中扩增FLAG-SND1基因片段,连接到慢病毒载体表达质粒pLVX-IRES-Hyg中,获得重组慢病毒载体pLVX-FLAG-SND1。以pLVX-FLAG-SND1瞬时转染293T细胞48 h,采用Western blotting法检测SND1蛋白表达量。pLVX-FLAG-SND1重组质粒通过与包装质粒共转染293T细胞,获得携带FLAG-SND1的重组慢病毒。以慢病毒感染SKOV3细胞48 h,在细胞培养基中加入1 μg/mL 潮霉素B,筛选稳定表达SND1蛋白的细胞株,采用Western blotting法检测该细胞株内SND1蛋白表达量。结果 重组慢病毒载体经双酶切和基因测序比对鉴定正确。重组慢病毒载体在瞬时转染的293T细胞中SND1蛋白表达量高于野生型SKOV3细胞(P<0.01)。SKOV3细胞经慢病毒感染、药物筛选后获得的稳定表达株中SND1蛋白表达量高于野生型SKOV3细胞(P<0.01)。结论 成功构建了SND1基因慢病毒载体pLVX-FLAG-SND1,并筛选出稳定表达SND1蛋白的SKOV3细胞株,为进一步明确卵巢癌发生、发展机制奠定了基础。
SND1基因;慢病毒载体;SKOV3细胞;卵巢癌
人类SND1蛋白又称p100或Tudor-SN,是一种在真核细胞中广泛表达、偶联转录调控和剪接的多功能蛋白,参与基因转录、RNA干扰、pre-mRNA剪切等多种生物学过程,在细胞增殖、凋亡、应激及脂肪代谢等多种生理过程中发挥重要调控作用[1~4]。SND1蛋白在乳腺癌、肺癌、肝癌、结肠癌、前列腺癌等多种恶性肿瘤中发挥促癌作用,其过表达可能是导致恶性肿瘤发生、发展的重要原因[5~7]。但SND1与卵巢癌发生、发展的关系尚不明确。2015年8~12月,本研究构建了SND1基因慢病毒载体,包装病毒后感染并筛选稳定表达SND1蛋白的人卵巢癌SKOV3细胞株,为进一步探讨SND1在卵巢癌中的作用提供体外细胞系模型。现将研究过程及结果报告如下。
1 材料、方法与结果
1.1 材料 人卵巢癌SKOV3、293T细胞系、pCMV-FLAG-SND1质粒均为本实验室保存。慢病毒载体质粒pLVX-IRES-Hyg、包装质粒1和包装质粒2由天津医科大学生物化学与分子生物学系石磊教授馈赠。大肠杆菌DH5α感受态、Trans2K PlusⅡ DNA Marker、Trans 15K DNA Marker购自北京全式金生物技术有限公司。氨苄青霉素和潮霉素B购自罗氏公司。转染试剂Polyethyleneimine购自Sigma公司。DreamTaqGreen PCR Master Mix(2X)、Xba1和Not1限制性内切酶、T4 DNA连接酶购自Fermentas公司。引物合成和基因测序均由上海Invitrogen公司完成。小量DNA快速回收试剂盒购自北京博大泰克生物基因技术有限公司。质粒快速小提试剂盒购自北京索莱宝科技有限公司。去内毒素质粒抽提试剂盒购自Omega公司。鼠源SND1单克隆抗体由本实验室制备。鼠源FLAG M2抗体购自Sigma公司。辣根过氧化氢酶标抗鼠IgG购自KPL公司。BCA蛋白浓度检测试剂盒购自Pierce公司。ECL Western blotting试剂盒购自上海碧云天生物技术有限公司。
1.2 潮霉素B最低致死浓度测定 将SKOV3细胞按3×105/孔接种于24孔板,用含10% FBS的McCOY 5A培养基常规培养24 h,分别加入0、0.5、1、1.25、1.5 μg/mL 潮霉素B培养3天,结果显示加入1、1.25、1.5 μg/mL潮霉素B的全培养基培养的SKOV3细胞全部死亡,加入0.5 μg/mL潮霉素B的全培养基培养的SKOV3细胞部分死亡,由此确定潮霉素 B对SKOV3细胞的最低致死浓度为1 μg/mL,后续研究选择1 μg/mL 潮霉素 B进行抗药筛选。
1.3 重组慢病毒载体pLVX-FLAG-SND1的构建与鉴定 设计FLAG-SND1基因的PCR引物,在两条引物中分别引入Xba1、Not1限制性酶切位点。上游引物为5′-GCTCTAGAATGGATTACAAGGATGACG-ACG-3′,下游引物为5′-TTGCGGCCGCTTAGCGGCTGTAGCCAAATT-3′。PCR反应体系参照说明书,退火温度为60 ℃,从pCMV-FLAG-SND1质粒中克隆完整的FLAG-SND1片段,所得PCR产物大小为2 798 bp。PCR产物及pLVX-IRES-Hyg慢病毒载体同时采用Xba1、Not1双酶切,电泳后回收纯化线性的酶切产物。用T4 DNA连接酶将线性化的慢病毒载体与FLAG-SND1片段进行16 ℃连接过夜。连接产物转化大肠杆菌DH5α感受态,在具有氨苄青霉素抗性的LB平板上筛选出16个阳性单克隆,编号1~16,进行菌落PCR鉴定,并挑取鉴定阳性的单克隆摇菌扩大培养,采用去内毒素质粒小提试剂盒提取重组质粒(按试剂盒说明书操作);采用FLAG-SND1引物进行质粒PCR,PCR产物大小为2 798 bp。采用Xba1、Not1双酶切鉴定重组质粒,两条条带分子量分别在9 000 bp和3 000 bp左右为初步鉴定正确的质粒;若显示一条条带则为未切开或未连接成功的质粒。将双酶切鉴定正确的质粒进行DNA测序,进一步鉴定插入序列的准确性。
电泳结果显示,第3、4、8、11、12、13、16条带位于3 000 bp左右,大小与预期相符,证明转化成功,见图1。选取3、4、8、11、12、13号单克隆扩大培养后提取质粒进行Xba1和Not1双酶切,电泳结果显示8、11、12、13号菌液提取质粒经双酶切得到两条条带,分别在9 000 bp左右和3 000 bp左右,初步鉴定质粒正确;4号菌液提取质粒经双酶切仅显示一条9 000 bp左右的条带,说明未连接成功;3号菌液提取质粒电泳结果条带不明显,质粒抽提失败;见图2。随机选取8、11号菌液提取质粒,采用FLAG-SND1引物进行PCR扩增,产物电泳条带均位于3 000 bp左右,与预期相符,见图3。重组质粒基因测序结果经序列比鉴定正确,证实FLAG-SND1序列已正确插入pLVX-IRES-Hyg质粒,重组载体构建完成。

注:M为Trans2K PlusⅡ DNA Marker;1~16分别为1~16号阳性单克隆菌落PCR产物;+为阳性对照。
图1 重组质粒菌落电泳图
1.4 重组慢病毒载体SND1蛋白表达检测 常规传代培养293T细胞,待细胞生长至60%左右汇合,在转染试剂Polyethyleneimine介导下用8、11、12、13号阳性单克隆菌落重组质粒瞬时转染293T细胞,48 h后收集蛋白,采用Western blotting法检测SND1蛋白表达量,具体操作按试剂盒说明书进行。野生型293T细胞作为空白对照,瞬时转染pCMV-FLAG-SND1质粒的293T细胞作为阳性对照。以空白对照野生型293T细胞SND1蛋白表达量为1,8、11、12、13号重组质粒SND1蛋白的相对表达量分别为15.91±0.84、15.50±0.95、16.27±0.61、15.43±0.10,阳性对照细胞的相对表达量为18.66±1.31;重组质粒及阳性对照细胞SND1蛋白的相对表达量均较空白对照细胞明显增加(P均<0.01);说明重组质粒LVX-FLAG-SND1在293T细胞中瞬时转染成功。
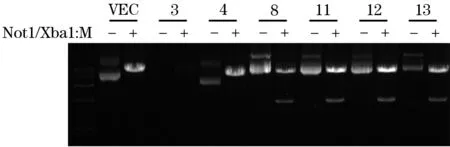
注:M为Trans15K DNA Marker;VEC/-为环状pLVX-IRES-Hyg载体;VEC/+为Not1/Xba1双酶切后的线性pLVX-IRES-Hyg载体;3/-、4/-、8/-、11/-、12/-、13/-分别为3、4、8、11、12、13号阳性单克隆菌落提取的环状pLVX-FLAG-SND1重组质粒;3/+、4/+、8/+、11/+、12/+、13/+分别为Not1/Xba1双酶切后的线性pLVX-FLAG-SND1重组质粒。
图2 重组质粒Not1、Xbal双酶切产物电泳图
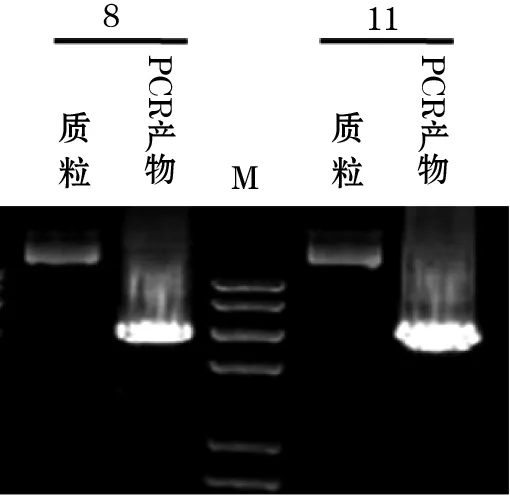
注:M为Trans2K PlusⅡ DNA Marker;8/质粒、11/质粒分别为8、11号阳性单克隆菌落pLVX-FLAG-SND1重组质粒;8/PCR产物、11/PCR产物分别为 8、11号阳性单克隆菌落pLVX-FLAG-SND1重组质粒PCR产物。
图3 重组质粒电泳图
1.5 慢病毒质粒包装 转染前一天将293T细胞接种于10 cm细胞培养皿中,置于含10% FBS的高糖DMEM培养基,于37 ℃、5% CO2培养箱中培养。将去内毒素质粒小提试剂盒制备的重组质粒(或空载质粒)与包装质粒1、包装质粒2按照22.5 μg:7.9 μg:14.6 μg体系比在500 μL opti-MEM中混匀,另用500 μL opti-MEM与100 μL转染试剂Polyethyleneimine混匀。将混有质粒的opti-MEM加入至混有Polyethyleneimine的opti-MEM中,轻弹混匀,室温静置5~20 min,逐滴缓慢加入到70%~80%汇合率的293T细胞中,培养24 h,收集病毒上清至离心管,4 ℃保存。更换新的完全培养基继续培养48 h,再收集病毒上清至离心管中,4 ℃下500 g离心10 min,用0.45 μm的滤器过滤,-80 ℃长期保存用于感染。
1.6 SKOV3细胞感染、稳定株筛选及鉴定 将SKOV3细胞以1×106/孔接种于6孔板中,常规培养使其融合率达60%左右;培养第2天弃上清,分别加入第8、11号pLVX-FLAG-SND1表达载体包装病毒液2 mL,补加200 μL FBS和12 μg polybrene,感染24 h;采用新鲜的完全培养基代替含polybrene的培养基培养48 h,加入1 μg/mL潮霉素B进行筛选。筛选过程中以不加慢病毒、只加1 μg/mL潮霉素 B的SKOV3细胞作为对照,此皿细胞全部死亡即筛选完成。筛选出的SKOV3细胞能够持续稳定表达FLAG-SND1,即为SKOV3慢病毒稳定株。将一部分稳定株冻存保种;剩余的细胞制备成细胞裂解液,采用Western blotting法检测SND1蛋白表达量。以野生型SKOV3细胞作为空白对照,以pCMV-FLAG-SND1质粒瞬时转染293T细胞作为阳性对照;以空白对照细胞SND1蛋白表达量为1,8、11号重组质粒的相对表达量分别为9.62±0.40、9.96±0.89,阳性对照细胞的相对表达量为12.07±1.50;8、11号重组质粒及阳性对照细胞的相对表达量均较空白对照细胞明显增加(P均<0.01);证明稳定表达SND1蛋白的SKOV3细胞株构建成功。
2 讨论
SND1蛋白是一种在真核细胞中广泛表达的多功能蛋白,具有高度同源性,其分子量为100 kDa,因此又称为p100蛋白。1995年,SND1作为EB病毒核蛋白2(EBNA2)的转录调控激活因子被首次发现并鉴定[8]。1997年,Callebaut等[9]发现人类Tudor-SN蛋白N端为由4个重复葡萄球菌核酸酶样(SN-like)的SN(1~4)结构域,C端为Tudor-SN5(TSN)结构域,因此又被称为Tudor-SN蛋白。研究发现,SND1作为转录共激活因子借助结构域与STAT6、c-Myb、STAT5等蛋白结合,参与基因转录调控,促进结合蛋白的转录活性。本课题组前期研究解析了SND1蛋白N端TSN结构域的晶体结构,并且证实SND1不仅参与基因转录调控,还可以促进剪接体装配和pre-mRNA剪接加工过程。另外,SND1通过参与RNA诱导沉默复合体(RISC)组成来调节RISC活性,从而影响微小RNA(miRNA)介导的靶mRNA沉默[10]; SND1作为细胞内的一种多功能蛋白,在多种信号通路中发挥重要作用,参与细胞的生长、发育和癌变等过程。
目前已经发现SND1在肝癌、前列腺癌、结肠癌等多种恶性肿瘤中表达上调,但其参与不同肿瘤发生的具体机制有所不同。在大鼠小肠隐窝上皮细胞中稳定过表达小鼠SND1,细胞间接触抑制消失并且细胞增殖加快[11]。进一步研究发现,SND1蛋白作为RISC组成成分之一,在人类结肠癌组织中高表达,结肠癌细胞系中SND1通过影响RISC活性下调结肠腺瘤样息肉(APC)蛋白的表达[12]。此外,在结肠癌组织中SND1及异黏蛋白(MTDH)的相互作用与结肠癌的发生、发展及预后密切相关[13]。在肝癌细胞中SND1通过调节NF-κB诱导激活miR-221进而促进肿瘤血管生成[7]。在肝癌细胞系SMMC-7721中,SND1通过调节胰岛素样生长因子结合蛋白3(IGFBP3)的表达促进肝癌细胞增殖。SND1协调剪接因子Sam68调控CD44基因的可变剪接,促进前列腺癌细胞增殖[14]。Ho等[15]在乳腺癌转移模型的组织芯片中发现,随着肿瘤侵袭、转移能力的增强,SND1表达亦呈上升趋势。SND1的表达受TGF-β信号通路的调控,通过上调HECT类泛素连接酶smurf-1促进乳腺癌细胞转移[11]。但是,目前对卵巢癌的发生、发展机制缺乏足够的认识。
慢病毒载体是以HIV-1病毒为基础改造的病毒载体系统,对于一些难转染的细胞,使用慢病毒载体能高效地将外源目的基因稳定整合入宿主细胞的基因组中,从而实现目的基因稳定持久性表达的目的。与真核表达质粒相比,重组慢病毒技术的转染效率和稳定性显著提高。本课题组前期研究构建的真核表达载体pCMV-FLAG-SND1在人卵巢癌细胞系SKOV3中转染效率低。为了提高基因转染效率,本研究选择将FLAG-SND1基因插入慢病毒表达载体pLVX-IRES-Hyg,构建重组慢病毒载体pLVX-FLAG-SND1,与慢病毒包装质粒同时转染293T细胞,在细胞中进行慢病毒包装。用包装好的慢病毒颗粒感染SKOV3细胞,经过潮霉素B抗性筛选,建立SKOV3慢病毒稳定株,且慢病毒毒粒感染后的SKOV3细胞中SND1稳定高表达,提示已成功运用该载体将SND1基因整合入SKOV3细胞的基因组中。SND1蛋白稳定表达的SKOV3细胞株的获得,为从细胞与分子水平上探讨SND1基因对卵巢癌细胞的调控作用及机制提供了体外细胞系模型,为进一步明确卵巢癌形成、发展及转移机制奠定了基础,并为卵巢癌的治疗提供了新的分子靶标。
[1] Santhekadur PK, Das SK, Gredler R, et al. Multifunction protein staphylococcal nuclease domain containing 1 (SND1) promotes tumor angiogenesis in human hepatocellular carcinoma through novel pathway that involves nuclear factor kappaB and miR-221[J]. J Biol Chem, 2012,287(17):13952-13958.
[2] Tsuchiya N, Nakagama H. MicroRNA, SND1, and alterations in translational regulation in colon carcinogenesis[J]. Mutat Res, 2010,693(1-2):94-100.
[3] Gao X, Shi X, Fu X, et al. Human Tudor staphylococcal nuclease (Tudor-SN) protein modulates the kinetics of AGTR1-3′UTR granule formation[J]. FEBS Lett, 2014,588(12):2154-2161.
[4] Duan Z, Zhao X, Fu X, et al. Tudor-SN, a novel coactivator of peroxisome proliferator-activated receptor gamma protein, is essential for adipogenesis[J]. J Biol Chem, 2014,289(12):8364-8374.
[5] Yu L, Liu X, Cui K, et al. SND1 acts downstream of TGFbeta1 and upstream of smurf1 to promote breast cancer metastasis[J]. Cancer Res, 2015,75(7):1275-1286.
[6] Yoo BK, Santhekadur PK, Gredler R, et al. Increased RNA-induced silencing complex (RISC) activity contributes to hepatocellular carcinoma[J]. Hepatology, 2011,53(5):1538-1548.
[7] Kuruma H, Kamata Y, Takahashi H, et al. Staphylococcal nuclease domain-containing protein 1 as a potential tissue marker for prostate cancer[J]. Am J Pathol, 2009,174(6):2044-2050.
[8] Tong X, Drapkin R, Yalamanchili R, et al. The Epstein-Barr virus nuclear protein 2 acidic domain forms a complex with a novel cellular coactivator that can interact with TFIIE[J]. Mol Cell Biol, 1995,15(9):4735-4744.
[9] Callebaut I, Mornon JP. The human EBNA-2 coactivator p100: multidomain organization and relationship to the staphylococcal nuclease fold and to the tudor protein involved in Drosophila melanogaster development[J]. Biochem J, 1997,321(Pt 1):125-132.
[10] Murashov AK, Chintalgattu V, Islamov RR, et al. RNAi pathway is functional in peripheral nerve axons[J]. Faseb J, 2007,21(3):656-670.
[11] Tsuchiya N, Ochiai M, Nakashima K, et al. SND1, a component of RNA-induced silencing complex, is up-regulated in human colon cancers and implicated in early stage colon carcinogenesis[J]. Cancer Res, 2007,67(19):9568-9576.
[12] Wang N, Du X, Zang L, et al. Prognostic impact of Metadherin-SND1 interaction in colon cancer[J]. Mol Biol Rep, 2012,39(12):10497-10504.
[13] Yin J, Ding J, Huang L, et al. SND1 affects proliferation of hepatocellular carcinoma cell line SMMC-7721 by regulating IGFBP3 expression[J]. Anat Rec (Hoboken), 2013,296(10):1568-1575.
[14] Cappellari M, Bielli P, Paronetto MP, et al. The transcriptional co-activator SND1 is a novel regulator of alternative splicing in prostate cancer cells[J]. Oncogene, 2014,33(29):3794-3802.
[15] Ho J, Kong JW, Choong LY, et al. Novel breast cancer metastasis-associated proteins[J]. J Proteome Res, 2009,8(2):583-594.
Construction of human SND1 lentivirus vector and its application in screening human ovarian cancer cell line SKOV3 for stable expression
RENYuanyuan,LEIJing,ZHAORan,XINLingbiao,SUChao,GAOXingjie,YANGJie
(TianjinMedicalUniversity,Tianjin300070,China)
Objective To construct the lentivirus vector of human SND1 gene and to screen the human ovarian cancer cell line SKOV3 which can stably expresses SND1 protein. Methods The fragment of FLAG-SND1 was cloned from pCMV-FLAG-SND1 plasmid, and then was inserted into lentivirus vector pLVX-IRES-Hyg. The lentivirus expression vector pLVX-FLAG-SND1 was established and was transiently transfected into 293T cells for 48 h. Western blotting was employed to determine SND1 expression. Then the lentivirus expression vector was co-transfected into 293T cells with packaging plasmids to obtain the recombinant lentivirus carrying FLAG-SND1. The lentivirus was collected to infect SKOV3 cells. After 48 h of infection, 1 μg/mL hygromycin B was used to screen the infected cells, so as to obtain a cell line with stable expression of SND1 protein. The expression level of SND1 was detected by Western blotting. Results Double restriction enzyme digestion and DNA sequencing demonstrated the lentivirus expression vector pLVX-FLAG-SND1 was constructed. The recombinant plasmids were transiently transfected into 293T cells, and the expression level was significantly higher than that of the wild-type SKOV3 cells (P<0.01). In the SKOV3 cells which stably expressed SND1 after infection and drug screening, the expression of SND1 was significantly higher than that of the wild-type SKOV3 cells (P<0.01). Conclusion The SND1 gene lentivirus vector pLVX-FLAG-SND1 is constructed successfully and we screen the SKOV3 cell line stably overexpressing SND1 via lentivirus system.
SND1 gene; lentivirus vector; SKOV3 cells; ovarian carcinoma
国家杰出青年基金资助项目(31125012);教育部“创新团队发展计划”(IRT13085);国家自然科学基金资助项目(31370749/31571380);天津市应用基础与前沿技术研究计划青年基金项目(15JCQNJC09900)。
任媛媛(1984-),女,助理实验师,研究方向为生物化学与分子生物学。E-mail: happyxinyuren@126.com
杨洁(1968-),女,教授,研究方向为细胞因子及其信号传导通路。E-mail: yangj@tijmu.edu.cn
10.3969/j.issn.1002-266X.2016.28.001
Q591.2;Q784
A
1002-266X(2016)28-0001-04
2016-02-26)

