喉癌组织糖原合成酶激酶3β、T细胞因子4表达及意义
魏金龙,刘鸣,王苏亮,赵治明,杨艳,李晶,袁雪
(1哈尔滨医科大学附属第二医院,哈尔滨150001;2齐齐哈尔医学院附属第二医院)
喉癌组织糖原合成酶激酶3β、T细胞因子4表达及意义
魏金龙1,2,刘鸣1,王苏亮2,赵治明2,杨艳2,李晶2,袁雪2
(1哈尔滨医科大学附属第二医院,哈尔滨150001;2齐齐哈尔医学院附属第二医院)
目的 探讨糖原合成酶激酶3β(GSK-3β)和T细胞因子4(TCF-4)在喉癌发生、发展中的作用。方法 采用免疫组织化学法检测45例喉癌患者喉癌组织(观察组)及其癌旁正常组织(对照组)GSK-3β和TCF-4的表达情况,分析喉癌组织GSK-3β、TCF-4阳性表达与患者临床病理参数的关系,探讨喉癌组织GSK-3β与TCF-4表达的关系。结果 观察组与对照组GSK-3β阳性表达率分别为86.67%、22.22%, TCF-4阳性表达率分别为80.00%、15.56%;两组比较P均<0.05。TCF-4、GSK-3β阳性表达均与喉癌组织分化程度、TNM分期和淋巴结转移有关(P均<0.05),与患者性别、年龄和肿瘤分型均无关(P均>0.05)。GSK-3β和TCF-4表达无相关性(r=0.292,P>0.05)。结论 喉癌组织GSK-3β、TCF-4高表达可促进喉癌的发生、发展。
喉癌;糖原合成酶激酶3β;T细胞因子4;Wnt信号传导通路
喉癌是头颈部常见的恶性肿瘤之一,近年来发病率逐年升高[1],但其发病机制尚未明确。研究发现,Wnt信号通路的信号表达异常与多种肿瘤的发生、发展关系密切[2,3]。糖原合成酶激酶3β(GSK-3β)和T细胞因子4(TCF-4)是Wnt信号通路中重要的信号分子。非小细胞肺癌组织中GSK-3β表达显著下降,影响β-链蛋白(β-catenin)的磷酸化降解过程[4],导致过量的β-catenin进入细胞核,与核内TCF-4特异性结合,激活Wnt靶基因启动子的转录过程,促进肿瘤的发生、发展。本研究观察喉癌组织中GSK-3β和TCF-4的表达情况,探讨Wnt信号通路在喉癌发生、发展中的作用。
1 材料与方法
1.1 临床资料 选取2013年1月~2015年12月齐齐哈尔医学院附属第二医院诊治的喉癌患者45例,男36例、女9例,年龄29~75(55.8±11.7)岁,均为鳞状细胞癌,其中声门型22例、声门上型19例、声门下型4例;根据美国癌症联合委员会(AJCC)2002年制定的喉癌TNM分期标准,Ⅰ期6例、Ⅱ期20例、Ⅲ期16例、Ⅳ期3例。均经手术治疗,术中取病理组织明确诊断;术中分别取喉癌组织0.5 cm×0.5 cm×0.1 cm作为观察组,取距肿瘤边缘≥3 cm处同样大小正常黏膜组织作为对照组。纳入标准:原发性喉癌;首次确诊为喉癌,术前未接受放疗、化疗、生物治疗等;临床资料完整。排除标准:合并内分泌疾病;确诊前曾使用雌激素或抗雌激素药物;合并其他原发性肿瘤。本研究通过我院伦理委员会批准,研究对象对本研究均知情同意。
1.2 GSK-3β、TCF-4表达检测 将两组标本经4%多聚甲醛固定,常规石蜡包埋,制成厚度为3~5 μm厚的切片,于60 ℃环境中烘烤12 h;脱蜡,入水;0.1 mol/L PBS冲洗,滴加山羊血清,室温下封闭20 min;滴加兔抗人TCF-4单克隆抗体(1∶150)、兔抗人GSK-3β单克隆抗体(1∶100)于4 ℃培养12 h;PBS冲洗后滴加生物素化二抗(IgG),37 ℃培养20 min;用PBS冲洗后滴加辣根过氧化物酶标记的链霉卵白素工作液(S-A/HRP),DAB试剂盒显色,苏木素复染,封片。实验步骤均严格按照试剂盒说明书进行。GSK-3β阳性表达定位于细胞质,呈棕黄色;TCF-4阳性表达定位于细胞质和细胞核,呈棕黄色。400倍镜下随机选取5个互不重叠的视野,计数视野内细胞数及阳性细胞数。阳性细胞百分比评分:<5%为0分,≥5%~25%为1分,>25%~50%为2分,>50%~80%为3分,>80%为4分;细胞染色程度评分:无染色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。两项评分相乘为0~4分为阴性,5~7分为弱阳性,8~12分为强阳性。弱阳性、强阳性均记为阳性。分析喉癌组织GSK-3β、TCF-4阳性表达与患者临床病理参数的关系。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验,相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 GSK-3β、TCF-4表达 观察组GSK-3β表达阴性6例、弱阳性24例、强阳性15例,阳性表达率为86.67%;对照组分别为36、9、1例及22.22%;观察组阳性表达率高于对照组(P<0.05)。观察组TCF-4表达阴性9例、弱阳性17例、强阳性19例,阳性表达率为80.00%;对照组分别为38、6、1例及15.56%;观察组阳性表达率高于对照组(P<0.05)。见插页Ⅲ图6。
2.2 喉癌组织TCF-4、GSK-3β阳性表达与患者临床病理参数的关系 喉癌组织TCF-4、GSK-3β阳性表达与肿瘤分化程度、TNM分期和淋巴结转移均有关(P均<0.05),与患者性别、年龄和肿瘤分型均无关(P均>0.05)。见表1。
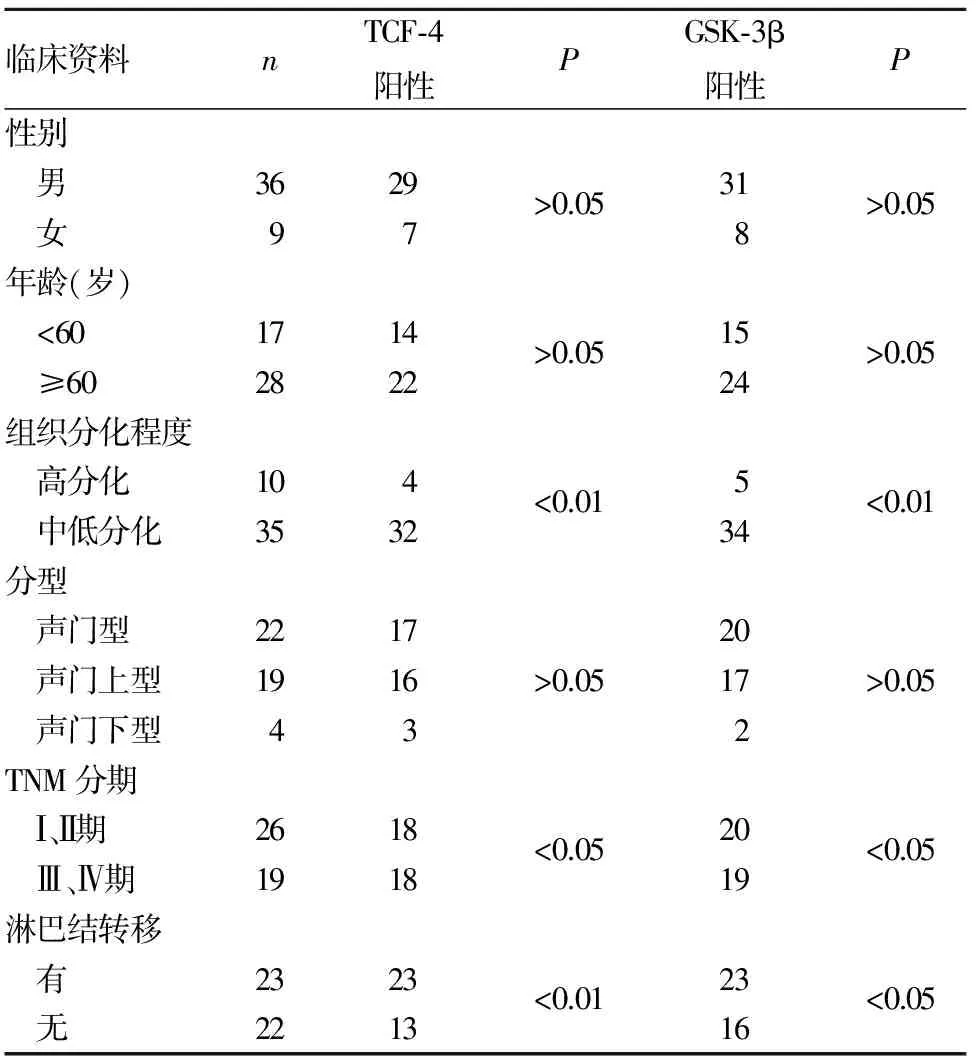
表1 喉癌组织TCF-4、GSK-3β表达与患者临床病理参数的关系(例)
2.3 喉癌组织中GSK-3β与TCF-4阳性表达的关系 喉癌组织中GSK-3β和TCF-4阳性表达无相关性(r=0.292,P>0.05)。
3 讨论
导致喉癌发生的因素有很多,如吸烟、空气污染等环境因素及信号通路异常等分子生物学因素等[5]。Wnt信号通路广泛存在于无脊椎动物和脊椎动物中,是一类在物种进化过程中高度保守的信号通路。Wnt信号通路传导异常与多种肿瘤的发生均关系密切。李冬等[6]利用香烟烟雾对肺癌小鼠模型进行刺激,发现小鼠肺癌组织中TNF-α和β-catenin表达显著升高,继而通过Akt/GSK-3β途径激活Wnt/β-catenin信号通路。Wnt信号通路通过Wnt蛋白与细胞表面的Frizzled受体结合,导致细胞质中的Dishevelled蛋白接受上游信号,抑制细胞质中腺瘤性结肠息肉病蛋白(APC)、轴蛋白(Axin)和GSK-3β之间形成复合物,从而避免细胞质内β-catenin被大量降解,导致多余的β-catenin进入细胞核,与其内的TCF-4结合,启动下游靶基因的转录[7];此通路上任何一个位点发生变异,均可能导致肿瘤的发生。
本研究发现,喉癌组织GSK-3β、TCF-4阳性表达率均显著高于癌旁正常黏膜组织,TCF-4、GSK-3β阳性表达均与喉癌分化程度、TNM分期和淋巴结转移有关,与Li等[8]研究结果相似,提示Wnt信号通路异常参与喉癌的发生、发展。原因可能为喉癌细胞内APC基因发生突变,导致体内合成的APC蛋白不具有与β-catenin、GSK-3β形成复合物的能力[9,10]。GSK-3β作为Wnt通路中重要的的负性调节因素,可以将β-catenin中的丝氨酸和苏氨酸位点磷酸化,使β-catenin大量降解,从而沉默Wnt通路[11,12]。GSK-3β亦可使APC发生磷酸化,降解β-catenin,沉默Wnt通路[13,14]。当存在Wnt信号刺激时,喉癌细胞质内大量β-catenin蓄积,并与核内的TCF-4结合,形成的复合体激活Wnt靶基因,促使其发生转录,促进肿瘤细胞的增殖。结合上述研究结果,推测虽然喉癌组织GSK-3β蛋白阳性表达率显著高于癌旁正常黏膜组织,但绝大部分处于失活状态,无法在细胞质内形成APC-GSK-3β-Axin复合体,无法降解细胞质中的β-catenin,故仍然有大量β-catenin进入细胞核,进而激活TCF-4/LEF-1通路,启动喉癌靶基因,促进癌症的发生。本研究喉癌组织中GSK-3β和TCF-4表达无相关性,也间接支持上述推论。Wang等[15]认为,细胞质中GSK-3β被磷酸化可导致其失活;Cuilliere-Dartigues等[16]则认为,喉癌发生过程中可能存在其他通路导致TCF-4水平异常升高;但GSK-3β失活的确切机制有待进一步研究。
综上所述,喉癌组织GSK-3β、TCF-4阳性表达显著升高,二者高表达导致Wnt信号传导通路异常,进而促进喉癌的发生、发展,但其具体作用机制有待进一步研究。
[1] 潘新良.强化喉癌的规范化治疗不断提高喉癌治疗水平[J].中华耳鼻咽喉头颈外科杂志,2014,49(8):617-619.
[2] 袁程,许新华.Wnt/β-catenin 信号通路在鼻咽癌肿瘤干细胞中作用的研究进展[J].广东医学,2015,36(20):3242-3244.
[3] Philipp I, Aufschnaiter R, Ozbek S, et al. Wnt/beta-Catenin and noncanonical Wnt signaling interact in tissue evagination in the simple eumetazoan Hydra[J]. Proc Natl Acad Sci U S A, 2009,106(11):4290-4295.
[4] Liu W, Huang YJ, Liu C, et al. Inhibition of TBK1 attenuates radiation-induced epithelial-mesenchymal transition of A549 human lung cancer cells via activation of GSK-3 beta and repression of ZEB1[J]. Lab Invest, 2014,94(4):362-370.
[5] 梁国祥,刘丽,蔡海燕,等.喉癌病因分析[J].临床医学,2011,31(6):98.
[6] 李冬,万海英,姚懿雯,等.香烟烟雾激活肺癌细胞Wnt/β-catenin信号途径的机制研究[J].中国癌症杂志,2014,24(12):881-888.
[7] 环奕.WNT信号通路与肿瘤[J].基础医学与临床,2006,26(8):922-925.
[8] Li Y, Wang Z, Kong D, et al. Regulation of Akt/FOXO3a/GSK-3 beta/AR signaling network by isoflavone in prostate cancer cells[J]. J Biol Chem, 2008,283(41):27707-27716.
[9] Park EJ, Chung HJ, Park HJ, et al. Suppression of Src/ERK and GSK-3/β-catenin signaling by pinosylvin inhibits the growth of human colorectal cancer cells[J]. Food Chem Toxicol, 2013(55):424-433.
[10] 徐丽娜,范松青.Wnt/β-catenin信号转导通路异常及其在鼻咽癌发生中的作用[J].中国耳鼻咽喉颅底外科杂志,2008,14(4):316-320.
[11] 陶丽,盛晓波,刘玉萍,等.GSK-3β活性调节与肿瘤治疗[J].中国药理学通报,2014,30(6):741-743,744.
[12] 王菲莉.Wnt-1、β-catenin在鼻咽癌组织中的表达及其临床意义[J].癌症,2009(1):91-95.
[13] 吴红霞,郑绘霞,梁建芳,等.Wnt信号通路中GSK-3β和CD44 v6在人结直肠肿瘤组织中的表达及意义[J].山西医科大学学报,2015,46(12):1203-1207.
[14] Bush BM, Brock AT, Deng JA, et al. The Wnt/β-catenin/T-cell factor 4 pathway up-regulates high-mobility group A1 expression in colon cancer[J]. Cell Biochem Function, 2013,31(3):228-236.
[15] Wang H, Fang R, Wang XF, et al. Stabilization of snail through AKT/GSK-3β signaling pathway is required for TNF-α-induced epithelial-mesenchymal transition in prostate cancer PC3 cells[J]. Eur J Pharmacol, 2013,714(1/3):48-55.
[16] Cuilliere-Dartigues P, El Bchiri J, Krimi A, et al. TCF-4 isoforms absent in TCF-4 mutated MSI-H colorectal cancer cells colocalize with nuclear CtBP and repress TCF-4-mediated transcription[J]. Oncogene, 2006,25(32):4441-4448.
齐齐哈尔市科学技术研究与发展计划项目(SFGG201446);哈尔滨医科大学附属第二医院科研项目。
刘鸣(E-mail: 244544098@qq.com)
10.3969/j.issn.1002-266X.2016.28.021
R739.6
B
1002-266X(2016)28-0060-03
2016-01-22)

