黑果枸杞多糖的分离及LRP-80的单糖组成
刘树兴, 杜 丁, 郭林新, 花俊丽, 杨 麒, 冯丽琴
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
黑果枸杞多糖的分离及LRP-80的单糖组成
刘树兴, 杜 丁, 郭林新, 花俊丽, 杨 麒, 冯丽琴
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
超声波辅助法提取三氯乙酸脱蛋白制备黑果枸杞粗多糖,蒸馏水复溶后用95%乙醇分级沉淀得到4种多糖LRP-60、LRP-70、LRP-80和LRP-90;以多糖保留率和除杂率作为评价指标,探索AB-8、HPD100和D101大孔吸附树脂及聚酰胺对黑果枸杞多糖纯化结果的影响;采用高效毛细管电泳对LRP-80作单糖组成分析.结果表明:在同等条件下,HPD100 大孔吸附树脂对粗多糖的纯化效果较好; LRP-80 由鼠李糖、阿拉伯糖、葡萄糖和半乳糖4 种单糖组成,且摩尔比为Rha∶Ara∶Glc∶Gal=0.3∶2.2∶1.0∶1.5.
黑果枸杞; 多糖; 分离纯化; 单糖组成
0 引言
黑果枸杞(Lycium ruthenicum Murr.)为茄科(Solanaceae)枸杞属(Lycium)植物,是一种生长在我国青海、新疆等西北地区的野生植物资源,具有较高的光合效率和较强的耐环境压力[1].枸杞作为补药已有数千年历史,而黑果枸杞含有更多的营养成分[2],其味甜多汁,富含糖类、色素、微量元素、黄酮、甜菜碱,以及鞣质等[3].黑果枸杞作为一种药食两用的植物,也可作为一种天然的抗氧化剂,值得开发和利用.
多糖,是由大量单糖通过糖苷键链接起来的一类碳水化合物的组成[4],具有抗肿瘤、抗衰老、抗疲劳、降血脂、降血糖,调节免疫等多种保健功能[5,6].国内外研究发现,合理摄入天然抗氧化剂可预防和延缓癌症、动脉粥样硬化、痴呆和衰老等退行性疾病的发生与发展[7,8].
黑果枸杞多糖近年来被广泛关注,多集中在提取纯化工艺的研究,对其结构研究相对较少,也被发现具有抗疲劳、降血脂、缓解防治糖尿病等的作用[9].
本研究拟对黑果枸杞多糖的分离纯化及单糖组成进行测定,以期为其资源开发利用提供理论依据.
1 材料与方法
1.1 材料与仪器
1.1.1 材料
黑果枸杞干果,含水量0.6%,购于青海久实中药材开发有限公司;三氯乙酸、乙醇、葡萄糖、浓硫酸、苯酚、DNS等试剂均为分析纯;葡萄糖、木糖、阿拉伯糖、甘露糖、鼠李糖、半乳糖、葡萄糖醛酸,美国Sigma公司.
1.1.2 仪器
UV-2600型分光光度计,尤尼柯(上海)仪器有限公司;HH-S6型电热恒温水浴锅,北京科伟永兴仪器有限公司;HK-06B 型摇摆式粉碎机,广州市旭朗机械设备有限公司;DZF型真空干燥箱,北京科伟永兴仪器有限公司;FD-1D-50型冷冻干燥机,上海比朗仪器制造有限公司; Beckman P/ACETM MDQ高效毛细管电泳仪,美国Beckman公司.
1.2 实验方法
1.2.1 黑果枸杞多糖的提取分离
称取黑果枸杞粉末50 g , 超声波辅助法提取,提取参数为:超声功率为200 W,料液比为1∶30,提取温度为70 ℃,提取时间为30 min.提取两次,合并两次提取液, 离心取上清液,浓缩,加入10%三氯乙酸4 ℃静置24 h,重复两次去蛋白.离心取上清液浓缩,加入95%乙醇至乙醇含量达到80%,4 ℃静置48 h,离心所得沉淀,依次用无水乙醇、丙酮、乙醚各洗2次,真空冷冻干燥得黑果枸杞粗多糖,记为LRP.
分级沉淀:将黑果枸杞粗多糖用蒸馏水复溶,加入95%乙醇,使乙醇体积分数达到60%,4 ℃下静置48 h,离心取沉淀,真空冷冻干燥得到多糖LRP-60.上清液继续加入95%乙醇至乙醇体积分数为70% ,通过上述步骤离心、沉淀并冷冻干燥后多糖样品为LRP-70.依照上述步骤,再分别得到LRP-80和 LRP-90.
1.2.2 多糖的纯化
(1)树脂的预处理
用90%以上的乙醇浸泡24 h,以蒸馏水洗至无醇味,然后用5%的盐酸浸泡8 h,以蒸馏水洗至中性,再用5%的氢氧化钠溶液浸泡8 h,用蒸馏水洗至中性,备用[10].
(2) 动态吸附
以蒸馏水作为洗脱剂,分别将粗多糖水溶液经过AB-8、HPD100和D101大孔树脂及聚酰胺层析柱进行纯化.进样流速2 mL/min , 洗脱速度为10滴/min,收集洗脱液,浓缩冻干后用紫外-可见光谱定量分析,以多糖的除杂率和保留率为评价指标,选择纯化效果较好的树脂纯化黑果枸杞多糖[11].
1.2.3 多糖含量、保留率及除杂率的测定
选用苯酚-硫酸法联合DNS法测定黑果枸杞多糖的含量[12,13].
(1)葡萄糖标准溶液的配制
精密称取干燥至恒重的无水葡萄糖对照品25 mg,置于250 mL 量瓶中,加入适量蒸馏水溶解,定容,摇匀,即得0.1 mg/mL葡萄糖储备液a;如法配制浓度为1.5 mg/mL的葡萄糖储备液b.
(2)供试品溶液的制备
将四个组分的多糖提取液分别定容至1 000 mL,作为测定还原糖的供试样品.另取还原糖供试样品溶液1.5 mL于100 mL量瓶中,蒸馏水定容,作为测定总糖的供试品溶液.
(3)总糖含量测定
总糖含量采用苯酚-硫酸法测定.精密吸取葡萄糖储备液a:0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL分别置于具塞试管中,加水至2 mL.精密加入1 mL 5% 苯酚溶液,摇匀后加入5 mL浓硫酸,混匀后放置10 min,于40 ℃水浴中保温15 min,取出后冷却至室温.以蒸馏水为空白对照,于波长490 nm处测定吸光度,以吸收度(A1)对葡萄糖含量(X1)作回归计算,得出回归方程.取2 mL总糖供试品溶液,按标准曲线方法操作,测定吸光度,根据标准曲线计算总糖含量.
(4)还原糖含量测定
还原糖含量采用DNS法测定.精密吸取葡萄糖储备液b:0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL分别置于具塞试管中,加水至2 mL,再分别加入1.5 mL DNS试剂,混匀后于沸水浴中加热5 min,取出迅速冷却至室温,加水定容至25 mL.以蒸馏水为空白对照,于波长540 nm 处测定吸光度,以吸光度(A2)对葡萄糖含量(X2)作回归计算,得出回归方程.取1 mL 还原糖样品溶液,按标准曲线方法操作,测定吸光度,根据标准曲线计算还原糖含量.
(5)多糖含量、保留率、除杂率的计算
多糖含量:总糖含量减去还原糖含量即为多糖含量.
多糖含量(%)=(X1-X2)n/m×100%
(1)
式(1)中:m—为黑果枸杞样品的质量,g;n—为稀释倍数;X1—为测总糖含量时葡萄糖含量;X2—为测还原糖含量时葡萄糖含量.
多糖保留率的计算公式[11]:
多糖保留率=m1/m2×100%
(2)
式(2)中:m1、m2后分别为吸附前后的多糖总质量.
除杂率的计算公式[11]:
除杂率=(A3-A3/A4)×100%
(3)
式(3)中:A3为吸附前吸光度;A4为吸附后吸光度.
1.2.4 红外光谱分析
称取1 mg的多糖样品,与100 mg KBr 充分混匀,压片,在4 000~400 cm-1波数范围内进行红外光谱扫描.
1.2.5 LRP-80的单糖组成
LRP-80的单糖组成采用高效毛细管电泳确定[14,15].
(1) 单糖标准品的α-萘胺衍生化
衍生试剂的配制:称取α-萘胺143.2 mg和NaBH3CN 35 mg,溶于450μL无水甲醇中,再加入41μL冰乙酸,置于冰箱中待用.
单糖的α-萘胺衍生:用超纯水配成浓度为20 mg/mL的各种单糖标准溶液,各取200μL,加入40μL衍生试剂置于安瓿管中封管,80 ℃恒温2 h衍生化.然后各加入三氯甲烷和重蒸水各1 mL,反复离心萃取3次,取上层水相过滤后,冷藏备用.
(2) LRP-80水解样品的制备
取LRP-80样品20 mg,加入1 mol/L H2SO41 mg,封管100 ℃恒温水解8 h,冷却后用碳酸钡完全中和,静置过夜,过滤取200μL,依照单糖的衍生方法衍生化.
(3) 单糖及LRP-80的测定
将衍生化的标准品及LRP-80试液经孔径0.45μm的微滤膜过滤后,进行毛细管电泳,根据各吸收峰的峰面积计算单糖组成的相对比例.
2 结果与讨论
2.1 纯化结果比对
各种大孔吸附树脂对枸杞多糖提取液的除杂率和保留率见表1所示.
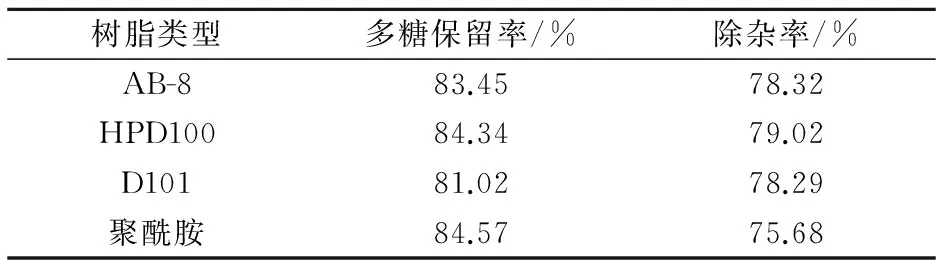
表1 不同型号大孔吸附树脂对多糖 提取液的除杂率和保留率
通过数据分析,综合考虑,本实验选择HPD100进行纯化.
2.2 黑果枸杞中多糖的含量
以标准葡萄糖溶液质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程:A1=4.795X1+0.035 1,R2=0.998 5;A2=4.96X2+0.056 6,R2=0.997 7.
通过分级沉淀后测得LRP-60、LRP-70 、LRP-80和LRP-90的质量分别为1.21g、0.67g、0.57g、0.38g.
而通过紫外光谱定性测得LRP-60、LRP-70 、LRP-80和LRP-90的含量分别为69.27%、76.07%、78.11%、74.43%.
综合以上数据分析,选择LRP-80的样品进行单糖组成研究.
2.3 红外光谱分析
红外光谱分析结果如图1所示.黑果枸杞多糖具有典型的多糖吸收峰3 420cm-1、2 926cm-1、1 738cm-1、1 648cm-1、1 424cm-1[16].其中,3 420cm-1处的吸收峰主要是多糖的配糖体羟基缔合引起的伸缩振动,由于羟基形成氢键缔合,偶极矩增大,所以在3 420cm-1处表现强而宽的峰;2 926cm-1处的吸收峰是由碳键的伸缩振动引起的,强度相对较弱;1 738cm-1处的吸收峰是C=O(-COOH)的伸缩振动吸收;1 424cm-1处的吸收峰为C-H弯曲振动.1 251cm-1处的吸收峰表示-COOH中的O-H的变角振动和C-O-C的非对称;1 090cm-1处的吸收峰表明此处为C-O键的伸缩振动,是碳氧键伸缩振动的特征,689cm-1处的吸收峰表明黑果枸杞多糖具有吡喃糖环的骨架结构.
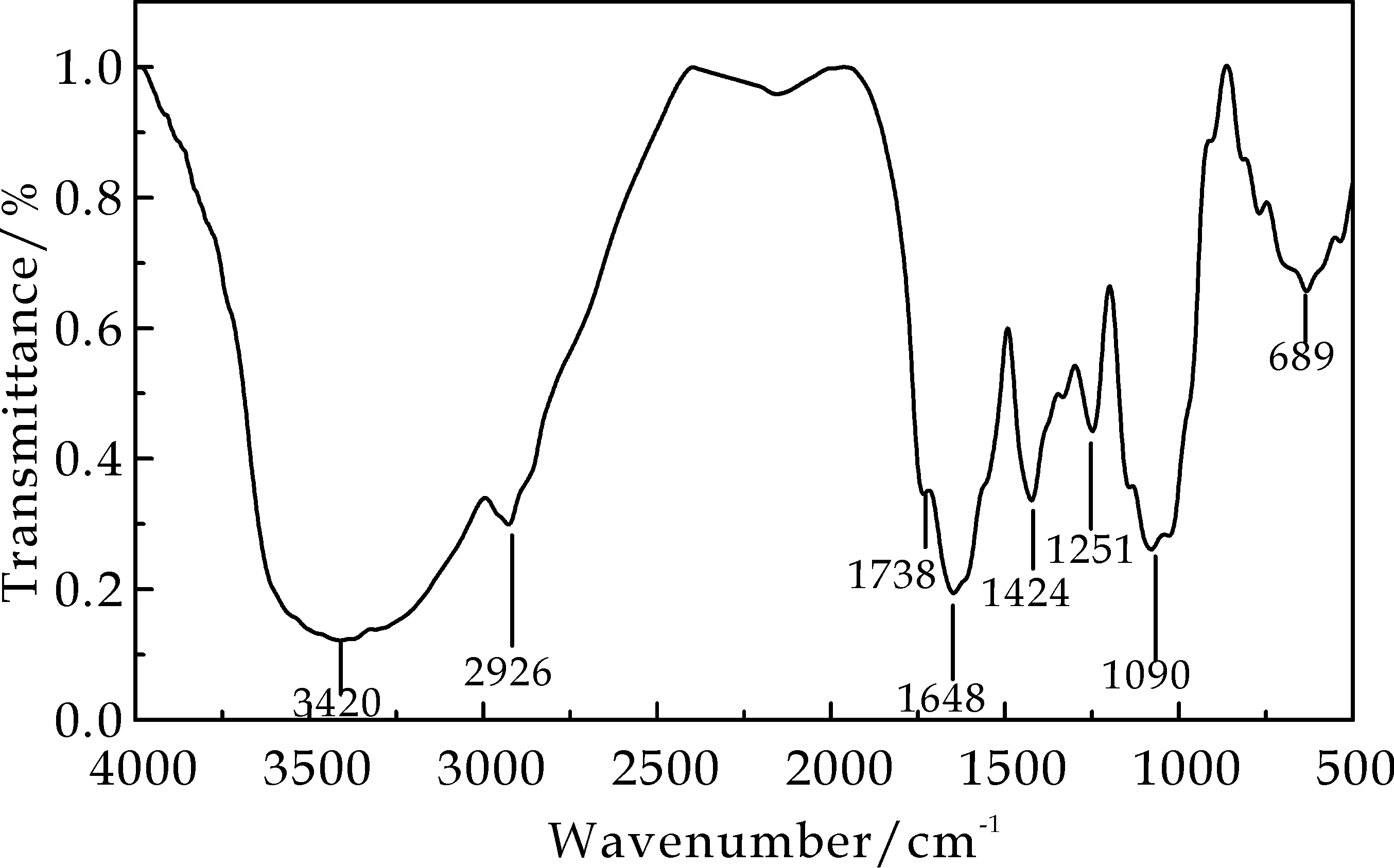
图1 LRP-80的红外光谱
2.4LRP-80的单糖组成分析
LRP-80的单糖组成如图2(b)所示,是由LRP-80鼠李糖、阿拉伯糖、葡糖糖及半乳糖4种单糖组成.其中以阿拉伯糖含量最多,鼠李糖的含量较少.根据峰面积计算出LRP-80的组成比例为Rha∶Ara∶Glc∶Gal=0.3∶2.2∶1.0∶1.5.
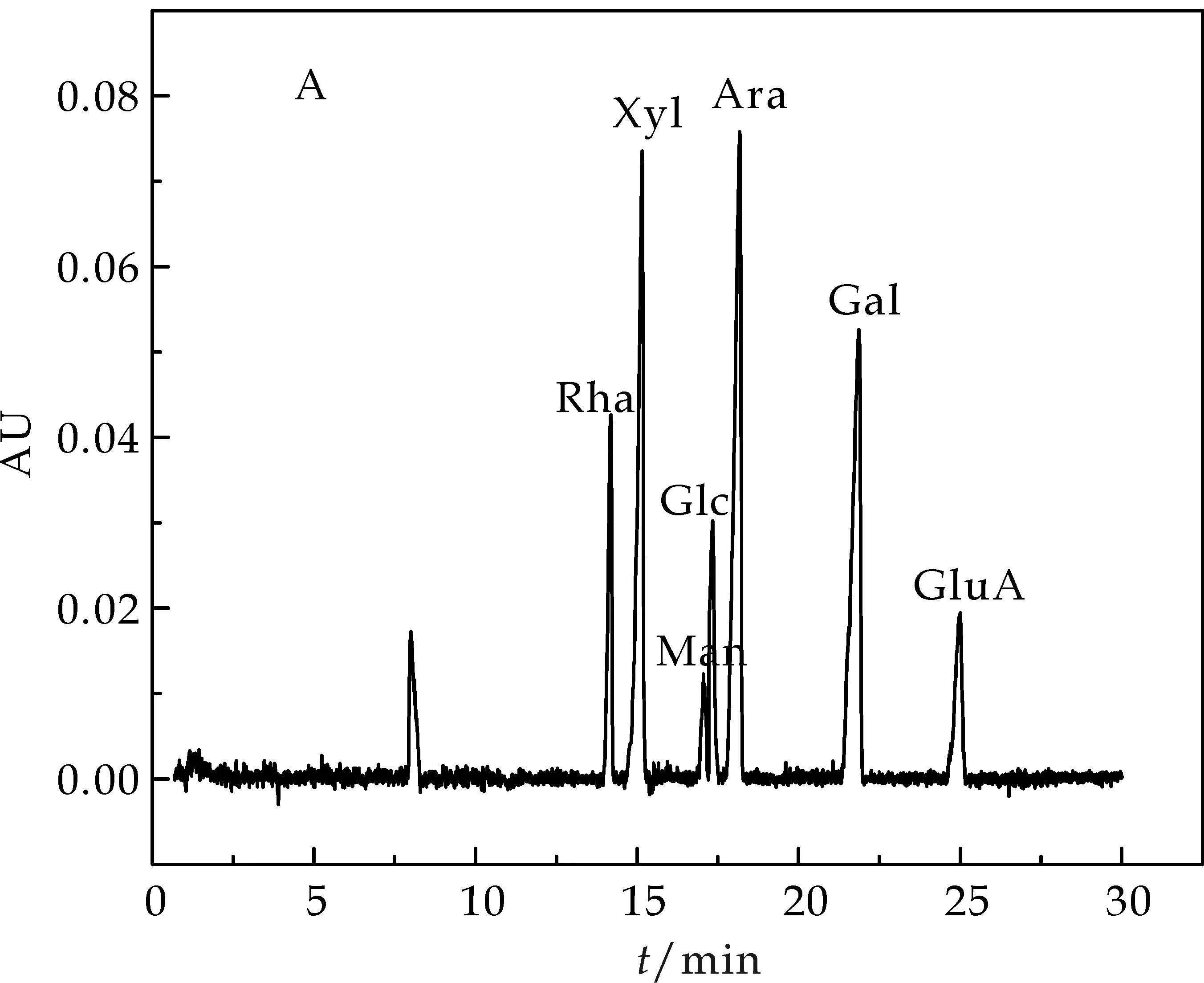
(a)单糖标准品毛细管电泳图
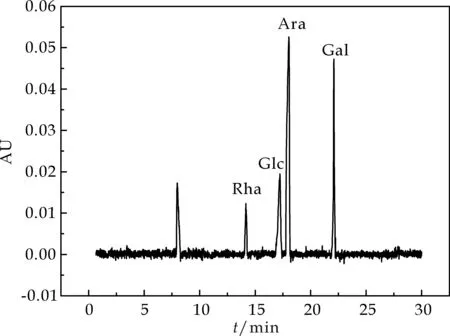
(b)LRP-80的单糖组成图2 单糖组成
3 结论
黑果枸杞粗多糖为浅褐色、易溶于水、不溶于乙醇、丙酮等有机溶剂的粉末状固体.紫外光谱定性分析得出LRP-60、LRP-70 、LRP-80和LRP-90的含量,综合考虑,用LRP-80进行高效毛细管电泳实验,测出其由鼠李糖、阿拉伯糖、葡萄糖和半乳糖四种单糖组成,通过峰面积计算得出这四种单糖的摩尔比为Rha∶Ara∶Glc∶Gal=0.3∶2.2∶1.0∶1.5.黑果枸杞内在的机理、理化性质、结构和活性仍将是今后研究的重点.
[1]XiaopengLv,ChengjianWang,YangCheng,etal.IsolationandstructuralcharacterizationofapolysaccharideLRP4-AfromLyciumruthenicumMurr[J].CarbohydrateResearch,2013,365(2):20-25.
[2] 陈红军,侯旭杰,白红进,等,黑果枸杞中的几种营养成分的分析[J].中国野生植物资源,2002(2):55.
[3] 彭 强,白雪芳,杜昱光.黑果枸杞多糖的研究进展[J].农产品加工(学刊),2010(12):77-79.
[4]ZongA,CaoH,WangF.Anticancerpolysaccharidesfromnaturalresources:Areviewofrecentresearch[J].CarbohydratePolymers,2012,90:1 395-1 410.
[5] 陈 亮, 张 炜, 陈元涛,等.响应面法优化黑果枸杞多糖的超声提取工艺[J].食品科技,2015,40(1):220-227.
[6] 黄秋婷, 陈远峰.枸杞多糖的研究及其进展[J].食品研究与开发,2006,27(1):172-174.
[7]KalioraAC,DedoussisGVZ,SchmidtH.Dietaryantioxidantsinpreventingatherogenesis[J].Atherosclerosis,2006,187(1):1-17.
[8]WilliamPryorA.VitaminEandheartdiseasebasicsciencetoclinicalinterventiontrials[J].FreeRadicalBiologyandMedicine,2000,28(1):141-164.
[9] 马玉婷.黑果枸杞酒渣花色苷、多糖制备及其功能研究[D].乌鲁木齐:新疆师范大学,2012.
[10] 鲁晓丽,刘继婷,张自萍.大孔吸附树脂脱除枸杞多糖色素技术研究[J].食品工业科技,2014,35(18):293-297.
[11] 肖 珊,刘 江,张 淼,等.不同型号大孔吸附树脂对枸杞多糖纯化工艺影响的研究[J].广东化工,2015,42(7):21-22.
[12] 毛淑敏,许家珍,周帅飞,等.苯酚-硫酸法联合DNS法测定金银花不同花期多糖的含量[J].中南药学,2015,13(1):65-67.
[13] 张文芳,陈丹红.茯苓中多糖含量的测定方法研究[J].福建轻纺,2015(5):35-39.
[14] 汲晨锋,季宇彬.高效毛细管电泳法测定香菇多糖中单糖的组成[J].化学与黏合,2006,28(4):276-278.
[15] 耿 越,王建波,刘靓雯,等.高效毛细管电泳法测定玉米花粉多糖中单糖的组成[J].中草药,2005,36(8):1 164-1 166.
[16] 朱彩萍,张 民,张声华.枸杞多糖的组成及结构分析[J].中草药,2006,37(6):872-874.
【责任编辑:蒋亚儒】
Isolation of polysaccharides from Lycium ruthenicum Murr.and monosaccharide composition of LRP-80
LIU Shu-xing, DU Ding, GUO Lin-xin, HUA Jun-li, YANG Qi, FENG Li-qin
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
In this paper,polysaccharides of Lycium ruthenicum Murr. were extracted with ultrasonic extraction and deproteinized by three chloroacetic acid.After rehydration with distilled water,soluble polysaccharides were successively fractionated by different gradient concentrations of ethanol( 60%,70%,80%,90%) into four precipitation fractions,named LRP-60,LRP-70, LRP-80 or LRP-90.Considering the quality and content of polysaccharides,further research of LRP-80 was determined.By removal rate and polysaccharide retention rate as evaluation index,it is best for the purification effect of HPD100 among AB-8,HPD100,D101 three types of macroporous adsorption resin and polyamide adsorption method to polysaccharides of Lycium ruthenicum Murr.Monosaccharide composition analysis revealed that LRP-80 mainly consisted of rhamnose,arabinose,glucose,and galactose in the molar ratio of 0.3∶2.2∶1.0∶1.5.
Lycium ruthenicum Murr.; polysaccharide; isolation and purification; monosaccharide composition
2016-05-27
陕西省科技厅科学技术研究发展计划项目(2014SJ-06-02)
刘树兴(1962-),男,河南新乡人,教授,研究方向:食品加工及食品添加剂开发应用
1000-5811(2016)05-0119-04
TS218
A

