痛风与高尿酸血症患者血清黄嘌呤氧化酶与炎症因子水平比较*
邓建平,林 雯
(1.武汉科技大学医学院,湖北武汉 430081;2.湖北省黄石市爱康医院,湖北黄石 435000)
·临床研究·
痛风与高尿酸血症患者血清黄嘌呤氧化酶与炎症因子水平比较*
邓建平1,2,林 雯2△
(1.武汉科技大学医学院,湖北武汉 430081;2.湖北省黄石市爱康医院,湖北黄石 435000)
目的 观察痛风和高尿酸血症患者血清中黄嘌呤氧化酶、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)等炎症因子的表达水平。方法 采用酶联免疫吸附法(ELISA)检测20例痛风初次发作患者(痛风组)、20例高尿酸血症患者(高尿酸血症组)及20例健康志愿者(健康对照组)血清中黄嘌呤氧化酶、IL-6、IL-8的水平,比较3个实验组中各项指标的表达差异。结果 痛风组患者急性发作期的黄嘌呤氧化酶、IL-6、IL-8及血尿酸、C反应蛋白、血沉的水平显著高于高尿酸血症组及健康对照组(P<0.01);高尿酸血症组显著高于健康对照组(P<0.01)。结论 痛风患者急性发作期血清中的黄嘌呤氧化酶表达水平明显升高且血尿酸、C反应蛋白、IL-6、IL-8及血沉等炎症指标在痛风发病的过程中起到了重要作用。
痛风; 黄嘌呤氧化酶; 高尿酸血症; 白细胞介素
痛风性关节炎是由于嘌呤代谢紊乱导致血尿酸持续升高,并能造成组织器官损伤的一组代谢性疾病。常表现为痛风性急性关节炎导致的关节剧痛、软组织的痛风石沉积、慢性间质性肾炎和肾尿酸结石等临床症状。临床研究表明,高尿酸血症也是心血管疾病的独立危险因素[1-2]。既往痛风是“帝王病”,现在则成为常见病,是仅次于糖尿病的第二大类疾病。我国高尿酸血症男性患病率为1.4%~32.1%,女性患病率为1.3%~21.8%;约有5%~12%的高尿酸血症患者最终发展为痛风[3-4],1995~2005年间痛风患病率增加48%。已知黄嘌呤氧化酶可加速次黄嘌呤氧化成黄嘌呤,进而加速黄嘌呤生成尿酸引发高尿酸血症。近年来,随着分子生物学的发展,认为肿瘤坏死因子、白细胞介素等细胞因子也参与到痛风性关节炎、高尿酸血症等疾病的发生、发展过程中。本文通过检测患者血清中黄嘌呤氧化酶及相关炎症因子的表达水平,探讨其在痛风及高尿酸血症发病过程中的作用。
1 资料与方法
1.1 一般资料 收集2014年1~12月黄石市爱康医院门诊和住院20例急性痛风首次发病的患者作为痛风组。诊断均符合1977年美国风湿病学会痛风的诊断标准[5]。痛风急性发作期符合以下条件:(1)痛风初次发作0~48 h内,临床表现为寡关节肿胀疼痛,患者主诉疼痛程度评分(VRS-4法)大于5分;(2)炎症指标(血沉和C反应蛋白)升高。高尿酸血症患者组20例,诊断均符合男性患者血清尿酸水平大于420 μmol/L,女性大于360 μmol/L。健康对照组20例,均来自同期在本院健康体检中心常规体检的健康志愿者。本研究得到黄石市伦理委员会批准,受试者均知情同意。所有受试者均排除合并有心血管系统疾病、恶性肿瘤、肝病、肾功能障碍、高血压、糖尿病、其他急慢性炎症、感染及自身免疫性疾病等其他疾病病史者。分组情况见表1。

表1 痛风组、高尿酸血症组及健康对照组人群
1.2 方法 所有受试者空腹8 h以上,晨起抽取外周静脉血4 mL。室温静止1小时后,3 000 r/min离心10 min,收集上清液,于-80℃冰箱保存待测。痛风组急性发作期患者采血前未予以任何治疗。采用全自动生化分析仪(贝克曼AU5800)测定其血尿酸水平和超敏C反应蛋白浓度,采用酶联免疫吸附法测定黄嘌呤氧化酶、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)水平(试剂盒购自上海佳和生物科技有限公司),采用魏氏法测定血沉(一次性血沉管购自武汉海盛科贸有限公司)。操作严格按照说明书进行。
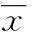
2 结 果
痛风组黄嘌呤氧化酶、IL-6、IL-8、血沉、血尿酸、CRP水平明显高于高尿酸血症组、对照组(P<0.01)。高尿酸血症组显著高于对照组(P<0.01),见表2。
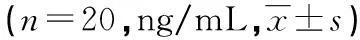
表2 痛风组、高尿酸血症组及健康对照组实验室
3 讨 论
近年来,我国人民的生活水平日益提高,痛风和高尿酸血症的发病率也逐年上升,并有年轻化的趋势,对整个社会的生产生活造成了很大的经济负担。研究显示,黄嘌呤氧化酶能够催化次黄嘌呤和黄嘌呤生成尿酸。因此,当黄嘌呤氧化酶活性升高时,会引发尿酸生成过多,尿酸水平升高。然而,一项来自欧洲的流行病学调查显示血尿酸水平大于590 μmol/L的高尿酸血症患者的痛风5年累积患病风险也仅为30.5%[6]。临床也发现,相当一部分高尿酸血症患者甚至有MSU沉积的患者并没有发展成为痛风。因此,痛风急性发作可能还需要其他因素的共同参与。本研究中,痛风患者初次急性发作期黄嘌呤氧化酶表达水平显著高于高尿酸血症组和健康对照组。提示黄嘌呤氧化酶水平升高可能会加重关节损害。
痛风的发病机制十分复杂[7],它的急性发作是尿酸钠微晶体在关节周围组织沉积引起的一种急性炎症反应,同时有研究显示无症状的高尿酸血症状态,也会造成关节病变;一些白介素等细胞因子如IL-6[8-9]、IL-8[10]在此起到了重要作用。本文中IL-6、IL-8在痛风急性期均呈高表达状态,且明显高于高尿酸血症期,被认为与痛风的病情活动性相关。因此,在痛风和高尿酸血症的治疗中,可考虑同时降低黄嘌呤氧化酶活性以及相关炎症因子水平。本研究在后续的工作中将会扩大样本量,对黄嘌呤氧化酶及IL-6、IL-8与痛风及高尿酸血症之间的相关性进行深入探讨。
[1]Iseki K,Ikemiya Y,Inoue T,et al.Significance of hyperuricemia as a risk factorfor developing ESRD in a screened cohort[J].Am J Kidney Dis,2004,44(4):642-650.
[2]Sundström J,Sullivan L,D′Agostino RB,et al.Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence[J].Hypertension,2005,45(1):28-33.
[3]Poons H,Hallh A,Zimmermann B.Approach to the treatment of hyperuricemia[J].Med Health,2009,92(3):359-362.
[4]Dubchak N,Falasca GF.New and improved strategies for the treatment of gout[J].Int J Nephrol Renovasc Dis,2010,3:145-166.
[5]Wallace SL,Robinson H,Masi AT,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[6]Annemans L,Spaepen E,Gaskin M,et al.Gout in the UK and Germany:prevalence,comorbidities and management in general practice 2000-2005[J].Ann Rheum Dis,2008,67(7):960-966.
[7]Joosten LA,Netea MG,Mylona E,et al.Engagement of fatty acids with Toll-like receptor 2 drives interleukin-1β production via the ASC/caspase 1 pathway in monosodium urate monohydrate crystal-induced gouty arthritis[J].Arthritis Rheum,2010,6(20):3237-3248.
[8]Takahashi M.Inflammatory cytokines in the pathogenesis of atherosclerosis[J].Nippon Rinsho,2011,69(1):30-33.
[9]Punzi L,Calo L,Plobani M.Clinical significance of cytokine determination in synovial fluid[J].Crit Rev Clin Lab Sci,2002,39(1):63.
[10]Fransès RE,McWilliams DF,Mapp PI,et al.Osteochondral angiogenesis and increased protease inhibitor expression in OA[J].Osteoarthritis Cartilage,2010,18(4):563-571.
湖北省自然科学基金项目(2014CFC1039)。
△
,E-mail:3yue12@sina.com。
10.3969/j.issn.1673-4130.2016.07.033 文献标识码:A 文章编号:1673-4130(2016)07-0953-02
2015-12-10)

