阿魏酸钠治疗糖皮质激素性骨质疏松的实验研究
刘 洋,陈 臖,翟玉莹,叶小天,肖 珊,柯诗韵,李青南,杨国柱,卢 丽,陆幸妍
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广东广州 510006)
阿魏酸钠治疗糖皮质激素性骨质疏松的实验研究
刘 洋,陈 臖,翟玉莹,叶小天,肖 珊,柯诗韵,李青南,杨国柱,卢 丽,陆幸妍
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广东广州 510006)
目的 探讨阿魏酸钠对于大鼠糖皮质激素性骨质疏松症的治疗作用。方法 3月龄Wistar大鼠随机均分5组:对照组、模型组、治疗组(阿魏酸钠低、中、高剂量组)。动物处死前进行钙黄绿素双荧光标记。采用骨组织形态计量学方法测量胫骨的静态参数、动态参数、骨组织细胞和生长板变化。结果 ①静态参数:与对照组相比,模型组骨小梁面积百分数、骨小梁厚度、骨小梁数量明显减少,骨小梁分离度增大;与模型组相比,阿魏酸钠中、高剂量组骨小梁面积百分数、骨小梁厚度、骨小梁数量明显增加,骨小梁分离度明显减小。低剂量组骨小梁厚度明显增加。②动态参数:与对照组相比,模型组标记周长百分数、骨转化率、骨表面新骨形成率明显增大;与模型组相比,中、高剂量组新骨年形成率增加。③骨组织细胞:与对照组相比,模型组单位骨小梁面积成骨细胞数量、破骨细胞数量以及成骨细胞周长占骨小梁周长百分率均明显增加。与模型组相比:各个实验组均没有明显变化。④生长板:与对照组相比,模型组生长板宽明显增大;与模型组相比,各实验组生长板退行细胞高度、生长板宽均没有明显变化。结论 阿魏酸钠对糖皮质激素性骨质疏松的治疗作用主要体现在增加骨量和改善骨小梁结构,并促进骨形成。
糖皮质激素性骨质疏松;阿魏酸钠;骨组织形态计量学;骨组织细胞;生长板;骨小梁;松质骨
糖皮质激素性骨质疏松症(glucocorticoid-in-duced osteoporosis,GIOP)是目前发病率最高最常见的继发性骨质疏松症。糖皮质激素诱导的细胞氧化应激反应,损伤成骨细胞、使成骨细胞凋亡增加[1]。但由于其强大抗炎和免疫抑制作用,很多患者必须长期甚至终生大剂量使用糖皮质激素[2]。现有研究多是针对糖皮质激素用药时骨骼的变化,而对停药后及停药后药物治疗对大鼠骨骼变化的研究较少。
阿魏酸钠(sodium ferulate,SF)是一种稳定的、低毒性、水溶性内皮素受体拮抗剂,具有防止DNA的损伤,抗细胞凋亡,保护内皮细胞,促进血管平滑肌细胞增殖,改善局部血液供给等多种生理功能[3]。已有研究发现SF具有刺激体外培养的成骨细胞(osteoblast,Ob)增殖、分化和矿化的功能,可以促进成骨相关基因的表达[4]。近来有国外学者报道,应用阿魏酸钠来治疗骨关节炎、软骨退变取得了较好的疗效[5]。阿魏酸钠有较强的舒张血管的作用,可有效减轻血流瘀滞状态[6],减少骨坏死的发生率;另据报道,阿魏酸钠可以有效地促进去卵巢大鼠的骨重建作用,抑制去卵巢大鼠骨吸收作用[7-8]。但是对于糖皮质激素性骨质疏松症干预治疗的研究,尚未见报道。
1 材料与方法
1.1 材料
1.1.1 实验动物 3月龄♀Wistar大鼠30只(SPF级,中山大学动物中心提供),许可证号:44008500006272,体质量(220±15)g,标准饲料,室温。
1.1.2 药品与试剂 地塞米松磷酸钠注射液(辰欣药业股份有限公司,批号:1405216421,规格1 ml:2 mg)、荧光标记物Calcein(Sigma Chemcal Co.USA);2-Methyloxethyl acetate(Sigma Chemcal Co.USA);甲基丙烯酸甲酯(成都市新都区木兰镇工业开发区);邻苯二甲酸二丁酯(成都市科龙化工试剂厂);过氧化苯甲酰(天津市福晨化学试剂厂)。
1.1.3 仪器 硬组织切片机(德国Leica RM2255);骨组织形态计量学测量系统(美国BIOQUANT OS-TEO公司)。
1.2 动物分组和实验处理
1.2.1 动物分组 Wistar大鼠随机分成5组:对照组(Con组肌肉注射生理盐水120 d);模型组[Mod组肌注地塞米松(Dex)1 mg·kg-1每周5次,90 d,停药肌注生理盐水恢复30 d];阿魏酸钠治疗组[低、中、高剂量组(Low、Mid、Hig组),肌注Dex 1 mg·kg-1,每周5次,90 d,停药10 d,分别肌注阿魏酸钠(20、40、80 mg·kg-1·d-1,20 d)]。
1.2.2 动物处理 所有大鼠每周称体重1次。并按体重变化调整给药量。所有动物处死前d 14、13 和d 4、3分别皮下注射钙黄绿素,进行双荧光标记。取实验组大鼠胫骨,经不脱钙包埋后,根据文献方法[9],用Leica RM2255型切片机(Leica Co.Germa-ny)将PTM松质骨切出5 μm薄片和9 μm厚片,5 μm薄片经脱塑后采用甲苯胺蓝染色法对切片染色,9 μm经脱塑后荧光下观察。
1.3 骨组织形态计量学 采用骨组织形态计量学方法进行静态参数测量,通过相关静态参数包括骨小梁面积百分数(%Tb.Ar)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp),分析各组大鼠胫骨近心端松质骨骨量和骨结构变化情况。通过相关动态参数包括骨矿化沉积率(MAR)、标记周长百分数(%L.Pm)、新骨年形成率(BFR/TV)、骨转化率(BFR/BV)、骨表面新骨形成率(BFR/BS),分析各组大鼠胫骨近心端松质骨骨形成和骨代谢的变化情况[10-11];通过相关骨细胞参数包括单位骨小梁面积成骨细胞数量(Ob.N/BS)、破骨细胞数量(Oc.N/BS);以及成骨细胞周长占骨小梁周长百分率(%Ob.S/BS)和破骨细胞周长占骨小梁周长百分率(%Oc.S/BS)。松质骨生长板变化情况测量其生长板宽(G.P.Wi)和退行细胞高度(D.C.H)。
2 结果
Tab 1 Comparison of static parameters of cancellous bone proximal tibia in different groups(±s,n=6)
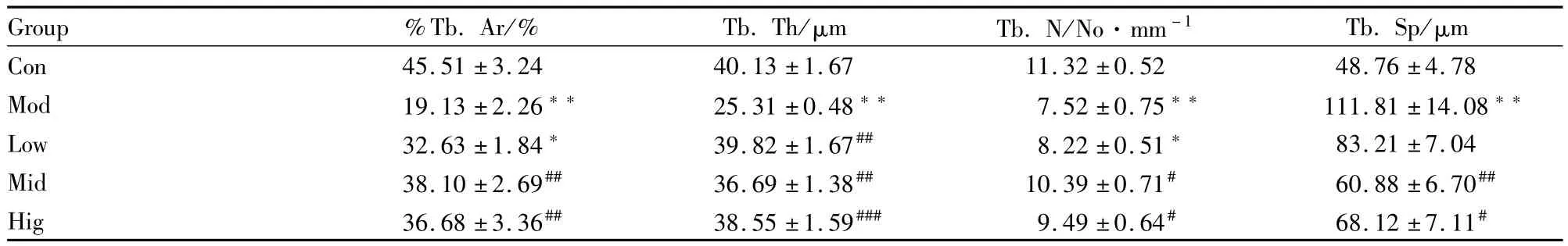
Tab 1 Comparison of static parameters of cancellous bone proximal tibia in different groups(±s,n=6)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
4.78 Mod 19.13±2.26** 25.31±0.48** 7.52±0.75** 111.81±14.08**Low 32.63±1.84* 39.82±1.67## 8.22±0.51* 83.21±7.04 Mid 38.10±2.69## 36.69±1.38## 10.39±0.71# 60.88±6.70##Hig 36.68±3.36## 38.55±1.59### 9.49±0.64# 68.12±7.11 Group %Tb.Ar/% Tb.Th/μm Tb.N/No·mm-1 Tb.Sp/μm Con 45.51±3.24 40.13±1.67 11.32±0.52 48.76± #
2.1 PTM骨量骨结构变化 如Fig 1、Tab 1所示:与对照组相比,模型组%Tb.Ar减小(P<0.01),Tb.Th明显减小(P<0.01),Tb.N明显减少(P< 0.01),Tb.Sp明显增大(P<0.01)。与模型组相比,阿魏酸钠中、高剂量组%Tb.Ar增大(P<0.01),Tb.Th明显增加(P<0.01),Tb.Sp明显增大(P<0.05)。Tb.Sp明显减少(高剂量组P<0.05,中剂量组P<0.01)。
Tab 2 Comparison of dynamic parameters of cancellous bone proximal tibia in different groups(±s,n=6)

Tab 2 Comparison of dynamic parameters of cancellous bone proximal tibia in different groups(±s,n=6)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
Group MAR/μm %L.Pm/% BFR/TV/%·y-1 BFR/BV/%·y-1 BFR/BS/%·y -1 Con 1.22±0.08 2.63±0.29 21.21±1.84 61.34±5.24 1151±64.83 Mod 1.14±0.05 6.13±0.92* 28.57±3.50 202.4±32.39** 2557±403.1*Low 1.17±0.08 7.59±0.62** 46.31±5.40** 155.1±20.00** 3320±511.9**Mid 1.49±0.16 7.56±1.03** 65.40±5.09**## 217.8±18.83** 4014±439.4**Hig 1.39±0.14 6.57±1.09* 51.53±9.94*# 175.8±33.95* 3446±719.0*
Tab 3 Comparison of bone formation and resorption parameters of cancellous bone proximal tibia in different groups(±s,n=6)

Tab 3 Comparison of bone formation and resorption parameters of cancellous bone proximal tibia in different groups(±s,n=6)
*P<0.05,**P<0.01 vs control.
Group Ob.N/BS/N·mm-1 %Ob.S/BS/% Oc.N/BS/No·mm-1%Oc.S/BS/% Con 3.61±0.55 97.07±16.92 3.43±0.60 46.68±9.85 Mod 8.41±1.46* 336.0±83.14* 8.19±1.432* 219.9±45.37**Low 7.96±1.43* 248.0±63.42* 7.034±1.77 153.2±16.39**Mid 6.18±1.08 355.5±94.49* 8.59±1.53* 134.3±15.53**Hig 8.98±0.47** 323.9±57.40** 7.77±0.97** 220.6±14.33**

Fig 1 Effects of dexametha-sone and dexamethasone plus SF at different doses on bone histomorphometry of cancel-lous bone proximal tibia in Toluidine blue-stained(5 μm,×20)

Fig 2 Fluorescent Calcein markers in bone formation of proximal tibia(9 μm,×100)
2.2 PTM骨形成骨代谢影响 如Fig 2、Tab 2所示:与对照组相比,模型组%L.Pm明显增大(P<0.05),BFR/BV明显增大(P<0.01),BFR/BS明显增大(P<0.05)。与模型组相比,阿魏酸钠中、高剂量组新骨年形成率明显增大(中剂量组P<0.01,高剂量组P<0.05)。
2.3 PTM骨组织细胞 骨小梁表面成骨细胞和破骨细胞如Fig 3、Tab 3所示:与对照组相比,模型组Ob.N/BS、%Ob.S/BS、Oc.N/BS明显增加(P<0.05),%Oc.S/BS明显增加(P<0.01)。与模型组相比,各个实验组均没有明显变化。

Fig 3 Osteoblast(dashed lines)and osteoclast(solid lines)in adjacent trabecular bone labeled in Toluidine blue-stained(5 μm,×200)
2.4 PTM生长板影响 如Fig 4、Tab 4所示:与对照组相比,模型组生长板宽明显增大(P<0.05)。与模型组相比,阿魏酸钠各组生长板退行细胞高度、生长板宽均没有明显变化。

Fig 4 Effects of dexametha-sone and dexamethasone plus SF in different dose on bone histomorphometry of growth plate(5 μm,×200)
Tab 4 Comparison of histomorphometry parameter of growth plate in different groups(±s,n=6)

Tab 4 Comparison of histomorphometry parameter of growth plate in different groups(±s,n=6)
*P<0.05,**P<0.01 vs control
Group G.P.Wi/μm D.C.H/μm Con 73.21±2.93 11.97±0.73 Mod 89.38±4.61* 15.39±1.96 Low 95.37±8.56* 15.52±1.37 Mid 93.15±7.51* 15.66±1.33 Hig 95.27±4.45** 18.18±1.37***
3 讨论
骨代谢平衡是指成骨细胞的骨形成作用生成新骨,破骨细胞的骨吸收作用吸收旧骨,骨形成和骨吸收动态平衡[12],而骨量的改变是骨代谢平衡的结果。目前研究普遍认为,糖皮质激素给药,抑制了肠钙吸收及骨钙、磷重吸收,会促进成骨细胞和骨细胞的凋亡,使成骨细胞失活,抑制成骨细胞的功能[13]。停用糖皮质激素,成骨细胞的功能可逐渐恢复,随着停用时间的延长,骨质疏松症状有所恢复[14]。本实验结果显示模型组骨形成明显增加,在细胞水平发现模型组成骨细胞和破骨细胞都增加,但骨量和骨小梁结构没有恢复,原因可能是停药30 d的时间增加骨转换,但不足以大鼠骨质疏松症状完全恢复。
有研究表明,阿魏酸钠通过抑制炎症反应,可以维护缺血区域神经元的基本结构功能[15];同时阿魏酸钠还可以提高VEGF以及其它骨生长因子,如TGF-13、BMP等表达,从而促进了局部血管增生和成骨细胞分化,使成骨细胞活性增强[16];本研究中阿魏酸钠促进成骨细胞增殖作用不明显,但是其明显增强成骨细胞的骨形成作用。另外阿魏酸钠上的酚羟基结构可使氧自由基发生还原反应,降低氧自由基水平,减少氧自由基对细胞和组织的损害等作用[17-18]。本研究发现与模型组相比,阿魏酸钠组骨转化明显增加,这可能是由于阿魏酸钠对细胞的保护从而使成骨细胞在骨的形成和修复中发挥作用。
生长板是位于长骨两端骨骺和骨干之间的软骨组织。可分裂、成熟、肥大,以软骨内成骨的方式对于长骨生长具有重要作用[19]。大鼠成熟后,软骨增殖潜能逐渐下降[20],本实验所用大鼠为7月龄,糖皮质激素使用90 d,停药30 d后模型组软骨细胞增殖区面积增大,这显示停用糖皮质激素后刺激软骨增殖能力。
综上所述:本研究发现糖皮质激素使用90 d,停药30 d后,模型组的骨量减少和骨结构被破坏的情况没有恢复;而应用阿魏酸钠治疗可以通过促进骨转化增加骨量和改善骨小梁结构。
(致谢:本研究相关实验主要在广东药科大学生命科学与生物制药学院骨骼与骨骼肌疾病研究室和广东省生物技术候选药物研究重点实验室完成,感谢以上实验室的老师对本研究给予的支持。)
[1] Weinstein R S,Nicholas R W,Manolagas S C.Apoptosis of os-teocytes in glucocorticoid-induced osteonecrosis of the hip[J].Clin Endocrinol Metab,2000,85(8):2907-12.
[2] Schwetz V,Pieber T,Obermayer-Pietsch B.The endocrine role of the skeleton:background and clinical evidence[J].Eur J Endocri-nol,2012,166(6):959-67.
[3] Perluigi M,Joshi G,Sultana R,et al.In vivo protective effects of ferulic acid ethyl ester against amyloid-β peptide 1-42-induced oxi-dative stress[J].Neurosci Res,2006,84(2):418-26.
[4] 杨 雷,郭岱琦,颜 滨,等.阿魏酸对骨髓基质干细胞的成骨分化与增殖的影响实验研究[J].临床和实验医学杂志,2009,07:6-7.
[4] Yang L,Guo D Q,Yan B.The effects of ferulic acid on osteogen-ic differentiation and proliferation of bone marrow stromal stem cells:an experimental study[J].J Clin Exp Med,2009,07:6-7.
[5] Barone E,Calabrese V,Mancuso C.Ferulic acid and its thera-peutic potential as a hormetin for age-related diseases[J].Biogero-ntology,2009,10(2):97-108.
[6] Khanduja K L,Avti P K,Kumar S,et al.Anti-apoptotic activity of caffeic acid,ellagic acid and ferulic acid in normal human pe-ripheral blood mononuclear cells:a Bcl-2 independent mechanism [J].Biochim Biophys Acta,2006,1760(2):283-9.
[7] Tian L,Dang X Q,Wang C S,et al.Effects of sodium ferulate on preventing steroid-induced femoral head osteonecrosis in rabbits [J].J Zhejiang Univ Sci B,2013,14(5):426-37.
[8] Miller V M,Komori K,Burnett J C Jr,et al.Differential sensitivi- ty to endothelin in canine arteries and veins[J].Am J Physiol,1989,257(4 Pt 2):1127-31.
[9] 陈 臖,李凤华,袁顺仪,等.不同频率糖皮质激素骨质疏松造模对大鼠肱骨的影响[J].中国药理学通报,2013,29(3):393 -7.
[9] Chen J,Li F H,Yuan S Y,et al.Effects of different frequency glucocorticoid-induced osteopenia model on rat humerus[J].Chin Pharmacol Bull,2013,29(3):393-7.
[10]李青南.骨质疏松实验动物研究——骨组织形态计量学[M].成都:四川大学出版社,2001:68-81.
[10]Li Q N.The Study of Animal Experiment on Osteopenia[M].Chengdu:Sichuan University Press,2001:68-81.
[11]廖二元.谭利华主编.代谢性骨病学[M].北京:人民卫生出版社,2003:1052-8.
[11]Liao E Y,Tan L H.Metabolic Osteology[M].Beijing:People′s Medical Publishing House,2003:1052-8.
[12]Rodan G A.Bone homeostasis[J].Proc Natl Acad Sci USA,1998,95(23):13361-2.
[13]O′Brien C A,Jia D,Plotkin L I,et al.Glucocorticoids act direct-ly on osteoblasts and osteocytes to induce their apoptosis and re-duce bone formation and strength[J].Endocrinology,2004,145 (4):1835-41.
[14]曹丽梅,董培智,李 波.糖皮质激素诱导的骨质疏松大鼠模型综合评价[J].中国药事,2005,10:589-91.
[14]Cao L M,Dong P Z,Li B.Comprehensive assessment of rat model with glucocorticoid-induced osteoporosis[J].Chin Pharm Aff,2005,10:589-91.
[15]Cheng C Y,Su S Y,Tang N Y.Ferulic acid provides neuropro-tection against oxidative stress-related apoptosis after cerebral is-chemia/reperfusion injury by inhibiting ICAM-1 mRNA expression in rats[J].Brain Res,2008,1209:136-50.
[16]Rukkumani R,Aruna K,Varma P S,et al.Influence of ferulic acid on circulatory prooxidant-antioxidant status during alcohol and PUFA induced toxicity[J].Physiol Pharmacol,2004,55(3):551 -61.
[17]Graf E.Antioxidant potential of ferulic acid[J].Free Radic Biol Med,1992,13(4):435-48.
[18]Sudheer A R,Muthukumaran S,Kalpana C,et al.Protective effect of ferulic acid on nicotine-induced DNA damage and cellular changes in cultured rat peripheral blood lymphocytes:a compari-son with N-acetylcysteine[J].Toxicol In Vitro,2007,21(4):576 -85.
[19]Burdan F,Szumiło J,Korobowicz A,et al.Morphology and phys-iology of the epiphyseal growth plate[J].Folia Histochem Cytobiol,2009,47(1):5-16.
[20]李 涛,陈建庭,朱青安,等.不同年龄大鼠胸椎椎体生长板的组织学观察及增殖能力测定[J].南方医科大学学报,2011,31 (2):353-6.
[20]Li T,Chen J T,Zhu Q A,et al.Histology and proliferative capa-bility of thoracic vertebral body growth plates of rats at different a-ges[J].J Southern Med Univ,2011,31(2):353-6.
Effect of Sodium ferulate on glucocorticoid-induced osteoporosis
LIU Yang,CHEN Jun,ZHAI Yu-ying,YE Xiao-tian,XIAO Shan,KE Shi-yun,LI Qing-nan,YANG Guo-zhu,LU Li,LU Xing-yan
(School of Life Science and Biopharmacy,Guangdong Pharmaceutical University/Guangdong Provincial Key Laboratory of Biotechnology Candidate Drug Research,Guangzhou 510006,China)
Aim To study the influence of Sodium fer-ulate(SF)on bone metabolism in glucocorticoidin-duced osteoporosis rats.Methods Thirty cases of fe-male Wistar Rats(3-month-old)were divided into con-trol group,model group and SF group(low-dose group,middle-dose group,high-dose group)by ran-domized block design.Double fluorochrome labeling with calcein was performed before necropsy.The left tibia was taken for bone histomorphometry.Results In static parameters,the proximal tibia cancellous bone trabecular thickness,trabecular quantity and area ratio were significantly reduced in model group compared with control group;while compared with model group,those were increased in middle and high-dose SF group.Trabecular separation degree was increased in model group compared with control group,while it was decreased in middle and high-dose SF group compared with model group.In dynamic parameters,the calcula-tion parameters of cancellous bone mark perimeter rate and the bone formation rate were increased in model group compared with control group,in middle and high-dose SF group the bone formation rate was in-creased compared with model group.In bone cells,os-teoclast number per mm,osteoblast number per mm,percent osteoblast surface perimeter and percent osteo-clast surface perimeter were increased in model group compared with control group.In growth-plate,the thickness of growth-plate was increased in model group compared with control group.In bone cells and growth-plate there was no statistical significance between treat-ment group and model group.Conclusion This study demonstrates that SF can increase bone mass and im-prove bone structure,which may be related to the im-provement of bone formation.SF is effective for GIOP in rats.
GIOP;Sodium ferulate;bone histomor-phometry studies;bone cell;growth-plate;bone tra-becula;cancellous bone
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.038.html
10.3969/j.issn.1001-1978.2016.03.019
A
1001-1978(2016)03-0394-05
R-332;R323.72;R336;R681.05;R977.11
2015-10-04,
2015-11-24
国家自然科学基金面上项目(No 30971172);广东省科技计划项目(No 2013B060300022)
刘 洋(1989-),女,硕士生,研究方向:骨骼疾病药理药效学,Tel:020-39352201,E-mail:15817148003@139.com;李青南(1956-),女,博士,教授,研究员,研究方向:骨代谢病理生理及药理药效学,Tel:020-39352589,E-mail:qingnanli@sina.com;陆幸妍(1963-),女,副教授,研究方向:骨和骨骼肌代谢性疾病分子机制及药物靶点发现,通讯作者,Tel:020-39352201,E-mail:xingyanlu2005@126.com