超临界CO2萃取所得细齿樱桃籽油和挥发油的抗氧化活性和成分分析
杨潇,罗静,张广峰,秦佳
1(西华大学 食品与生物工程学院,四川 成都,610039) 2(小金县夹金山天然野樱桃酒业有限公司,四川 小金,624200)
超临界CO2萃取所得细齿樱桃籽油和挥发油的抗氧化活性和成分分析
杨潇1*,罗静1,张广峰1,秦佳2
1(西华大学 食品与生物工程学院,四川 成都,610039)2(小金县夹金山天然野樱桃酒业有限公司,四川 小金,624200)
摘要采用超临界CO2工艺萃取得到细齿樱桃籽油及其挥发油并对其抗氧化活性和化学成分进行分析。结果表明: 细齿樱桃籽油具有较高的抗氧化活性,其成分由14种脂肪酸组成, 其中不饱和脂肪酸占88.12%,主要为油酸(47.09%)和亚油酸(38.69%)。细齿樱桃籽挥发油经气相色谱-质谱联用-自动质谱退卷积定性系统(gas chromatography-mass spectrometry-automocted mass spectral deconfolotion and iderclification system, GC/MS/AMDIS)分析,鉴定出17种主要物质, 其中主要成分是具有多种药理学活性的β-谷甾醇(60.3%)。
关键词细齿樱桃籽油;挥发油;抗氧化;成分分析
细齿樱桃(CerasusserrulaFranch. Yu et Li),又名“四川樱桃”、“野樱桃”,属蔷薇科(Rosaceae)李亚科 (Prunoideae) 樱属(Cerasus)细齿组 (Sect.Serrula)乔木。主要分布于四川、云南、西藏,生长于海拔2 600~3 900 m的山坡草地和山谷林中[1]。属地域性稀缺特种资源,营养极为丰富,果肉和果皮可入药,具清肺利咽,止咳的功效。由于生长海拔高,少有病虫害浸袭和农药的污染,是不可多得的绿色食品。但细齿樱桃鲜果为低糖、高酸且不耐运输储藏,基本没有鲜果销售的商业价值。目前主要作为野樱桃果酒、罐头、果脯等深加工的原料,而在这些加工过程中产生的大量樱桃籽,则大部分用作动物饲料生产或直接废弃,造成极大的资源浪费和环境污染。
由于目前针对细齿樱桃籽开发的基础研究较少,本研究对采用超临界CO2萃取的细齿樱桃籽油和挥发油的抗氧化活性、理化性质及化学成分进行了全面的研究。
1材料与方法
1.1材料与试剂
细齿樱桃由小金县夹金山天然野樱桃酒业有限公司提供;CO2(纯度>99.0%),成都侨源气体有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picryhydrazyl,DPPH),购自美国Sigma公司; 石油醚、KOH、无水乙醚、三氯甲烷、无水Na2SO4,均为国产分析纯。
1.2仪器与设备
HA 221-50-06型超临界萃取装置,南通市华安超临界萃取设备有限公司;BS323S电子分析天平,赛多利斯科学仪器北京有限公司;XFB-400小型粉碎机, 中南制药机械厂;GCMS-2010 plus 气相色谱质谱联用仪,日本岛津;SOX-406脂肪测定仪,济南海能仪器股份有限公司;M100多功能酶标仪,奥地利Tecan公司。
1.3樱桃籽预处理
将樱桃果肉与樱桃籽进行分离,并将樱桃籽清洗后置于电热鼓风干燥箱中50 ℃烘干、粉碎,60目过筛后,置于干燥器内室待用。
1.4樱桃籽中粗脂肪含量和挥发油含量的测定
根据“GB/T 14772—2008 食品中粗脂肪的测定”所提供方法测定细齿樱桃籽中的粗脂肪含量。根据”GB/T 30385—2013 香辛料和调味品挥发油含量的测定”所提供方法检测细齿樱桃籽中挥发油含量。
1.5超临界CO2萃取樱桃籽油和挥发油
称取500 g樱桃籽粉装入超临界CO2萃取装置中,在萃取温度50 ℃、萃取时间120 min、CO2流量20 L/h的条件下进行萃取,分离釜1的压力10 MPa,温度40 ℃。分离釜2压力为5 MPa,温度30 ℃。从分离釜1和分离釜2中收集样品。
1.6超临界CO2萃取细齿樱桃籽油的理化性质测定
取超临界CO2萃取的细齿樱桃籽油,参照GB/T 5530—2005提供方法测定其酸值;参照“GB/T5532—2008 动植物油脂碘值的测定”中提供的方法测定碘值;参照“GB/T 5527—2010 动植物油脂折光指数的测定”中提供的方法测定折光指数;参照“GB/T 5534—2008 动植物油脂皂化值的测定” 中提供的方法测定皂化值;参照“GB/T 5535.1—2008 动植物油脂不皂化物测定”中提供的方法测定不皂化物含量;参照“GB/T 5537—2008 粮油检验磷脂含量的测定”中提供的方法测定磷脂含量。
1.7樱桃籽油和挥发油抗氧化活性测定
采用DPPH(1,1-diphenyl-2-picryhydrazyl)法进行抗氧化活性测定[2-3],通过检测对DPPH自由基清除率来比较超临界CO2萃取所得樱桃籽油和挥发油的抗氧化活性。取5 μL样品加入120 μL无水乙醇稀释,置于96孔酶标板中,加入275 μL的DPPH溶液,于酶标仪内室温避光反应90 min,同时以无水乙醇为空白,每5 min于517 nm波长处测定吸光值。 每个样品取4个平行样,按下列公式计算DPPH自由基清除率。同时以油酸为对照组。
DPPH自由基清除率/%=[1-(As-Ac)/A0]×100
式中:A0,125 μL无水乙醇 + 275 μL DPPH溶液的吸光度值;As,125 μL样品稀释液 + 275 μL DPPH溶液的吸光度值;Ac,125 μL样品稀释液 + 275 μL无水乙醇的吸光度值。
1.8樱桃籽油中脂肪酸组成分析
准确称取0.5 g 樱桃籽油于10 mL具塞试管中,分别加入5.0 mL 0.4 mol/L NaOH-甲醇溶液,涡旋混合20 s,每5 min摇匀1次,室温下反应40 min,分别加入5.0 mL正己烷,摇匀,静置分层,取上清液分别加入0.5 g无水Na2SO4干燥,用0.22 μm过滤器过滤后,供GC-MS联用仪分析。
分析条件如下:气相色谱条件:Rtx-5MS毛细管色谱柱(30 m ×0.25 mmID×0.25 μm); 采用程序升温,100℃维持6 min,6 ℃/min,升至230 ℃,停留10 min;载气为高纯He (99.999%),载气流量1.0 mL/min;柱前压57.4 kPa;汽化室温度为250 ℃;进样量1 μL;分流比10∶1。质谱条件:EI 离子源;离子源温度230 ℃;四极杆温度:200 ℃;接口温度250 ℃;电子能量70 eV;倍增器电压1.8 kV;溶剂延时4 min;扫描方式:SCAN;质量扫描范围40~550 amu。
1.9樱桃籽挥发油成分的GC/MS/AMDIS分析
取从分离釜2中收集所得樱桃籽挥发油,用甲醇按5%的比例将其稀释后采用GC/MS 联用仪进行检测,分析条件如下:气相色谱条件:Rtx-5MS毛细管色谱柱(30 m ×0.25 mmID×0.25 μm); 采用程序升温,150 ℃维持3 min,5 ℃/min,升至280 ℃,停留6 min;载气为高纯He (99.999%),载气流量1.0 mL/min;柱前压57.4 kPa;汽化室温度为220 ℃;进样量1 μL;分流比20∶1。质谱条件:EI 离子源;离子源温度230 ℃;四极杆温度:200 ℃;接口温度280 ℃;电子能量70 eV;倍增器电压1.8 kV;溶剂延时4 min;扫描方式:SCAN;质量扫描范围40~450 amu。由于樱桃籽挥发油中成分十分复杂,总离子流色谱图(TIC)中可能存在着重叠峰,甚至内嵌峰,从而影响成分的鉴别。因此可通过自动质谱退卷积定性系统(AMDIS,version 2.69, National Institute of Standards and Technology)进行重叠峰拆分分析[4],再应用NIST质谱搜索程序(version 2.0 d, National Institute of Standards and Technology)从NIST11谱库中检索出相应的化合物。
2结果与讨论
2.1超临界CO2萃取细齿樱桃籽油的理化性质
细齿樱桃籽中粗脂肪含量为(8.9±0.2) %,挥发油含量为(0.56±0.15) %。采用超临界CO2萃取后,从分离釜1中收集到呈淡黄色透明状的樱桃籽油, 从分离釜2中收集到呈无色透明状,具有芳香气味的樱桃籽挥发油。其中樱桃籽油经检测,其主要理化性质见表1。

表1 细齿樱桃籽油理化性质
2.2超临界CO2萃取细齿樱桃籽油的抗氧化活性分析
细齿樱桃籽油、挥发油与油酸对DPPH自由基清除率的时间效应变化见图1。当反应体系中存在5 μL/mL 油样的条件下,三者对DPPH自由基清除率均随着时间的延长先急剧增加而后趋于平稳。而细齿樱桃籽油对DPPH自由基的清除能力在多个时间点上均显著高于油酸,最终的自由基清除率超过50%,表明细齿樱桃籽油具有较高的抗氧化能力;而樱桃籽挥发油对DPPH自由基的清除能力却略低于油酸,表明其抗氧化能力并不高。这暗示着细齿樱桃籽油和挥发油具有完全不同的成分。
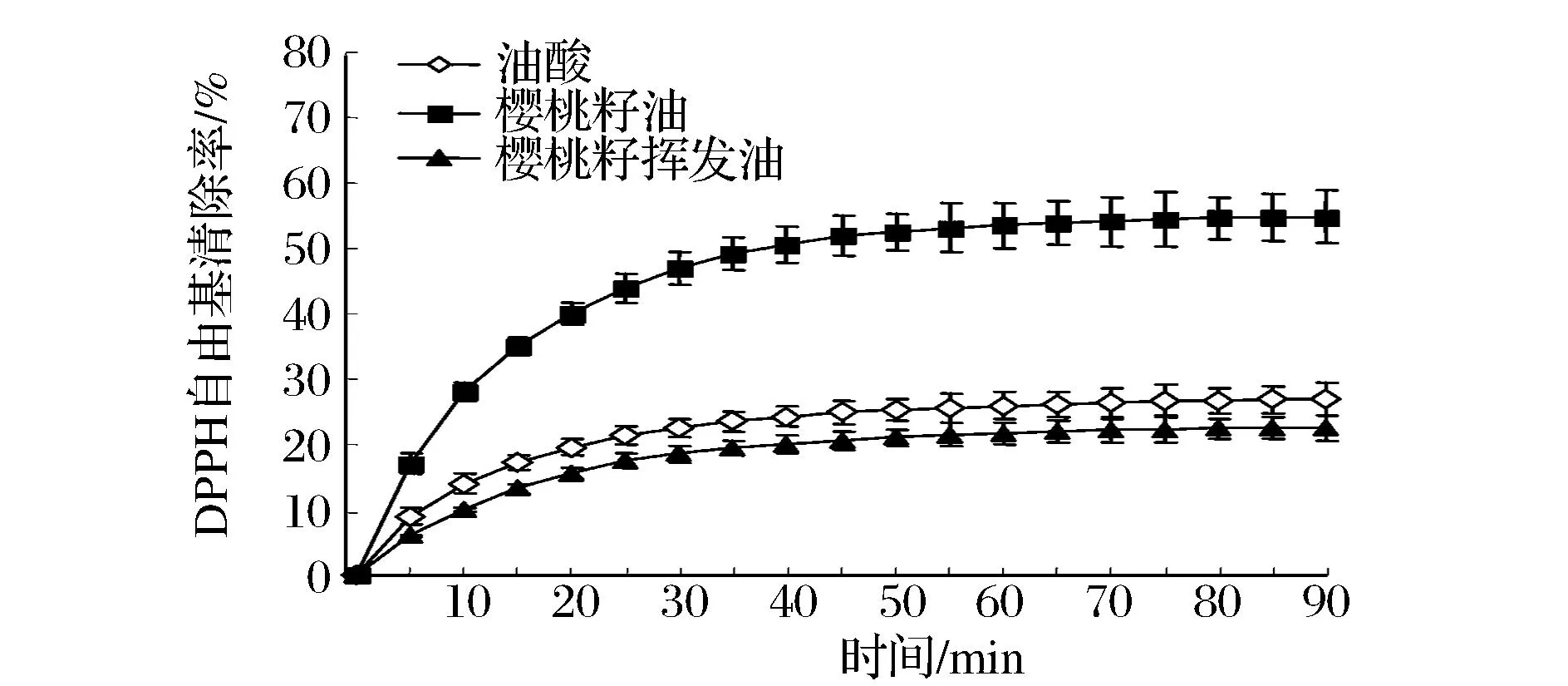
图1 樱桃籽油和挥发油自由基清除率时间效应曲线Fig.1 Time effect curve of free radicals clearance rate from serration cherry seed oil and volatile oil
2.3超临界CO2萃取细齿樱桃籽油的的脂肪酸组成
通过超临界CO2萃取工艺所得细齿樱桃籽油甲酯化处理后, 经GCMS分析所得TIC图见图2,经NIST08库比对检索,共检测出14种主要脂肪酸(见表2)。其中以油酸、亚油酸、亚麻酸为主的不饱和脂肪酸含量达88.18%,高于目前文献所报道的普通樱桃籽油中不饱和脂肪酸含量[5-7]。由于不饱和脂肪酸具有保证细胞的正常生理、酯化胆固醇降低血脂、改善血液微循环、提高脑细胞的活性等生理功能[8],因此细齿樱桃籽油具有较高的营养价值。但是油脂中不饱和脂肪酸含量较高又存在着易于氧化变质的问题,因此当以细齿樱桃籽为原料进行油脂加工时应实施抗氧化保护。
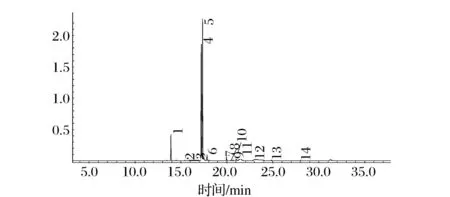
图2 细齿樱桃籽油脂肪酸甲酯总离子流色谱图Fig.2 TIC of serration cherry seed oil fatty acid methyl esters

序号甲酯化产物保留时间/min名称结构缩写相对含量/%113.913棕榈酸(hexadecanoicacid)C16∶05.43215.422棕榈油酸(9-hexadecenoicacid)C16∶10.06315.90315-甲基十六烷酸(methylisoheptadecanoate)C17∶00.05417.209亚油酸(9,12-octadecadienoicacid)C18∶238.69517.352油酸(9-octadecenoicacid)C18∶147.04617.833硬脂酸(octadecanoicacid)C18∶01.62719.957亚麻酸(9,12,15-Octadecatrienoicacid)C18∶31.15820.45711,14-二十碳二烯酸(11,14-Eicosadienoicacid)C20∶20.11920.6687,10,13-二十碳三烯酸(eicosatrienoicacid)C20∶30.291021.01311-二十烯酸(11-eicosenoicacid)C20∶10.841121.483花生酸(eicosanoicacidr)C20∶04.21223.198二十一碳烷酸(heneicosanoicacid)C21∶00.161324.868山嵛酸(docosanoicacid)C22∶00.281428.011二十四烷酸(tetracosanoicacid)C24∶00.08
2.4樱桃籽挥发油的化学成分
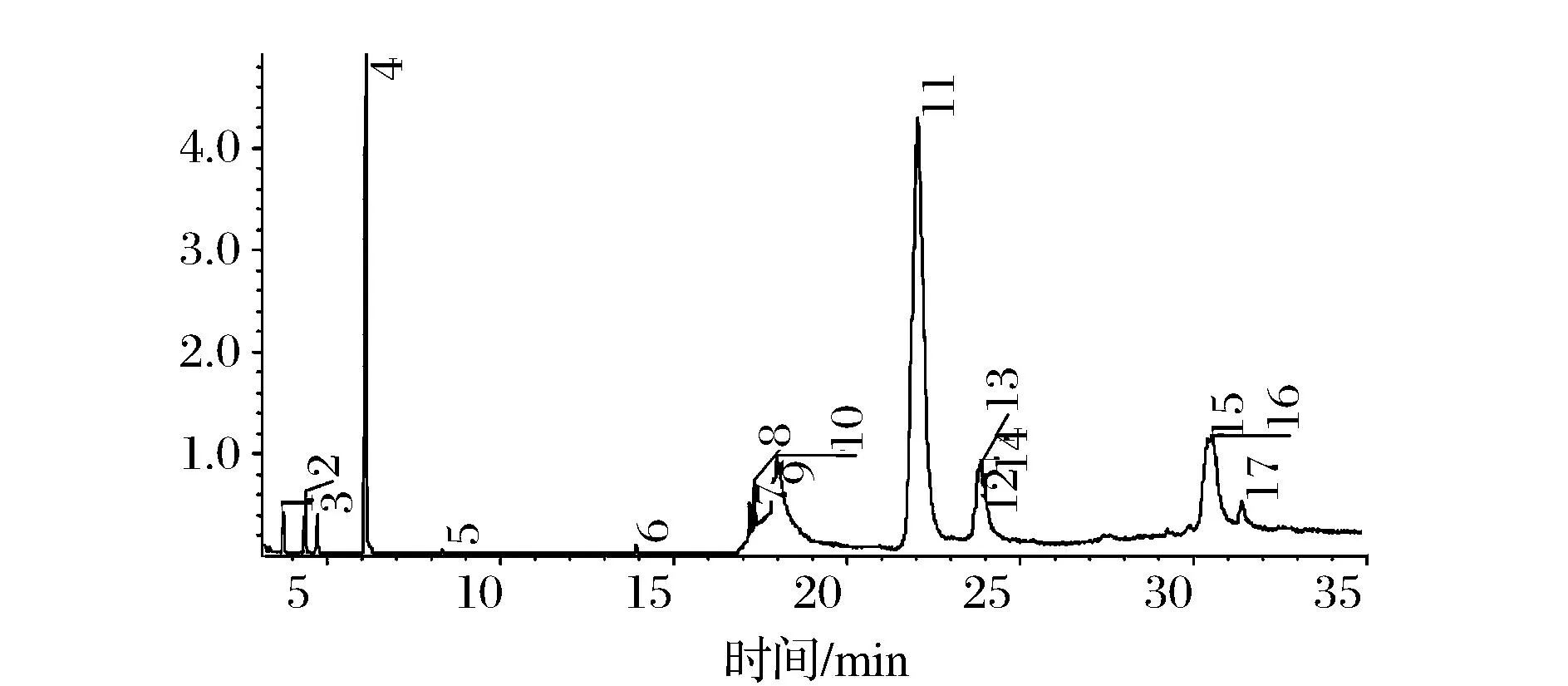
图3 细齿樱桃籽挥发油总离子流色谱图Fig.3 TIC of serration cherry seed volatile oil
超临界CO2萃取工艺所得细齿樱桃籽挥发油经GCMS-AMDIS分析后所得TIC图见图3,共鉴定出匹配因子大于750的化合物17种(见表3),其主要成分为β-谷甾醇、扁桃酰胺等,其中含量最高的β-谷甾醇被证明具有抗炎[9]、解热、降血脂[10]和抗肿瘤[11]等多种药理学活性,在医药领域具有广泛的用途。而最新的研究也表明樱桃籽挥发油对大、小鼠急性炎症模型都具有显著的抑炎症作用[12]。因此本研究的结果也阐明了樱桃籽挥发油中的抗炎症活性物质很可能就是其中高含量的β-谷甾醇。由于β-谷甾醇的含量高达60.3%,使得细齿樱桃籽挥发油可以作为β-谷甾醇的生产原料而具有重要的商业价值。
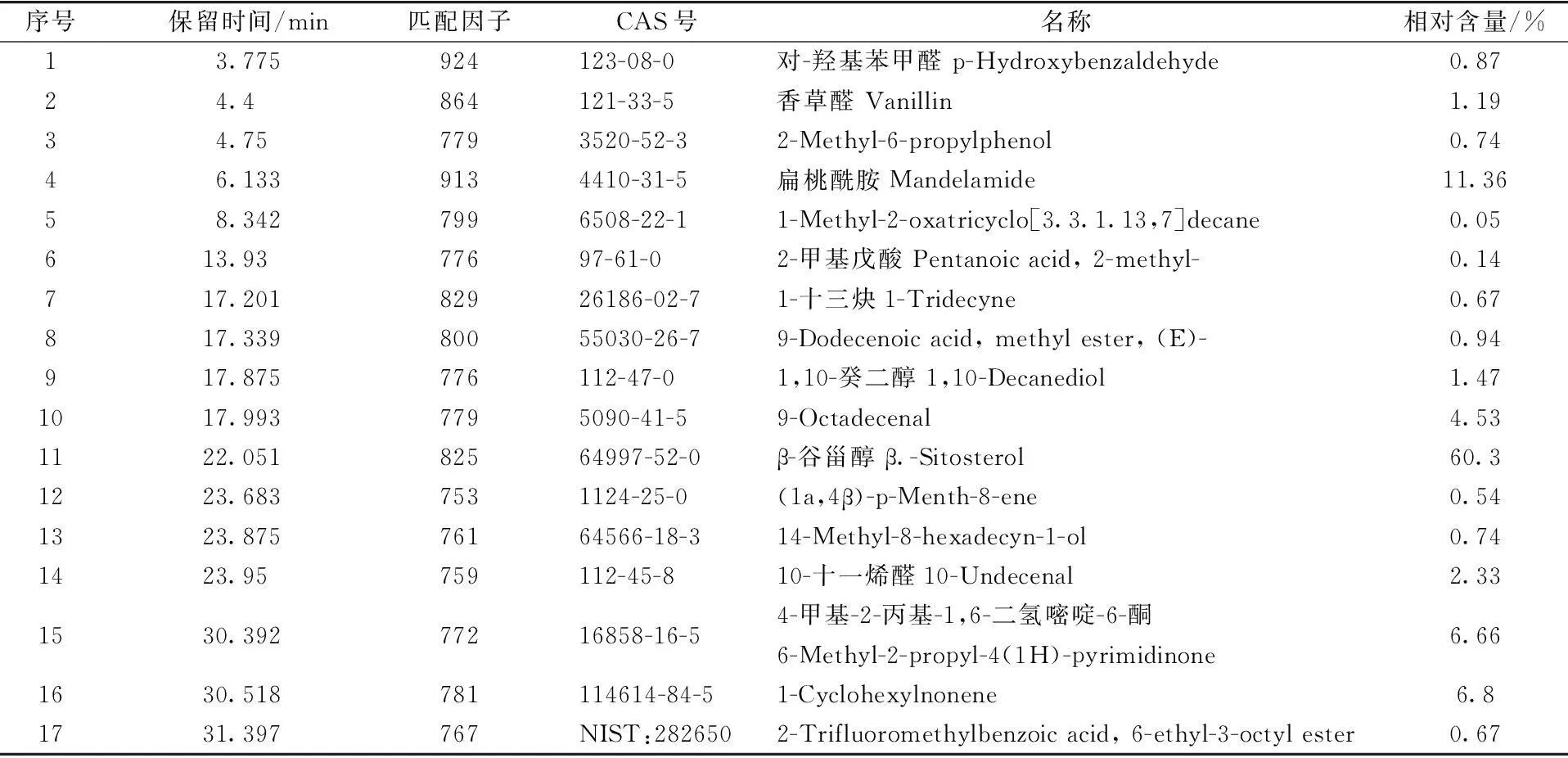
表3 细齿樱桃籽挥发油成分
3结论
细齿樱桃籽中粗脂肪含量为(8.9±0.2)%,挥发油含量为(0.56±0.15) %。当采用超临界CO2萃取时,可同时提取到樱桃籽油及挥发油。细齿樱桃籽油中油酸、亚油酸等不饱和脂肪酸含量达88.18%,属于高油酸亚油酸型油脂,具有较高的抗氧化活性。细齿樱桃籽挥发油中β-谷甾醇含量达60.3%,研究已证明β-谷甾醇具有抗炎症活性[9],且最新的研究也证明樱桃籽挥发油对大、小鼠急性炎症模型都具有显著的抑炎症作用[12]。说明细齿樱桃籽挥发油可能具有抗炎症活性。因此本研究的结果不仅提示了细齿樱桃籽在食品和医药领域均具有较好的开发前景,也为细齿樱桃的进一步精深加工利用提供了基础数据。
参考文献
[1]中国科学院中国植物志编辑委员会. 中国植物志,第38卷[M].北京:科学出版社, 1986:79.
[2]LARRAURI J A, SNCHEZ-MORENO C, SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. J Agric:Food Chem, 1998, 46(7): 2 694-2 697.
[3]陈计峦, 宋丽军, 张云, 等. 薰衣草精油抗氧化成分提取及其对DPPH·清除率的研究 [J]. 食品与发酵工业, 2009, 35(1): 173-176.
[4]王坚, 陈鸿平, 刘友平, 等. 应用自动质谱退卷积定性系统拆分中药挥发油总离子流谱图中的重叠峰——以青皮为例 [J]. 中国中药杂志, 2013, 38(10):1 564-1 569.
[5]耿薇, 郑敏燕, 尚永辉, 等. 樱桃仁的脂肪酸组成与含量分析 [J]. 化学工程师, 2015, 29(3): 18-20.
[6]王春玲. 烟台大樱桃仁油理化性质及脂肪酸组成分析 [J]. 中国粮油学报, 2015, 30(2): 65-67.
[7]张玲丽, 卢奎. 樱桃仁油的理化性质及成分分析 [J]. 中国油脂, 2009, 34(9): 74-76.
[8]HARRIS W S, MOZAFFARIAN D, RIMM E, et al. Omega-6 fatty acids and risk for cardiovascular disease[J]. Circulation, 2009, 119(6): 902-907.
[9]LOIZOU S, LEKAKIS I, CHROUSOS G P, et al. β-Sitosterol exhibits anti-inflammatory activity in human aortic endothelial cells [J]. Molecular Nutrition & Food Research, 2010, 54(4): 551-558.
[10]BASKAR A A, AL NUMAIR K S, GABRIEL P M, et al. β-sitosterol prevents lipid peroxidation and improves antioxidant status and histoarchitecture in rats with 1, 2-dimethylhydrazine-induced colon cancer [J]. Journal of Medicinal food, 2012, 15(4): 335-343.
[11]TALATI R, SOBIERAJ D M, MAKANJI S S,et al. The comparative efficacy of plant sterols and stanols on serum lipids: a systematic review and meta-analysis [J]. Journal of the American Dietetic Association, 2010, 110(5): 719-726.
[12]王松, 张成义, 陈曦. 樱桃核挥发油的抗炎作用研究 [J]. 新中医, 2012, 32(10): 139-140.
Antioxidant activity analysis and composition analysis of seed oil and volatile oil extracted by supercritical CO2from serration cherry
YANG Xiao1*, LUO Jing1, ZHANG Guang-feng1, QIN Jia2
1 (Food and Bioengineering School, Xihua University, Chengdu 610039, China)2 (Xiaojin Jiajin Mountain Natural Wild Cherry Wine Co., Ltd., Xiaojin 624200, China)
ABSTRACTSeed oil and volatile oil from serration cherry have been extracted by supercritical CO2, their antioxidant activities and chemical composition were analyzed. The results show that seed oil had a high antioxidant activity, composed of 14 fatty acids, 88.48% of which was the unsaturated fatty acid. The main components of seed oil were oleic acid (47.09%) and linoleic acid (38.69%). The GC/MS/AMDIS analysis demonstrated that 17 kinds of major substance in volatile oil, 60.3 % of which was β-sitosterol, whith has a variety of pharmacological activities.
Key wordsserration cherry seed oil; volatile oil; antioxidant; component analysis
收稿日期:2015-08-08,改回日期:2015-10-09
基金项目:阿坝州野樱桃全产业链现代生产技术集成与产业化示范(四川省科技厅科技支撑项目,编号:2015NZ0075)
DOI:10.13995/j.cnki.11-1802/ts.201603037
第一作者:博士,高级实验师(本文通讯作者,E-mail:yangxiao19810625@163.com)。

