TGF-β2和TGFβRⅡ在子痫前期胎盘中的表达**?
杨秀华,孟 涛
(中国医科大学附属第一医院产科,辽宁沈阳 110001)
TGF-β2和TGFβRⅡ在子痫前期胎盘中的表达**?
杨秀华,孟涛**
(中国医科大学附属第一医院产科,辽宁沈阳110001)
[摘要]目的:检测子痫前期(Pre-eclampsia,PE)胎盘组织中转化生长因子-β2(TGF-β2)和受体TGFβRⅡmRNA和蛋白的表达。方法:正常足月剖宫产孕妇30例为对照组,子痫前期剖宫产孕妇30例(20例足月妊娠、10例未足月妊娠)为子痫前期组,比较两组孕妇的年龄、孕周、胎盘重量及新生儿重量,采用Real-time PCR、Western blot和免疫组织化学方法检测娩出胎盘组织的TGF-β2及TGFβRⅡ的mRNA和蛋白表达。结果:子痫前期孕妇胎盘重量及新生儿体重均低于对照组(P<0.05) ;子痫前期孕妇胎盘组织中TGF-β2和TGFβRⅡ的mRNA和蛋白表达水平均显著高于对照组孕妇胎盘组织(P<0.05) ;免疫组化显示子痫前期胎盘中TGF-β2和TGFβRⅡ的阳性率均高于对照组孕妇的胎盘组织(P<0.05)。结论:子痫前期胎盘组织中TGF-β2及TGFβRⅡ升高可能与子痫前期的发生有关。
[关键词]子痫;前期;转化生长因子β;受体,转化生长因子β;免疫组织化学
**通信作者E-mail: cmumt@163.com
网络出版时间: 2016-02-23网络出版地址: http: / /www.cnki.net/kcms/detail/52.5012.R.20160223.1842.010.html
子痫前期(Pre-eclampsia,PE)发病率为7%~10%,是导致我国孕产妇死亡的主要原因,其病因和发病机制尚未完全明了,目前认为与母胎界面滋养细胞浅植入导致的胎盘功能不良有关。孕早期绒毛外滋养细胞(extravillous trophoblasts,EVTs)从固定绒毛中长出,侵袭至母体蜕膜并重塑子宫螺旋动脉,孕早期EVT侵袭不足与妊娠合并症如子痫前期有关。转化生长因子-β(transforming growthfactor-beta,TGF-β)是一组研究较为广泛的细胞因子,由TGF-β1、TGF-β2和TGF-β3组成,TGF-β通过与细胞表面受体TGFβⅠ、TGFβⅡ和TGFβⅢ结合发挥生物学功能。TGF-β可抑制滋养细胞的浸润和迁移,同时参与胎盘的形成,在胎盘和胚胎的生长发育中起一定作用[1],其表达异常可能与子痫前期的发生和发展有关。研究认为,TGF-β1在子痫前期胎盘组织中表达增高,但TGF-β2在子痫前期中的研究较少。本文拟通过观察TGF-β2其受体TGFβRⅡ在子痫前期胎盘中的表达,探讨这两种细胞因子在子痫前期发病中的作用。
1 材料与方法
1.1一般资料
收集2013年1月~2015年9月剖宫产分娩的子痫前期孕妇30例,包括足月20例,未足月10例,子痫前期轻度和重度各15例;选取同期剖宫产的正常足月妊娠孕妇30例为对照组。所有产妇均为初产妇,孕前及孕后无其他合并症和并发症,依据第八版《妇产科学》诊断子痫前期。所有研究对象知情同意参加研究,实验得到医院伦理委员会批准。
1.2主要试剂
TGF-β2和TGFβRⅡ引物由上海Sangon生物工程公司合成,TRIZOL和SYBR Primescript RTPCR试剂盒购自大连宝生物公司,鼠抗人TGF-β2单克隆抗体、鼠抗人TGFβRⅡ单克隆抗体和鼠抗人GAPDH单克隆抗体购自美国Abcam公司。
1.3检测TGF-β2 mRNA及TGFβRⅡmRNA
Real-time PCR检测胎盘组织中TGF-β2 mRNA和TGFβRⅡmRNA水平。用TRIZOL一步法提取总RNA,以GAPDH作为内参,根据2-ΔΔCT计算相对表达量。引物序列TGF-β2上游为5'-ATGTGCAGGATAATTGCTGCC-3',下游为5'-TGGTGTTGTACAGGCTGAGG-3'; TGFβRⅡ上游为5'-TTTCCACCTGTGACAACC-3',下游为5'-TGACAGATATGGCAACTC-3'; GAPDH上游为5'–TCGACAGTCAGCCGCATCTTCTTT-3',下游为5'-ACCAAATCCGTTGACTCCGACCTT-3'。每个样品设置3个重复孔,实验重复3次。程序: 95℃,10 min,40个PCR循环; 95℃,5 s; 60℃,34 s(收集荧光)。
1.4检测TGF-β2蛋白及TGFβRⅡ蛋白
1.4.1 Western blot Western blot检测子痫前期和正常胎盘组织中TGF-β2和TGFβRⅡ的蛋白水平。从胎盘中提取蛋白,蛋白浓度测定采用考马斯亮蓝G250方法。选取50 μg总蛋白进行变性5 min,再行SDS-聚丙烯酞胺凝胶电泳(SDSPAGE)进行蛋白检测,用80 V恒压2 h后转移到PVDF膜。将PVDF膜移至含有封闭液(TBST配制0.5% 0脱脂奶粉)平皿中,室温下脱色,摇床上摇动封闭2 h。置入2 mL/L的TGF-β2特异抗体和1 mg/L的TGFβII抗体,在4℃脱色摇床上过夜,以同样方法用TBST缓冲液按比例稀释第二抗体并与膜接触,室温下孵育2 h后,用TBST在室温下脱色摇床上洗3次,每次15 min。化学发光法(ECL)显带,利用Image J软件分析条带相对表达值。以GAPDH作为内参。
1.4.2免疫组织化学免疫组织化学检测子痫前期和正常胎盘组织中TGF-β2和TGFβRⅡ的蛋白表达。将切片常规脱蜡和水化后在高温高压条件下进行抗原修复,以PBS代替一抗作为阴性对照,用已知的TGF-β2和TGFβRⅡ表达阳性的乳腺癌组织做阳性对照,以胞质呈棕黄色颗粒沉着为染色阳性,按照染色强度和染色阳性细胞的数量进行强度分级。染色强度:基本不染色0分,染色淡黄1分,染色适中2分,深染3分。染色阳性细胞数:<10%为0分,10%~25%为1分,>25%~≤50% 为2分,>50%为3分。将每张切片的2项评分相加,0~1分代表低表达,≥2分代表高表达。
1.5统计学分析
利用SPSS 19.0统计软件进行分析,基因的相对表达水平用均数±标准差表示,各组数据间的比较采用独立样本t检验,P<0.05为有统计学差异。
2 结果
2.1病例资料
正常孕妇组与子痫前期组年龄和孕周比较无统计学差异,子痫前期孕妇组胎盘质量明显低于对照孕妇组(P<0.05),子痫前期组新生儿体重明显低于对照组(P<0.05),见表1。
2.2 TGF-β2 mRNA和TGFβRⅡmRNA
TGF-β2 mRNA在正常胎盘中的表达量为0.84±0.25,子痫前期胎盘中表达量升高,为1.14 ±0.27,两者比较有显著差异(P<0.05) ; TGFβR ⅡmRNA在正常胎盘中的表达量为0.79±0.20,子痫前期胎盘中表达量升高,为1.20±0.31,两者比较有显著差异(P<0.05)。见图1。
表1 两组孕妇年龄、孕周、胎盘重量及新生儿体重比较(±s)Tab.1 Comparison of gravidas age,gestational weeks,placenta weight and neonatal weight between the two groups

表1 两组孕妇年龄、孕周、胎盘重量及新生儿体重比较(±s)Tab.1 Comparison of gravidas age,gestational weeks,placenta weight and neonatal weight between the two groups
(1)P<0.05
病例资料 正常妊娠组(n =30)子痫前期组(n =30)年龄(岁)27.5±2.2 28.4±2.5孕周(周) 38.5±1.5 36.5±1.2胎盘重量(g) 578.5±98.5 530.0±80.5(1)新生儿体重(g) 3 340.0±405.0 2 450.0±425.0(1)

(1)P<0.05图1 胎盘组织中TGF-β2 mRNA和TGFβRⅡ表达(Real-time PCR)Fig.1 The mRNA expression of TGF-β2 and TGFβRⅡin placenta tissues
2.3 TGF-β2蛋白和TGFβRⅡ蛋白
Western blot检测结果显示,TGF-β2在正常胎盘中的蛋白表达量为0.92±0.29,子痫前期胎盘中表达量为1.23±0.32,两者比较有显著差异(P <0.05) ; TGFβRⅡ在正常胎盘中的蛋白表达量为0.72±0.25,子痫前期胎盘中表达量为1.31± 0.28,两者比较有显著差异(P<0.05)。见图2。
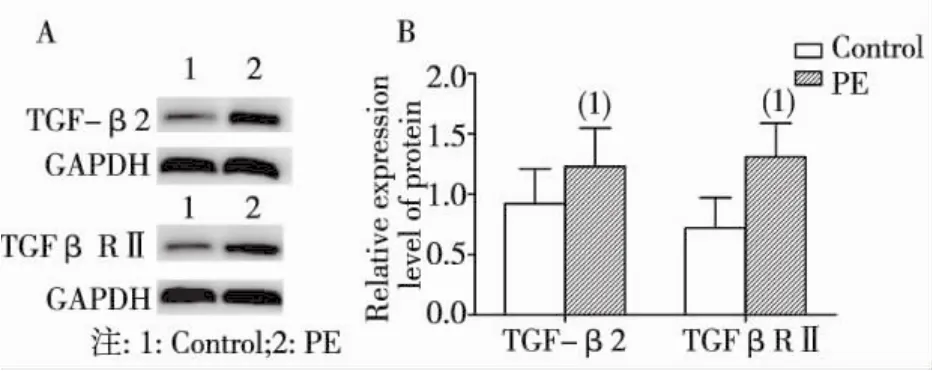
(1)P<0.05图2 胎盘组织TGF-β2蛋白及TGFβRⅡ蛋白表达(Western biot)Fig.2 The protein expression of TGF-β2 and TGFβRⅡin placenta tissues
免疫组化染色结果(图3)提示TGF-β2蛋白及TGFβRⅡ蛋白主要表达于胎盘绒毛滋养细胞,表达部位主要在细胞浆。在子痫前期组、正常胎盘组中TGF-β2的阳性表达率分别为66.67% (20/ 30)、20.00%(6/30),TGFβRⅡ的阳性表达率分别为53.33% (16/30)、16.67% (5/30)。TGF-β2和TGFβRⅡ在子痫前期组中的表达均明显高于正常胎盘组,差异均有统计学意义(P<0.05)。

注: A、B为TGF-β2,C、D为TGFβ RⅡ; A、C为对照,B、D为PE图3 胎盘绒毛滋养细胞中TGF-β2蛋白和TGFβRⅡ蛋白表达(免疫组化,×200)Fig.3 Expression of TGF-β2 and TGFβRⅡof the specimens by immunohistochemistry SP method
3 讨论
正常胎盘的发育依赖于子宫螺旋动脉的生理性重铸。早期妊娠时绒毛外滋养细胞从固定绒毛中侵袭到子宫内膜蜕膜层和子宫肌层,绒毛外滋养细胞侵袭分两步,第一步是妊娠8~10周侵袭到子宫螺旋动脉蜕膜,第二步是妊娠16~18周侵袭到子宫肌层。子痫前期是导致孕产妇死亡的主要原因之一,与滋养细胞侵袭和子宫螺旋动脉重铸障碍有关。在产科领域,TGF-β通路可抑制滋养细胞侵袭和迁移[2-3]。子痫前期患者血清中TGF-β表达升高,并抑制组织中VEGF的表达[4-6],另有研究发现,子痫前期患者胎盘中TGF-β通路基因DNA甲基化明显增高[7]。周仲元等[8]报道,子痫前期孕妇胎盘和血浆中的TGF-β1含量均明显升高。Deepthi等[9]认为TGF-β1是子痫前期分子病理中一个关键的基因,它不仅能够调节靶细胞的血管生成和凋亡,而且可以控制TH1/TH2细胞因子平衡,并产生抗炎性外周调节T细胞。师海英等[10]发现,TGF-β3在早孕期妊娠组织中有表达,子痫前期胎盘中TGF-β3表达增高,然而子痫前期胎盘组织中TGF-β2的表达情况报道较少。
本研究结果显示,子痫前期胎盘组织中TGF-β2的mRNA和蛋白表达水平均高于正常胎盘,提示TGF-β2可能参与子痫前期的发生。免疫组化、RT-PCR、Western blot和ELISA检测发现,在早孕期胚胎组织中有TGF-β2持续表达,提示这种细胞因子可能在滋养细胞侵袭中发挥作用[3]。早期胎盘发育过程中低氧环境对于EVT侵袭很重要[11],而这种低氧环境对于EVT的侵袭作用依赖于TGF-β超家族成员。研究者利用高通量定量方法在2-D早孕期EVT侵袭模型研究中发现,外源性增加TGF-β2的表达可使EVT侵袭范围减小,说明TGF-β2在早孕期抑制EVT侵袭[12];也有研究发现,子痫前期患者血清中TGF-β2表达增高,并被认为是子痫前期的预测指标[13]。目前考虑子痫前期胎盘中TGF-β2升高的原因部分是由于TGF-β2抑制EVT侵袭,使子宫螺旋动脉生理性重铸受限,使滋养细胞的浸润能力下降,导致其对子宫肌层和螺旋小动脉的浸润程度降低,引发子痫前期。
TGF-β2发挥作用时需要TGFβRⅡ存在,有研究表明,TGF-β2与其受体TGFβRⅡ作用后,通过TGF-β/Smads信号通路来调控滋养细胞的增殖、免疫、分化和内分泌[14]。尚丽新等[15]利用免疫组化方法也证实在正常妊娠和妊娠期高血压疾病胎盘滋养细胞和蜕膜中均存在TGFβRⅡ,且妊娠期高血压疾病胎盘中TGFβRⅡ表达高于正常,与本研究结果相一致。
本研究通过免疫组化方法探讨了子痫前期和正常胎盘中TGF-β2和TGFβRⅡ的表达情况,结果发现TGF-β2和TGFβRⅡ在正常孕妇组和子痫前期孕妇组胎盘组织中都有表达,但两者在子痫前期孕妇组的阳性表达率都高于正常对照组孕妇,提示子痫前期存在TGF-β2和TGFβRⅡ表达异常,这种表达异常和子痫前期的因果关系值得进一步研究。TGF-β2和TGFβRⅡ表达部位主要在胎盘的绒毛滋养细胞,提示TGF-β2可通过TGFβRⅡ来调控滋养细胞的增殖与分化,在胚胎着床和继续妊娠过程中发挥作用。本研究还发现,在TGF-β2表达阳性的子痫前期孕妇的胎盘中TGFβRⅡ表达也多为阳性,在TGF-β2表达阴性的正常胎盘中TGFβRⅡ表达也多为阴性,两者呈相似的表达趋势,说明TGF-β2和TGFβRⅡ作用一致,共同调控滋养细胞的侵袭能力。
综上,TGF-β2和TGFβRⅡ表达增高可抑制滋养细胞侵袭,使子宫胎盘的血流下降,导致滋养细胞植入变浅和异常的子宫胎盘血管重铸,引起子痫前期的发生。目前关于TGF-β2及其受体TGFβRⅡ的信号通路尚不清楚,深入探讨二者的相互作用可进一步揭示子痫前期的病因,为子痫前期的诊治提供理论依据。有效调控TGF-β2及其受体TGFβRⅡ的表达可能为预防和治疗子痫前期提供一条新的途径。由于本实验样本量偏少,仍需进一步探讨。
4 参考文献
[1]廖志琼,甘婷,陈希明,等.TGF-β1在子痫前期患者胎盘组织中的表达[J].解剖学研究,2012(1) : 1-4.
[2]Tan T,Tang X,Zhang J,et al.Generation of trophoblast stem cells from rabbit embryonic stem cells with BMP4 [J].PLoS One,2011(2) : e17124.
[3]Zuo Y,Fu Z,Hu Y,et al.Effects of transforming growth factor-β1 on the proliferation and invasion of the HTR-8/ SVneo cell line[J].Oncol Lett,2014(5) : 2187-2192.
[4]Moore T,Dveksler GS.Pregnancy-specific glycoproteins: complex gene families regulating maternal-fetal interactions[J].Int J Dev Biol,2014(2-4) : 273-80.
[5]Kuznetsova RA,Rachkova OV,Kulida LV,et al.Growth factors are markers of placental insufficiency in third-trimester miscarriage[J].Arkh Patol,2010(6) : 40-43.
[6]Lakshmi Tanuja Petla,Rosy Chikkala,Ratnakar KS,et al.Biomarkers for the management of pre-eclampsia in pregnant women[J].Indian Jmed Res,2013(1) : 60-67.
[7]Elizabeth M,Paul DR,Lisa S,et al.Epigenetics and Preeclampsia: Defining Functional Epimutations in the Preeclamptic Placenta Related to the TGF-β Pathway[J].PLoS One,2015(10) : e0141294.
[8]周仲元,王晓娟,许雅娟.子痫前期患者胎盘及血浆uPA、TGF-β1含量变化及意义[J].中国优生与遗传杂志,2014(6) : 59-61.
[9]Deepthi G,Chaithri PK,Latha P.TGFB1 Functional Gene Polymorphisms (C-509T and T869C) in the Maternal Susceptibility to Pre-eclampsia in South Indian Women [J].Scand J Immunol,2015(4) : 390-397.
[10]师海英,匡静,胡金瑜,等.TGF-β1、β3在子痫前期患者胎盘组织中的表达[J].昆明医科大学学报,2013(6) : 120-121。
[11]Shi X,Liu H,Cao J,et al.Promoter Hypomethylation of Maspin Inhibits Migration and Invasion of Extravillous Trophoblast Cells during Placentation[J].PLoS One,2015(8) : e0135359.
[12]Prossler J,Chen Q,Chamley L,et al.The relationship between TGFb,low oxygen and the outgrowth of extravillous trophoblasts from anchoring villi during the first trimester of pregnancy[J].Cytokine,2014(1) : 9-15.
[13]Shaarawy M,Meleigy ME,Rasheed K.Maternal serum transforming growth factor beta-2 in preeclampsia and eclampsia,a potential biomarker for the assessment of disease severity and fetal outcome[J].J Soc Gynecol Investig,2001(1) : 27-31.
[14]Cheng JC,Chang HM,Leung PC.Transforming growth factor-β1 inhibits trophoblast cell invasion by inducing Snail-mediated down-regulation of vascular endothelialcadherin protein[J].J Biol Chem,2013(46) : 33181-33192.
[15]尚丽新,康德凡,曲冬颖,等.TGF-β1、TGFβRⅠ、TGFβRⅡ在妊高征患者胎盘组织中的表达及临床意义[J].中华围产医学杂志,2005(2) : 85-88.
(2015-10-22收稿,2015-12-30修回)
中文编辑:潘娅;英文编辑:周凌
Expression and Significance of TGF-β2 and TGFβRⅡin Placenta of Pre-eclampsia Patients
YANG Xiuhua,MENG Tao
(Department of Obstetrics,the First Hospital Affiliated to China Medical University,Shenyang 110001,Liaoning,China)
[Abstract]Objective: To investigate the mRNA and protein expression levels of transforming growth factor beta-2 (TGF-β2) and transforming growth factor beta receptor 2 (TGFβRⅡ) in placentas of pre-eclampsia (PE) patients.Methods: Thirty cases of normal gravidas served as control group and 30 cases of PE patients as PE group.Gravidas age,gestational weeks,placenta weight and neonatal weight between the two groups were compared.The mRNA and protein expression levels of TGF-β2 and TGFβRⅡof the specimens were determined by real-time PCR,Western blot and immunohistochemistry.Results: The placenta and neonatal weight of PE group were lower than those of control group(P<0.05) ; TGF-β2 and TGFβRⅡmRNA and protein levels in PE group were significantly higher than those of control group (P<0.05) ; The positive expression rates of TGF-β2 and TGFβRⅡin PE group were significantly higher than those of normal placentas detected by immunohistochemistry method(P<0.05).Conclusion: The high expression levels of TGF-β2 and TGFβRⅡmight be related to the aetiology of PE.
[Key words]eclampsia; prophase; transforming growth factor β; receptor,transforming growth factor; immunohistochemistry
*[基金项目]国家自然科学基金(81270711)
[中图分类号]R714.24
[文献标识码]A
[文章编号]1000-2707(2016) 02-0185-05

