基于RNA-Seq技术的苜蓿根蘖性状发生相关下调基因
郭 云,王铁梅,2
(1.北京林业大学林学院,北京 100083; 2.北京林业大学草地资源与生态研究中心,北京 100083)
基于RNA-Seq技术的苜蓿根蘖性状发生相关下调基因
郭 云1,王铁梅1,2
(1.北京林业大学林学院,北京 100083; 2.北京林业大学草地资源与生态研究中心,北京 100083)
为了从分子水平上分析苜蓿(Medicago sativa)根蘖性状的发生机制,对根蘖型苜蓿的根蘖与非根蘖根部进行RNA-seq转录组文库构建,并分析差异表达基因及其功能。分别提取品系“BL-101”的根蘖型苜蓿根蘖与非根蘖部位总RNA,利用磁珠法分离mRNA后通过PCR扩增构建RNA-Seq转录组文库,并对差异表达基因进行分析,得到差异表达基因15 978条,本研究重点分析下调基因,通过生物过程分类,发现与根蘖性状发生有关的表达下调的基因为5个,经生物学信息分析确定,其中2个属于Lon蛋白酶家族,其余分别属于植物肌动蛋白酶家族,硫氧还蛋白和脂氧合酶,其与植物抗逆性相关,且与植物激素ABA的调控有关。研究结果可以为探讨苜蓿根蘖性状发生的分子机制提供理论依据。
苜蓿;根系生长;生物信息学;脱落酸
苜蓿(Medicago sativa)作为牧草之王,是当前生态建设中应用最为广泛的生态草之一[1]。在形态学方面,根蘖型苜蓿与普通紫花苜蓿相比,主根上会生长出很多侧生水平根,在侧根上会有膨大根蘖节,这些根蘖节距离不等且可以形成新芽继而长出地面形成新的枝条,因此根蘖性状的根系分布更广[2]。研究表明,根蘖性状具有优良的抗寒性[3-5]、耐牧性[6-8]、耐旱性。近年来,国内外学者对于苜蓿发生根蘖性状的机理取得了较多的成果。在形态发生机制方面,根蘖与非根蘖苜蓿在水平根上根蘖节的数量上比较,根蘖性状的节数显著高于非根蘖性状;根蘖苜蓿在水平根上存在原生丘状组织,而非根蘖苜蓿没有该原生丘状组织[9]。在生理机制方面,通过测定根系酯酶及内源激素含量动态得出酯酶同工酶可能与苜蓿调控发生根蘖性状的基因表达有关;但对于苜蓿根蘖与非根蘖苜蓿性状的遗传差异仍然缺少分子水平的研究[10]。因此,通过对根蘖部位与非根蘖部位的差异表达基因筛选分析进行功能预测,得出可能与苜蓿根蘖性状发生有关的基因,以期为探讨苜蓿根蘖性状发生的分子机制提供理论依据。
转录组是指某一细胞在特定发育阶段或者生理条件下全部基因表达的总和,表示了每一个基因在该状态下的身份和表达水平[11],包括编码蛋白的mRNA和非编码蛋白的RNA,是基因组遗传信息与蛋白质组的生物功能之间的桥梁[12]。转录组研究是研究结构及基因功能的基础,而转录组在揭示基因组中的功能元件中是必需的[13]。随着高通量测序技术的快速发展,RNA测序(RNA-seq)将是转录组学中一个重要的技术手段。
RNA-seq技术是新崛起的转录组学研究技术[14]。该技术可以对数百万个DNA分子同时进行测序[15],这使得对一个物种的转录组或基因组进行细致地分析成为可能[16],是具有里程碑意义的技术。高通量测序有三大优点,第一是其利用芯片测序可以在百万个点上同时阅读测序,第二是其具有完美的定量功能,第三是价格低廉[15]。早有较多学者还基于RNA-Seq技术用来研究不同基因的差异表达。Zhang等[17]以水稻(Oryza sativa)愈伤组织、根尖、茎尖等为材料进行转录组测序,Jiao等[18]使用高通量测序分析玉米(Zea mays)叶片的转录组,均十分成功。
为了从分子水平理解苜蓿根蘖性状的发生机制,本研究对苜蓿根蘖部位与非根蘖部位进行了RNA-Seq测序,对与根系相关差异表达基因进行生物学信息分析,希望从分子角度把握与根蘖发生性状的基因。
1 试验材料与方法
1.1材料和主要试剂
试验材料选用品种品系为“BL-101”的根蘖型苜蓿,于根糵性状表达最明显的生育期进行取样,植株年龄为3年。“BL-101”品系是一种新品系,种植于北京林业大学草业科学系顺义苜蓿试验基地,为单株种植。采用混合取样,分别挖取5株表现出根蘖性状植株的根蘖芽和根蘖节之间的部分与未表现根蘖性状的植株的水平根。
主要试剂为PolyA Tracted mRNA Isolation System 3 (Promega公司)、Clontech PCR-SelectTM cDNA Subtraction Kit(北京科百奥生物技术有限公司)和Trizol Reagent (天根生化公司),其余的化学试剂是国产的分析纯。
分别提取根蘖性状与非根蘖性状根部的总RNA来构建转录组基因文库,然后进行测序,对庞大的表达上下调的基因表达量数据进行分析,通过生物信息学分析确定基因功能,找到与根蘖性状发生的基因。
1.2试验方法
本试验采用Trizol试剂方法提取苜蓿根部总RNA,使用1%琼脂糖凝胶电泳和分光光度计检测RNA的浓度和纯度。采用磁珠法分离mRNA,以mRNA为模板,用六碱基随机引物合成第1条cDNA链,随后加入缓冲液、RNase、dNTPs和DNA polymeraseⅠ双链cDNA链。经试剂盒纯化并加EB缓冲液洗脱之后做末端修复并加Poly(A)连接测序接头,回收目的片段进行PCR扩增,获得完整文库。采用高通量测序方法进行测序。通过BLAST等[19-20]网站、Gene Ontology[21-22]功能显著性富集分析以及DNAMAN生物信息学软件对基因序列检测并进行生物信息学分析。
2 结果与分析
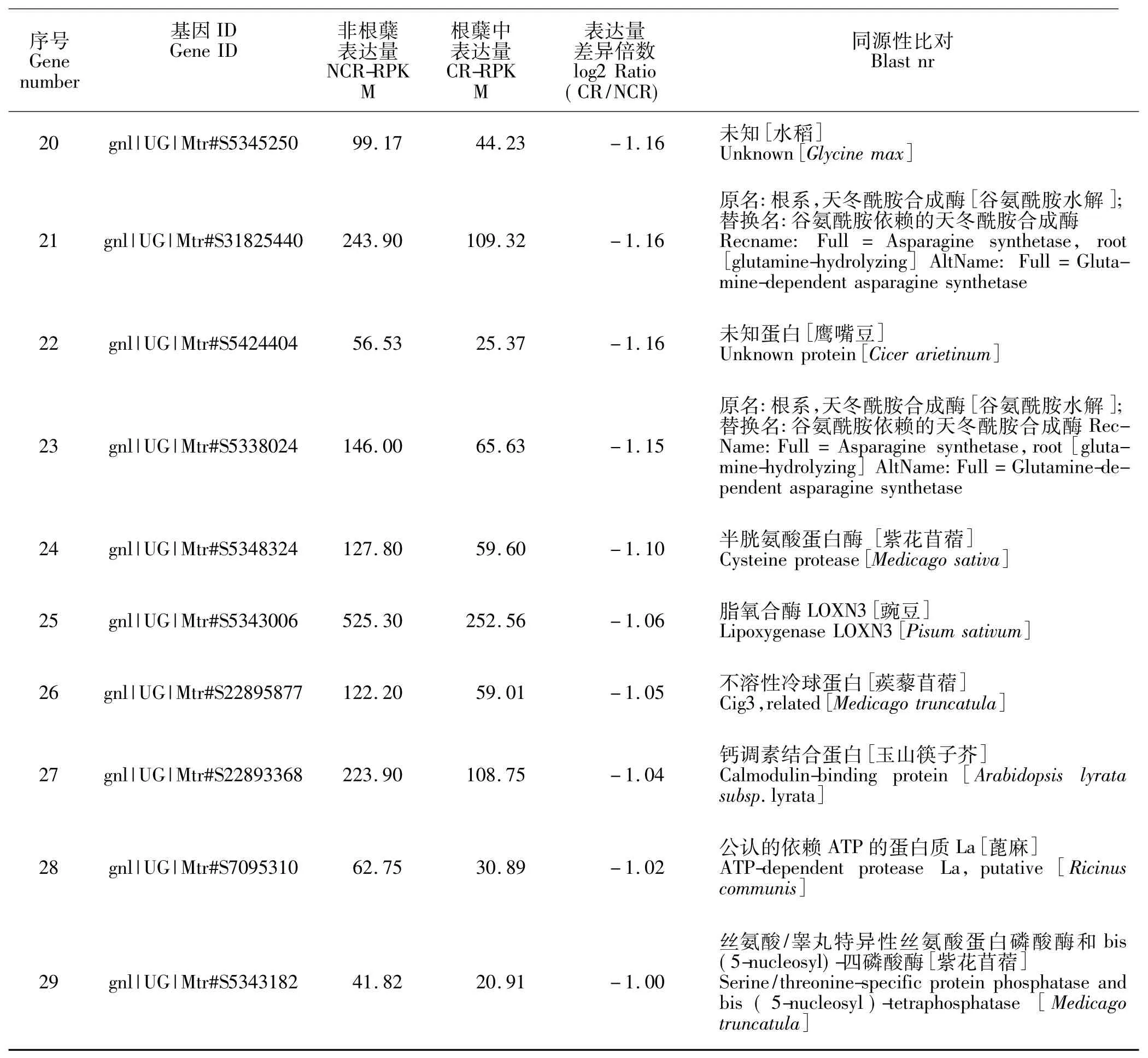
2.1表达差异的下调基因
在根蘖与非根蘖测序后,表达下调的基因及其表达差异倍数、同源性比对如表1所示。
得到差异表达量最高的是细胞色素和硫氧还蛋白。将上述表达下调的基因按参与生物过程分类,差异表达基因中其中9个为未知的功能基因,其他已知功能基因中主要包括硫氧还蛋白、蛋白激酶、天冬酰胺合成酶、依赖ATP的蛋白质和脂氧合酶等。差异表达显著的功能为8类,大部分基因功能与抗逆性、信号传导有关,具体如表2所示。
续表1
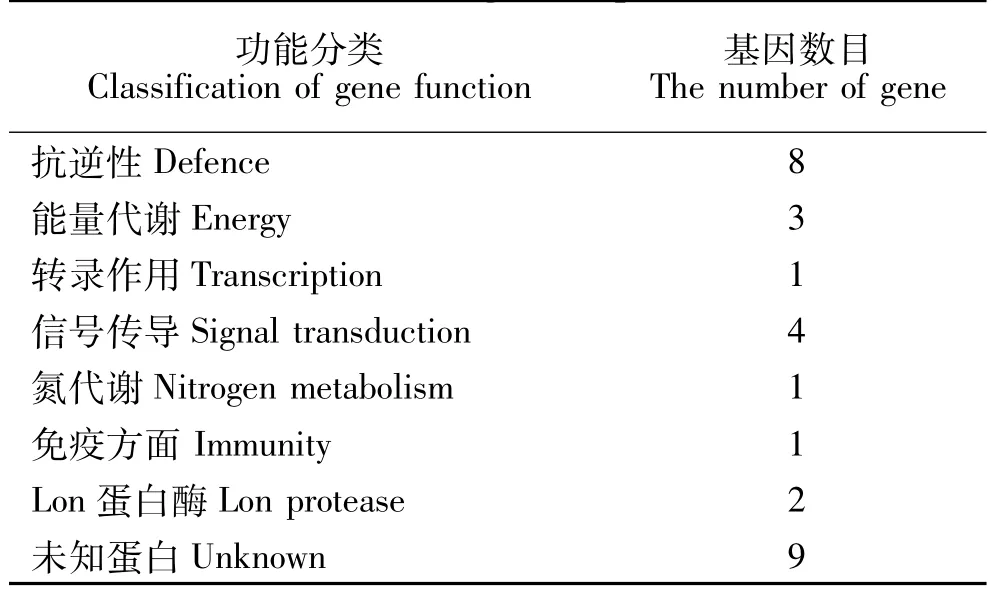
表2 表达下调基因的差异基因主要功能分类Table 2 Classification of gene function in difference cut genes expression
2.2 5个下调基因的生物学分析
通过Blast基因功能分析,29个下调基因,得出可能与根系生长有关的基因有5个,基因ID分别为gnl|UG|Mtr#S7095310,gnl|UG|Mtr#S5424404,gnl|UG |Mtr#S5372550,gnl|UG|Mtr#S5343205和gnl|UG|Mtr #S5342067。将这5个与根蘖相关的表达下调基因通过同源性对比和生物信息学分析从而推测其功能。
2.2.1 gnl|UG|Mtr#S7095310基因的序列分析与功能预测 通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)网站的Blastx比对功能,基因gnl|UG|Mtr#S7095310同源性分别与鹰嘴豆、菜豆、大豆、蒺藜苜蓿、牵牛花、麻风树相同,同源百分比为37% (表3)。且运用DNAMAN软件将目的基因与这些基因进行比对,总体相似度为69.15%,该基因属于Lon蛋白酶基因家族。此外对目的基因进行蛋白结构域分析,结果也表明其为Lon蛋白酶。Lon蛋白酶是一类依赖ATP的丝氨酸蛋白酶,广泛分布于原核生物和真核生物的丝氨酸类型蛋白酶,属于AAA蛋白酶超家族。
2.2.2 gnl | UG | Mtr#S5372550基因的序列分析与功能预测 通过NCBI网站的Blastx比对功能,对gnl|UG| Mtr#S5372550基因进行同源性对比,同源性最高的是豌豆、蒺藜苜蓿和鹰嘴豆,其次是长喙田菁、菜豆、大豆、麻风树(表4)。运用DNAMAN软件将目的基因与这些基因进行比对,总体相似度为70.14%。在上述植物中同源性较高的都是果胶酯酶,但是利用InterProScan软件对其基因编码的蛋白结构域进行分析,结果表明,该基因属于Lon蛋白酶家族和依赖ATP的蛋白酶,即与基因gnl| UG| Mtr# S7095310的功能相类似。
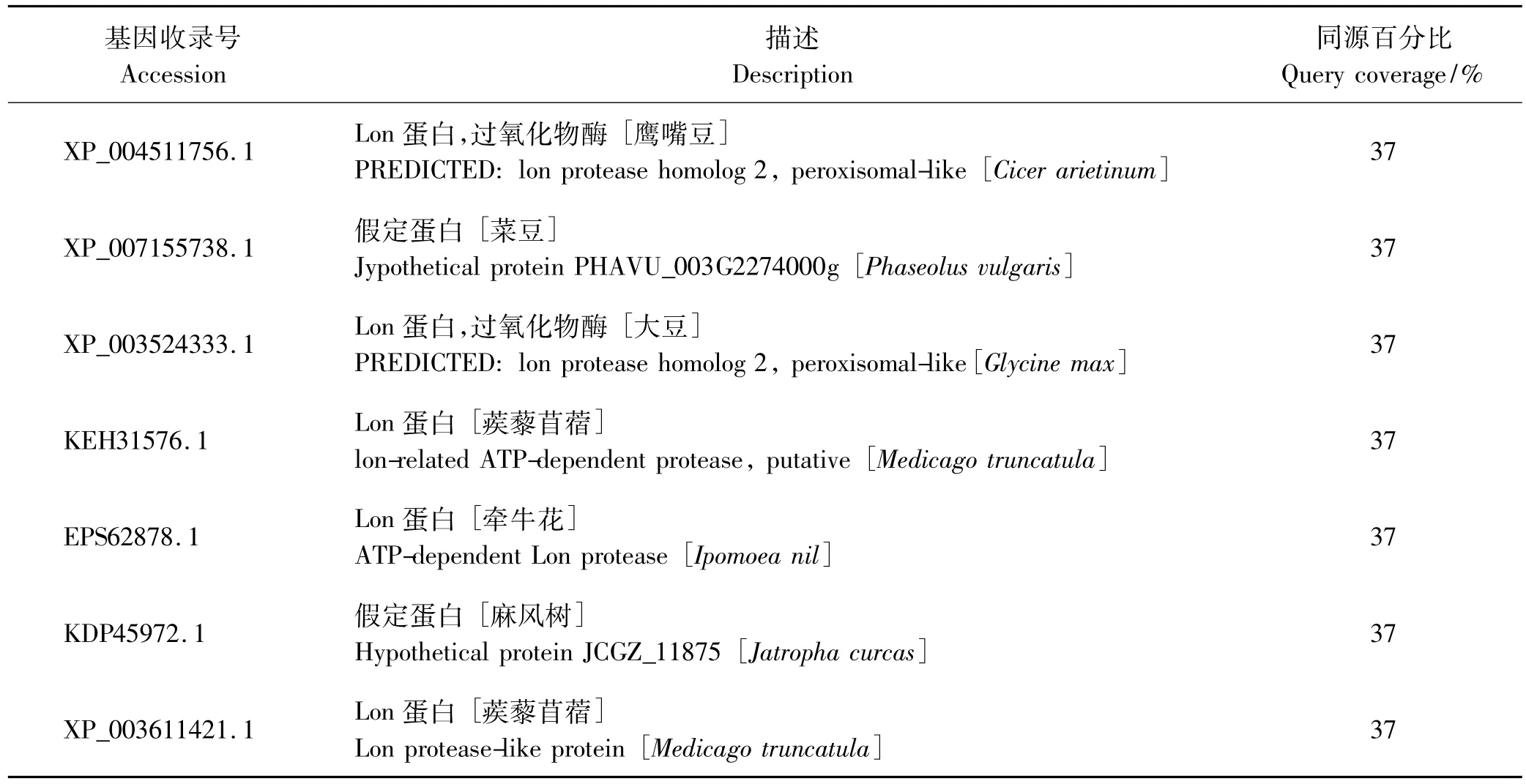
表3 gnl|UG|Mtr#S7095310基因Blastx同源性对比分析Table 3 Homology comparison analysis of gnl|UG|Mtr# S7095310 gene

表4 gnl|UG|Mtr#S5372550基因Blastx同源性对比分析Table 4 Homology comparison analysis of gnl|UG|Mtr# S5372550 gene
2.2.3 gnl|UG|Mtr#S5424404基因的序列分析与功能预测 通过NCBI网站的Blastx比对功能,对gnl| UG|Mtr#S5424404基因进行同源性对比,与鹰嘴豆、大豆、菜豆、可可树、碧桃、梅的同源性均为49% (表5),其中在可可树中发现为ACT结构域。其属于一种肌动蛋白,保守性很高,由377个氨基酸残基组成。且运用DNAMAN软件将目的基因进行与上述基因比对,总体的相似性为67.23%,同时利用InterProScan软件对其基因编码的蛋白结构域进行分析,进一步证实了该基因属于ACT基因家族。
2.2.4 gnl | UG | Mtr#S5343205基因的序列分析与功能预测 通过NCBI网站的Blastx比对功能,对gnl|UG| Mtr#S5343205基因进行同源性对比,与蒺藜苜蓿、鹰嘴豆、大豆、菜豆、野生大豆的同源性均在52%~57%(表6),且几乎在所有种类中该基因均是硫氧还蛋白。其分子量约为12 kD,具有一个保守的活性中心Trp-Cys-Gly(Ala) -Pro-Cys[23]。且运用DNAMAN软件将目的基因进行与上述基因比对,总体的相似性为79.31%,同时利用InterProScan软件对其基因编码的蛋白结构域进行分析,也同样证实了该基因编码的蛋白是硫氧还蛋白。
2.2.5 gnl | UG | Mtr#S5342067基因的序列分析与功能预测 通过NCBI网站的Blastx比对功能,对gnl|UG|Mtr#S5342067基因进行同源性对比,与蒺藜苜蓿、鹰嘴豆、大豆、菜豆的同源性均在72%~96% (表7),且几乎在所有种类中该基因均是脂氧合酶。分子质量范围一般在90 000~100 000,是由酶蛋白由单肽链组成的一种含非血红素铁蛋白的氧合酶,属氧化还原酶[24]。且运用DNAMAN软件将目的基因进行与上述基因比对,总体的相似性为69.64%,同时利用InterProScan软件对该基因编码的蛋白结构域进行分析,也同样证实了该基因编码的蛋白是脂氧合酶。

表5 gnl|UG|Mtr# 5424404基因Blastx同源性对比分析Table 5 Homology comparison analysis of gnl|UG|Mtr# S5424404 gene

表6 gnl|UG|Mtr# 5343205基因Blastx同源性对比分析Table 6 Homology comparison analysis of gnl|UG|Mtr# S5343205 gene
2.3 Lon蛋白酶基因在植物中的功能
Lon蛋白酶是一类依赖ATP的蛋白酶家族,分子量约为106 kDa。它是细菌和线粒体中的Lon蛋白酶的同系物,可以形成有活性的同质寡聚复合体。Lon蛋白酶属于AAA+超家族[25]。Lon蛋白酶活性对于维持细胞体内平衡、蛋白质控制和代谢调控起着重要作用[26]。李笑一[27]指出拟南芥(Arabidopsis thaliana)中有4个编码Lon的基因,其中Lon1既定位于线粒体又定位于叶绿体,在线粒体中其主要功能是响应三羧酸循环中复合物Ⅱ与复合物Ⅳ的酶的活性,Lon4突变体对干旱胁迫和高盐胁迫均比野生型敏感,此外,Lon4蛋白酶可能参与ABA信号途径中的蛋白降解。
2.4 ACT基因在植物中的功能
肌动蛋白是由一条肽链组成的球形蛋白质,有两个结构域,分子量在43 000 bp左右。通过研究过ActS/ActR双组份系统酸调节基因的功能分析,确定了其可以调节苜蓿中华根瘤菌对酸性环境的适应[28]。此外,植物生长过程中控制向性生长的机理目前还不是很清楚,但是有研究表明,淀粉粒与内质网与植物向性生长有关,且细胞质的流动对淀粉粒的沉积影响很大,因此植物微丝对植物细胞感受重力起了重要的作用[29],从而得出植物肌动蛋白(ACT)在生理功能上可能影响和控制植物的向性生长。在生长着的拟南芥根毛中,细胞核与顶点的距离是固定的,是细胞核顶端的肌动蛋白束阻止了其向顶端移动[30],因此,肌动蛋白在根系生长过程中促进根毛伸长生长,是细胞顶端生长的动力。此外,仍有研究表明,在拟南芥中编码肌动蛋白的相关基因发生突变,则拟南芥的根毛细胞变得弯曲[31],进一步证明植物肌动蛋白表达量若下调,导致根毛的垂直生长和顶端生长,从而可能导致根系侧根或根蘖节的发生。
2.5硫氧还蛋白在植物中的功能
硫氧还蛋白(Thioredoxin,Trx)是一类广泛存在于动物、植物以及细菌细胞的低分子量的蛋白质,分子量约为12 kD[23]。蛋白质组学的发展已经发现了很多线粒体中硫氧还蛋白的潜在靶标,但是它们具体在植物不同部位所起的作用仍然不是很清楚。刘东等[32]指出硫氧还蛋白对植物自交不亲合过程起调控作用。在叶绿体中,硫氧还蛋白是参与并且调节植物光合作用[33]。在植物抗逆性方面,许多学者已经通过试验验证硫氧还蛋白的Trx部分通过生化反应对植物抗逆性进行调控。细胞内的氧化还原状态是决定植物抵御生物和非生物胁迫的一个重要指标,而Trx部分就是通过自身的氧化还原反应来进行调节的。夏德习等[34]利用拟南芥通过转基因试验得出植物体内的硫氧还蛋白不仅自身具有抗逆境胁迫能力,同时,还可以通过对抗逆基因的表达的调控来起作用,在植物的抗逆系统中起较重要的作用。
2.6脂氧合酶在植物中的功能
脂氧合酶(LOX)是植物体内一种同工酶,在植物的生长发育及抵御机械伤害、病虫侵染等逆境过程起到重要的调节作用[24]。此外,LOX在植物生理功能中对植物的生长衰老、抗病反应都有一定的作用。植物LOX的生理功能是为植物激素提供合成前体物如茉莉酸(JA)等[35],其代谢产物中含有对细胞膜具有一定的破坏作用的活性氧和氧自由基,因而参与植物的衰老和抗病性过敏坏死反应[36-37]。此外,LOX对植物的衰老起着非常重要的作用,LOX过氧化产物可导致组织衰老,运作机制主要包括抑制叶绿体的光化学活性、促进合成蛋白质酶类的失活[24]。脂氧合酶除了与植物的衰老有关,也是植物抗逆境胁迫的重要酶。研究表明,当植物体要面临许多环境胁迫因素,如缺水、病原感染、高温或低温、氧胁迫和紫外辐射等都可诱导单个或多个LOX基因的响应表达,LOX在植物抗逆性等方面起着重要作用[38]。且已有研究表明,在动、植物受到环境胁迫而产生的诱导响应中,脂氧合酶(Lipoxy genase)扮演重要的角色[39-40]。
3 讨论与结论
苜蓿根蘖性状是遗传和环境相互作用的结果[2]。在遗传性方面,根蘖性状则属复杂的数量性状,遗传力较低环境对根蘖性状的影响较大[41]。为了全面具体了解分子机制上苜蓿发生根蘖性状的机理,本研究采取苜蓿根蘖部位与非根蘖部位进行RNA-Seq技术分析,发现差异基因15 978个,其中在表达上调的基因中,经王晓娜[42]分析得出有两个是参与根系生长的,该基因属于AP2家族的RAV转录因子,其对赤霉素的诱导发生响应,使转录因子表达,进而通过生化反应使相关蛋白质合成。下调的基因有5个,为本研究的重点,其分别属于Lon蛋白酶家族,植物肌动蛋白家族硫氧还蛋白和脂氧合酶(表8)。
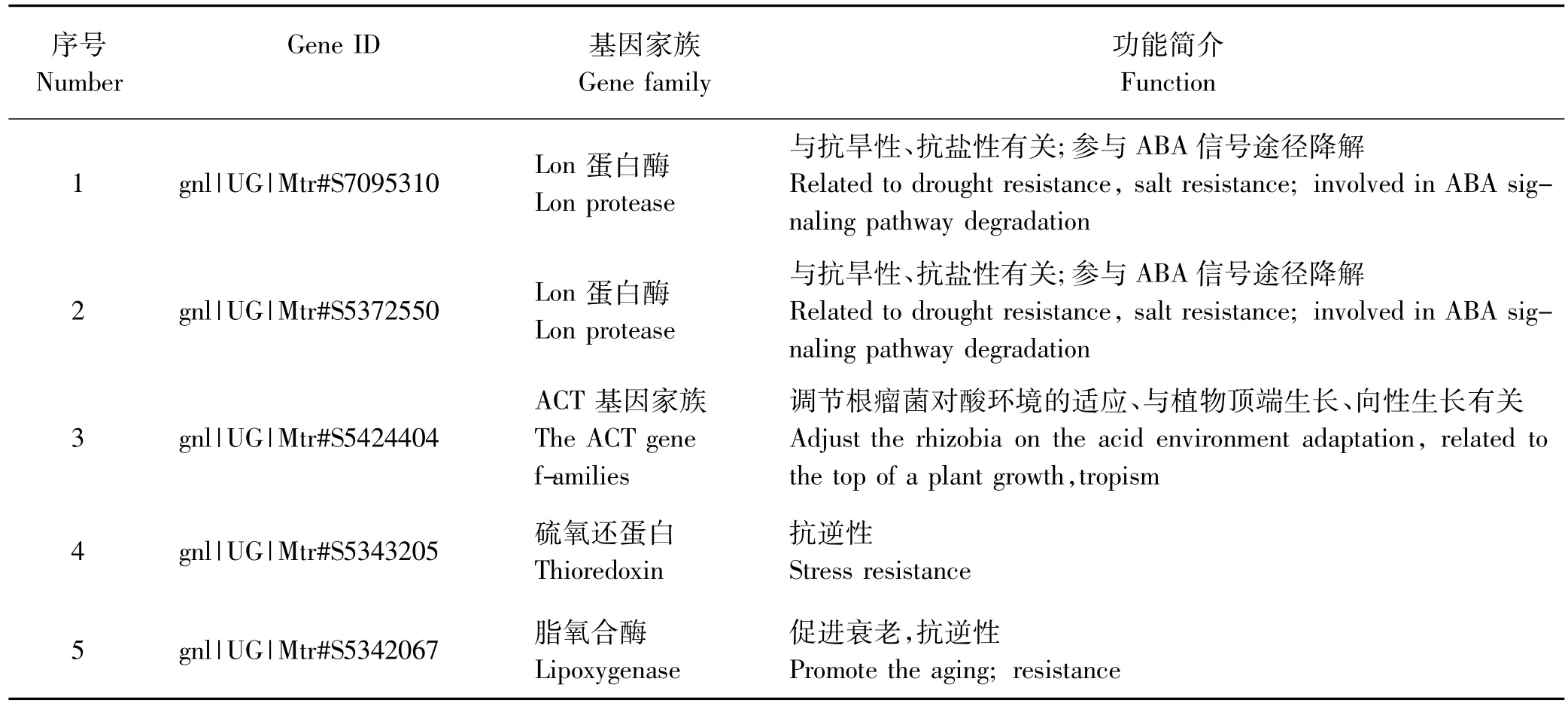
表8 参与苜蓿根系生长调控的表达量下调的基因分析表Table 8 Analysis of down regulated gene related with alfalfa root growth regulation
脱落酸(ABA)作为一种重要的胁迫激素的观点已被人们广泛接受[43]。研究证实,植株在干旱情况下,会启动脱落酸合成系统,根部ABA累积是一种主要的信号物质,经木质部的传导到达叶片,通过一系列生化反应使蒸腾作用减少[44]。此外,高菲和张金鹏[45]测出根蘖型苜蓿的脱落酸(ABA)的含量高于非根蘖型苜蓿,从而推测ABA的含量与根蘖发生的程度有关,且根系中GA和ABA的含量与根系水平根总量呈正相关[46]。Lon蛋白酶的存在使植物对于干旱胁迫和高盐胁迫更加敏感,并且参与ABA信号途径的降解,使植物根系ABA含量降低。因此,苜蓿发生根蘖性状时,一般是在环境较干旱时发生的,由ABA的诱导作为外界刺激产生信号,导致编码Lon蛋白的基因表达下调,有助于苜蓿在干旱情况下发生根蘖性状,且ABA在根系的积累通过生物过程提高了植株的抗旱性。
编码植物肌动蛋白的基因在根蘖性状中的表达量下调。肌动蛋白在生理功能上可以感受重力方向,与植物向性生长有很大关系,也控制顶端生长优势。苜蓿发生根蘖性状时根系编码植物肌动蛋白的基因表达下降,从而控制植物根系向地下生长的能力下降,有利于植株根系产生较多水平侧根,从而可以进一步产生根蘖性状。此外,植物肌动蛋白的下降使根系的顶端优势现象减弱,同样也利于根蘖性状侧根的生长发育。
硫氧还蛋白和脂氧合酶都是与植物抗逆性有关的,且他们具有调控与抗逆性有关的基因的表达,而这两个基因的表达量的下降使植物根系抗逆性的能力下降,从而进一步加强了植物中ABA的积累,促使植物根系产生根蘖性状。
综上所述,参与苜蓿根蘖性状调控表达基因,有受到植物根部内源激素脱落酸的诱导。且根蘖性状是由于受到生长过程中各种外界因素的影响以及内部多个基因的响应和调控,从而通过内源激素的变化完成的。通过Lon蛋白酶家族、植物肌动蛋白、硫氧还蛋白和脂氧合酶表达量的下降调控根蘖性状的发生。
References)
[1]南丽丽,师尚礼,张建华.不同根型苜蓿根系发育能力研究.草业学报,2014,23(2) : 117-124.Nan L L,Shi S L,Zhang J H.Analysis of dynamic variations in crown characteristics of different root-type alfalfa plants.Acta Prataculturae Sinica,2014,23(2) : 117-124.(in Chinese)
[2]梁慧敏.苜蓿根蘖特性与环境的关系.国外畜牧学——草原与牧草,1994(2) : 5-7.
[3]Heinrichs D H,Morley F H.Inhritance of resistance to winter injure and it’s correlation with creeping-rootedness in alfalfa.Canadian Journal of Plant Science,1960(40) : 487-489.
[4]洪绂曾,吴义顺,于康富,白永和,程渡.根蘖型苜蓿引种的研究.草业科学,1987(5) : 1-4.Hong F Z,Wu Y S,Yu K F,Bai Y H,Cheng D.The research of the introduction of root type tillers alfalfa.Pratacultural Science,1987(5) : 1-4.(in Chinese)
[5]梁慧敏,夏阳.碳水化合物含量和过氧化物酶活性变化与苜蓿抗寒性的关系.甘肃农业大学学报,1995,30(4) : 307-311.Liang H M,Xia Y.Carbohydrate content and peroxidase activity change relations with alfalfa winter hardiness.Journal of Gansu Agricultural University,1995,30(4) : 307-311.(in Chinese)
[6]Heinrichs D H.Creeping alfalfa.Advances in Agronomy,1963(15) : 317-337.
[7]Heinrichs D H.Winterhardiness of alfalfa cultivars in southern Saskatchewan.Canadian Journal of Plant Science,1973(53) : 773-777.
[8]Luciano P E,Valentini P,Pecetti L.Evaluation of a lucerne germplasm collection in relation to traits conferring grazing tolerance.Euphytica,1996,89: 279-288.
[9]Pecetti L,Piano E.Penetrance of creeping-rootedness in clonal progenies of lucerne and obvservations on underground morphology of plants differing for this character.Euphytica,2002,128: 35-45.
[10]高振生,王培.苜蓿根系酯酶及内源激素变化与根蘖发生的研究.草地学报,1994(2) : 1-11.Gao Z S,Wang P.Chang of esterase isozyme and endogenous hormone in root system on ontogenesis of creeping-rooted character in alfalfa.Acta Agrestia Sinica,1994(2) : 1-11.(in Chinese)
[11]吴琼,孙超,陈士林,罗红梅,李滢,孙永珍,牛云云.转录组学在药用植物研究中的应用.世界科学技术:中医药现代化,2010,12(3) : 457-462.Wu Q,Sun C,Chen S L,Luo H M,Li Y,Sun Y Z,Niu Y Y.Application transcriptomics in the studies of medicial plant.World Science and Technology/Modernazation of Traditional Chinese Medicine and Materia Medica,2010,12(3) : 457-462.(in Chinese)
[12]Costa V,Angelini C,de Feis I,Ciccodocola A.Uncovering the complexity of transcriptomes with RNA-seq.Journal of Biomedicine and Biotechnology,2010,2010: 853-916.
[13]祁云霞,刘永斌,荣威恒.转录组研究新技: RNA-Seq及其应用.遗传,2011,33(11) : 1191-1202.Qi Y X,Liu Y B,Rong W H.RNA-Seq and its applications: A new technology for transcriptomics.Heretida,2011,33(11) : 1191-1202.(in Chinese)
[14]付畅,黄宇.转录组平台技术及其在植物抗逆性分子生物学中的应用.生物技术通报,2011(6) : 40-46.Fu C,Huang Y.Transcriptome platforms and their applications and molecular biology of plant stress resistance.Biotechnology Bulletin,2011(6) : 40-46.(in Chinese)
[15]王兴春,杨致荣,王敏,李玮,李生才.高通量测序技术及其应用.中国生物工程杂志,2012,32(1) : 109-114. Wang X C,Yang Z R,Wang M,Li W,Li S C.High throughput senquencing technology and its application.China Biotechnology,2012,32(1) : 109-114.(in Chinese)
[16]岳桂东,高强,罗龙海,王军一,徐姣卉,尹烨.高通量测序技术在动植物研究领域中的应用.中国科学,2012,42(2) : 107-124.Yue G D,Gao Q,Luo L H,Wang J Y,Xu J H,Yin Y.The application of high-senquencing technology in plant and animal research.Scientia Sinica Vitae,2012,42(2) : 107-124.(in Chinese)
[17]Zhang G,Guo G,Hu X,Zhang Y,Li Q,Li R,Zhuang R,Lu Z,He Z,Fang X,Chen L,Tian W,Tao Y,Kristiansen K,Zhang X,Li S,Yang H,Wang J,Wang J.Deep RNA sequencing at single base-pair resolution reveals high complexity of the rice transcriptome.Genome Research,2010,20(5) : 646-654.
[18]Jiao Y P,Zhao H N,Ren L H,Song W B,Zeng B,Guo J J,Wang B B,Liu Z P,Chen J,Li W,Zhang M,Xie S J,Lai J S.Genome-wide genetic changes during modern breeding of maize.Nature Genetic,2012(44) : 812-817.
[19]夏云,雷二庆,王槐春.Internet实用技术与生物医学应用.北京:军事医学出版社,1997: 134-354.Xia Y,Lei E Q,Wang H C.The Internet Technology and Biomedical Applications.Beijing: Military Medical Publishing House,1997: 134-354.(in Chinese)
[20]Green P.Against a whole-genome shotgun.Genome Research,1997,7(5) : 410-417.
[21]吕军,张颖,冯立芹,李宏.生物信息学工具BLAST的使用简介.内蒙古大学学报,2003,34(2) : 179-186.Lv J,Zhang Y,Feng L Q,Li H.A brife introduction bioinformatic tool blast.Acta Scientiarum Naturalium Universitatis Neimengol,2003,34(2) : 179-186.(in Chinese)
[22]师红雯,黄原.基因产物功能分类系统.生命的化学,2006,26(4) : 366-368.Shi H W,Huang Y.Gene product function classification system.Chemistry of Life,2006,26(4) : 366-368.(in Chinese)
[23]Holmgren A.Thioredoxin and glutaredoxin systems.The Journal of Biological Chemistry,1989,264(24) : 13963-13966.
[24]李彩凤,赵丽影,陈叶婷,越鹏,谷维,田园园,滕祥勇,王楠博.高等植物脂氧合酶研究进展.东北农业大学学报,2010,41(10) : 143-149.Li C F,Zhao L Y,Chen Y T,Yue P,Gu W,Tian Y Y,Teng X Y,Wang N B.Research advances on higher plant lipoxygenase.Journal of Northeast Agricultural university,2010,41(10) : 143-149.(in Chinese)
[25]夏雷,刘永章,姚蔚,黎珍,张纪亮,武芝,陈林,吕斌.ATP依赖的Lon蛋白酶研究进展.中国细胞生物学学报,2012,34(7) : 713-720.Xia L,Liu Y Z,Yao W,Li Z,Zhang J L,Wu Z,Chen L,Lv B.Progress on studies of ATP-dependent lon protease.Chinese Journal of Cell Biology,2012,34(7) : 713-720.(in Chinese)
[26]Ngo J K.The human Lon protease in mitochondrial stress protection and aging.Los Angeles: Graduate Student Degree Thesis of University of Southern California,2008.
[27]李笑一.拟南芥叶绿体LON4蛋白酶功能研究.兰州:兰州大学硕士学位论文,2010.Li X Y.Chloroplast Lon4 Protease in Arabidopsis thaliana.Master Thesis.Lanzhou: Lanzhou University,2010.(in Chinese)
[28]鲁大伟.苜蓿中华根瘤菌中ActS/ActR双组份系统酸调节基因的功能分析.安徽:安徽大学博士学位论文,2014.Lu D W.Analysis of ActS/ActR about acid regulation two-component system in sinorhizobium meliloti.PhD Thesis.Anhui: Anhui University,2014.(in Chinese)
[29]刘雄,阎隆飞.植物肌动蛋白研究的过去及现状.生物化学与生物物理进展,1994,21(3) : 203-207.Liu X,Yan L F.Plant actin research in the past and the present situation.Progress in Biochemistry and Biophysics,1994,21(3) : 203-207.(in Chinese)
[30]王卓,张少斌,马镝,马冠宇.植物肌动蛋白研究进展.安徽农业科学,2007,35(10) : 2860-2863.Wang Z,Zhang S B,Ma D,Ma G Y.Advance in plant actin.Journal of Anhui Agricultural Sciences,2007,35(10) : 2860-2863.(in Chinese)
[31]韩利波,陈志玲.植物的肌动蛋白结合蛋白.植物生理学通讯,2008,44(3) : 387-391.Han L B,Chen Z L.Plant actin-binding Proteins.Plant Physiology Communications,2008,44(3) : 387-391.(in Chinese)
[32]刘东,朱利泉,王小佳.芸薹属植物自交不亲和分子机制的研究进展.遗传,2003,25(2) : 241-244.Liu D,Zhu L Q,Wang X J.Progress of molecular mechanism of self-incompatibility in Brassica.Heretida,2003,25 (2) : 241-244.(in Chinese)
[33]孙虎,薛保国,杨丽荣,全鑫,朱自贤,武超,马雪娇.植物硫氧还蛋白系统.基因组学与应用生物学,2010,29(4) : 748-753.Sun H,Xue B G,Yang L R,Quan X,Zhu Z X,Wu C,Ma X J.Plant thioredoxin system.Genomics and Applied Biology,2010, 29(4) : 748-753.(in Chinese)
[34]夏德习,管清杰,金淑梅,李宇佳,梁涵,张欣欣,西内俊策,高野哲夫,柳参奎.拟南芥硫氧还蛋白M1型基因(AtTRX m1)与环境逆境之间的关系.分子植物育种,2007,5(1) : 21-26.Xia D X,Guan Q J,Jin S M,Li Y J,Liang H,Zhang X X,Shunsaku Nishiuchi,Tetsuo Takano,Liu S K.The relationship of Arabidopsis thaliana thioredoxin M-type 1 (AtTRX m1) gene with environmental stress.Molecular Plant Breeding,2007,5(1) : 21-26.(in Chinese)
[35]Croft K P C,Slusarenko A J.Volatile products of the lipoxygenase pathway evolved from Phaseolus vulgaris L.leaves inoculated with pseudomanassy ring as pv.phaseolicola.Plant Physiology,1993(1) : 13-24.
[36]Milan M A.An Arabidopsis thaliana lipoxygenase gene can be induced by pathogens; abscisic acid,and methyl jasmonate.Plant Physiology,1993,101: 441-450.
[37]Keppler L D,Novacky A.Initiation ofmembrane lipid peroxidation during bacteria induced hypersensitire reaction.Physiological and Molecular Plant Pathology,1987,30: 233-245.
[38]李靖,马长乐.植物脂氧合酶研究进展.生物学杂志,2007,24(6) : 5-9.Li J,Ma C L.Recent advances on study of plant lipoxygenases.Journal of Biology,2007,24(6) : 5-9.(in Chinese)
[39]Minke A N,Gerrit A V,Johannes F GV.Falty acid hydroperoxide lyase: Aplant cytochrome P450 enzyme involved in wound healing and pest resistance.Chembiochem,2001(2) : 494-504.
[40]Gardner W H.Biological roles and biochem istry of the lipoxygenase pathway.Hortscience,1995,30(2) : 197-205.
[41]高振生,谢雪菊,洪绂曾,王培.苜蓿根蘖性状遗传规律的研究.草业学报,1996,5(4) : 41-47.Gao Z S,Xie X J,Hong F Z,Wang P.A study on inheritance of creeping-rooted character in alfalfa.Acta Prataculturae Sinica,1996,5(4) : 41-47.(in Chinese)
[42]王晓娜.根蘖型苜蓿(Medicago varia)差异表达基因分析及根蘖性状发生分子机制研究.北京:北京林业大学硕士学位论文,2011.Wang X N.Analysis on different gene expression and molecular mechanism for creeping-rooted type Medicago varia.Master Thesis.Beijing: Beijing Forestry University,2011.(in Chinese)
[43]杨亚军,郑雷英,王新超.冷驯化和ABA对茶树抗寒力及其体内脯氨酸含量的影响.茶叶科学,2004,24(3) : 177-182.Yang Y J,Zhen L Y,Wang X C.Effect of cold acclimation and ABA on cold hardiness content of proline in teaplant.Journal of Tea Science,2004,24(3) : 177-182.(in Chinese)
[44]师晨娟,刘勇,荆涛.植物激素抗逆性研究进展.世界林业研究,2006,19(5) : 21-26.Shi C J,Liu Y,Jing T.Review on stress-resistance of phytohormone.Word Forestry Research,2006,19(5) : 21-26.
[45]高菲,张金鹏.苜蓿几种内源激素对根蘖形成影响的研究.第四届(2011)中国苜蓿发展大会论文集.北京:中国畜牧业协会,2011: 129-133.Gao F,Zhang J P.Alfalfa several endogenous hormones to research on the effects of root sprouts formation.The fourth (2011) of conference on the development of Chinese alfalfa proceedings.Beijing: China Animal Agriculture Association,2011: 129-133.(in Chinese)
[46]王铁梅,卢欣石.内源激素影响苜蓿根蘖性状发生及表现的研究.2007年中国草学会青年工作委员会学术研讨会论文集.海口:中国草学会,2007: 363-367.Wang T M,Lu X S.Endogenous hormones affect alfalfa root rice traits and performance research.The Chinese society of grass academic symposium on youth work committee in 2007.Haikou: Chinese Grassland Society,2007: 363-367.(in Chinese)
(责任编辑 王芳)
The down regulated genes related with creeping-rooted characteristics of alfalfa based on the RNA-seq
Guo Yun1,Wang Tie-mei1,2
(1.College of Forestry,Beijing Forestry University,Beijing 100083,China; 2.Grassland Resources and Ecology Research Center of Beijing Forestry University,Beijing 100083,China)
In order to understand the mechanism of alfalfa creeping-rooted characteristics at the molecular level,the transcriptome library of non creeping-rooted parts and the creeping-rooted parts of alfalfa variety“BL-101”with creeping-rooted characteristics were constructed and the differentially expressed genes and their functions were analyzed.The results showed that there were totally 15 978 differentially expressed genes,including five down regulated genes involved in the biological rooting processes.For these 5 genes,2 genes belonged to Lon protease family which associated with the regulation of plant hormone ABA and the other 3 genes belong to plant actin protease family,thioredoxin and lipoxygenase,respectively.These results could provid the theory basis to understand the molecular mechanism of creeping-rooted characteristics.
alfalfa; root growth; information biology; ABA
Wang Tie-mei E-mail: alfalfa@126.com
S551+.703; Q943.2
A
1001-0629(2016) 1-0075-11*
10.11829/j.issn.1001-0629.2015-0266
郭云,王铁梅.基于RNA-Seq技术的苜蓿根蘖性状发生相关下调基因.草业科学,2016,33(1) : 75-85.
Guo Y,Wang T M.The down regulated genes related with creeping-rooted characteristics of alfalfa based on the RNA-seq.Pratacultural Science,2016,33(1) :75-85.
2015-05-08 接受日期: 2015-10-09
国家自然科学基金——基于RNA-seq技术的苜蓿根蘖性状发生分子机制研究(31201843) ;北京林业大学校级大学生创新项目——基于RNA-seq技术的苜蓿根蘖性状发生分子机制的研究(X201410022009)
郭云(1993-),女,浙江嘉兴人,在读本科生,主要从事牧草种质资源研究。E-mail: guoyun199310@163.com
王铁梅(1981-),女,四川内江人,讲师,博士,主要从事牧草遗传资源与育种。E-mail: alfalfa@126.com

