MICU1在心肌缺血损伤中的保护作用*
杨怡 李秀川 裴海峰 邱琛茗 黄容
MICU1在心肌缺血损伤中的保护作用*
杨怡 李秀川 裴海峰 邱琛茗 黄容
(成都军区总医院心内科, 四川 成都 610083)
目的 探讨线粒体钙离子摄入蛋白1(MICU1)在心肌缺血损伤中是否能够发挥保护作用及其相关机制。方法 利用心肌点注射siRNA技术敲低心肌组织中的MICU1水平。48小时后,通过结扎小鼠冠状动脉前降支制备心肌梗死模型。结扎24小时后,利用western blot 检测心肌组织中的MICU1含量;利用离子火焰法测定心肌细胞线粒体中Ca2+水平。结扎72小时后,利用JC-1试剂盒及ATP试剂盒分别检测心肌细胞线粒体膜电位及ATP水平;利用Caspase-3试剂盒测定心肌细胞凋亡水平;利用小动物超声检测小鼠心脏功能。结果 缺血明显地降低了心肌细胞线粒体膜电位水平,并减少了线粒体ATP生成(均P<0.01)。同时缺血显著地增加了心肌细胞线粒体内Ca2+含量,并降低了线粒体中MICU1的表达(均P<0.01)。通过基因干预手段我们发现,MICU1的敲低明显加重了缺血诱导的线粒体Ca2+超载与线粒体功能抑制(均P<0.01)。另外,MICU1的缺失显著地增加了缺血诱导的心肌细胞凋亡与心功能损伤(均P<0.01)。结论 MICU1能够通过抑制线粒体Ca2+超载来减轻缺血后心肌损伤。
心肌梗死; 线粒体; MICU1; Ca2+超载
心肌梗死( myocardial infarction, MI)发病率高,死亡率高,严重威胁着人们的生命安全和生活质量[1,2]。在心肌缺血过程中及缺血后,线粒体会出现Ca2+超载,功能受损,最终导致心肌细胞坏死或凋亡[3]。另有资料表明,线粒体钙离子摄入蛋白1(mitochondrial calcium uptake 1,MICU1)可以通过抑制线粒体Ca2+运输蛋白(mitochondrial Ca2+uniporter, MCU)所介导的Ca2+转运而调控细胞存活,其缺失会导致MCU摄入过多Ca2+,过度生成超氧阴离子,进而增加细胞凋亡[4]。为进一步明确MICU1对心肌缺血损伤的影响,我们建立了心肌梗死小鼠模型,深入挖掘MICU1在其中的作用。
1 材料与方法
1.1 材料 实验动物:SPF/ VAF级雄性C57BL6/J小鼠[SCXK(京2014-0001) 北京维通利华实验动物技术有限公司,SPF/ VAF级],体重22~25g,鼠龄10~12周。试剂:JC-1试剂盒购于Invitrogen公司; ATP试剂盒购自中国Beyotime; Casepase-3试剂盒购自南京凯基; MICU1 siRNA 购于GenePharma公司;抗MICU1抗体购于美国Immunoway公司; PVDF膜购自美国Milipore公司。建立心肌梗死合并MICU1降低小鼠模型后分为4组(n=8):①Sham(健康对照组)。②MI (心梗组)。③Control(乱码RNA对照组)。 ④Mkd(心梗+MICU1降低组)。
1.2 方法
1.2.1 MICU1降低及心梗小鼠模型建立 经小鼠左胸前第4~5肋间暴露心脏,将MICU1 siRNA(20μg)注射于左室心肌壁内,然后将心脏放回胸腔,排空胸腔气体,并荷包缝合伤口。48小时后,基因干预效率达到峰值,而后通过结扎左冠状动脉前降支建立心肌梗死模型,心电图显示心肌有缺血表现,即证明造模成功。
1.2.2 线粒体膜电位测定 于心梗72小时后,采用JC-1试剂盒检测线粒体膜电位,按试剂盒说明进行操作。当膜电位水平较高时, JC-1主要以聚合体形式存在,呈红色荧光;当膜电位水平较低时,主要以单体形式存在,呈绿色荧光。通过Image Pro Plus 图像分析软件测定细胞内的红色和绿色荧光强度,相对定量线粒体膜电位水平。
1.2.3 线粒体ATP水平测定 于心梗72小时后,将心肌组织裂解后12 000g离心5min,取上清液,按照ATP试剂盒说明书进行操作,结果以nmol/mg线粒体蛋白质表示。
1.2.4 线粒体Ca2+测定 于心梗24小时后,将心肌细胞线粒体悬液1.5ml 置于10ml的试管中,加入5ml浓硝酸,阴暗处消化1周,然后用烘箱加热使硝酸分解蒸发,并加入1%的氯化镧至10ml,混匀即成待测品。在原子吸收分光光度计(AA26601F ,日本岛津)上用火焰原子吸收法检测Ca2+浓度,结果以μg/ mg 线粒体蛋白质表示。
1.2.5 MICU1表达水平检测 心梗24小时后,取50μg蛋白样品,用SDS-PAGE电泳分离,然后转至PVDF膜上,于5%牛奶中室温封闭1小时。再用抗MICU1抗体 (1∶500)孵育,于4℃过夜。洗膜后再用二抗孵育(37℃)1小时,然后发光并分析结果。
1.2.6 心肌细胞凋亡水平及心脏功能检测 心梗72小时后,采用Casepase-3试剂盒测定细胞凋亡水平,按试剂盒说明进行操作;采用小动物超声系统测定小鼠左心室射血分数(LVEF)。
2 结果
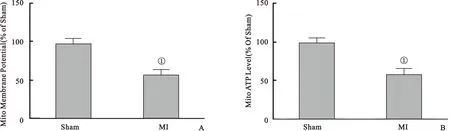
图1 缺血诱导心肌线粒体损伤
Figure 1 Myocardial ischemia induced myocardial mitochondrial damage
2.1 缺血诱导心肌线粒体损伤 结果发现,与对照组比较,缺血明显地降低了心肌线粒体膜电位及心肌线粒体ATP水平,差异均有统计学意义(均P<0.01),见图1。
2.2 缺血诱发心肌线粒体内Ca2+超载,降低线粒体中MICU1表达 结果发现,与对照组比较,缺血心肌线粒体内Ca2+含量明显增加,但MICU1水平则显著下降,差异均有统计学意义(均P<0.01),见图2。
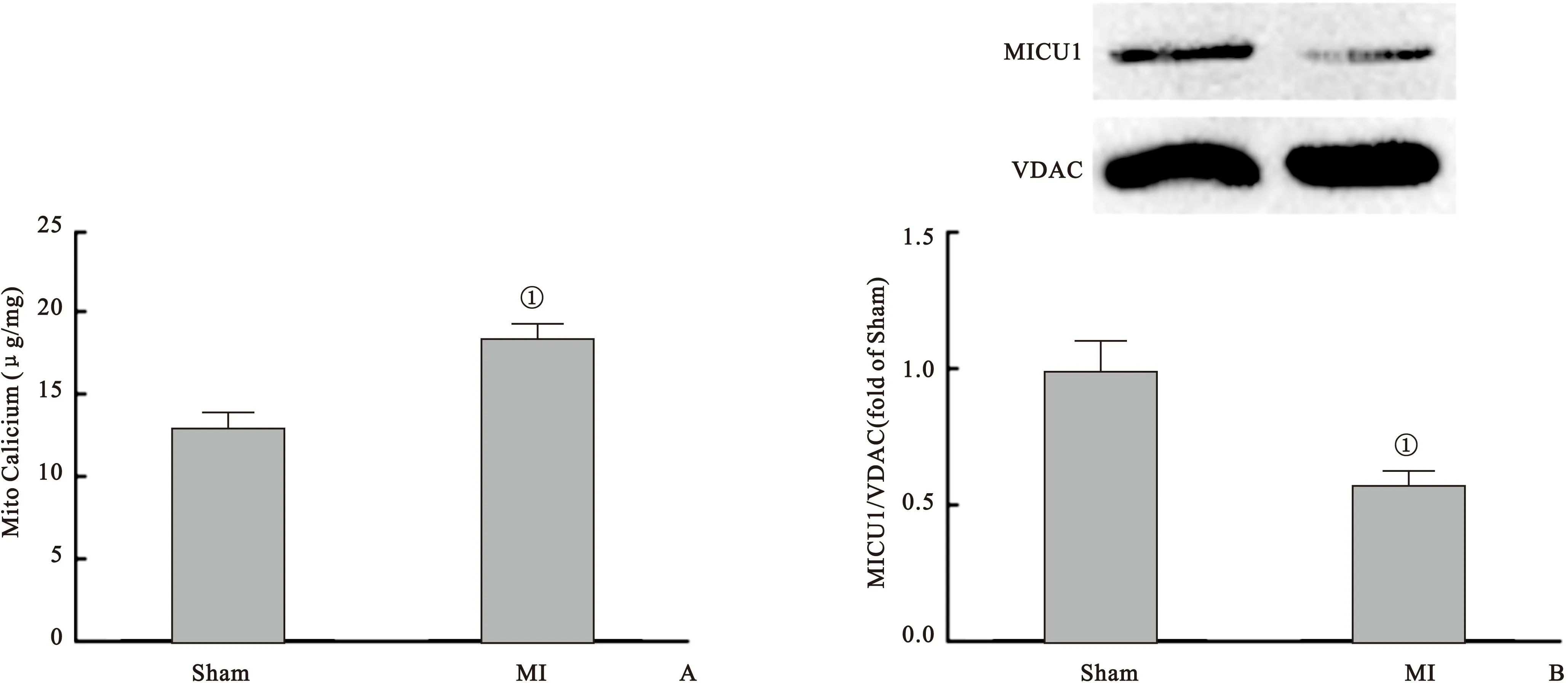
图2 缺血诱发心肌线粒体内Ca2+超载,降低线粒体中MICU1表达
Figure 2 Myocardial ischemia lead to Ca2+overload and MICU1 decreased in the mitochondria
2.3 MICU1缺失恶化缺血诱导的线粒体Ca2+超载,加重缺血诱导的线粒体损伤 在MICU1基因敲低小鼠造模成功的基础上,我们叠加心肌梗死模型。与对照组比较,MICU1缺失加重了缺血造成的线粒体Ca2+超载,并且明显地降低了心肌线粒体ATP水平,差异均有统计学意义(均P<0.01),见图3。

图3 MICU1缺失恶化线粒体内Ca2+超载,加重缺血诱导的线粒体损伤
Figure 3 MICU1 deficiency exacerbated Ca2+overload in the mitochondria and aggravated mitochondrial injury induced by ischemia

图4 MICU1缺失加重心肌缺血损伤
Figure 4 Downregulation of MICU1 aggravated myocardial ischemia injury
2.4 MICU1缺失加重心肌缺血损伤 心肌梗死3天后,使用Caspase-3 试剂盒及小动物超声分别检测心肌细胞凋亡水平和心脏功能。结果发现,与对照组比较,MICU1降低的心梗小鼠中,Caspase-3活性明显增高,心脏功能显著下降,差异均有统计学意义(均P<0.01),见图4。
3 讨论
心肌梗死是一种常见的心血管疾病,目前已成为西方国家致死和致残的主要原因[5]。根据世界卫生组织(WHO)数据推测,到2020年,急性心肌梗死将从全球导致死亡的第五大原因上升为第一大原因[6]。在我国,每年新发心肌梗死至少50万人,至2012年,调查数据显示,我国患心肌梗死人数已达到250万人,并且给家庭和社会带来严重的经济负担[7]。因此,深入研究心肌缺血损伤的干预靶点和治疗措施是很有必要的。
Ca2+作为重要的信号分子参与或调节细胞的分泌、分裂、收缩、兴奋、凋亡等重要活动,但过多的Ca2+进入线粒体会引发细胞的死亡[8]。有文献报道,Ca2+超载与线粒体功能障碍、细胞死亡、缺血损伤等有关[9~11]。目前的研究认为,Ca2+超载与氧自由基过度生成是造成心肌缺血损伤的主要原因[3],然而其确切机制及治疗靶点仍有待进一步研究。资料表明,MICU1作为线粒体Ca2+摄取过程中的一个关键调控蛋白,可以与MCU相互作用[12]。并且MICU1缺失会导致MCU摄入过多的Ca2+,造成Ca2+超载,过度生成超氧阴离子,进而增加细胞凋亡[4]。总之,由于MICU1能够调控Ca2+摄入,且Ca2+超载被认为与心肌缺血性损伤有关,说明MICU1可能参与了心肌缺血性损伤这一病理过程。因此,为了验证这一假说,我们建立了心肌梗死小鼠模型。结果发现,心肌缺血导致了线粒体损伤。为了阐释这一病理过程是否与线粒体Ca2+超载有关,我们通过可靠的实验方法检测了缺血心肌中的Ca2+含量。结果表明,心肌缺血导致了线粒体Ca2+超载,并且显著地抑制了Ca2+摄取调节蛋白MICU1的表达。这些结果与早前的研究一致[9],提示MICU1所介导的Ca2+超载与心肌缺血性损伤有关。为了进一步明确MICU1在心肌缺血性损伤中的作用,给予心梗小鼠心肌点注射特异性siRNA来降低心肌MICU1水平。然后再观察MICU1对心肌梗死的影响。结果发现,MICU1缺失恶化了线粒体内Ca2+超载,加重了缺血诱导的线粒体损伤。同时MICU1缺失显著地加重了缺血后心肌细胞凋亡与心功能损伤。
4 结论
MICU1能够减轻缺血性心肌损伤,并且这一过程可能是通过抑制线粒体Ca2+超载来实现的。这为心肌缺血损伤的防护提供了新的理论机理,提示MICU1有可能作为新的干预靶点来研究。
[1]White HD, Chew DP. Acute myocardial infarction [J]. Lancet, 2008, 372: 570-584.
[2]Dominguez-Rodriguez A, Abreu-Gonzalez P, Reiter RJ. Cardioprotection and pharmacological therapies in acute myocardial infarction: Challenges in the current era [J]. World J Cardiol, 2014, 6: 100-106.
[3]贾冰. Ca2+在心肌缺血/再灌注损伤的线粒体调控机制中的作用[J]. 心脏杂志,2007, 19(5): 596-600.
[4]Mallilankaraman K, Doonan P, Cardenas C,etal. MICU1 is an essential gatekeeper for MCU-mediated mitochondrial Ca2+uptake that regulates cell survival [J]. Cell, 2012, 151: 630-644.
[5]Weir RA, McMurray JJ, Velazquez EJ,etal. Epidemiology of heart failure and left ventricular systolic dysfunction after acute myocardial infarction: prevalence, clinical characteristics, and prognostic importance [J]. Am J Cardiol, 2006, 97: 13F-25F.
[6]Lopez AD, Murray CC. The global burden of diseases, 1999-2020 [J]. Nat Med, 1998,4: 1241-1243.
[7]顾晓龙. 急性心肌梗死合并心力衰竭再灌注后早期应用洋地黄的近期疗效和安全性研究[D].广州:南方医科大学,2014:1-85.
[8]Mallilankaraman K, Cardenas C, Doonan PJ,etal. MIUR1 is an essential component of mitochondrial Ca2+uptake that regulates cellular metabolism [J]. Nat cell Biol, 2012, 14: 1366-1343.
[9]Piper HM, Meuter K, Schafer C. Cellular mechanisms of ischemia-reperfusion injury [J]. Ann Thorac Surg, 2003, 75: S644-652.
[10] Liu T, Takimoto E, Dimaano VL,etal. Inhibiting mitochondrial Na+/ Ca2+exchange prevents sudden death in a Guinea pig model of heart failure [J]. Circ Res, 2014, 115: 44-54.
[11] Brookes PS, Yoon Y, Robotham JL,etal. Calcium, ATP, and ROS: a mitochondrial love-hate triangle [J]. Am J Physiol Cell Physiol, 2004, 287: C817-833.
[12] 王乐乐.线粒体钙离子摄取中关键蛋白的结构与功能研究[D]. 天津:南开大学,2014:1-116.
MICU1 protects against myocardial infarction injury
YANG Yi,LI Xiuchuan,PEI Haifeng,etal
(DepartmentofCardiovascularMedicine,GeneralHospitalofChengduMilitaryArea,Chengdu610083,China)
Objective To investigate whether MICU1 (mitochondrial calcium uptake1) attenuates myocardial ischemia injury and underlying mechanism. Methods MICU1 Specific small interfering RNA (siRNA) was delivered through intramyocardial injection to knockdown MICU1 levels. After 48 hours, a mice model of myocardial infarction was induced by ligating left anterior descending branch of coronary artery. After 24 hours’ ligation, MICU1 levels were determined by western blot. The mitochondrial Ca2+contents measured via atomic absorption flame spectroscopy. After 72 hours’ ligation, mitochondrial membrane potential and ATP contents were detected by JC-1 assay kit and ATP assay kit, respectively; cell apoptosis assessed by caspase-3 activity assay and cardiac function determined by ultrasound. Results Mitochondrial membrane potential, ATP contents in mice subjected to myocardial infarction were decreased (P<0.01). Meanwhile, myocardial ischemia injury significantly increased mitochondrial Ca2+contents but decreased MICU1 levels (P<0.01). With method of genetic intervention, we found that MICU1 deficiency exacerbated mitochondrial Ca2+overload and suppressed mitochondrial function (P<0.01). Furthermore, MICU1 deficiency aggravated mitochondrial ATP contents and cardiac function induced by ischemia (P<0.01). Conclusion MICU1 protects against myocardial ischemia injury induced by Ca2+overload.
Myocardial infarction; Mitochondria; MICU1; Ca2+overload
国家自然科学基金(81500208; 81470396);四川省科技支持计划项目(2015JY0277);全军医学科技青年培育项目(14QNP050)
裴海峰,Email:web2010@foxmail.com
R -33
A
10.3969/j.issn.1672-3511.2016.03.007
2015-12-01;修回日期: 2016-02-17; 编辑: 母存培)

