MIF基因多态性与剖宫产术后腹壁子宫内膜异位症遗传易感性相关性研究
林蓉蓉,谷杭芝,周星星,郑飞云(.温州医科大学 第一临床医学院,浙江 温州 505;.温州医科大学附属第一医院 妇科,浙江温州 505;.温州医科大学附属第一医院 检验科,浙江 温州 505)
MIF基因多态性与剖宫产术后腹壁子宫内膜异位症遗传易感性相关性研究
林蓉蓉1,谷杭芝2,周星星3,郑飞云2
(1.温州医科大学第一临床医学院,浙江温州325035;2.温州医科大学附属第一医院妇科,浙江温州325015;3.温州医科大学附属第一医院检验科,浙江温州325015)
[摘 要]目的:研究巨噬细胞移动抑制因子(MIF)启动子上游的rs2012133G/C、rs4822443A/G和rs4822446G/A位点基因多态性与剖宫产术后腹壁子宫内膜异位症易感性的关系。方法:收集60例经病理确诊的剖宫产术后腹壁子宫内膜异位症患者作为病例组,同期选取109例健康志愿者作为对照组,采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)方法对MIF基因多态性进行分析,分析基因型的分布及其与剖宫产术后腹壁子宫内膜异位症发病风险的关系。结果:rs2012133G/C SNP的CC、CG、GG基因型频率在病例组和对照组2组中比较差异有统计学意义(P=0.032);C、G等位基因频率分布2组比较差异有统计学意义(P= 0.031)。与CG+CC基因型相比,携带GG基因型可明显增加子宫内膜异位症的发病风险(OR=2.284,95%CI:1.200~4.345)。而rs4822443A/G、rs4822446G/A SNP的基因型频率在病例组和对照组中的比较,差异无统计学意义(P>0.05)。结论:MIF rs2012133G/C位点基因多态性与剖宫产术后腹壁子宫内膜异位症发生的易感性有关,GG基因型是子宫内膜异位症的易感基因型。
[关键词]子宫内膜异位症;巨噬细胞移动抑制因子;基因多态性;剖宫产
子宫内膜异位症为妇科常见疾病,传统上将其分为卵巢型、腹壁型和深部浸润型。近年来无产科指征剖宫产及社会因素剖宫产逐年增加,剖宫产术后腹壁子宫内膜异位症发病率也呈上升趋势,逐渐引起妇产科医师的重视。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种可溶性淋巴因子。已有研究证实MIF水平在子宫内膜异位症患者的外周血及腹腔液中呈明显升高的趋势[1]。MIF基因多态性在子宫内膜异位症中已有研究[2-4],而MIF基因启动子上游的rs2012133G/C、rs4822443A/G和rs4822446G/A位点的基因多态性与剖宫产术后腹壁子宫内膜异位症的关系尚未见报道,故本研究拟用聚合酶链式反应-限制性片段长度多态性分析(PCR-RFLP)技术,探讨MIF基因多态性与剖宫产术后腹壁子宫内膜异位症易感性的关系,进一步阐明剖宫产术后腹壁子宫内膜异位症发生的分子机制。
1 资料和方法
1.1一般资料 选取2015年1月至2015年7月温州医科大学附属第一医院妇科收住的剖宫产术后腹壁子宫内膜异位症患者共60例为病例组,年龄24~44岁,平均(33.48±6.93)岁。最短发病年龄为剖宫产术后4个月,最长为剖宫产术后5年。所有病例术后病理诊断为腹壁子宫内膜异位症。随机选取同时期本院109例健康体检者为对照组,年龄22~50岁,平均(31.25±7.17)岁,2组间年龄差异无统计学意义(P>0.05)。2组受试者彼此之间无血缘关系,家族史中无遗传病,无肝炎、结核等感染性疾病,无糖尿病、甲状腺功能异常等内分泌疾病,无妇科良、恶性肿瘤,无类风湿性关节炎及其他自身免疫性疾病,3个月内未服用过激素类药物。对照组均通过腹部B超检查及外周血CA125测定,排除腹壁子宫内膜异位症、盆腔子宫内膜异位症及子宫腺肌病。以上标本采集均由受试者本人及其家属知情同意。
1.2方法
1.2.1 DNA提取:清晨空腹条件下抽取2组受试者外周静脉血3 mL,加入内置有0.85 mL枸橼酸钠的试管中,使用天根血液基因组DNA提取试剂盒提取外周血白细胞DNA。
1.2.2 基因多态性检测:MIF-rs2012133G/C、rs4822443A/G和rs4822446G/A基因型检测采用PCRRFLP方法。PCR反应体积为20 μL,其中模板DNA 1 μg,2X Taq PCR Mastermix 10 μL(北京天根生化科技有限公司),primer1(10 μmol/L)1 μL,primer2(10 μmol/L)1 μL(所有引物均由primer premier 5.0设计,由上海生工生物工程有限公司合成,引物及退火条件见表1),双蒸水补足至20 μL;酶切反应体系10 μL,其中PCR产物4 μL,限制性内切酶(北京NEB有限公司)0.2 μL,10X NEBuffer 1 μL,双蒸水补足至10 μL,37 ℃水浴4 h。酶切产物于2%的琼脂糖凝胶电泳分析基因型。通电,稳压110 V,电泳以溴酚蓝指示剂至胶2/3处停止。

表1 各基因位点的引物、退火条件、产物长度、内切酶种类及酶切后片段长度
1.3统计学处理方法 采用SPSS19.0统计软件进行分析。计量资料采用t检验,计数资料采用卡方检验,以非条件logistic回归方法计算等位基因和基因型相对风险度的比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)。P<0.05为差异有统计学意义。
2 结果
2.1酶切结果 rs2012133G/C位点GG基因型不能被HpaII酶切,只可见一条793 bp大小的条带,而CC基因型被HpaII酶切后可见一条209 bp和一条584 bp大小的条带,GC基因型同时见上述三条条带。rs4822446G/A位点GG基因型不能被AluI酶切,只可见一条326 bp大小的条带,而AA基因型被AluI酶切后可见一条200 bp和一条126 bp大小的条带,GA基因型同时见上述三条条带。rs4822443A/G位点AA基因型不能被HaeIII酶切,只可见一条326 bp大小的条带,而GG基因型被HaeIII酶切后理论上将会有一条298 bp和一条38 bp大小条带,但38 bp的条带在琼脂糖凝胶上电泳速度过快,所以在最终曝光的结果中并不能见到清楚的38 bp条带,所以GG基因型被HaeIII酶切后可见到一条略低于326 bp的298 bp大小的条带,AG基因型同时见上述两条条带。见图1。
2.22组研究对象Hardy-Weinberg平衡检验 统计学处理显示2组MIF-rs2012133G/C、rs4822443A/G 和rs4822446G/A基因型位点的基因型频率分布均符合Hardy-Weinberg平衡(均P>0.05)。
2.32组间多态性位点基因型、等位基因频率比较
rs2012133G/C SNP的CC、CG、GC基因型频率在病例组和对照组中分别是20.0%、25.0%、55.0%和 23.9%、41.3%、34.9%,2组比较差异有统计学意义(P=0.032);C、G等位基因频率分布在病例组和对照组中分别是32.5%、67.5%和44.5%、55.5%,2组比较差异有统计学意义(P=0.031)。使用logistic回归分析计算结果显示,与CG+CC基因型相比,携带GG基因型可明显增加子宫内膜异位症的发病风险(OR=2.284,95%CI:1.200~4.345)。rs4822443A/ G和rs4822446G/A SNP的基因型频率在病例组和对照组患者中的比较,差异无统计学意义(P>0.05)。见表2。
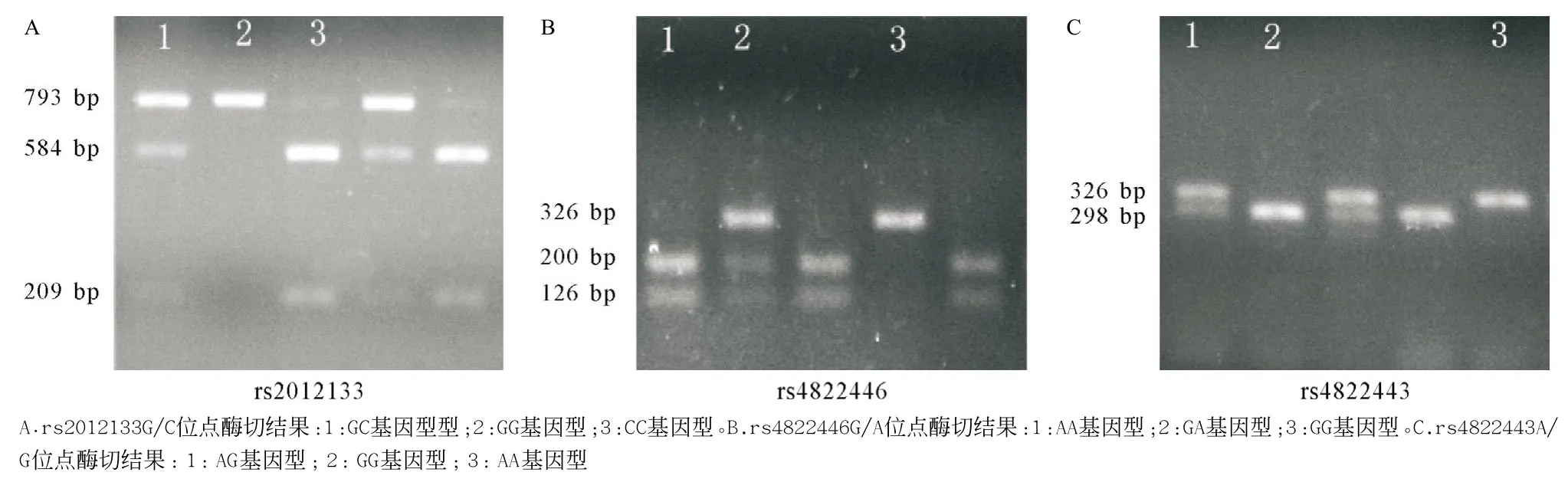
图1 rs2012133G/C、rs4822446G/A及rs4822443A/G位点酶切产物电泳图

表2 2组研究对象3个基因位点基因型及等位基因频率比较[n(%)]
3 讨论
剖宫产术后腹壁子宫内膜异位症是一种特殊类型的盆腔外子宫内膜异位症。随着剖宫产率的逐年增加,其发生率也在不断增高。一般认为剖宫产瘢痕子宫内膜异位症系活性的子宫内膜种植于腹壁剖宫产部位而产生的,属医源性种植[5]。但在实际观察中发现,剖宫产术后腹壁子宫内膜异位症的发生率远低于剖宫产切口污染率,可见该疾病发生与否并不完全由内膜种植所致。近年来的大量研究发现,免疫调节异常参与子宫内膜异位症的发生发展,免疫机制在异位内膜的种植、定位、增殖及生长过程中起了很大的作用。子宫内膜异位症患者体内大量细胞因子分泌失调(包括数量及活性的改变),它们相互之间形成了正反馈,使体内的无菌性炎症反应大大增加,导致子宫内膜异位症的发生及发展。因此,可以把子宫内膜异位症看作是一种免疫缺陷导致的炎症相关性疾病。
目前已有较多研究将关注点聚焦于MIF,其在子宫内膜异位症发病中的作用已日益受到重视。MIF是一种可溶性的细胞因子,人的MIF基因片段长度小于1 kb,位于22号染色体长臂(22ql1.2)的保守区内,由3个外显子和2个内含子组成[6]。研究发现子宫内膜异位症患者的异位病灶中和外周血中MIF水平明显升高[1]。雌激素能刺激异位子宫内膜细胞分泌MIF,而MIF又能反过来刺激雌激素合成过程中的关键酶—芳香化酶的表达,MIF在环路中起到了关键作用[7]。检测子宫内膜异位症患者腹腔液中的MIF水平发现,与对照人群比较其明显升高[8]。早期的研究发现腹腔中的MIF主要由腹腔巨噬细胞分泌[9],进一步的研究发现子宫内膜异位症患者腹腔的巨噬细胞活性也发生了明显的改变,其MIF的基础分泌量和脂多糖刺激分泌量都较正常人多[10]。而在癌症和其他炎症性疾病领域对MIF的研究中发现,MIF不仅参与感染、自身免疫性疾病的病理生理过程,还可通过刺激细胞增殖和迁移[11]、促进血管生成[12]、影响肿瘤抑制基因p53转录活性[13]、抑制细胞周期蛋白G1[14]等影响肿瘤的发生和发展。MIF的作用似乎都涉及到了子宫内膜异位症形成的过程中的3A程序—黏附、侵袭、血管形成[15]。MIF在子宫内膜异位症无菌性炎症中可通过抑制局部巨噬细胞和单核细胞的移行,促进其在炎症部位的聚集、浸润、增殖,增强其吞噬功能,并可促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的释放[16]。VEGF是内皮细胞的特异性丝裂原,是目前已知的作用最强的促血管生成因子之一,同时也是一种有效的血管通透性诱导因子[17]。目前已有大量的研究表明在子宫内膜异位症的发病过程中VEGF是一个重要的因子。在早期子宫内膜异位盆腔囊肿形成的过程中,聚集了更多的VEGF[18],小鼠造模过程中形成的子宫内膜异位症病灶组织中,VEGF及其受体的表达明显升高[19]。早期的研究发现,腹腔中的VEGF也可以来源于巨噬细胞[20]。这些炎症因子之间构成了一个复杂的网络关系。但关于子宫内膜异位症患者体内高表达MIF的始发因素,目前仍未见相关报道。
本文将MIF基因启动子区的MIF-rs2012133G/C、rs4822443A/G和rs4822446G/A三个SNP位点纳入研究,结果发现rs2012133G/C位点中携带GG基因型的女性剖宫产术后腹壁子宫内膜异位症的发病风险增加(OR=2.284),GG基因型是子宫内膜异位症的易感基因型。推测rs2012133G/C位点中携带GG基因型的女性,其MIF基因启动子的活性增强,从而增加MIF的表达进而促进异位内膜细胞在局部种植、黏附、浸润、生长、病灶形成。而该位点突变的确切功能仍需进一步的实验证明。
参考文献:
[1]MAHDIAN S,AFLATOONIAN R,YAZDI R S,et al.Macrophage migration inhibitory factor as a potential biomarker of endometriosis[J].Fertil Steril,2015,103(1):153-9.e3.
[2]王春平,秦成路,周芸,等.MIF基因启动子区-794CATT微卫星多态性与子宫内膜异位症的相关性研究[J].中国妇幼保健,2011,26(7):1086-108 9.
[3]于雅,袁清连,王春平,等.MIF基因多态性与子宫内膜异位症的相关性[J].中国热带医学,2013,13(5):625 -628.
[4]石瑾秋,张怡.巨噬细胞移动抑制因子- 173位点单核苷酸多态性与子宫内膜异位症关系的研究[J].实用妇产科杂志,2010,26(9):668 -671.
[5]魏薇,卢丹,张建萍,等.剖宫产术后腹壁子宫内膜异位症手术119例临床分析[J].现代妇产科进展,2010,19(8):573-579.
[6]BLOOM B R,BENNETT B,OETTGEN H F,et al.Demonstration of delayed hypersensitivity to soluble antigens of chemically induced tumors by inhibition of macrophage migration[J].Proc Natl Acad Sci USA,1969,64(4):1176-1180.
[7]VEILLAT V,SENGERS V,METZ C N,et al.Macrophage migration inhibitory factor is involved in a positive feedback loop increasing aromatase expression in endometriosis[J].Am J Pathol,2012,181(3):917-927.
[8]PIZZO A,SALMERI F M,ARDITA F V,et al.Behaviour of cytokine levels in serum and peritoneal fluid of women with endometriosis[J].Gynecol Obstet Invest,2002,54(2):82-87.
[9]CALANDRA T,BERNHAGEN J,MITEHELL R A,et al.The macrophage is an important and previously unrecognized source of macrophage migration inhibitory factor[J].J Exp Med,1994,179(6):1895-1902.
[10]AKOUM A,KONG J,METZ C,et al.Spontaneous and stimulated secretion of monocyte chemotactic protein-1 and macrophage migration inhibitory factor by peritoneal macrophages in women with and without endometriosis[J].Fertil Steril,2002,77(5):989-994.
[11]GUO P,WANG J,LIU J,et al.Macrophage immigration inhibitory factor promotes cell proliferation and inhibits apoptosis of cervical adenocarcinoma[J].Tumour Biol,2015,36 (7):5095-5102.
[12]CHOUDHARY S,HEGDE P,PRUITT J R,et al.Macrophage migratory inhibitory factor promotes bladder cancer progression via increasing proliferation and angiogenesis[J].Carcinogenesis,2013,34(12):2891-2899.
[13]BROCK S E,RENDON B E,XIN D,et al.MIF family members cooperatively inhibit p53 expression and activity [J].Plos One,2014,9(6):e99795.
[14]OLIVEIRA C S,DE BOCK C E,MOLLOY T J,et al.Macrophage migration inhibitory factor engages PI3K/Akt signalling and is a prognostic factor in metastatic melanoma[J].BMC cancer,2014,14:630.
[15]DONNEZ J,VAN LANGENDONEKT A,CASANASROUX F,et al.Current thinking on the pathogenesis of endometriosis[J].Gynecol Obstet Invest,2002,54 Suppl 1:52-58; discussion 59-62.
[16]VEILLAT V,CARLI C,METZ C N,et al.Macrophage migration inhibitory factor elicits an angiogenic phenotype in human ectopic endometrial cells and triggers the production of major angiogenic factors via CD44,CD74,and MAPK signaling pathways[J].J Clin Endocrinol Metab,2010,95 (12):E403-12.
[17]LEUNG D W,CACHIANES G,KUANG W J,et al.Vascular endothelial growth factor is a secreted angiogenic mitogen [J].Science,1989,246(4935):1306-1309.
[18]NISOLLE M,CASANAS-ROUX F,DONNEZ J.Earlystage endometriosis:adhesion and growth of human menstrual endometrium in nude mice[J].Fertil Steril,2000,74 (2):306-312.
[19]MACHADO D E,BERARDO P T,PALMERO C Y,et al.Higher expression of vascular endothelial growth factor (VEGF) and its receptor VEGFR-2 (Flk-1) and metalloproteinase-9 (MMP-9) in a rat model of peritoneal endometriosis is similar to cancer diseases[J].J Exp Clin Cancer Res,2010,29(1):1-9.
[20]MCLAREN J,PRENTICE A,CHARNOCK-JONES D S,et al.Vascular endothelial growth factor is produced by peritoneal fluid macrophages in endometriosis and is regulated by ovarian steroids[J].J Clin Invest ,1996,98(2):482-489.
(本文编辑:赵翠翠,丁敏娇)
·消息·
Correlation study of single nucleotide polymorphisms in macrophage migration inhibitory factor gene with the risk of abdominal wall endometriosis after cesarean section
LIN Rongrong1,GU Hangzhi2,ZHOU Xinxin3,ZHENG Feiyun2.1.First Clinical Medical College,Wenzhou Medical University,Wenzhou,325035; 2.Department of Gynecology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015; 3.Department of Clinical Laboratory,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Abstract:Objective:To investigate whether polymorphisms of macrophage migration inhibitory factor (MIF) in promoter region (rs2012133G/C,rs4822443A/G and rs4822446G/A) are associated with hereditary susceptibility of abdominal wall endometriosis after cesarean section.Methods:Sixty patients with abdominal wall endometriosis after cesarean section were selected as case group and 109 healthy volunteers were collected as control group.The genotypes were detected by polymorphism chain reaction and restriction fragment length polymorphism analysis (PCR-RFLP).Results:There were statistical differences in genotype frequencies and allele frequencies between the case group and the control group (P=0.032; P=0.031) in rs2012133G/C site,GG genotype may markedly increase the risk of abdominal wall endometriosis after cesarean section (OR=2.284,95%CI:1.200~4.345).While no significant statistical differences could be found in rs4822443A/G,rs4822446G/ A sites (P>0.05).Conclusion:The results suggest that MIF rs2012133G/C polymorphism is associated with abdominal wall endometriosis after cesarean section,GG genotype is the risk genotype.
Key words:endometriosis; macrophage migration inhibitory factor; polymorphism; cesarean section
通信作者:郑飞云,主任医生,教授,博士生导师,Email:zfy 5710@163.com。
作者简介:林蓉蓉(1990-),女,浙江温州人,硕士生。
基金项目:浙江省临床医学重中之重一级学科开放基金(447201 206/002);温州市科技局科研基金资助项目(Y20140125)。
收稿日期:2015-12-09
[中图分类号]R711.71
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.03.005

