超低温保存对玉蝉花种子生理生化特性的影响1)
宋红 曹柏 王玲
(东北林业大学,哈尔滨,150040)
超低温保存对玉蝉花种子生理生化特性的影响1)
宋红曹柏王玲
(东北林业大学,哈尔滨,150040)
摘要以玉蝉花种子为试材,将种子自然含水量9.8%分别降至7.2%、5.0%、3.6%、1.9%,液氮保存超24 h后,采用自来水和室温两种方法化冻,测定种子电导率、发芽率、过氧化物酶活性等活力指标,探讨超低温保存对玉蝉花种子生理生化特性的影响及其超低温保存的可行性。结果表明:玉蝉花种子进行超低温保存是可行的,含水量和化冻方式是影响玉蝉花种子超低温保存效果的重要因素,超低温保存可以适度脱水,选择含水量3.6%的种子保存后有较高的发芽率;超低温保存后采用自来水化冻,玉蝉花种子的发芽率、可溶性蛋白质量分数、POD酶活性优于室温化冻,并且细胞膜结构及透性受损伤小。
关键词玉蝉花种子;超低温保存;生理生化特性;种子发芽率
分类号Q945
Physiological and Biochemical Characteristics ofIrisensataSeeds after Cryopreservation
Song Hong, Cao Bai, Wang Ling
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(4):44-47.
WithIrisensataseeds materials, we dried their moisture contents from 9.8% to 7.2%, 5.0%, 3.6% and 1.9%, respectively. After 24-h cryopreservation, we used the tap water thaw and thaw at room temperature to measure the level of various indicators of the vitality of seeds, including germination, conductivity and POD, to explore the influence on physiological and biochemical characteristics ofI.ensataseeds after cryopreservation.I.ensataseed cryopreservation is feasible, the moisture and the thaw are important factors affecting cryopreservation effect, the cryopreservation can moderate dehydration, and the moisture content of 3.6% of the seeds have a high germination rate after cryopreservation. After cryopreservation by using tap water to thaw, the germination rate, soluble protein content, and POD activity were better than those thawed at room temperature, and cell membrane structure and permeability were with less damage.
KeywordsIrisensataseeds; Cryopreservation; Physiological and biochemical; Seed germination rate
玉蝉花(Irisensata),鸢尾属(Iris)植物中耐寒性较强的种,形色兼备,连续花期较长,连片栽植观赏效果极佳,在东北三省均有分布[1-2]。随着环境的恶化,野生玉蝉花资源受到日益加重威胁,但当前我国对玉蝉花的开发保护、利用还未形成体系,仅有少部分科研工作者在从事相关方面的研究,对其种质资源的保护已经迫在眉睫。在低温保存、超低温保存、超干保存等众多种质资源保存方法中,超低温保存被认为是目前实现生物种质永久保存的理想方法而被广泛应用[3-4]。当前,国内外超低温保存实际生产应用,主要集中在农作物和蔬菜上[5];针对观赏植物,目前也已成功对部分种子、花粉、茎段、悬浮细胞等组织培养物进行了保存试验[6-8],但对玉蝉花种子的超低温贮藏可行性以及超低温保存后生理生化指标是否发生变化、变化规律均不明了,有关方面的研究甚少。因此,本研究选择耐寒、观赏价值极佳的寒地鸢尾典型种玉蝉花鸢尾为试验材料,探讨超低温保存对玉蝉花种子生理生化特性的影响,以此实现玉蝉花优良种质长久保存目的,也为玉蝉花种质资源的保护提供技术基础。
1材料与方法
试验材料为玉蝉花种子,于2013年9月采于东北林业大学帽儿山实验基地,种子质量为10.7 mg/粒。室内自然阴干后,测得初始含水量为9.8%,密封于铝箔袋,贮藏于冰箱中4 ℃暂存。
采用室温硅胶干燥法对种子进行处理,得到含水量分别为7.2%、5.0%、3.6%、1.9%的种子。将得到的不同含水量的种子放入冻存管中,拧紧盖子后放在冻存管架上直接投入液氮中,超过24 h后取出冻存管,用自来水化冻(冲洗6~7 min)和室温化冻(置于25 ℃室温中,自然冷却0.5 h)两种方式解冻,测定生理生化指标。
种子使用前需进行逐级回水处理。将不同含水量玉蝉花种子分别置于尼龙网袋中,首先放入装有饱和氯化钙溶液的密封干燥器中,20 ℃下放置24 h;然后再依次转移到装有饱和氯化氨溶液和水的干燥器中,20 ℃下分别平衡24 h[9]。
发芽率的测定:参考《国际种子检验规程》[10]。将铺有滤纸的培养皿里均匀摆上50粒种子,重复3次。放在光照恒温培养箱内培养,昼夜变温处理:30 ℃(8 h)/20 ℃(16 h)。以后每天检查并记录种子的萌发情况,保持培养皿内滤纸表面一直是湿润状态。发芽率=(发芽的种子数/供监测的种子数)×100%。
电导率的测定:准确称取各条件下的种子1 g置于烧杯中,加入去离子水50 mL,充分震荡后于25 ℃条件下静置24 h,摇匀后用LC-116型电导仪测定其浸出液,重复3次,计算单位质量电导率[11]。
可溶性蛋白质量分数及过氧化物酶(POD)活性的测定:参照王学奎[12]的植物生理实验方法。
运用SPSS19.0及Excel软件进行统计分析,用平均值和标准误表示测定结果,并用Duncan法对各测定数据进行多重比较。
2结果与分析
2.1超低温保存对种子发芽率的影响
由表1可见:在超低温保存前,随含水量的降低,种子发芽率呈现先上升再降低的趋势,含水量7.2%、5.0%、3.6%、1.9%的种子发芽率均高于初始含水量的种子,且含水量5.0%的种子发芽率显著升高了10.24%,表明玉蝉花种子有较强的耐脱水性,脱水处理促进了种子的萌发。超低温保存后,采用自来水化冻,含水量5.0%、3.6%的种子发芽率与其它含水量种子相比差异显著,较初始含水量分别升高了5.63%、6.60%,含水量3.6%时测得发芽率最高,各含水量种子发芽率较保存前均有升高;采用室温化冻,含水量3.6%的种子发芽率(92.70%)显著高于多数种子,含水量9.8%、7.2%、3.6%的种子发芽率高于保存前。含水量5.0%、3.6%的种子发芽率在保存前后均保持较高的水平,其中含水量3.6%的种子采用自来水化冻和室温化冻发芽率较保存前均上升,分别升高了6.06%、5.47%。
玉蝉花种子发芽率受不同化冻方式和含水量的影响明显,差异达极显著水平(见表2)。
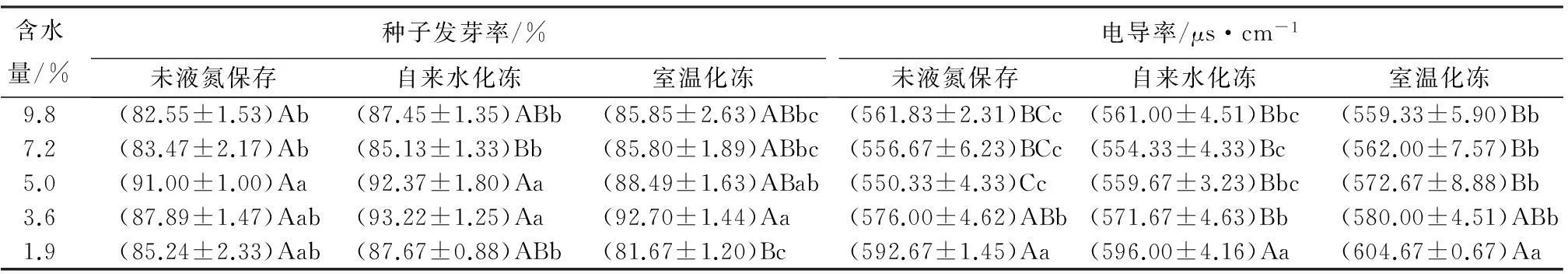
表1 超低温保存前后种子发芽率及电导率的比较
注:数字后,同列不同小写字母表示差异显著(P<0.05)、同列不同大写字母表示差异极显著(P<0.01)。
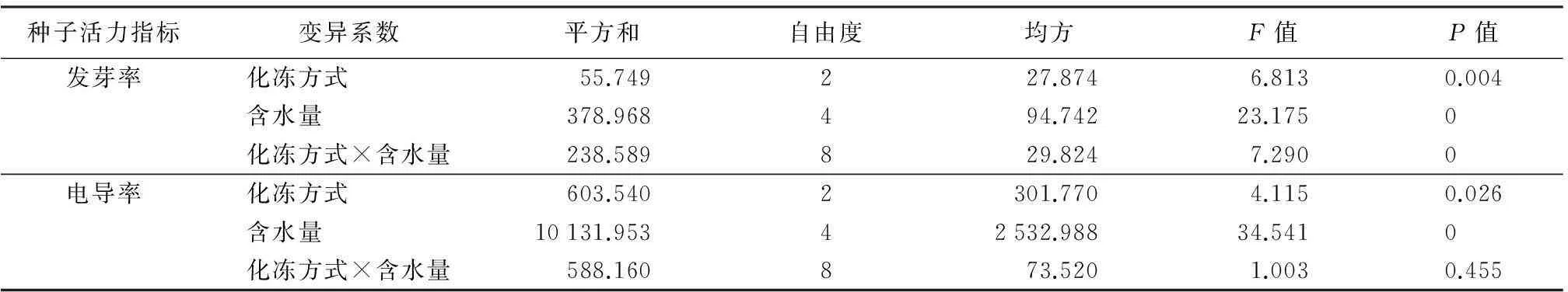
表2 不同化冻方式和含水量对玉蝉花种子发芽率和电导率影响的方差分析
注:双因素方差分析置信区间为95%。
2.2超低温保存对细胞膜透性的影响
在贮藏过程中,由于外部环境因素变化或自身因素种子会发生一定程度的老化劣变,导致细胞膜完整性受损及膜透性增大,种子内电解质向周围溶液渗漏,浸出液电导率随之上升[13]。由表1可见:超低温保存前,随含水量的降低,种子电导率呈现下降—上升趋势。含水量7.2%、5.0%的种子电导率与初始含水量相比,无显著差异;含水量3.6%的种子电导率与初始含水量相比,差异显著,升高了2.52%;含水量1.9%的种子电导率与初始含水量相比,差异极其显著,升高了5.49%。玉蝉花种子超低温保存后,采用自来水及室温化冻,含水量7.2%、5.0%、3.6%的种子电导率与初始含水量比,差异不显著;含水量1.9%的种子电导率与其它任意含水量种子,差异均极其显著。采用自来水化冻的各含水量种子电导率,比保存前变化小,有些甚至降低,说明快速解冻能使种子迅速通过危险温度区,对细胞膜的影响不大;采用室温化冻的各含水量种子电导率,比保存前变化大,多数都升高,说明缓慢解冻种子细胞膜受到了损伤,修复能力减弱,种子活力不如快速解冻种子。
玉蝉花种子电导率受不同化冻方式影响达显著水平,受含水量影响则达极显著水平(见表2)。
2.3超低温保存对可溶性蛋白质量分数的影响
由表3可见:超低温保存前,随含水量降低,种子可溶性蛋白质量分数呈上升—下降的趋势。含水量7.2%、5.0%、3.6%的种子可溶性蛋白质量分数与初始含水量种子比,差异显著,分别升高了38.92%、79.41%、100.98%。超低温保存后,无论采用何种化冻方式,含水量7.2%、5.0%、3.6%的种子可溶性蛋白质量分数,均显著高于初始含水量种子,且含水量3.6%的种子可溶性蛋白质量分数显著高于其它任意含水量种子。超低温保存后,种子可溶性蛋白质量分数基本都降低了,对于大多数种子而言,采用室温化冻可溶性蛋白质量分数降幅大,含水量3.6%的种子可溶性蛋白质量分数保存前后均高于其它任意含水量种子,说明含水量3.6%的种子低温耐性好。
玉蝉花种子可溶性蛋白质量分数受不同化冻方式影响非常明显,达极显著水平,受含水量的影响也达到极显著水平(见表4)。

表3 超低温保存前后种子可溶性蛋白质量分数及POD活性的比较
注:数字后,同列不同小写字母表示差异显著(P<0.05)、同列不同大写字母表示差异极显著(P<0.01)。

表4 不同化冻方式和含水量对玉蝉花种子可溶性蛋白质量分数和过氧化物酶活性影响的方差分析
注:双因素方差分析置信区间为95%。
2.4超低温保存对过氧化物酶(POD)活性的影响
过氧化物酶(POD)是植物体内膜质过氧化过程中的保护酶之一,是种子自身抵制活性氧、清除自由基有害物质的清除剂。由表3可见:超低温保存前,含水量5.0%、3.6%的种子POD活性有所升高,含水量7.2%、1.9%的种子POD活性则明显降低。超低温保存后,仅含水量7.2%(室温化冻)和含水量3.6%(自来水化冻)的种子POD活性升高,其余种子POD活性均降低,且采用室温化冻POD活性降幅更大,不如自来水化冻。
玉蝉花种子过氧化物酶活性受不同化冻方式影响非常明显,达极显著水平;含水量对玉蝉花种子过氧化物酶活性的影响也达到极显著水平(见表4)。
3结论与讨论
试验表明:超低温保存后,无论采用何种化冻方式,各含水量的种子发芽率比保存前都有所提升,且在含水量降低到1.90%时发芽率仍能达到80%以上的,说明超低温保存对玉蝉花种子萌发有促进作用。这与刘燕等[8]对47种花卉种子的超低温保存研究结果一致。含水量3.6%比其它含水量种子超低温保存后发芽率显著高,说明选择合适含水量进行超低温保存是必要的。
低温保存中,细胞膜结构的损坏也会影响超低温保存效果[14]。本试验中采用快冻快解的方法对种子细胞膜结构影响不大,而采用缓解的方法则容易造成对细胞膜的损伤,这与蒋燕等[15]对南瓜种子的超低温保存生理生化研究结果一致。含水量7.2%、5.0%、3.6%的种子保存后电导率,与初始含水量比差异不显著,说明玉蝉花种子适当脱水可保持种子细胞膜系统的相对完整性,这与对蓝桉种子、金钱松种子的研究结论一致[16-17]。
植物的超低温耐性与植物体内的水分状态和保护性物质是分不开的,在植物细胞中,可溶性蛋白是保护性物质之一,它的存在有利于低温耐性的提高[18]。而种子POD的存在,可为萌发过程中清除细胞内脂质过氧化产生的毒害。本试验中发现:适当降低玉蝉花种子的含水量,可以提高种子内可溶性蛋白质量分数及POD活性,含水量7.2%、5.0%、3.6%的种子可溶性蛋白质量分数明显高于初始含水量种子,含水量5.0%、3.6%的种子POD活性同样高于初始含水量种子,多数自来水化冻种子可溶性蛋白质质量分数及POD活性高于室温化冻,说明适当降低种子含水量和采用自来水化冻有利于保持种子的低温耐性和维持抗脂质过氧化功能。
关于化冻方式对超低温保存后种子的种子活力影响,有研究发现,缓慢解冻时,细胞内易发生剧烈再结晶,冰晶体增大,使细胞死亡;快速解冻能使其通过略低于冰融点的危险温度区,防止降温过程中所形成晶核生长对细胞损伤[19]。任淑娟等[20]认为,快速解冻的七叶树种子,离体胚活力更高;但胡晋等[21]认为,室温化冻,可以使种子慢慢适应温度变化而免遭伤害。本试验研究发现:超低温保存后,采用自来水化冻发芽率变化相对较稳定,发芽率、膜透性优于室温化冻,经自来水化冻多数含水量种子的可溶性蛋白质量分数、POD活性也高于室温化冻,说明超低温保存后玉蝉花种子适合快速解冻,从而维持种子的活力。
超低温保存技术多以材料进入液氮后保存一定时间,取出后检验材料存活情况判定保存方法是否成功[22]。综上分析认为,无论是发芽情况,还是生理指标,都不同程度地表明玉蝉花种子进行超低温保存是可行的,且对种子的有些性能具有一定的促进作用[23]。玉蝉花种子的超低温保存效果,主要受含水量和化冻方式两个重要因素的影响,含水量3.6%、自来水化冻的组合最适进行超低温保存,此时种子具有较高的发芽率、可溶性蛋白质量分数和POD活性,细胞膜结构相对完整。
参考文献
[1]肖月娥,田旗,周翔宇,等.玉蝉花繁殖生态学研究[J].云南植物研究,2010,32(2):93-102.
[2]庄春慧,陈荀,付尧,等.玉蝉花种胚的丛生芽诱导和植株再生技术[J].草业科学,2014,31(9):1712-1717.
[3]林富荣,顾万春.植物种质资源设施保存研究进展[J].世界林业研究,2004,17(4):19-23.
[4]TAKAGI H, THINH N T, ISLAM O M, et al. Cryopreservation of invitro-grown shoot tips of taro (Colocasiaesculenta(L.) Schott) by vitrification. 1. Investigation of basic conditions of the vitrification procedure[J]. Plant Cell Rep,1997,16(9):594-599.
[5]刘燕,周慧,方标.园林花卉种子超低温保存研究[J].北京林业大学学报,2001,23(4):39-44.
[6]王越,刘燕.观赏植物种质资源的超低温保存[J].植物生理学通讯,2006,42(3):559-566.
[7]张亚利,尚晓倩,刘燕.花粉超低温保存研究进展[J].北京林业大学学报,2006,28(4):139-147.
[8]ENGELMANN F. 3. Plant germplasm cryopreservation: Progress and prospects[J]. Cryobiology,2009,59(3):370-371.
[9]高艳波,王振兴,耿晓东.超干贮藏对美女樱种子活力的影响[J].安徽农业科学,2013,41(12):5492-5494.
[10]国际种子检验协会.国际种子检验规程[M].颜启传,毕辛华,译.北京:中国农业出版社,1985.
[11]丁格根其尔.桃叶卫矛种子活力影响因素的研究[D].哈尔滨:东北林业大学,2014.
[12]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:167-168.
[13]李庆荣.樟科等树种种子超低温保存机理与技术研究[D].福州:福建农林大学,2003.
[14]STEPONKUS P L, WEBB M S. Freeze-Induced dehydration and membrane destabilization in plants[J]//SOMERO G N, OSMOND C B, BOLIS C L. Water and Life. Berlin: Springeuerlag,1992:338-362.
[15]蒋燕,郝文利,田野.液氮保存对南瓜种子生理生化特性的影响[J].北方园艺,2009(2):77-79.
[16]王晓丽,曹子林,李根前.超干处理对蓝桉种子发芽及生理生化特性的影响[J].西北林学院学报,2008,23(3):33-35.
[17]廖文燕.金钱松种子贮藏过程中的生理生化变化[D].南京:南京林业大学,2011.
[18]文彬.植物种质资源超低温保存概述[J].植物分类与资源学报,2011,33(3):311-329.
[19]徐刚标.植物种质资源离体保存研究进展[J].中南林学院学报,2000,20(4):81-87.
[20]任淑娟,王航,刘洁,等.七叶树种子离体胚的超低温保存[J].南京林业大学学报(自然科学版),2010,34(2):19-23.
[21]胡晋,徐湲,陈叶平,等.超低温保存对某些作物种子生活力和活力的影响[J].浙江农业大学学报,1994,20(4):411-416.
[22]王冠球,张文明,姚大年,等.糯小麦种子超低温保存适宜含水量的研究[J].种子,2011,30(11):1-3,7.
[23]史锋厚,喻方圆,沈永宝,等.超低温贮藏对油松种子的影响[J].南京林业大学学报(自然科学版),2005,29(6):119-122.
收稿日期:2015年12月14日。
作者简介:第一宋红,女,1966年10月生,东北林业大学园林学院,高级工程师。E-mail:851100942@qq.com。通信作者:王玲,东北林业大学园林学院,教授。E-mail:Wanglinghlj@126.com。
1)中央高校基本科研业务费专项资金(DL13EA07-2)。
责任编辑:张玉。

