浅论基因检测对肿瘤精准医疗的意义
张如奎,徐增辉
浅论基因检测对肿瘤精准医疗的意义
张如奎,徐增辉
作者单位:201805 上海白泽医学检验所/上海细胞治疗工程技术研究中心
1 基因检测对精准医疗的涵义
基因检测,顾名思义就是通过测序等手段对基因位点进行检测。最初的基因检测只是检测基因载体——染色体的数目异常,之后测序技术使得可以更清晰地认识基因序列,但在高通量测序之前,找到致病基因首先要通过各种方法进行染色体定位和确定候选基因,然后通过在该病的患者中筛查来验证致病基因的假说。2005 年第一台高通量测序仪 Genome Sequencer 20 System 的诞生给测序界带来变革(高通量测序又称第二代测序、新一代测序),也为致病基因研究带来新的方法。美国国立卫生研究院(NIH)掌门人、人类基因组计划的首席科学家 Francis S. Collins 博士对此评价道:“测序技术需要变得更小型、更快速、更便宜,才能满足个性化医疗的需求。我们期待这种创新技术能够应用在生物医学研究,并最终应用于临床。”而现在,基因检测通过新一代测序技术同时检测成千上万个基因位点,能够对肿瘤以及各种多基因遗传病的易感性进行预测、对临床治疗进行针对性的指导[1]。
基因检测并非突如其来,在人类基因组计划及其大量相关研究的支持下,基因信息对人类健康逐渐显示出非凡的意义,随后基因检测才悄然兴起。成立于 2006 年的美国一家提供基因检测服务的公司 23andMe 是个人基因检测的先行者,该公司2011 年在 PLoS ONE 杂志上发表了一篇论文,论述其有能力分析用户的基因检测数据与相关遗传疾病之间的关联[2]。2008 年,更快、更廉价的基因组测序因在肿瘤患者中得到普遍的应用,被Science 杂志评为十大科学突破。基因组测序产生的大量数据为精准医疗提供了科学依据,奠定了坚实基础[3]。2015 年 1 月 20 日,美国总统奥巴马在国情咨文演讲中适时倡导加速进入精准医疗时代,阐述了“精准医疗带领我们战胜肿瘤和糖尿病等疾病,通过个性化预防和个体化治疗促进健康”这一思想。所以说,精准医疗是基于个体基因信息、健康档案以及临床病例的大数据分析而进行的个性化预防和个体化治疗[4-5]。
精准医疗的思想在我国拥有悠久的历史,众所周知中医的诊疗有很强的个性化倾向,因人、因地、因时制宜的辨证论治是中医“个性化医疗”的具体表现形式,这与精准医疗思想有契合之处。同时我国具备精准医疗的样本优势,临床资源多是我国肿瘤研究一大特点,充分利用这些资源,完善中国健康人群和肿瘤患者基因数据库,组建生物信息学大数据分析平台,建立基于黄种人的特性化的基因解读公式。近年来,中国的肿瘤患者显著增加,很多医院和研究机构合作组建精准医学中心,四川大学华西医院、复旦大学中山医院已经开始行动[6]。广泛开展基因检测不但能给中国的医疗带来颠覆,使过去经验式的看病模式改变为个性化医疗模式,还将对以后的肿瘤筛查、精准治疗产生深远的指导意义。
显然,目前精准医疗是理想,实现理想则需要缜密的落地方案。中国政府谨慎而积极地释放加大精准医疗投入的信号,2015 年 4 月 15 日国家卫生计生委和科技部组织了生物信息学和临床医学等专业领域的专家,以及中国科学院和国家自然科学基金委员会等部门的领导,共同研讨精准医学研究计划的实施原则、目标及重点内容,谋划我国医学发展战略。另据悉,中国“十三五”规划会涉及精准医疗并给予资金资助,但具体数额未知。肿瘤作为人类健康的主要杀手,又具有很强的遗传因素,因此,以肿瘤治疗为近期目标的精准医疗或将成为推动未来医疗领域的动力。
2 肿瘤基因检测的临床应用价值
“癌症是最常见的基因疾病,所有癌症的发生,都源自脱氧核糖核酸(DNA)序列的异常。”英国剑桥大学桑格研究所掌门人 Michael Stratton教授指出,尽管不同癌症有不同的诱因和症状,但都可以通过基因突变得到解释。不管是美国主导的人类基因组计划(HGP)、肿瘤基因组计划(TCGA),还是英国的 10 万人基因组计划,以及 MD 安德森癌症中心的“Moon Shots”计划,都承载一个共同的梦想——攻克癌症,并且坚信一个理念——只要坚持,梦想总是能够实现的。
TCGA 计划是 2006 年美国国立癌症研究所和国立人类基因组研究所主导的一个大型肿瘤基因测序试点项目,研究对象覆盖 25 种以上的主要癌种,发表论文数十篇[7-8]。作为肿瘤基因组研究的倡导者和领路人,一直以来,TCGA 的研究成果对人类认识肿瘤的意义是不可估量的,其中之一是改变了人类对肿瘤的认识:肿瘤是一种基于基因突变定义的疾病而非发病部位。如此一来,如果一种肿瘤没有有效的药物,或许可以受益于其他具有相同基因突变的治疗方案。
Moon Shot 是美国 MD 安德森癌症中心在2013 宣布实施的堪比把人类送上月球的目标——抗癌“登月”计划。计划在未来十年内,形成一个跨多领域研究人员组成的大型团队,包括肿瘤学家、临床医师、大数据专家、纳米技术专家、NASA图像专家、药物转化工作者等,专注于急性髓性白血病、骨髓增生异常综合征、慢性淋巴细胞白血病、黑色素瘤、肺癌、前列腺癌、三阴性乳腺癌和卵巢癌,以做到早期预测、有效治疗、显著提高生存率。计划将涉及基础研究和应用转化,通过密切合作努力把各领域的科研成果应用于临床实践[9]。
不仅如此,在攻克癌症的道路上,国际社会进行了广泛的合作。2008 年成立的国际癌症基因组联盟(ICGC)旨在通过国际合作对 50 种不同类型的肿瘤分别采集 500 份样品进行基因组测序研究,包括之前就已开展的英国桑格研究所主导的肿瘤基因组项目和上述 TCGA 项目[10]。在这个协作联盟的推动下,肿瘤基因研究将为肿瘤的早期预测提供基础。表 1 总结了已经发表的肿瘤及其热点基因/驱动性突变基因突变频率。
可以看出在生物医学领域,近年来肿瘤基因组学研究取得了很多的突破和进展,但是基于相关的研究、技术、产业的生态并不成熟。况且直接关系到人类健康的医疗对新技术的接受需要十分的谨慎。可喜的是,2013 年 11 月,美国食品和药物管理局(FDA)批准的第一个高通量测序仪Illumina’s MiSeqDx 用于临床[11]。这标志着高通量测序的临床价值得到了认可,高通量产生的海量基因数据及其信息挖掘将为临床医生提供无限可能的医学意义。有了这些数据为研究转型开启了大门,为精准诊断、临床护理、患者参与决策提供了科学的依据。
肿瘤的基因检测目前在临床上第二个主要的价值是对症下药[12]。在临床上这样的现象并不少见:同一种药物对不同的患者疗效差别很大;不同的疾病有时可以使用同一种药物,却都可以得到很好的疗效。因此对待不同基因背景的人,推荐具有针对性的药物显得十分必要。以前根据癌症的形态学特点将癌症分类,现在随着基因检测技术的发展,对癌症的认识可以深入到分子层面,可与传统诊断相互补充。以二代基因测序技术为基础,根据癌症基因检测结果,让“个体化用药”走进临床,让医生能够根据患者的遗传信息进行有针对性的癌症治疗。自 1997 年首个以 CD20 为靶点的癌症靶向药美罗华(rituximab)获得 FDA 批准用于治疗非霍奇金淋巴瘤,癌症靶向药物陆陆续续在美国批准上市,目前,FDA 批准的超过 167 种药物在使用前需要了解使用者的基因信息[13]。
贺林院士在主题报告中曾指出“茫茫人海,序列差异”使得国内外用药不良反应的人群难以计数;用药模式更新亟需从经验性用药向个性化用药转变。在实践中,这样的例子比比皆是,一位大肠癌患者,医生用药首先是爱必妥,后来用安维汀,效果均不佳,后经基因检测发现 BRAF 基因突变,而这两个单抗药物的靶点基因分别是 EGFR 和VEGFR。再比如常用的治疗肺腺癌的治疗药物吉非替尼是针对 EGFR 基因突变的分子靶向药,根据COSMIC 的统计,EGFR 确实是肺癌患者中除TP53 之外突变频率最高的基因,所以多数肺癌患者可受益于吉非替尼,但是对于没有 EGFR 基因突变的患者效果则是很低的。由此可见,为了更有针对性的治疗和把握最佳治疗窗口期,肿瘤患者在治疗之前做基因检测是多么重要!
对肿瘤基因检测淋漓尽致的应用则是个人定制化的肿瘤免疫治疗[14-15]。这是精确到个人的特异性治疗,针对肿瘤细胞才有而健康细胞没有的免疫原性突变。要找到这个个人定制的“灵丹妙药”,首先要对肿瘤细胞和健康细胞的基因进行测序,鉴定出它们之间的差异。差异是突变带来的,具有独一无二的特点,它可能有几十个甚至上千个突变。然后从中找到能够被 MHC 蛋白展示的制备新抗原,在实验室进行合成。最后刺激并富集针对新抗原的精准 T 细胞,回输肿瘤患者进行精准免疫治疗。在国内,第二军医大学钱其军教授领导的上海细胞治疗工程技术研究中心等单位正致力于肿瘤精准细胞免疫治疗的研发、临床试验与应用。
基因检测可以应用于通过寻找驱动性突变基因预测肿瘤发生的可能性,应用于临床上的用药指导,应用于个性化的免疫治疗,在其他领域的应用价值也是毋庸置疑的。美国国立卫生研究院网站总结了开展基因检测的几大理由[16]:①筛查胎儿遗传病,如 21 三体综合症;②筛查是否携带可能遗传给后代的遗传病基因;③筛查成年人的遗传病致病基因,虽然可能还未出现症状;④复杂疾病的基因水平诊断;⑤定制个性化的治疗药物和剂量。不过对待基因检测也要客观的评价。基因检测只能从基因水平检测受检者的基因突变情况,然而限于人类对基因功能和肿瘤发病原因的认识还不全面,基因突变和肿瘤发生仅仅是一种相关性,而不能量化对应。就目前看来,肿瘤基因检测不尽如人意之处有如下三点:①基因检测的监管滞后和管理制度不健全,夸大的商业市场宣传时有存在,即使在欧美也是如此;②基因检测的结果需要专业解读,但目前不管是基础研究、积累的临床数据、还是专业基因学家都还不够;③很多基因检测结果,人类目前依然没有有效的手段进行干预,或许带来负面的心理影响。
在著名的孟德尔豌豆遗传实验中,一个等位基因就能够果断决定一个性状,然而在很多疾病中(单基因遗传病除外),特别是肿瘤,基因多半决定肿瘤的易感性,肿瘤发生还受到外界环境和个人习惯的影响。而这种肿瘤易感基因也不容易找到,只要看看 IDH1 这个基因,就可管窥致病基因的发现历程[10]。通过大量的测序,有时依然找不到致病基因,这是因为人类基因调控和疾病发生机制都极其复杂,需要长期不懈的努力。探索未知和克服困难是人类前进的动力,寻找肿瘤与基因,患者与药物疗效关系的道路虽然不是一帆风顺,但是在人类的不断努力下,这种关系一定会渐渐明晰,基因检测也将会体现更大的价值。
3 基因检测的技术与项目
目前,不管是基于肿瘤基因组的基础研究,还是基因检测转化研究都在为精准医疗和个性化医疗摇旗擂鼓。国内国外大大小小的肿瘤基因组计划如火如荼地开展。不可否认基因检测技术促进了这些研究计划的实施进度,反过来计划实施在推动基因检测技术发展方面亦是功不可没。现在基因检测技术趋于成熟,不但为疾病的临床诊断,治疗方案的准确制定提供了保障,还能用于致病基因携带者的检测与产前诊断。
第一代测序技术出现于 1977 年前后[17],使得人们能够从基因序列水平清晰认识疾病的发病原因。Sotos 综合征(MIM117550)的大多病例散发,也没有完好的家系用于连锁绘图,通过 FISH 鉴定了跨越染色体易位断裂点的 BAC 克隆,通过一代测序对断裂点周围进行测序,从而锁定 NSD1 基因。人类基因组计划采用的也是一代测序技术,历时 13 年耗资近 30 亿美元,进行大量的测序显然是不切实际的。基因测序技术需要不断改进,2005年底,454 生命科学公司和罗氏诊断公司联合推出了基于焦磷酸测序法的超高通量基因组测序系统——GS20,被 Nature 杂志以里程碑事件报道[18],从此拉开了第二代测序技术的激烈竞争。相比于一代测序,二代测序成本下降却通量上升,测序时间变短测序深度却提高。截至到 2015 年年底,二代测序的市场基本被 Thermo Fisher 公司和 Illumina公司占领,Pacific Biosciences 公司因其开发单分子实时测序技术也要分一杯羹。三种高通量测序技术比较见表 2。
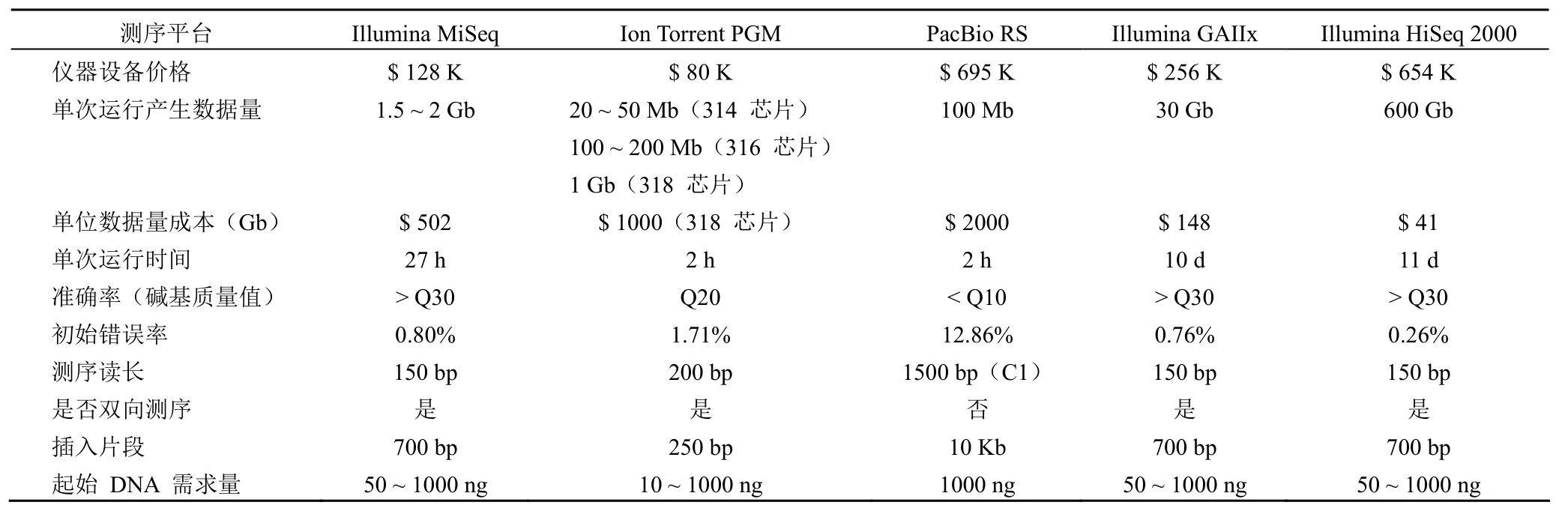
表2 Ion torrent、Illumina 和 Pacific Biosciences 测序技术比较[19]
二代测序技术通过广泛的基因测序,解码肿瘤的基因突变信息,为预测癌症的发病风险,帮助医生确定癌症不同亚型以及开展针对性治疗提供了科学的依据。然而基因检测在迈向精准医学这个最终目标的道路上,面临巨大的挑战:第一,肿瘤在治疗一段时间后会发生抗药性突变,如何做到耐药性突变的实时监测;第二,肿瘤高通量测序产生大量数据,比如对肺癌组织进行全基因组测序之后发现了 22 910 处点突变[20],如何找出有价值的突变,如何鉴别肿瘤发生的驱动突变;第三,如何收集更多的样本病例,并在此基础上做好“基因-肿瘤-药物”的基础性研究工作,以便更好地指导临床。解决这些问题,还需要肿瘤基因组学、临床医学和生物信息学的紧密合作、研究与创新。
此外,二代测序在临床上的应用还需要面临一些特殊的问题:第一,癌症有异质性,对于已经发生转移的癌症患者而言,仅仅取某个部位的癌组织,并不能反映患者整体的情况,但是,对所有的癌组织都取样又不好操作;第二,有些肿瘤在受到手术的扰动之后,有加速转移的风险;第三,有些患者自身的情况决定了其不适合组织活检,即使所有的条件都适宜,组织活检的滞后性对患者的治疗也是不利的。直到 2012 年肿瘤液体活检的出现[21],为二代测序在临床应用带来了新的曙光。这也是 MIT Technology Review 杂志将体液活检评选为“2015 十大突破”的原因,液体活检也因此受到媒体和行业的广泛关注。捕获肿瘤脱落进入血液的肿瘤细胞或 DNA,液态活检第一次非介入性地,可重复性地抽取肿瘤样本,医生们从而可以建立肿瘤基因突变谱、耐药突变谱,准确开展靶向治疗,快速判断治疗效果,及时监测肿瘤的发展而调节治疗方案。
在二代测序技术的带动下,基因检测市场方兴未艾,目前我国基因检测产业处于研究发展初级阶段,但因为无创产前筛查等项目的广泛开展使得人们对基因检测并不陌生。根据华大基因招股说明书推算,近三年来我国共有 20 万孕妇接受产前基因检测,市场规模超过 10 亿元。另外,根据全国肿瘤登记中心记录的每年新增病例为 350 万,假使每位肿瘤患者基因检测的费用为 5000 元,则肿瘤基因检测市场规模可达 175 亿元。在庞大的市场需求驱动下,基因检测飞速发展,目前提供面向临床应用基因检测的公司如雨后春笋般涌现(表 3)。

表3 国内外开展液体活检的项目及对应机构
4 基因检测的政策法规
一方面基因检测作为一种新技术,为人类的健康预防与疾病治疗带来革命性的变化,另一方面基因检测技术还需发展,服务亟待规范,而政府监管却处于初期探索阶段。为此,2014 年 2 月 9 日国家食品药品监督管理总局办公厅和国家卫生和计划生育委员会办公厅联合发布《关于加强临床使用基因测序相关产品和技术管理的通知》,通知指出:包括产前基因检测在内的基因测序相关产品和技术属于当代前沿产品和技术研究范畴,涉及伦理、隐私和人类遗传资源保护、生物安全以及医疗机构开展基因诊断服务技术管理、价格、质量监管等问题。目前,基因测序相关产品和技术已由实验室研究演变到临床使用,对此,国务院有关部门高度重视。通知同时强调说:国家卫生计生委确定的基因测序临床应用试点单位,可以按照医疗技术临床应用管理的相关规定试用基因测序产品。2014 年 3 月即允许基因检测临床试点申报。2014 年12 月起,一些单位陆续获得遗传病诊断、产前筛查与诊断、肿瘤诊断与治疗的高通量基因测序技术临床试点单位资质。截至 2015 年,超过 100 家医疗机构和检测机构列入试点单位,这被业界解读为基因检测临床应用被叫停一年后的再回归。
美国的基因检测区分为直接面向客户的基因检测和供医生临床使用的基因检测,前者的监管和中国大体类似。在美国,2013 年 11 月 22 日,FDA 勒令 23andMe 公司停止销售基因检测服务,因为这些产品的临床和分析有效性均未获得 FDA的认可。然而 2015 年 2 月,23andMe 向 FDA 申请的一个检测罕见遗传疾病布鲁姆综合征的 BLM基因检测得到了批准[26]。FDA 表示,批准这个基因检测是因为该检测结果是准确可靠的,且检测样本是唾液,这对于普通大众而言是安全便捷的。同时,美国制定了基因信息不歧视条约,比如雇佣者和保险公司不得根据个人基因信息做出提高保费、工作升迁等决定。
供医生临床使用的基因检测早已常规化开展,对于靶向药物来说,基因检测是开展治疗的先决条件。2012 年,FDA 批准了给一些肿瘤患者使用某些药物(如爱必妥)前需进行 EGFR、KRAS等基因检测[27-28]。此外美国国立综合癌症网络(NCCN)肿瘤学临床实践指南反映了人们对目前认可的治疗方法的普遍观点。已经将 EGFR 突变、KRAS/NRAS 突变、ALK 重排、HER2 突变、RET重排、BRAF 突变、BRCA1/2 突变、ERCC1 表达、RRM1 表达等基因检测纳入到肺癌、胃癌、结直肠癌、卵巢癌等各大癌症治疗指南中,以确认每个肿瘤独特的驱动靶点,给予患者基于基因测序结果的个体化治疗。不过上述癌症基因检测主要技术通量不是高通量测序而是 PCR 技术。对于检测实验室,美国联邦标准临床实验室改进法案(CLIA-88)对所有开展检测人体标本的临床检测项目(包括基因检测)进行认证[29],NCCN 推荐基因检测只应在CLIA-88 授权实验室进行。另据不可靠消息,全球提供基因检测的机构有 1762 家(其中绝大部分在美国),可以应用基因检测技术进行检测的疾病数有 1502 种,其中 1214 种已经或正在应用于实际检测,288 种在实验室阶段。在美国,每年进行此类检测的就有 700 多万人次,使得美国女性乳腺癌发病率降低了 70%,直肠癌发病率降低了 90%。
5 基因检测的未来趋势
想预测肿瘤的发生似乎没有想象的那么简单,但是基因测序确实给我们指明了一条道路。美国加州大学劳伦斯伯克利国家实验室的肿瘤研究人员Joe Gray 认为肿瘤的基因检测是非常有用的,但这仅仅只是一个开始。他说:“起初,我认为对几百个肿瘤组织样品进行测序就足以解决问题,但是当我们检测了 1000 多个样品之后我才发现我们还没找到想要的东西”,他要找到的就是肿瘤发生的驱动性突变,而这种驱动性突变的发现有赖于超大样本量的统计。
尽管如此,基因检测越发成为肿瘤科医生进行病例诊断和治疗的必要参考,这有助于治疗方案的准确制定,也有助于未来通过专业大数据平台对包括基因信息的健康档案进行解读。然而目前基因检测的费用虽然在不断降低,但是基于人力成本、仪器试剂成本持续上升,对于很多人来说检测价格仍然不低。在激烈的市场竞争面前,企业的利润无法保证,检测质量令人担忧。未来将基因检测部分纳入医保系统是一个可供选择的方向,而这部分的支出可以从通过精准医疗节省的无效医疗费用中替补回去。
基因测序数据的解读是目前基因检测行业的瓶颈,将队列研究引入到肿瘤的基因预测将是一项有意义的健康工程。肿瘤一般历时多年才形成。在此期间基因信息的变化以及其他促进因素共同作用,最终导致肿瘤发生。鉴于肿瘤发生驱动基因的复杂性,对未发病人群进行样本库大规模测序——肿瘤大型阵列跟踪研究也许是一种缘“因”求“果”的研究方法。这一研究也将在未来对个体基因信息的解读和随访监测具有直接的价值,此外大规模基因测序对其他疾病以及儿童天赋成长指导也有潜在的价值。
沿着“基因-肿瘤-药物”这个思路,基于中国肿瘤患者的基因数据库和分析平台将形成一种独特的资源,促进我国的肿瘤靶向药物研发取得突破性的成就,特别是针对中国较多发癌种如肺癌、胃癌、肝癌的靶向药物。总的来说,不久的将来以基因检测为主要基石的精准医疗将从早期预测、个性化诊疗、药物研发、免疫治疗等方面使更多的人受益。
参考文献
[1] National Human Genome Research Institute. Regulation of genetic tests. (2015-04-17) [2016-02-23]. http://www.genome.gov/10002335.
[2] Tung JY, Do CB, Hinds DA, et al. Efficient replication of over 180 genetic associations with self-reported medical data. PLoS One, 2011, 6(8):e23473.
[3] Palotie A, Widén E, Ripatti S. From genetic discovery to future personalized health research. N Biotechnol, 2013, 30(3):291-295.
[4] Collins FS, Varmus H. A new initiative on precision medicine. N Engl J Med, 2015, 372(9):793-795.
[5] Ashley EA. The precision medicine initiative: a new national effort. JAMA, 2015, 313(21):2119-2120.
[6] Cyranoski D. China embraces precision medicine on a massive scale. Nature, 2016, 529(7584):9-10.
[7] Kandoth C, McLellan MD, Vandin F, et al. Mutational landscape and significance across 12 major cancer types. Nature, 2013, 502(7471): 333-339.
[8] Lawrence MS, Stojanov P, Mermel CH, et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature, 2014, 505(7484):495-501.
[9] Printz C. MD Anderson program shoots for the moon: "Moon Shots" aims to quickly convert scientific advances into effective treatments. Cancer, 2012, 118(24):6015-6016.
[10] Ledford H. Big science: the cancer genome challenge. Nature, 2010, 464(7291):972-974.
[11] Collins FS, Hamburg MA. First FDA authorization for next-generation sequencer. N Engl J Med, 2013, 369(25):2369-2371.
[12] de Bono JS, Ashworth A. Translating cancer research into targeted therapeutics. Nature, 2010, 467(7315):543-549.
[13] U.S. Food and Drug Administration. Table of pharmacogenomic biomarkers in drug labeling. (2015-05-20) [2016-02-23]. http://www. fda.gov/drugs/scienceresearch/researchareas/pharmacogenetics/ucm08 3378.htm.
[14] Tran E, Turcotte S, Gros A, et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science, 2014, 344(6184):641-645.
[15] Kreiter S, Vormehr M, van de Roemer N, et al. Mutant MHC class II epitopes drive therapeutic immune responses to cancer. Nature, 2015, 520(7549):692-696.
[16] MedlinePlus. Genetic testing. [2016-02-23]. https://www.nlm.nih.gov/ medlineplus/genetictesting.html.
[17] Sanger F, Nicklen S, Coulson AR. DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci U S A, 1977, 74(12): 5463-5467.
[18] Margulies M, Egholm M, Altman WE, et al. Genome sequencing in microfabricated high-density picolitre reactors. Nature, 2005, 437(7057):376-380.
[19] Quail MA, Smith M, Coupland P, et al. A tale of three next generation sequencing platforms: comparison of Ion Torrent, Pacific Biosciences and Illumina MiSeq sequencers. BMC Genomics, 2012, 13:341.
[20] Pleasance ED, Stephens PJ, O'Meara S, et al. A small-cell lung cancer genome with complex signatures of tobacco exposure. Nature, 2010, 463(7278):184-190.
[21] Yong E. Cancer biomarkers: written in blood. Nature, 2014, 511(7511): 524-526.
[22] Cheung SW, Patel A, Leung TY. Accurate description of DNA-based noninvasive prenatal screening. N Engl J Med, 2015, 372(17):1675-1677.
[23] Hansen TB, Jensen TI, Clausen BH, et al. Natural RNA circles function as efficient microRNA sponges. Nature, 2013, 495(7441): 384-388.
[24] Memczak S, Jens M, Elefsinioti A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency. Nature, 2013, 495(7441):333-338.
[25] Melo SA, Luecke LB, Kahlert C, et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature, 2015, 523(7559): 177-182.
[26] 23andme obtains permission to market Bloom syndrome test. Am J Med Genet A, 2015, 167(6):viii-ix.
[27] Angulo B, Lopez-Rios F, Gonzalez D. A new generation of companion diagnostics: cobas BRAF, KRAS and EGFR mutation detection tests. Expert Rev Mol Diagn, 2014, 14(5):517-524.
[28] U.S. Food and Drug Administration. therascreen® KRAS RGQ PCR Kit - P110030. (2015-05-11) [2016-02-23]. http://www.fda.gov/Medical Devices/ProductsandMedicalProcedures/DeviceApprovalsandClearan ces/Recently-ApprovedDevices/ucm312055.htm.
[29] Schwartz MK. Genetic testing and the clinical laboratory improvement amendments of 1988: present and future. Clin Chem, 1999, 45(5):739-745.
文献编号表1常见肿瘤及其热点基因突变频率注:#Pubmed数据库中的;*欧美人群 11.4%,东亚人群 38.7%;(★)中国较其他地区高发癌种。急性髓性白血病AML膀胱尿路上皮癌BLCA乳腺癌BRCA慢性淋巴细胞白血病CLL结直肠癌COAD/READ/CRC弥漫大 B 细胞淋巴瘤DLBCL基因名称 突变频率 基因名称 突变频率 基因名称突变频率基因名称突变频率基因名称 突变频率 基因名称突变频率NPM1 27.00% TP53 50.00% PIK3CA 33.60% SF3B1 13.20% APC 81.90% CREBBP 24.10% FLT3 26.50% ARID1A 27.60% TP53 32.90% TP53 10.70% TP53 58.60% TP53 22.40% DNMT3A 25.50% KDM6A 26.50% GATA3 10.60% MYD88 7.50% KRAS 45.10% MLL2 20.70% IDH2 10.00% MLL2 25.50% MAP3K1 7.20% ATM 3.80% PIK3CA 17.60% CARD11 19.00% IDH1 9.50% MLL3 24.50% CDH1 7.00% XPO1 2.50% FBXW7 11.40% GNA13 15.50% RUNX1 9.00% PIK3CA 17.40% MLL3 6.40% HIST1H1E 2.50% SMAD4 9.80% TNFRSF14 13.80% TET2 8.50% EP300 17.40% MAP2K4 4.10% RPS15 2.50% NRAS 8.80% MYD88 12.10% TP53 7.50% MALAT1 15.30% NCOR1 3.90% SPEN 2.50% ATM 5.70% CD79B 12.10% NRAS 7.50% RB1 14.30% PTEN 3.80% MED12 2.50% ARID1A 5.70% B2M 10.30% CEBPA 6.50% CDKN1A 12.20% RUNX1 3.30% RPS2 1.30% SMAD2 5.70% EZH2 10.30% PMID#24132290 PMID 24132290 PMID 24132290 PMID 24390350 PMID 24132290 PMID 24390350食管鳞癌 ESCC 食管腺癌 ESO 胃癌 GA 胶质母细胞瘤 GBM肝癌 HCC(★)头颈鳞癌 HNSC基因名称 突变频率 基因名称 突变频率 基因名称突变频率基因名称突变频率基因名称 突变频率 基因名称突变频率TP53 93.00% TP53 65.20% TP53 50.00% PTEN 30.70% TP53 32.10% TP53 69.80% CCND1 33.00% FLG 18.40% ARID1A 14.00% TP53 28.30% CTNNB1 31.00% CDKN2A 21.30% CDKN2A 20.00% SACS 10.60% PIK3CA 12.00% EGFR 26.60% ARID2 10.80% PIK3CA 20.60% MLL2 19.00% COL5A1 9.20% CDH1 11.00% PIK3R1 11.40% ARID1A 8.80% NOTCH1 19.30% NFE2L2 10.00% SMAD4 7.10% SMAD4 8.00% PIK3CA 11.00% AXIN1 7.10% MLL2 17.90% EP300 10.00% CDKN2A 6.40% APC 7.00% NF1 11.00% ARID1B 6.70% NSD1 10.60% RB1 9.00% SMARCA4 6.40% RHOA 6.00% RB1 8.30% CDKN2A 5.30% EP300 8.00% KDM6A 7.00% ARID1A 4.30% KRAS 6.00% ATRX 5.50% ABL MLL3 7.30% MLL3 6.00% PIK3R1 4.30% MUC6 6.00% IDH1 5.20% PIK3CA NAV3 7.30% CREBBP 6.00% PIK3CA 3.50% MACF1 5.00% STAG2 4.10% TERT MALAT1 6.30% PMID 25151357 PMID 24390350 PMID 25079317 PMID 24132290 PMID 25362482 PMID 25631445肝内胆管癌 ICC 肾透明细胞癌 KIRC 肺腺癌 LUAD 肺鳞癌 LUSC 黑色素瘤(皮肤癌)MEL 多发性骨髓瘤 MM基因名称 突变频率 基因名称 突变频率 基因名称突变频率基因名称突变频率基因名称 突变频率 基因名称突变频率TP53 54% VHL 52.30% TP53 51.80% TP53 79.30% BRAF 52.27% KRAS 21.70% IDH1 36% PBRM1 32.90% KRAS 26.30% MLL2 20.10% NRAS 26.59% NRAS 17.90% KRAS 25% SETD2 11.50% NAV3 21.50% NAV3 19.00% NF1 16.62% DIS3 9.20% ARID1A 24% BAP1 10.10% MLL3 18.40% MLL3 15.50% TP53 16.01% FAM46C 7.20% MCL1 21% KDM5C 6.50% KEAP1 17.10% CDKN2A 14.90% ARID2 16.01% TP53 7.20% NRAS 8% MTOR 6.00% TSHZ3 14.90% PIK3CA 14.90% ITGA4 13.60% BRAF 6.30% PTEN 4.30% SETBP1 12.70% NFE2L2 14.90% CDKN2A 12.39% TRAF3 3.40% MLL3 3.60% NF1 11.80% KEAP1 12.10% MSR1 12.08% PRDM1 2.90% MLL2 3.10% EGFR 38.70%*LRRK2 11.50% FAM113B 9.06% FGFR3 2.40% PIK3CA 2.90% TLR4 11.40% NF1 10.30% RPS27 8.46% IRF4 1.90% PMID 25526346 PMID 24132290 PMID 25079552 PMID 22960745 PMID 26091043 PMID 24390350鼻咽癌 NPC(★)卵巢浆液性癌 OV 胰腺导管癌 PDAC 前列腺癌 PRAD 乳头状甲状腺癌 PTC 子宫内膜癌 UCEC基因名称 突变频率 基因名称 突变频率 基因名称突变频率基因名称突变频率基因名称 突变频率 基因名称突变频率TNFRSF19 TP53 94.60% KRAS 79.00% AR BRAF 59.70% PTEN 63.50% MDS1- NF1 3.80% TP53 44.00% ERG NRAS 8.50% PIK3CA 52.20% EVI1 BRCA1 3.50% SMAD4 28.00% ETV1 RET 6.30% PIK3R1 30.90% CDKN2A BRCA2 3.20% CDKN2A TMPRSS2 HRAS 3.50% ARID1A 30.00% CDKN2B LRRK2 2.90% MLL3 CHD1 TG 2.70% CTNNB1 28.30% ARID1A CDK12 2.90% TGFBR2 MAP3K7 MLL3 1.70% TP53 27.80% MLL2 APC 2.20% ARID1A PTEN ZFHX3 1.70% KRAS 20.00% MLL3 MLL3 1.90% SF3B1 TP53 EIF1AX 1.50% CTCF 16.50% BAP1 RB1 1.90% ATM CDKN1B PPM1D 1.20% FBXW7 11.70% TET2 MTOR 1.90% EPC1 SPOP ATM 1.20% RPL22 10.90% PMID 24952746 PMID 21720365 PMID 23103869 PMID 23622249 PMID 25417114 PMID 23636398
收稿日期:2016-02-29
通信作者:徐增辉,Email:zenghuixu@163.com
DOI:10.3969/j.issn.1673-713X.2016.02.002
