结肠癌组织Wnt/PCP信号通路相关因子表达及其意义
孟道林, 何跃君, 徐 海, 陈卫花, 王 建
临床与基础研究
结肠癌组织Wnt/PCP信号通路相关因子表达及其意义
孟道林, 何跃君, 徐 海, 陈卫花, 王 建
目的 探讨Wnt/PCP信号途径中Wnt7a、JNK和RhoA在结肠肿瘤组织中的表达和意义。方法 选取徐州医学院第二附属医院2012年3月至2015年3月经病理学确诊并行根治性手术的结肠癌石蜡标本共62例,同时分别选取癌旁正常组织(距肿瘤边缘>5cm)和良性结肠腺瘤62例作为对照组。采用免疫组化方法检测Wnt/PCP信号途径中Wnt7a、JNK和RhoA在结肠癌组织、结肠腺瘤和正常结肠组织中的表达情况,分析其与结肠癌临床病理参数的关系。结果 Wnt7a、JNK和RhoA在结肠癌组织中均高表达,明显高于癌旁正常组织和腺瘤组(P<0.05),三者在结肠癌临床分期Ⅲ+Ⅳ期中的表达明显高于Ⅰ+Ⅱ期(P<0.05),有淋巴结转移组的表达明显高于无淋巴结转移组(P<0.05)。结论 Wnt/PCP信号途径中Wnt7a、JNK和RhoA蛋白在结肠癌组织中高表达,可能与结肠癌的发生发展有关系,并有可能成为肿瘤靶向治疗的潜在靶点。
结肠癌; Wnt/PCP; 信号传导; 免疫组织化学; 治疗靶点
结肠癌在我国分别占女性和男性恶性肿瘤的第3位和第4位,尽管在早期诊断和治疗方面取得了一些进展,但发病率和死亡率却在逐年上升,因此,进一步明确结肠癌的发生发展机制并寻找有效的防治措施仍是我们需要解决的难题。Wnt信号途径调节控制着许多生命过程,参与细胞的癌变、增殖、分化、凋亡等[1-6]。大量数据证实肿瘤的发生与典型Wnt途径产生的稳定的β-链蛋白(β-catenin)有关,与此同时越来越多的证据表明其他途径如Ca2+通道、G蛋白等也在肿瘤发生中发挥作用[7]。其中,Wnt/PCP(plnercellpolarity)途径主要通过激活Dvl下游区、Rac、小GTP酶、RhoA和Cde42等,从而激活c-jun氮端激酶(c-Jun N-terminal kinase,JNK)来发挥作用,该途径是否与肿瘤的发生和发展有关需要进一步的研究。我们前期研究[8]发现,Wnt/PCP信号途径中重要因子Wnt7a、JNK和RhoA在大鼠结肠肿瘤组织中高表达,提示其可能参与大鼠结肠癌的发生、发展。本研究进一步以人结肠癌组织为实验对象,采用免疫组织化学方法检测其中Wnt7a、JNK、RhoA蛋白的表达情况,观察人结肠癌的形成过程中是否也有Wnt/PCP信号通路的参与。
1 材料与方法
1.1 标本来源 选取徐州医学院第二附属医院2012年3月至2015年3月经病理学确诊并行根治性手术的结肠癌石蜡标本共62例,男37例,女25例;年龄32~84岁,中位年龄68岁;高分化腺癌14例,中分化腺癌20例,低分化腺癌28例;有淋巴结转移36例,无淋巴结转移26例;根据TNM分期的临床病理分期Ⅰ+Ⅱ期24例,Ⅲ+Ⅳ期38例。所有病例术前均未行放、化疗。另分别选取癌旁正常组织(距肿瘤边缘>5 cm)和良性结肠腺瘤62例作为对照组。
1.2 主要试剂 兔抗人Wnt7a、RhoA单克隆抗体和JNK多克隆抗体均购自北京博奥森生物技术有限公司,免疫组化SP试剂盒(北京中杉金桥),DAB显色试剂盒(福州迈新)。
1.3 免疫组化 取结肠癌组织蜡块4 μm连续切片,常规脱蜡、抗原修复后,采用SP法免疫组化染色,DAB显色,苏木精复染后脱水、透明、封片。PBS缓冲液代替一抗作为阴性对照。
1.4 结果判定标准 Wnt7a、JNK和RhoA表达于细胞的胞质和(或)胞核,阳性细胞内可见清晰黄色颗粒。根据显色程度判断阳性程度,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。观察阳性细胞数在视野下细胞中所占的百分率,阳性细胞个数<25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。将阳性细胞百分比和着色强度两者的计分相加,0~1分为阴性(-),≥2为阳性(+)。
1.5 统计学方法 采用SPSS16.0软件进行统计学处理,阳性率以百分比表示,两样本间采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 Wnt7a、JNK和RhoA的表达 Wnt7a、JNK和RhoA阳性反应主要定位于细胞浆和(或)细胞核,胞浆可见黄色或棕黄色颗粒。Wnt7a在正常结肠组织和结肠腺瘤中的阳性表达率分别为24.2%(15/62)和35.5%(22/62),在结肠癌组织的阳性表达率为74.2%(46/62),癌变组阳性表达率高于腺瘤组(P=0.000)和正常组(P=0.000),腺瘤组与正常组阳性表达率相比差异无统计学意义(P=0.239)。JNK在正常结肠组织和结肠腺瘤中的阳性表达率分别为25.8%(16/62)和38.7%(24/62),在结肠癌组织的阳性表达率为74.2%(46/62),癌变组阳性表达率明显高于腺瘤组(P=0.000)和正常组(P=0.000),腺瘤组与正常组阳性表达率差异无统计学意义(P=0.178)。RhoA在正常结肠组织和结肠腺瘤中的阳性表达率分别为29.0%(18/62)和40.3%(25/62),在结肠癌组织的阳性表达率为80.6%(50/62),癌变组阳性表达率明显高于腺瘤组(P=0.000)和正常组(P=0.000),腺瘤组与正常组阳性表达率差异无统计学意义(P=0.257)。
2.2 与临床病理因素的关系 结肠癌组织中Wnt7a的阳性表达与患者的性别、年龄、病理分化程度无关(P>0.05),与是否有淋巴结转移及肿瘤的临床分期相关(P<0.05)。JNK的阳性表达与性别、年龄、病理分化程度无关(P>0.05),与是否有淋巴结转移及肿瘤的临床分期相关 (P<0.05)。RhoA的阳性表达与性别、年龄、病理分化程度无关(P>0.05),与是否有淋巴结转移及肿瘤的临床分期相关 (P<0.05)。见表1。
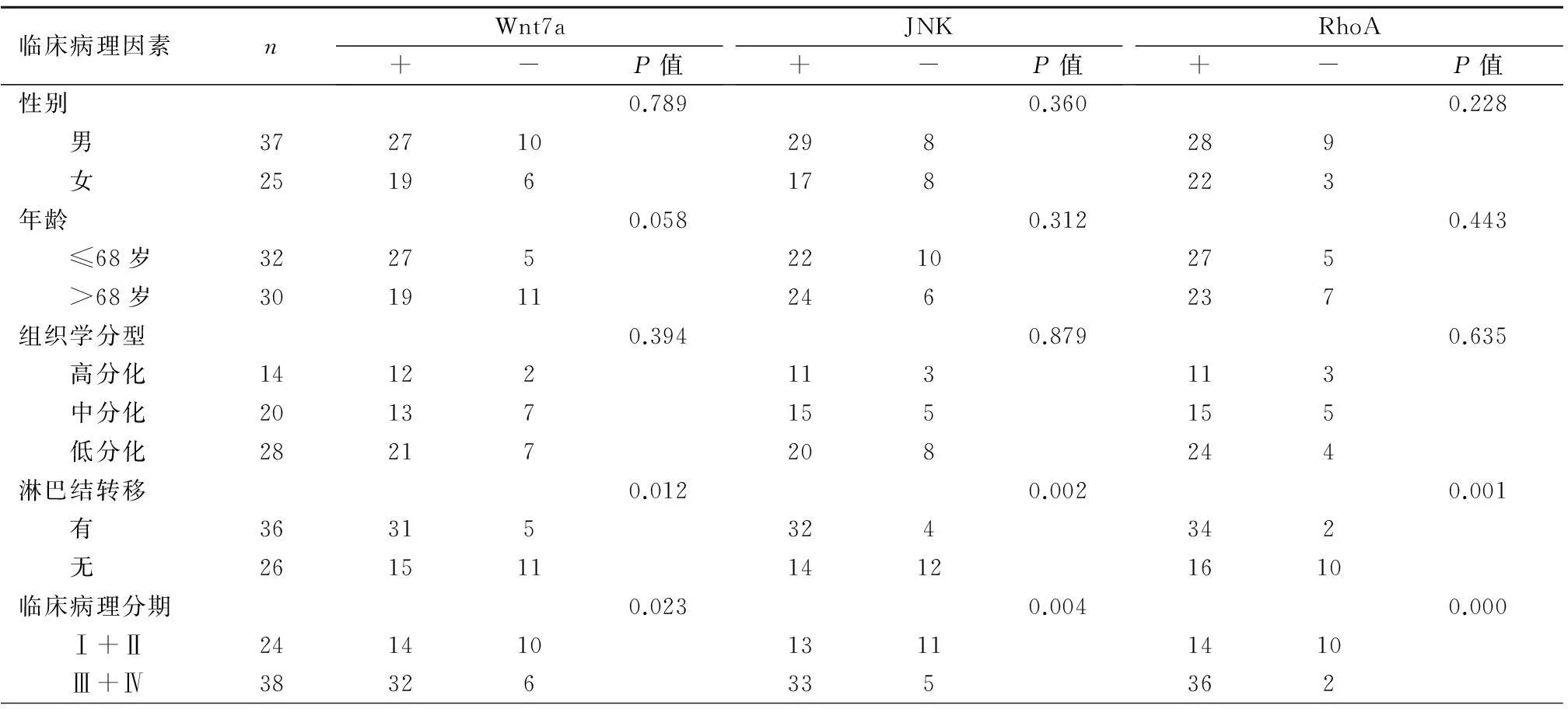
表1 Wnt7a、JNK和RhoA蛋白表达和结肠癌临床病理参数的关系
3 讨论
随着科学技术的发展和治疗模式的改变,有学者提出肿瘤分子病理分期的概念[9],即运用分子生物学知识对肿瘤从分子水平重新认识,这将使肿瘤的治疗更贴近肿瘤的生物学发展原理,改变肿瘤以往的治疗策略,提高患者的生存率及改善预后。最近,肿瘤的靶向治疗正在兴起,以其高选择性、低毒性的优势正成为肿瘤治疗研究的热点。
Wnt通路是一条对控制发育起重要作用的信号途径,在进化上具有高度保守性,从低等生物果蝇到高等哺乳动物,其成员都具有高度的同源性,Wnt信号的某些异常活化与多种组织细胞癌变、肿瘤发生发展以及肿瘤侵袭过程有密切联系[10-14]。根据Wnt信号蛋白传递方式不同,Wnt信号通路分为3条途径:(1)经典Wnt信号途径,即Wnt/β-catenin信号途径。此通路是目前研究最明确的通路,其在胚胎发育和肿瘤中的作用已基本阐明,因此被公认为新的抗癌治疗分子靶点[11-14]。(2)Wnt/Ca2+途径。此通路主要由Wnt5a或Wnt11激活,调节细胞运动和黏着性,同时能拮抗经典Wnt信号通路,发挥抑癌作用[15-16]。(3)平面细胞极性(PCP)途径,即Wnt/PCP途径。在脊椎动物中又称Wnt/JNK途径,主要通过激活Dvl下游区、Rac、小GTP酶、RhoA和Cde42等,从而激活JNK来发挥作用,在胚胎发育阶段调控细胞骨架的重排,并参与原肠胚形成[17-18]。
JNK是一种丝氨酸/苏氨酸蛋白激酶,JNK基因包括:JNK1,JNK2和JNK3。JNK1和JNK2在哺乳动物全身组织中表达广泛,而JNK3只表达于心、脑和睾丸[19]。JNK基因编码产生相对分子质量为46×103和55×103的2种蛋白质[20]。JNK参与多种生理过程的调控,如细胞生长、细胞分化、细胞死亡和癌基因转化[19-20]。多种刺激信号,如细胞因子和炎性介质等,可介导JNK基因的磷酸化进入活化状态,活化的JNK激活下游Elk-1、c-Jun等信号分子,从而在细胞增殖和转化、细胞周期调节等过程中发挥重要作用[21]。研究表明,JNK与肿瘤的发生有关,在多种恶性肿瘤如甲状腺癌、食管癌、胃癌和乳腺癌中存在不同JNK基因的高表达或者突变[22-23]。同时有研究表明JNK会促进肿瘤的侵袭和转移。RYOKO等[24]通过RNA干扰降低JNK的表达和加入JNK抑制剂阻断JNK信号通路后发现,HeLa细胞的体外迁移和侵袭能力明显减低。JNK促进大肠癌侵袭和转移机制可能为JNK通过激活其下游成员使大肠癌MMP的分泌增加、细胞-细胞黏附力下降而导致大肠癌细胞的运动和侵袭力增加,最终促进癌细胞的转移[25]。
本研究通过免疫组化在蛋白水平上观察了结肠癌组织、结肠腺瘤组织和正常结肠组织中Wnt7a、JNK和RhoA的表达情况。我们发现在结肠癌组织中Wnt7a、JNK和RhoA的表达明显高于正常结肠组织和结肠腺瘤组(P<0.05),有淋巴结转移的标本明显高于无淋巴结转移的标本(P<0.05),临床病理分期Ⅲ+Ⅳ期的肿瘤组织也明显高于Ⅰ+Ⅱ期的肿瘤组织(P<0.05),但Wnt7a、JNK和RhoA的表达与患者的性别、年龄以及肿瘤的分化程度无关(P>0.05)。这与之前关于JNK的研究结果一致,并且发现Wnt7a和RhoA的表达情况与JNK一致。而我们前期研究发现,在大鼠结肠癌和结肠非典型增生组织中Wnt/PCP信号途径中的重要因子Wnt7a、JNK和RhoA无论从蛋白质水平还是mRNA水平都是高表达的[8]。因此我们推测在Wnt/PCP信号途径中,上述因子在结肠癌形成过程中起到非常重要的作用,并有可能成为肿瘤靶向治疗的潜在靶点。但其参与结肠癌发生发展的具体作用机制仍需进一步的探讨。
[1] ARTHUR S T, COOLEY I D. The effect of physiological stimuli on sarcopenia; impact of Notch and Wnt signaling on impaired aged skeletal muscle repair[J]. Int J Biol Sci, 2012, 8(5):731-760.
[2] NAITO A T, SUMIDA T, NOMURA S,et al. Complement C1q activates canonical Wnt signaling and promotes aging-related phenotypes[J].Cell,2012,149(6):1298-1313.
[3] BORAS-GRANIC K, HAMEL P A. Wnt-signalling in the embryonic mammary gland[J].J Mammary Gland Biol Neoplasia,2013,18(2):155-163.
[4] GERTOW K, HIRST C E, YU Q C, et al.Wnt3a promotes hematopoietic or mesenchymal differentiation from hESCs depending on the time of exposure[J].Stem Cell Reports,2013,1(1):53-65.
[5] KANDYBA E, LEUNG Y, CHEN Y B, et al. Competitive balance of intrabulge BMP/Wnt signaling reveals a robust gene network ruling stem cell homeostasis and cyclic activation[J].Proc Natl Acad Sci USA,2013,110(4):1351-1356.
[6] WHYTE J L, SMITH A A, HELMS J A. Wnt signaling and injury repair[J].Cold Spring Harb Perspect Biol,2012,4(8):1-13.
[7] 刘向东,万莹铧.Wnt信号传导与肿瘤[J].癌症进展,2009,7(3):296-300.
[8] 王建,赵振春,白明东,等.大鼠结肠肿瘤组织Wnt/PCP信号通路相关因子表达意义分析[J].中华肿瘤防治杂志,2014,21(13):995-998.
[9] HUELSKEN J, HELD W.Canonical Wnt signalling plays essential roles[J]. Eur J Immunol, 2009, 39(12):3582-3583.
[10] 江州华,俞继卫,吴生华,等.胃癌组织Wnt5a和MMP14表达及其临床意义的探讨[J].中华肿瘤防治杂志,2011,18(12):940-945.
[11] ESPADA J, CALVO M B, DIAZ-PRADO S, et al. Wnt signaling and cancer stem cells[J]. Clin Transl Oncol,2009,11(7):411-427.
[12] CLEVERS H, NUSSE R. Wnt/β-catenin signaling and disease[J].Cell,2012,149(6):1192-1205.
[13] VINCAN E, BARKER N. The upstream components of the Wnt signaling pathway in the dynamic EMT and MET associated with colorectal cancer proghression[J].Clin Exp Metastasis,2008,25(6):657-663.
[14] HOFFMEYER K, RAGGILOI A, RUDLOFF S,et al. Wnt/beta-catenin signaling regulates telomerase in stem cells and cancer cells[J].Science,2012,336(6088):1549-1554.
[15] DING SZ, GOLDBERG J B, HATAKEYAMA M. Helicobacter pylori infection ,oncogenic pathways and epigenetic mechanisms in gastric carcinogenesis[J].Future Oncol,2010,6(5):851-862.
[16] FADARE O, REDDY H, WANG J, et al. E-caderin and β-catenin exspression in early stage cervical carcinoma :a tissue microarray study of 147 cases[J].World J Surg Oncol,2005,3(1):38-48.
[17] VELASCO J, ZARRABEITIA M T, PRIETO J R, et al.Wnt pathway genes in osteoporosis and osteoarthritis: differential expression and genetic association study[J].Osteoporos Int,2010,21(01):109-118.
[18] CLEMENT G, GUILLERET I, HE B, et al. Epigenetic alteration of the Wnt inhibitory factor-1 promoter occurs early in the carcinogenesis of Barrett’s esophagus[J].Cancer Sci,2008,99(1):46-53.
[19] CHEN F.JNK-induced apoptosis, compensatory growth, and cancer stem cells[J].Cancer Res,2012,72(2):379-386.
[20] MA C Y, JI W T, CHUEH F S, et al. Butein inhibits the migration and invasion of SK-HEP-1 human hepatocarcinoma cells through suppressing the ERK, JNK, p38, and uPA signaling multiple pathways[J]. J Agric Food Chem,2011,59(16):9032-9038.
[21] 古鉴,郭军.JNK信号级联的诱导性失活机制[J].中国药理学通报,2009,25(9):1128-1131.
[22] 丁涛,张祥宏,李学民,等.p-JNK JNK和PPAR γ在食管癌变过程中的表达及其意义[J].中国肿瘤临床,2008,35(23):1348-1352.
[23] 帅智峰,陈文静,董海影,等.胃癌组织JNK和VEGF-C表达临床意义的探讨[J].中华肿瘤防治杂志,2012,19(14):1082-1085.
[24] ONO R, MATSUOKA J, YAMATSUJI T, et al. M-RIP, a novel target of JNK signaling and a requirement for human cancer cell invasion[J].Int J Mol Med,2008,22(2):199-203.
[25] 周燕红,何小飞,高卉,等.JNK信号通路在大肠癌侵袭和转移中的作用及机制[J].世界华人消化杂志,2009,17(21):2142-2146.
Expression of Wnt7a,JNK and RhoA in Wnt/PCP signal pathway in the tissue of colonic neoplasms
MENGDaolin,HEYuejun,XUHai,CHENWeihua,WANGJian.
(DepartmentofGeneralSurgery,theSecondHospitalAffilatedtoXuzhouMedicalCollege,Xuzhou221006,China)
Corresponding author:WANGJian,E-mail:15005206620@163.com
Objective To investigate the expression of Wnt7a,JNK and RhoA in Wnt/PCP signal pathway in human colon cancer and their clinical significance.Methods Expression of Wnt7a,JNK and RhoA in 62 colon cancer tissue and colonic adenoma tissue and normal colon tissue samples were detected by immunohistochemical assay.Their relation with the clinicopathological characteristics of colon cancer was studied.Results Immunohistochemistry demonstrated that Wnt7a,JNK and RhoA were mainly located in the cancer cells nuclear and/or cytoplasm.The results showed that the expression of Wnt7a,JNK and RhoA was significantly higher in tumor tissue than colonic adenoma and normal tissue (P<0.05).Meanwhile,the expression was markedly higher in clinical stage Ⅲ+Ⅳ than in clinical Ⅰ+Ⅱ(P<0.05),in the cases with lymph node metastasis than those without metastasis (P<0.05). Conclusion The positive rate of expression of Wnt7a,JNK and RhoA protein in Wnt/PCP signaling pathway in colonic neoplasms tissues is higher than that in colonic adenoma tissue and normal colon tissue.These factors probably play an important role in the forming process of colonic neoplasms.
Colon cancer; Wnt/PCP; Cell signalling; Immunohistochemistry; Therapeutic target
221006 江苏 徐州,徐州医学院第二附属医院 普外科
孟道林,男,硕士研究生,研究方向:消化道肿瘤,E-mail:414804500@qq.com
王 建,男,主任医师,研究方向:消化道肿瘤,E-mail:15005206620@163.com
10.3969/j.issn.1674-4136.2016.01.006
1674-4136(2016)01-0019-04
2015-09-07][本文编辑:李 庆]

