大肠杆菌植酸酶AppA野生型和热稳定突变型特性研究
段园园,赵 颖,张 民,李新良
(上海尤特尔生化有限公司,上海 201201)
大肠杆菌植酸酶AppA野生型和热稳定突变型特性研究
段园园,赵颖,张民,李新良
(上海尤特尔生化有限公司,上海201201)
摘要:大肠杆菌植酸酶AppA和突变型均在毕赤酵母表达并被分泌到胞外,在分离纯化野生型和突变型植酸酶时发现突变型AppA植酸酶存在单体和复合体,而野生型植酸酶则没有这一现象,生化分析表明,复合体是由单体通过二硫键键合形成。对植酸酶野生型、突变型单体、突变型复合体进行酶学特性分析,降解植酸的比活力分别为1 750、994和1 082 U·mg(-1),突变型植酸酶单体和复合体的耐热性比野生型有明显提高,但植酸酶野生型km值(0.30 mM)与突变型单体(3.89 mM)和突变型复合体(0.96 mM)相比明显降低,表明耐热性能的提高在一定程度上影响植酸酶与底物的结合。
关键词:植酸酶;突变;毕赤酵母;复合体
植物性饲料成本低、来源广、营养价值全面且容易被动物吸收,应用广泛。植酸是从植物中提取的1种有机磷酸类化合物,主要存在于植物的种子、根干和茎中。磷是动物生长发育不可缺少的重要元素之一,植物性饲料中所含的磷只有一部分能被机体吸收利用,其余40%~70%的磷是以植酸磷的形式存在。猪、家禽以及一些鱼类等单胃动物其消化道内缺乏水解植酸磷的酶类,仅能利用玉米中磷的10%~20%,豆饼中磷的25%~ 35%,典型的猪日粮中利用率也只有15%,其余则从粪便中排出,造成磷的浪费,导致环境污染[1]。
植酸还是一种抗营养因子,具有较强的鳌合能力,能够鳌合生物体所需的二价阳离子,如Ca2+、Zn2+、Mn2+、Cu2+、Mg2+、Fe2+等,形成不溶性的盐类,影响动物对矿物质元素的吸收[2]。植酸还能络合蛋白质,形成难溶解的复合物,其相互作用的能力与pH有很大关系:在低pH时植酸可以与蛋白质分子的碱性基团结合形成蛋白质络合物,抑制一些消化酶如胃蛋白酶、胰蛋白酶和淀粉酶的活性;在高于蛋白质等电点的pH条件下,植酸以钙镁等阳离子为“桥梁”,形成植酸-金属离子-蛋白质的复合物[3]。植酸络合蛋白质的性质影响了动物对一些重要蛋白质的吸收,降低了蛋白质、脂类和淀粉等营养物质的利用率,进一步影响了动物的生长发育。
植酸酶是一种能够水解植酸并释放无机磷的磷酸酶类,广泛存在于植物及微生物中,作为单胃动物的饲料添加剂已得到世界范围内的广泛认可[4-7]。植酸酶分解植酸的性能对饲料工业的发展具有重要意义,饲料中添加植酸酶代替无机磷酸,不但可以解除植酸的抗营养作用,提高磷的利用率,降低饲料生产成本,更能够减少磷资源的浪费,从而降低因磷元素在环境中富集而造成的污染问题[8]。研究表明,向饲料中添加植酸酶,可以使磷的利用率提高40%~60%,减少粪便中磷的排放量达30%~50%。
植酸酶主要作为单胃动物的饲料添加剂,其饲喂效果以及生产效益均已得到普遍的认可。天然来源植酸酶生物酶含量水平低,难以大量生产且生产成本过高。天然的植酸酶的酶学性质不能满足饲料工业的应用,随着分子生物技术的兴起以及饲料工业的发展,利用基因重组技术获得高产植酸酶产品可以解决这一难题。植酸酶在生产上的主要用途就是用作饲料添加剂以提高磷的利用率。饲用酶制剂在造粒的过程中需要经过1个75~93℃的短暂高温过程,而很多的植酸酶在这个过程中将会导致酶活性降低,甚至丧失活性。选择具有高热稳定性,且能够在动物胃肠道环境中保持高活性的植酸酶作为饲料添加剂就显得尤为重要。
来自于大肠杆菌的AppA植酸酶是一种新型的植酸酶,在单胃动物胃肠道的酸性环境中适应能力和分解植酸的能力都很强,是目前已知的活性最强的植酸酶,在大肠杆菌和毕赤酵母中都能获得高效表达[9-12]。尽管AppA植酸酶pH特性较好,比活性也较高,但热稳定性较差,通过制粒高温过程酶活将损失>70%,难以在主要的颗粒料中应用。近年来研究表明,利用基因工程技术定向改造AppA植酸酶能够明显提高酶的热稳定性,Garrett等将来源于大肠杆菌的植酸酶基因AppA利用基因位点饱和突变技术(GSSM)进行突变,筛选到能提高该植酸酶热稳定性的14个单突变位点,其中Q84W热稳定性提高最明显[13]。以单突变位点Q84W为基础,引入其余13个突变位点构成双突变,以双突变为基础再将其余12个突变引入构成3突变,最后筛选到1个含有8个突变位点的酶,命名为Phy9x。其Tm值达到了75.7℃,比原酶高出12℃。
本研究纯化了在毕赤酵母中高效表达和分泌的野生型AppA植酸酶和耐热突变型Phy9x植酸酶,分别得到了纯度较高的植酸酶,测定了野生型和突变型植酸酶的酶学参数km和Vmax,对纯化的植酸酶进行了热稳定性分析,初步探讨了耐热突变型植酸酶单体与聚合体的存在形式。
1 材料与方法
1.1仪器和耗材
蛋白纯化系统AKTA purifier UPC100(GE life⁃sciences,Sweden),脱盐预装柱HiPrep 26/10 Desalt⁃ing Sephadex G- 25(26×100mm,GE lifesciences,Sweden),凝胶过滤预装柱Hiload 16/60 Superdex 75 (16×600 mm,GE lifesciences,Sweden),低温离心机Eppendorf Centrifuge 5810R,恒温水浴锅Fisher,755s紫外可见分光光度计,蛋白电泳仪Tanon EPS 300,Corning 10 kDa超滤离心管,0.22 μm无菌滤膜(Millipore Express PES Membrance,Germany),8%~16%预制胶Bio-Rad Criterion TGX Precast Gel,预染标准蛋白Bio-Rad Precision Plus Protein Stan⁃dards,SDS-PAGE电泳缓冲液Laemmli Sample Buf⁃fer,Native-PAGE电泳缓冲液Native Sample Buffer。
1.2大肠杆菌AppA植酸酶在毕赤酵母的表达与分泌
大肠杆菌AppA和突变型phy9x适合毕赤酵母表达的基因片段由GeneArt合成。为了有效克隆到毕赤酵母表达质粒pPIC9K,限制性内切酶序列SnaBI和NotI分别加到了基因片段的5'和3'端[13]。基因克隆、毕赤酵母转化、诱导培养和重组蛋白的制备都按Invitrogen公司提供的方法操作。
1.3植酸酶的纯化与浓缩
20 mL AppA植酸酶,经4℃9 000 r·min-1离心30 min,分离出上清液并用0.22 μm无菌滤膜过滤。滤液分批上样至26×100 mm的HiPrep 26/10 Desalt⁃ing Sephadex G-25脱盐预装柱,每次上样5 mL,用3.0 mL·min-1流速的25 mM pH 8.5 Tris-HCl缓冲液洗脱并收集,第1步纯化使AppA植酸酶置换到25 mM pH 8.5 Tris-HCl缓冲溶液中。取第1步纯化的AppA植酸酶,分批上样至16×600 mm的Hiload 16/60 Superdex 75凝胶过滤层析柱,每次上样0.5 mL,在1.0 mL·min-1的25 mM pH 8.5 Tris-HCl缓冲液推动下,AppA植酸酶中的蛋白按尺寸由大到小依次分离并收集,每管收集3 mL,共收集8管。根据AppA植酸酶凝胶层析图的峰形,收集酶液,并用Corning超滤管浓缩纯化的AppA植酸酶。
20 mL Phy9x植酸酶,4℃9 000 r·min-1离心30 min,分离出上清液并用0.22 μm无菌滤膜过滤。滤液分批上样至26×100mm的HiPrep 26/10 Desalting Sephadex G-25脱盐预装柱,每次上样5 mL,用3.0 mL·min-1流速的25 mM pH 8.5 Tris-HCl缓冲液洗脱并收集,第1步纯化使Phy9x植酸酶置换到25 mM pH 8.5 Tris-HCl缓冲溶液中。取第1步纯化的Phy9x植酸酶,分批上样至16×600mm 的Hiload 16/60 Superdex 75凝胶过滤层析柱,每次上样0.5 mL,在1.0 mL·min- 1的25 mM pH 8.5 Tris- HCl缓冲液推动下,Phy9x植酸酶中的蛋白按尺寸由大到小依次分离并收集,每管收集3 mL,共收集8管。根据Phy9x植酸酶凝胶层析图的峰分离情况,分组收集植酸酶各峰处的酶液,并用Corning超滤管浓缩纯化的Phy9x植酸酶。
1.4植酸酶的凝胶电泳方法
分别取AppA植酸酶和Phy9x植酸酶纯化过程中各收集管的酶液20 μL,加Laemmli sample buffer 20 μL摇匀,在沸水浴中煮沸5 min,冰水冷却后,加样20 μL至8%~16%的预制胶,通电160 V,40 mA,40 min,经定型、考马斯亮蓝染色、脱色、成像后,得到与纯化过程对应的AppA植酸酶和Phy9x植酸酶SDS-PAGE图。
取酶液20 μL,加native sample buffer 20 μL摇匀后,加样20 μL至8%~16%的预制胶,通电160 V,40 mA,40 min,经定型、考马斯亮蓝染色、脱色、成像后,得到植酸酶Native-PAGE图。
1.5植酸酶蛋白浓度的测定
粗蛋白的浓度用Bradford试剂(Bio-Rad公司)测定,以血清白蛋白作为标准对照。纯化后的Ap⁃pA和Phy9x的浓度由UV280nm测得,其在1.0 mg· mL-1的UV280nm的光密度分别为1.142和1.145。
1.6植酸酶酶活分析方法
根据GB/T18634-2009饲用植酸酶活性的测定分光光度法,稀释的植酸酶与底物植酸钠在37℃、pH 5.5的条件下反应30 min,用钒钼酸铵溶液终止反应并显色,在415 nm波长测定吸光值,依据磷酸二氢钾标准曲线换算出无机磷的量,代入公式1中计算出植酸酶的活性。

式中:X为试样中植酸酶的活性,单位为U·g-1或U·mL-1;y为根据实验样液的吸光值由直线回归方程计算出的无机磷的量,单位为μmol;t为酶解反应时间,单位为min;n为试样的稀释倍数;m为试样的量,单位为g或mL。
1.7植酸酶热稳定性分析
将纯化的AppA植酸酶和Phy9x植酸酶,用250 mM pH 5.5的乙酸-乙酸钠缓冲液稀释到500 U·mL-1,在酶活相同的条件下,每个样品在60℃水浴中分别处理5、10、30和60 min后,至于冰水浴中保存,检测植酸酶剩余活力。
1.8km与Vmax的计算
当底物浓度很低时,植酸酶酶促反应的速度(V)随底物植酸钠浓度(S)的增加而快速增加;随着底物植酸钠浓度的继续增加,酶促反应速度的增加开始减慢;当底物植酸钠浓度增加到某一程度时,酶促反应速度会达到一个极限值(Vmax)。底物植酸钠的浓度与酶促反应速度的这种关系可以用Michaelis-Menten方程式表示。米氏常数km等于酶促反应速度达到最大反应速度一半时的底物浓度,米氏常数km的单位为浓度单位(mmol·L-1或mM)。
方法为:用pH 5.5的缓冲液将酶稀释到0.5 U·mL- 1;配置浓度为0.375、0.75、1.5、3.0、3.75、4.5、6.0和7.5 mM的植酸钠底物溶液;在37℃、pH 5.5的条件下,不同浓度的底物分别与酶反应30 min后,加入终止显色液,415 nm下10 mm比色皿测吸光度值,依据磷酸二氢钾的标准曲线计算产物的浓度;根据产物浓度,计算出酶反应速度V;利用Linewearver-Burk双倒数法作图,绘制1/V对1/(S)的直线,直线在其横轴上的截距为-1/km,纵截距为1/Vmax,可求出km与Vmax。
1.9二硫苏糖醇处理Phy9x植酸酶
二硫苏糖醇(DTT)常用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间形成分子内或分子间二硫键。适量DTT能打开复合体内的二硫键,释放单体,去除DTT后,二硫键又重新键合形成复合体。对比DTT加入前后蛋白质相对分子质量的变化,可以分辨蛋白是否存在复合体。向完成第1步纯化的500 μL Phy9x植酸酶中加入1.0 mol·L- 1的DTT 50 μL,对照组中加ddH2O 50 μL,摇匀后放置于4℃冰箱待用。加DTT的Phy9x植酸酶500 μL与无DTT对照分别上样至Hiload 16/60 Superdex 75凝胶过滤层析柱,进行尺寸排阻色谱分离,UV280nm跟踪蛋白洗脱位置。
2 结果与分析
2.1野生型AppA植酸酶
AppA植酸酶凝胶层析见图1,AppA植酸酶SDS-PAGE见图2。
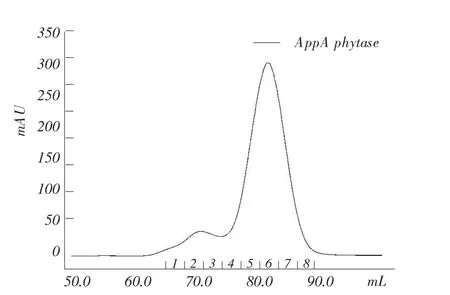
图1 AppA植酸酶凝胶层析
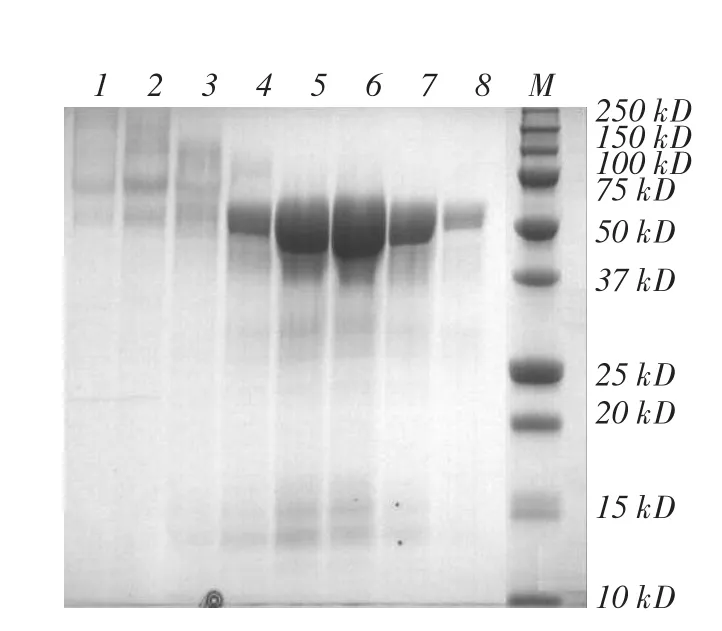
图2 AppA植酸酶SDS-PAGE
由图1~2可知,在5~7收集管处对应一个峰形对称的洗脱峰,凝胶层析分离SDS-PAGE中5~7管蛋白相对分子质量集中在50 kDa以上,与罗会颖等研究一致[11]。把5~7管中的AppA植酸酶浓缩,计算出纯化浓缩后的AppA植酸酶浓度为5.78 mg·mL-1。根据钒钼酸铵法,测得野生型AppA植酸酶比活力为1 750 U·mg-1,与Golovan等测得的比活力1 700 U·mg-1接近,表明大肠杆菌AppA在毕赤酵母中能表达和分泌出与细菌表达相似的植酸酶[14]。
2.2突变型Phy9x植酸酶
Phy9x植酸酶凝胶层析图见图3,Phy9x植酸酶SDS-PAGE见图4,Phy9x植酸酶Native-PAGE见图5。
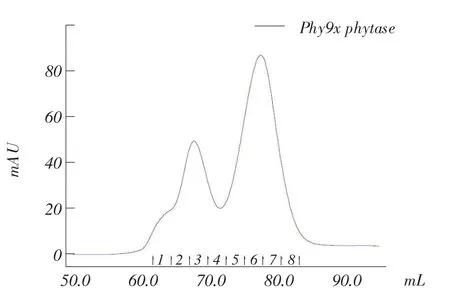
图3 Phy9x植酸酶凝胶层析
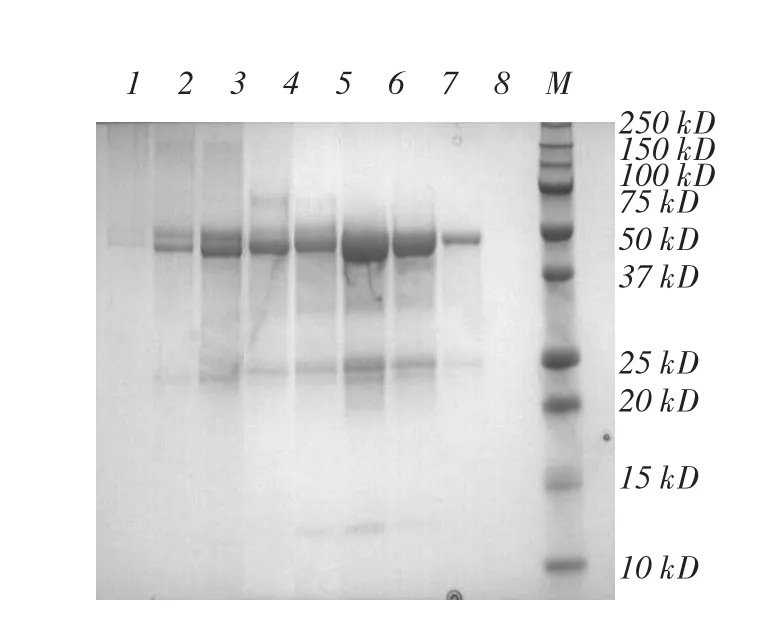
图4 Phy9x植酸酶SDS-PAGE
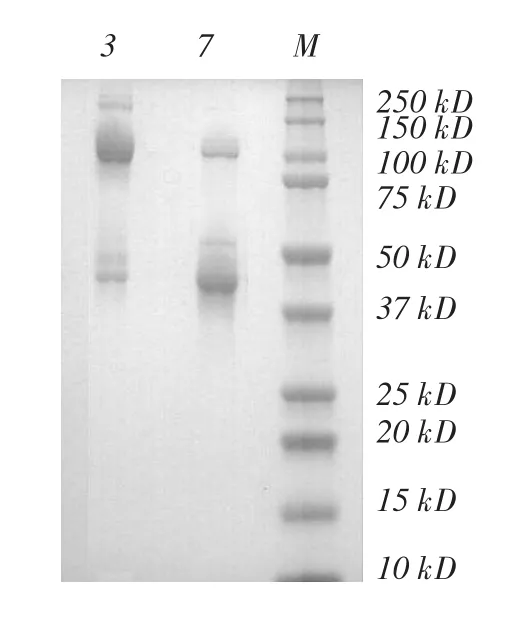
图5 Phy9x植酸酶Native-PAGE
毕赤酵母表达和分泌突变型Phy9x植酸酶凝胶层析分离图(图3)中有1个肩峰和2个对称的分离峰出现,凝胶层析分离SDS-PAGE(图4)显示两个峰对应的蛋白条带略有不同,第3管中50 kDa附近有两条清晰的蛋白条带,在第6和7管中50 kDa附近只有1条,第3管中还有>150 kDa的蛋白条带,在第6和7管中未发现。对Phy9x植酸酶第3和7管收集进一步做Native-PAGE(图5),显示第3管中蛋白集中在100 kDa附近,第7管中蛋白集中在44 kDa附近,50 kDa附近都有3条蛋白带,这与毕赤酵母表达的植酸酶存在多个N-端糖基化位点有关[12]。
综合以上结果,初步认为突变型Phy9x植酸酶存在单体与复合体形态,且两种形态之间存在动态平衡关系。把6、7管浓缩,作为纯化的突变型Phy9x植酸酶单体,把突变型Phy9x植酸酶的3管浓缩,作为纯化的突变型Phy9x植酸酶复合体。分别计算出Phy9x植酸酶单体和复合体的浓度为0.533 和0.497 mg·mL-1。钒钼酸铵法测得Phy9x植酸酶单体比活力为994 U·mg-1,Phy9x植酸酶复合体比活力为1 082 U·mg-1。与AppA植酸酶相比,Phy9x植酸酶单体和复合体的比活力都有所降低。
2.3剩余酶活比较
植酸酶60℃热稳定性趋势见图6,纯化植酸酶60℃热稳定性数据见附表。
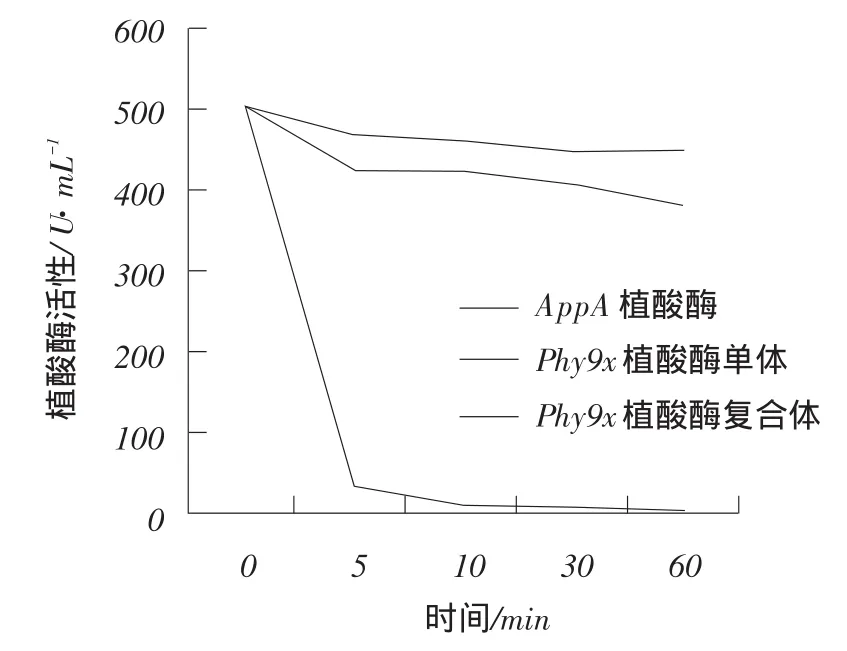
图6 植酸酶60℃热稳定性趋势
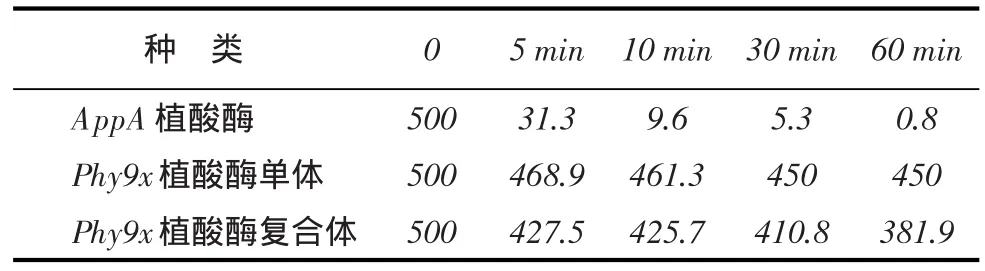
附表 纯化植酸酶60℃热稳定性数据 U·mL-1
AppA植酸酶、Phy9x植酸酶单体和Phy9x植酸酶复合体60℃热处理不同时间之后的剩余酶活数据见表1,趋势图见图6。与野生型AppA植酸酶相比,8位点突变的AppA基因表达的Phy9x植酸酶的热稳定性明显提高。Phy9x植酸酶单体和Phy9x植酸酶复合体60℃处理30 min后,剩余酶活比率均> 80%。热稳定性良好的突变型比较,单体比复合体耐高温性能更好。
2.4双倒数直线方程比较
AppA植酸酶Linewearver-Burk双倒数图见图7,Phy9x植酸酶Linewearver-Burk双倒数图见图8。
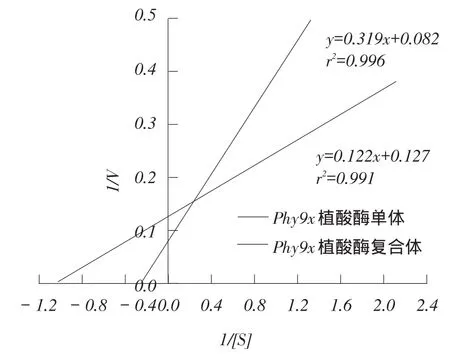
图7 AppA植酸酶Linewearver-Burk双倒数
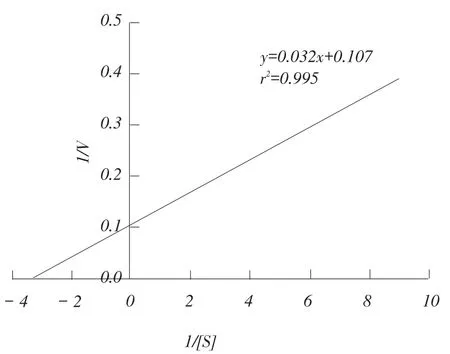
图8 Phy9x植酸酶Linewearver-Burk双倒数
通过选择不同浓度的底物植酸钠[S]测定相应的酶反应初速度V,建立1/V对1/[S]的线性关系,利用纵横轴的截距可方便地求出km与Vmax。AppA植酸酶的双倒数直线方程为y=0.032x+0.107(r2= 0.995,n=5),计算出km为0.30 mM,Vmax为2022.1μmol·min-1·mg-1。Phy9x植酸酶单体的双倒数直线方程为y=0.319x+0.082(r2=0.996,n=5),计算出km为3.89 mM,Vmax为1910.6 μmol·min- 1·mg- 1。Phy9x植酸酶复合体的双倒数直线方程为y= 0.122x+ 0.127(r2=0.991,n=5),计算出km为0.96 mM,Vmax为1 326.3 μmol·min-1·mg-1。比较Phy9x植酸酶单体和复合体与AppA植酸酶的参数,发现km值均升高,Vmax值均降低,表明突变型Phy9x植酸酶对底物植酸钠的结合能力和降解速度都有所降低。饲料原料通常含有0.2%~0.8%的植酸,在动物胃肠道的含量应为0.06%~0.25%,换算成摩尔浓度约为0.9~3.8 mM,野生型AppA植酸酶的km为0.30 mM,能比较完全地降解植酸的磷酯键,而突变型Phy9x植酸酶特别是突变型单体降解植酸磷酯键的程度将明显受到影响[15-17]。
2.5DTT处理后的Phy9x植酸酶
Phy9x植酸酶DTT处理前与处理后凝胶层析图见图9。Phy9x植酸酶DTT处理后(1、2)与处理前(3、4)的Native- PAGE见图10。Phy9x植酸酶SDS-PAGE(1、2)与Native-PAGE(3、4)见图11。
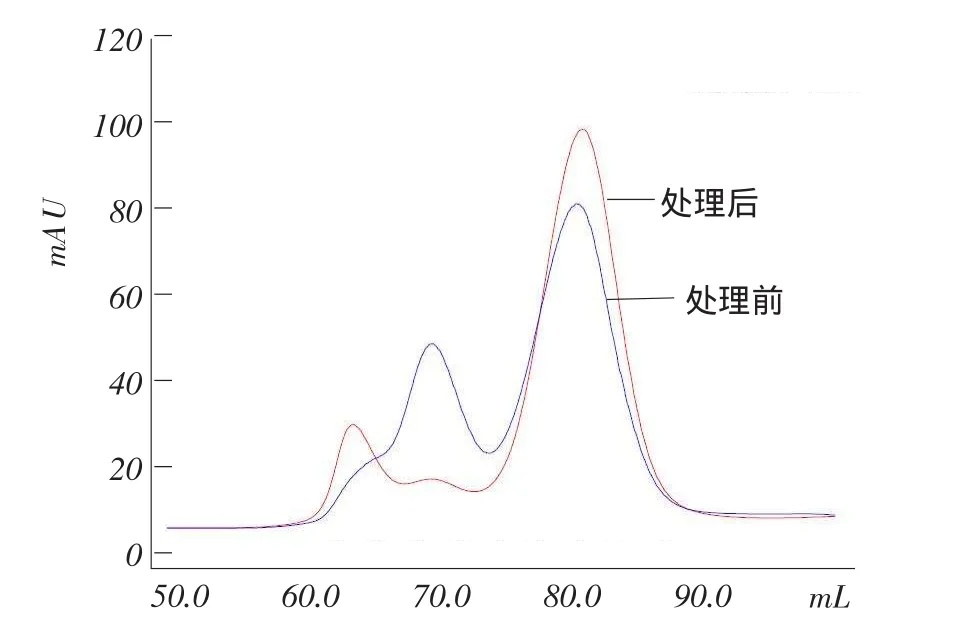
图9 Phy9x植酸酶DTT处理前与处理后凝胶层析
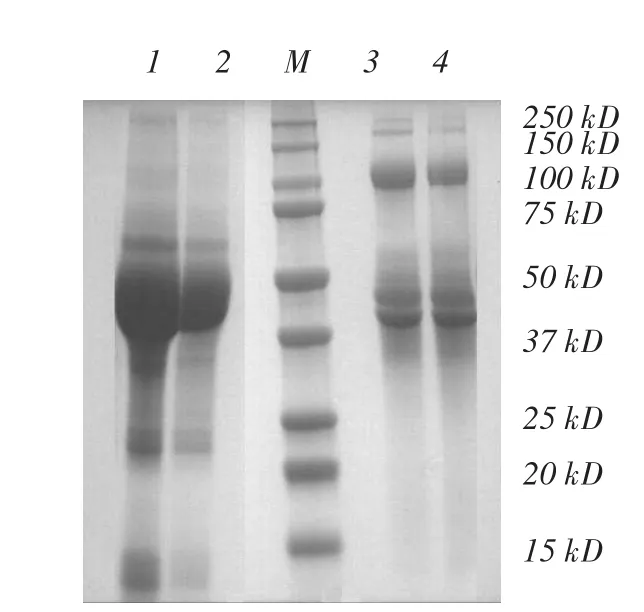
图10 Phy9x植酸酶DTT处理前后的Native-PAGE
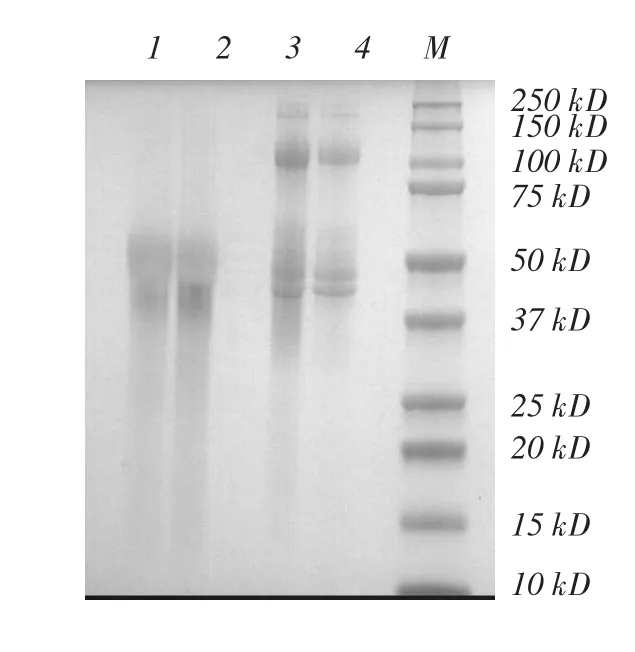
图11 Phy9x植酸酶SDS-PAGE(1、2)与Native-PAGE(3、4)
叠加对比DTT处理前后Phy9x植酸酶的凝胶层析图(图9)可知,加DTT的Phy9x植酸酶色谱线(处理后)第二分离峰降低,第三分离峰增高。
图10中加DTT前后Phy9x植酸酶的Native-PAGE中蛋白条带的变化,也证明DTT使处于第二分离峰的Phy9x植酸酶复合体分解成了Phy9x植酸酶单体。图10中3、4泳道中约100和200 kDa的蛋白条带,在DTT还原的1、2泳道中这些分子量较大的蛋白条带没有出现,同时40~54 kDa区间的蛋白条带增多。根据这些现象推断,Phy9x植酸酶中约100和200 kDa的蛋白是以二倍体和四倍体形式存在的复合体。
图11对比了Phy9x植酸酶的Native-PAGE和SDS-PAGE电泳图,其中Phy9x植酸酶的SDSPAGE与DTT处理后的Native-PAGE略有不同,是由于DTT和2-MP对二硫键的还原能力不同导致的。
3 结论
试验纯化了毕赤酵母高效表达的AppA植酸酶和突变型Phy9x植酸酶,分离提纯时发现突变型Phy9x植酸酶存在单体和复合体,而且耐高温突变型植酸酶单体和复合体的比活力以及与底物的亲和力都不如野生型AppA植酸酶,这些特性的改变可能会影响植酸酶的使用效果。
[参考文献]
[1]Rodriguez E,Han Y,Lei X G.Cloning,sequencing,and expres⁃sion of an Escherichia coli Acid Phosphatase/Phytase Gene(appA2)isolated from pig colon[J].Biochemical and Biophysical Research Communications,1999,257(1):117-123.
[2]Lei X,Ku P K,Miller E R,et al.Supplemental microbial phytase improves bioavailability of dietary zinc to weanling pigs[J].Jour⁃nal of Nutrition,1993,123(6):1 117-1 123.
[3]Pallauf J,Rimbach G.Nutritional significance of phytic acid and phytase[J].Arch Tieremahr,1997,50(4):301-319.
[4]贺建华.植酸磷和植酸酶研究进展[J].动物营养学报,2005,17 (1):1-6.
[5]吴妙宗,杨禄良,闫海洁.植酸酶营养与应用研究进展[J].中国饲料,1999(23):11-13.
[6]罗赞,贺建华.植酸酶在养猪生产中的应用研究进展[J].广东饲料,2008,17(6):31-33.
[7]李晓宇,陈耀国,柳志强.植酸酶生产与应用的研究进展[J].中国农学通报,2011,27(3):257-261.
[8]Lei X G,Stahl C H.Biotechnological development of effective phy⁃tases for mineral nutrition and environmental protection[J].Ap⁃plied Microbiology and Biotechnology,2001,57(4):474-481.
[9]潘军华,曾嵋涓,潘中明,等.大肠杆菌植酸酶基因appA及其过量表达[J].粮食与饲料工业,2001(10):32-34.
[10]陈寅,朱中泽,张志芳,等.大肠杆菌植酸酶基因appA的克隆与高效表达[J].微生物学通报,2004,31(3):74-78.
[11]罗会颖,黄火清,柏映国,等.增加植酸酶appA-m的拷贝提高其在巴斯德毕赤酵母的表达量[J].生物工程学报,2006,22 (4):528-533.
[12]Luo H Y,Huang H Q,Yang P L,et al.A novel phytase AppA from Citrobacrer amalonaticus CGMCC 1696:gene cloning and overex⁃pression in Pichia pastoris[J].Current Microbiology,2007,55(3):185-192.
[13]Garrett J B,Kretz K A,O'Donoghue E,et al.Enhancing the ther⁃mal tolerance and gastric performance of a microbial phytase for use as a phosphate-mobilizing monogastric-feed supplement[J].Applied and Environmental Microbiology,2004,70(5):3 041-3 046.
[14]Golovan S,Wang G,Zhang J,et al.Characterization and overpro⁃duction of the Escherichia coli appA encoded bifunctional enzyme that exhibits both phytase and acid phosphatase activities[J].Ca⁃nadian Journal of Microbiology,1999,46(1):59-71.
[15]欧阳富龙,彭媛媛,张光磊,等.植酸酶的开发利用研究进展[J].中国饲料添加剂,2015(7):13-19.
[16]王康宁,方热军.植酸性饲料中植酸磷和植酸酶的研究进展[J].中国饲料,2002(20):4-6.
[16]丁强,杨培龙,黄火清,等.植酸酶发展现状和研究趋势[J].中国农业科技导报,2010,12(3):27-33.
Characteristic Study on Escherichiacoli Phytase AppA and Thermostable Mutant
DUAN Yuanyuan,ZHAO Ying,ZHANG Min,LI Xinliang
(Shanghai Youtell Biochemical Co.,Ltd.,Shanghai 201201,China)
Abstract:Escherichia coli phytase AppA and its thermostable mutant have been over-expressed and secreted from Pichia pastoris.Separation and purification of the wild-type and mutant enzymes revealed that the mutant en⁃zyme existed both single and polymeric forms while only single form was found from the wild-type enzyme.Biochem⁃ical analysis indicated that the polymeric form of the mutant resulted from disulfide bonds between single forms.The specific activities of wild-type,mutant single and polymeric form enzymes for phytate degradation were 1 750,994 and 1 082 U·mg(-1),respectively.The mutant forms were more thermostable but the km value for the wild-type(0.30 mM)was much lower than those for mutant single(3.89 mM)and polymeric form(0.96 mM),indicating that with the in⁃crease of thermostability,the combination of phytate and substrate became weak.
Key words:phytase; mutation; Pichia pastoris; polymeric form
作者简介:段园园(1984-),女,山西阳泉人,硕士,主要从事蛋白质纯化研究。
收稿日期:2016-01-23
中图分类号:R378.2+1;TQ925
文献标志码:A
文章编号:1001-0084(2016)03-0004-07

