过敏性鼻炎小鼠鼻黏膜组织中白介素9及转录因子PU.1表达水平的研究
顾兆伟,赵 鹤,曹志伟
110004辽宁省沈阳市,中国医科大学附属盛京医院耳鼻咽喉科
·论著·
过敏性鼻炎小鼠鼻黏膜组织中白介素9及转录因子PU.1表达水平的研究
顾兆伟,赵 鹤,曹志伟
110004辽宁省沈阳市,中国医科大学附属盛京医院耳鼻咽喉科
【摘要】目的探讨辅助性T细胞9(Th9细胞)相关细胞因子白介素(IL)-9 mRNA/蛋白及转录因子PU.1 mRNA在过敏性鼻炎小鼠鼻黏膜组织中的表达及其作用。方法2014年7月选取SPF级Balb/c小鼠16只,采用随机数字表法分为两组,每组8只。实验组小鼠使用鸡卵清蛋白致敏,建立过敏性鼻炎小鼠模型;对照组小鼠同期使用0.9%氯化钠溶液。每组采用随机数字表法取4只小鼠,病理检查证明造模成功。每组剩余4只小鼠取鼻黏膜,采用实时荧光定量PCR法检测小鼠鼻黏膜组织中IL-9、转录因子PU.1 mRNA表达水平,采用流式微球术检测小鼠鼻黏膜组织中IL-9表达水平。结果实验组小鼠鼻黏膜组织中IL-9 mRNA表达水平〔(21.88±1.82)与(1.03±0.11)〕、转录因子PU.1 mRNA表达水平〔(24.63±1.88)与(1.02±0.07)〕高于对照组(P<0.05)。实验组小鼠鼻黏膜组织中IL-9表达水平〔(66.9±4.4)pg/ml与(20.9±2.1)pg/ml〕高于对照组(P<0.05)。小鼠鼻黏膜组织中IL-9 mRNA表达水平与转录因子PU.1 mRNA表达水平呈正相关(r=0.952,P<0.001)。结论Th9细胞相关细胞因子IL-9和转录因子PU.1参与过敏性鼻炎的发生发展过程,该结果将有希望提高对过敏性鼻炎发病机制的了解,为过敏性鼻炎免疫调节治疗潜在靶点的选择提供新的线索。
【关键词】鼻炎;T淋巴细胞,辅助诱导;白介素9;转录因子
顾兆伟,赵鹤,曹志伟.过敏性鼻炎小鼠鼻黏膜组织中白介素9及转录因子PU.1表达水平的研究[J].中国全科医学,2016,19(12):1420-1423,1428.[www.chinagp.net]
Gu ZW,Zhao H,Cao ZW.Expression levels of IL-9 and PU.1 in nasal mucosa of allergic rhinitis mice[J].Chinese General Practice,2016,19(12):1420-1423,1428.
过敏性鼻炎(allergic rhinitis,AR)是一种常见的上呼吸道慢性炎症性疾病,表现为连续打喷嚏、清水样涕、鼻塞及鼻痒等不适。虽然没有生命危险,但对患者的生活质量和工作效率造成严重影响。AR一直被认为是一种过敏反应,主要涉及辅助性T细胞2(Th2细胞),并且伴随辅助性T细胞1(Th1细胞)的相对缺乏[1]。虽然Th2细胞介导的免疫反应机制可以解释AR的很多特点,但是这种简单的炎症模型并不足以充分解释其免疫机制,研究发现,Th1细胞炎性反应并未使Th2细胞应答占主导的过敏反应炎症减轻[2],这表明过敏性疾病的发病机制不能完全归咎于Th1细胞/Th2细胞失调,而很可能同时伴有其他机制,并在发病过程中发挥重要作用。近年来,发现了一个新的独立的Th细胞亚群——辅助性T细胞9(Th9细胞),其高水平表达白介素(IL)-9[3-4]。IL-9可以影响炎性细胞以及正常组织细胞,增加淋巴细胞、嗜酸粒细胞和肥大细胞的数量,刺激IgE的分泌,增强肥大细胞对过敏原的免疫应答,促进黏蛋白的表达,并刺激分泌炎性细胞因子[5-8]。转录因子PU.1是Th9细胞特异性转录因子,与Th9细胞的分化和生物功能的发挥密切相关[9]。最近的研究证实,Th9细胞/IL-9及其转录因子PU.1参与了支气管哮喘的发生和发展[10],但尚不清楚AR中Th9细胞相关细胞因子IL-9和转录因子PU.1的表达情况。目前研究认为,AR和支气管哮喘是同一气道的同一疾病[11]。因此,本研究拟使用小鼠建立AR模型,通过检测小鼠鼻黏膜组织中IL-9 mRNA/蛋白、转录因子PU.1 mRNA表达水平及其相互关系,探讨Th9细胞在AR发生、发展中的作用。
1材料与方法
1.1实验材料2014年7月选取SPF级Balb/c小鼠16只,雄性,6~8周龄,体质量18~20 g(购自北京华阜康生物科技股份有限公司);无菌饲料(购自北京华阜康生物科技股份有限公司);鸡卵清蛋白(ovalbumin,OVA)(美国,Sigma-Aldrich,A5253);氢氧化铝粉(分析纯,购自天津市大茂化学试剂厂)。
1.2模型建立小鼠在屏障系统中饲养,采用随机数字表法分为两组,每组8只。实验组小鼠使用鸡卵清蛋白致敏,将100 μg鸡卵清蛋白+2 mg氢氧化铝粉溶于0.1 ml 0.9%氯化钠溶液中,分别于造模的第0、2、4、6、8、10、12、14天对实验组小鼠进行腹腔注射,第15~25天每日分别用500 μg鸡卵清蛋白溶于10 μl 0.9%氯化钠溶液中,对小鼠进行滴鼻,每个鼻孔10 μl,连续激发11 d。对照组小鼠均同期使用等量0.9%氯化钠溶液进行相同处理。
1.3模型评价通过激发,小鼠会出现鼻痒、打喷嚏、清水样涕等症状,末次激发后观察30 min。计分标准:鼻痒:轻摩擦鼻几次为1分,抓挠鼻面部不止为2分,到处摩擦为3分;打喷嚏:1~3个为1分,4~10个为2分,11个及以上为3分;清水样涕:流到前鼻孔为1分,超过前鼻孔为2分,涕流满面为3分。以叠加法记录总分,总分超过5分即为造模成功。应用上述计分标准记分,实验组小鼠均大于5分,对照组小鼠均小于5分。
1.4病理检查两组小鼠均于末次激发后2 h处死,每组采用随机数字表法取4只小鼠,头部放入乙醇甲醛混合固定液固定,之后置入5%甲酸溶液中脱钙4周,然后包埋成蜡块。蜡块制作完成后,进行切片,厚度2 μm。使用苏木素-伊红(HE)染色,后进行光镜检查。光镜下可见实验组小鼠鼻黏膜肿胀及嗜酸粒细胞浸润,对照组小鼠鼻黏膜未见明显肿胀及嗜酸粒细胞浸润(见图1,本文图1彩图见本刊官网www.chinagp.net电子期刊相应文章附件),说明造模成功。
1.5取材每组剩余4只小鼠处死后取其鼻黏膜,并且将鼻黏膜分成2份,其中一份制备成单细胞悬液,离心(300×g,10 min),取上清液,用于细胞因子检测,另一份直接用于提取RNA。
1.6反转录聚合酶链式反应(RT-PCR)应用TRIzol试剂盒(Invitrogen,上海)提取小鼠鼻黏膜组织细胞总RNA,紫外分光光度计测定RNA浓度及纯度。使用PrimeScript RT-PCR kit(Takara,大连)将0.5 μg总RNA反转录成cDNA。使用ABI 7500进行RT-PCR检测。以β-actin作为内参,IL-9和转录因子PU.1作为目的基因。β-actin上游引物:5′-GCAGAAGGAGATTACTGCTCT-3′,下游引物:5′-GCTGATCCACATCTGCTGGAA-3′,扩增产物长度137 bp;IL-9上游引物:5′-GGGCATCAGAGACACCAAT-3′,下游引物:5′-GGACGGAGAGACACAAGCA-3′,扩增产物长度104 bp;转录因子PU.1上游引物:5′-CTTCCAGTTCTCGTCCAAGC-3′,下游引物:5′-TTCTTCACCTCGCCTGTCTT-3′,扩增产物长度135 bp。使用2ΔΔCT法测出目的基因mRNA表达水平。
1.7流式细胞仪流式微球术(cytometric bead assay,CBA)采用CBA检测上清液IL-9 表达水平,按照试剂盒说明书严格操作。使用BD FACSCanto Ⅱ flow cytometer(BD Biosciences)获得数据,FACSDiva and BD CBA software 4.2(BD Biosciences)用于结果分析。IL-9 表达水平检测极限为10.7 pg/ml。

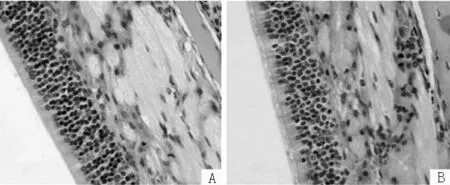
注:A为正常组,未见明显嗜酸粒细胞浸润;B为实验组,可见嗜酸粒细胞浸润
图1两组小鼠鼻黏膜苏木素-伊红染色结果(×200)
Figure1ResultsofHEstainingofnasalmucosainthemiceofthetwogroups
2结果
2.1小鼠鼻黏膜组织中IL-9、转录因子PU.1 mRNA表达水平比较实验组小鼠鼻黏膜组织中IL-9、转录因子PU.1 mRNA表达水平高于对照组,差异均有统计学意义(P<0.05,见表1)。
Table 1Comparison of the expression levels of IL-9 and PU.1 mRNA in nasal mucosa of mice between control group and experimental group
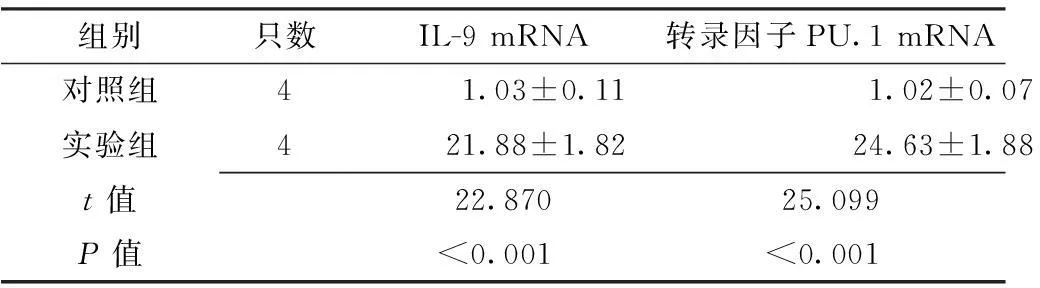
组别只数IL-9mRNA转录因子PU.1mRNA对照组41.03±0.111.02±0.07实验组421.88±1.8224.63±1.88t值22.87025.099P值<0.001<0.001
注:IL-9=白介素9
2.2小鼠鼻黏膜组织中IL-9表达水平比较实验组小鼠鼻黏膜组织中IL-9表达水平高于对照组,差异均有统计学意义(P<0.05,见表2)。
2.3小鼠鼻黏膜组织中IL-9 mRNA表达水平与转录因子PU.1 mRNA表达水平相关性小鼠鼻黏膜组织中IL-9 mRNA表达水平与转录因子PU.1 mRNA表达水平呈正相关(r=0.952,P<0.001,见图2)。
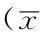
Table2ComparisonoftheexpressionlevelofIL-9innasalmucosaofmicebetweencontrolgroupandexperimentalgroup
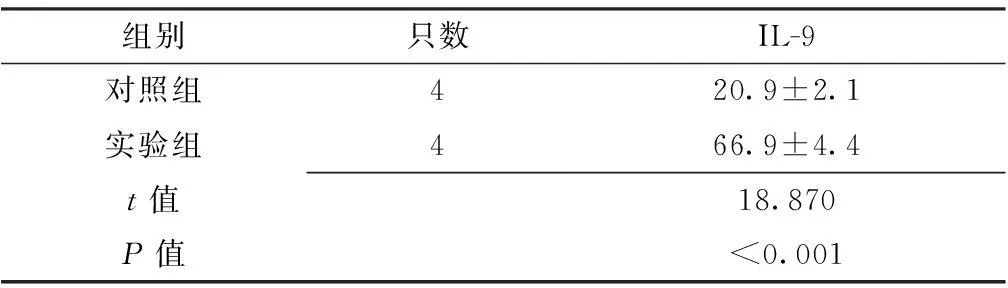
组别只数IL-9对照组420.9±2.1实验组466.9±4.4t值18.870P值<0.001

注:IL-9=白介素9
图2小鼠鼻黏膜组织中IL-9 mRNA表达水平与转录因子PU.1 mRNA表达水平相关性散点图
Figure 2Scatter diagram of the correlation between the expression levels of IL-9 and PU.1mRNA in nasal mucosa of mice
3讨论
AR是以嗜酸粒细胞及肥大细胞浸润为特点的Ⅰ型变态反应[11]。Th细胞及其分泌的细胞因子在调节嗜酸粒细胞和肥大细胞的迁移、凋亡和功能中发挥着核心作用[12]。AR一直被认为是一种过敏反应,主要涉及Th2细胞,并且伴随Th1细胞的相对缺乏[1]。Th1细胞分泌干扰素γ(IFN-γ)介导细胞免疫,而Th2细胞分泌IL-4、IL-5和IL-13来调解体液免疫[12]。IL-5刺激骨髓中嗜酸粒细胞发育,进入血液循环,而IL-4和IL-13可上调趋化因子(如eotaxin),促进嗜酸粒细胞浸润[13]。
Th9细胞是最近发现的以分泌细胞因子IL-9为典型特征的CD4+效应性T细胞,由辅助性T细胞0(Th0细胞)在IL-4和转化生长因子β(TGF-β)的特殊刺激下共同诱导产生或由TGF-β作用于Th2细胞分化而来[3-4]。不同于已知的Th1细胞、Th2细胞、辅助性T细胞17(Th17细胞)、Treg细胞,Th9细胞的特异性转录因子是PU.1,从而在基因水平上也提示Th9细胞与其他辅助性T细胞亚群不同[14]。研究显示,Th9细胞在支气管哮喘等免疫应答过程中起重要作用,Th9细胞功能的发挥主要依靠其分泌的功能性细胞因子IL-9实现[10]。
IL-9最初被认为是在小鼠体内刺激T细胞和肥大细胞的生长因子[15],对IL-9 的了解近年来在动物模型以及人体实验中逐渐扩展,有研究在支气管哮喘患者支气管活检组织中发现IL-9 mRNA表达水平升高,过度表达IL-9的转基因小鼠模型也在抗原刺激的作用下表现出高气道反应性、嗜酸粒细胞浸润以及IgE大量生成等支气管哮喘模型的表现[16]。而IL-9基因敲除的小鼠模型或者应用IL-9中和抗体的实验则可以得到逆转气道高反应性,减少嗜酸粒细胞浸润等[17-18]。上述实验证实了IL-9在支气管哮喘发病过程中对抗原反应的支持以及其在免疫调节中起到的重要作用。赵鹤等[11]利用免疫组化SABC法在AR小鼠鼻黏膜组织中检测到IL-9表达水平升高。
本实验采用RT-PCR以及CBA法检测AR小鼠鼻黏膜组织中IL-9 mRNA/蛋白的表达情况,结果发现,实验组小鼠鼻黏膜组织中IL-9 mRNA/蛋白均呈高表达,明显高于对照组。提示IL-9在AR发生发展中起到重要作用。Th9细胞是IL-9的主要来源,但是由于Th9 细胞在AR小鼠鼻黏膜中大量表达导致IL-9 表达水平升高还是基因调控导致IL-9 表达水平升高仍存在争议。
转录因子PU.1在产生Th9细胞表型中起着至关重要的作用,是Th9细胞转录因子[9]。在人T细胞中IL-9的产生需要转录因子PU.1与IL-9基因相结合。研究发现,通过小鼠T细胞条件缺失或人T细胞小干扰RNA(siRNA)导致转录因子PU.1表达水平下降,均会导致IL-9表达水平下降,然而转录因子PU.1的高表达会增加IL-9的表达[19-20]。本研究结果显示,实验组小鼠鼻黏膜组织中转录因子PU.1 mRNA表达水平升高,小鼠鼻黏膜组织中IL-9 mRNA表达水平与转录因子PU.1 mRNA表达水平呈正相关,间接提示了Th9细胞的高表达。下一步有必要对AR小鼠鼻黏膜组织中Th9细胞表达进行检测,明确Th9细胞的表达在调节AR中的作用。
众所周知,嗜酸粒细胞及肥大细胞浸润同样是AR的特征表现[12]。IL-9可以影响炎性细胞以及正常组织细胞,增加淋巴细胞、嗜酸粒细胞和肥大细胞的数量。在一定的条件下,IL-9对Th1细胞、Th2细胞、Th17细胞、调节性T细胞和Th9细胞的表达亚群起到多效性影响,根据微环境的不同扮演不同的角色[21-23]。考虑到对Th细胞在AR中的重要性以及IL-9对Th细胞的影响,本课题组下一步将阻断IL-9的表达来明确其对Th细胞亚群分化以及AR的影响。
综上所述,本研究发现Th9细胞相关细胞因子IL-9和转录因子PU.1参与AR的发生发展过程,该结果将有助于提高对AR发病机制的了解,为AR免疫调节治疗潜在靶点的选择提供新的线索。
作者贡献:顾兆伟进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;赵鹤进行实验实施、评估、资料收集;曹志伟进行质量控制及审校。
本文无利益冲突。
参考文献
[1] Malmhäll C,Bossios A,Pullerits T,et al.Effects of pollen and nasal glucocorticoid on FOXP3+,GATA-3+and T-bet+cells in allergic rhinitis[J].Allergy,2007,62(9):1007-1013.
[2] Reisinger J,Triendl A,Küchler E,et al.IFN-gamma-enhanced allergen penetration across respiratory epithelium augments allergic inflammation[J].J Allergy Clin Immunol,2005,115(5):973-981.
[3] Cortelazzi C,Campanini N,Ricci R,et al.Inflammed skin harbours Th9 cells[J].Acta Derm Venereol,2013,93(2):183-185.
[4] Schlapbach C,Gehad A,Yang C,et al.Human TH9 cells are skin-tropic and have autocrine and paracrine proinflammatory capacity[J].Sci Transl Med,2014,6(219):219ra8.
[5] McLane MP,Haczku A,van de Rijn M,et al.Interleukin-9 promotes allergen-induced eosinophilic inflammation and airway hyperresponsiveness in transgenic mice[J].Am J Respir Cell Mol Biol,1998,19(5):713-720.
[6] Dugas B,Renauld JC,Pène J,et al.Interleukin-9 potentiates the interleukin-4-induced immunoglobulin(IgG,IgM and IgE) production by normal human B lymphocytes[J].Eur J Immunol,1993,23(7):1687-1692.
[7] Louahed J,Toda M,Jen J,et al.Interleukin-9 upregulates mucus expression in the airways[J].Am J Respir Cell Mol Biol,2000,22(6):649-656.
[8] Soussi-Gounni A,Kontolemos M,Hamid Q.Role of IL-9 in the pathophysiology of allergic diseases[J].J Allergy Clin Immunol,2001,107(4):575-582.
[9] Ma L,Xue HB,Guan XH,et al.Possible pathogenic role of T helper type 9 cells and interleukin(IL)-9 in atopic dermatitis[J].Clin Exp Immunol,2014,175(1):25-31.
[10] Kaplan MH.Th9 cells:differentiation and disease[J].Immunol Rev,2013,252(1):104-115.
[11] Zhao H,Cao ZW,Gu ZW,et al.Expression of IL-9 in nasal mucosa of mouse model with allergic rhinitis[J].Chinese Journal of Otorhinolaryngology Skull Base Surgery,2015,21(1):4-7.(in Chinese)
赵鹤,曹志伟,顾兆伟,等.IL-9 在变应性鼻炎小鼠模型鼻黏膜中的表达研究[J].中国耳鼻咽喉颅底外科杂志,2015,21(1):4-7.
[12] Wang SB,Deng YQ,Ren J,et al.Exogenous interleukin-10 alleviates allergic inflammation but inhibits local interleukin-10 expression in a mouse allergic rhinitis model[J].BMC Immunol,2014,15:9.
[13] Zheng Y,Guo C,Zhang Y,et al.Alleviation of murine allergic rhinitis by C19,a C-terminal peptide of chemokine-like factor 1(CKLF1) [J].Int Immunopharmacol,2011,11(12):2188-2193.
[14] Park J,Li H,Zhang M,et al.Murine Th9 cells promote the survival of myeloid dendritic cells in cancer immunotherapy [J].Cancer Immunol Immunother,2014,63(8):835-845.
[15] Goswami R,Kaplan MH.A brief history of IL-9 [J].J Immunol,2011,186(6):3283-3288.
[16] Parker JC,Thavagnanam S,Skibinski G,et al.Chronic IL-9 and IL-13 exposure leads to an altered differentiation of ciliated cells in a well-differentiated paediatric bronchial epithelial cell model[J].PLoS One,2013,8(5):e61023.
[17] Sharma SK,Almeida FA,Kierstein S,et al.Systemic FasL neutralization increases eosinophilic inflammation in a mouse model of asthma[J].Allergy,2012,67(3):328-335.
[18] Oh CK,Leigh R,McLaurin KK,et al.A randomized,controlled trial to evaluate the effect of an anti-interleukin-9 monoclonal antibody in adults with uncontrolled asthma[J].Respir Res,2013,14:93.
[19] Perumal NB,Kaplan MH.Regulating IL-9 transcription in T helper cells[J].Trends Immunol,2011,32(4):146-150.
[20] Goswami R,Kaplan MH.Gcn5 is required for PU.1-dependent IL-9 induction in Th9 cells[J].J Immunol,2012,189(6):3026-3033.
[21] Kim MS,Cho KA,Cho YJ,et al.Effects of interleukin-9 blockade on chronic airway inflammation in murine asthma models[J].Allergy Asthma Immunol Res,2013,5(4):197-206.
[22] Singh TP,Schön MP,Wallbrecht K,et al.Involvement of IL-9 in Th17-associated inflammation and angiogenesis of psoriasis[J].PLoS One,2013,8(1):e51752.
[23]Zhang L,Hu H,Chen L,et al. Allergic rhinitis and its impact on asthma control and pulmonary function[J]. Chinese Journal of Difficult And Complicated Cases,2012,11(2):98-101.(in Chinese)
张丽,胡红,陈雷,等.变应性鼻炎对哮喘患者临床控制及肺通气功能的影响[J].疑难病杂志,2012,11(2):98-101
(本文编辑:陈素芳)
Expression Levels of IL-9 and PU.1 in Nasal Mucosa of Allergic Rhinitis Mice
GUZhao-wei,ZHAOHe,CAOZhi-wei.DepartmentofOtorhinolaryngology,ShengjingHospitalAffiliatedtoChinaMedicalUniversity,Shenyang110004,China
【Abstract】ObjectiveTo investigate the expression and role of T helper cells 9(Th9)-related cytokine IL-9 mRNA/protein and transcription factor PU.1 mRNA in the nasal mucosa of allergic rhinitis(AR) mice.MethodsIn July 2014,16 Balb/c mice were selected and randomly divided into two groups with 8 mice in each group.In experimental group,mice were used for establishing the animal models of AR with ovalbumin sensitization,and at the same time,control group were administrated with 0.9% physiological saline.In each group,4 mice were randomly taken and the pathological examination showed that the model building was successful.The nasal mucosa was taken from the remaining 4 mice in each group,and IL-9 and PU.1 mRNA were detected by real-time quantitative PCR and IL-9 protein in nasal mucosa of the two groups was detected by flow cytometry.ResultsThe expression levels of IL-9 mRNA 〔(21.88±1.82)vs.(1.03±0.11)〕,PU.1 mRNA 〔(24.63±1.88)vs.(1.02±0.07)〕in the nasal mucosa of the experimental group were higher than those in the control group(P<0.05).The expression level of IL-9 protein in the nasal mucosa of the experimental group 〔(66.9±4.4)pg/ml vs.(20.9±2.1)pg/ml〕 was higher than that in the control group(P<0.05).The expression level of IL-9 mRNA was positively correlated with the expression of PU.1 mRNA in the nasal mucosa of mice(r=0.952,P<0.001).ConclusionTh9-related cytokine IL-9 and transcription factor PU.1 are involved in the development of AR.Our results may improve the understanding of the pathogenesis of AR and provide a new clue for the selection of potential target of immune regulation therapy for AR.
【Key words】Rhinitis;T-lymphocytes,helper-inducer;Interleukin-9;Transcription factors
(收稿日期:2015-09-22;修回日期:2016-01-15)
【中图分类号】R 765.21
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.12.013
通信作者:曹志伟,110004辽宁省沈阳市,中国医科大学附属盛京医院耳鼻咽喉科;E-mail:caozw2008@aliyun.com
基金项目:国家自然科学基金资助项目(30872849);国家自然科学基金青年基金项目(81200730);辽宁省自然科学基金资助项目(2014021047)

