氨氯地平和缬沙坦对人冠状动脉内皮细胞 NADPH氧 化 酶 亚 基 gp91phox和 p22phox表 达 的 影 响
卢挪挪,韩卫星,刘 超,王 成,吴继军
氨氯地平和缬沙坦对人冠状动脉内皮细胞 NADPH氧 化 酶 亚 基 gp91phox和 p22phox表 达 的 影 响
卢挪挪1,韩卫星1,刘 超2,王 成3,吴继军1
目的研究不同浓度的氨氯地平和缬沙坦对人冠状动脉内皮细胞(HCAEC)内尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚基 gp91phox和 p22phox的影响。方法对照组:体外贴壁培养 HCAEC,不进行其他干预;实验组:相同培养条件下分别加入不同浓度氨氯地平(1×10-5、1×10-6、1 ×10-7、1×10-8、1×10-9mol/L)和不同浓度缬沙坦(1× 10-4、1×10-5、1×10-6、1×10-7、1×10-8mol/L)体外培养24 h。提取各组细胞的膜 蛋白,应用 Western blot法测两组细胞中 p22phox和 gp91phox的 表 达水平,对结果 进 行 统计分析并比较。结果不同浓度氨氯地平对 HCAEC内 NADPH氧化酶亚基 p22phox表达均有促进作用(P<0.05),高浓度氨氯地平 对 gp91phox有 抑 制 作 用 (P<0.05),低 浓 度 则 会 促 进gp91phox的 表 达 (P<0.05)。 不 同 浓 度 缬 沙 坦 对 p22phox与gp91phox的表达均有显著的抑制作用(P<0.05),且有随着药物浓度增高抑制作用增强的趋势(P<0.05)。结论缬沙坦有抑制氧化应激的效力,并随浓度增高而增强,呈现浓度依赖的趋势;氨氯地平仅在高浓度时抑制部分 NADPH氧化酶亚基(gp91phox)的 表达,低浓度时 反而可能增 加 氧化应激水平。
氨氯地平;缬沙坦;人冠状动脉内皮细胞;氧化应激;p22phox;gp91phox
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和 活 性 氮自由基(reactive nitrogen species,RNS)产生过多,氧化系统和抗氧化系统失衡,从而导致组织损伤。内尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶是内皮细胞中 ROS主要来源[1]。NADPH 氧 化 酶 由 gp91phox、p22phox、p67phox、p47phox、p40phox和 Rac等 6 种 亚 基 构 成。 其 中 gp91phox和 p22phox位于细胞质 膜上,当 与胞浆 中的另外几种亚基结合时可形成有活性的 NADPH氧化酶复合体[2]。gp91phox与 p22phox是 NADPH氧化酶的主要功能亚基[3]。内皮细胞静息状态时,通过 NADPH氧化酶产生适量活性氧满足正常的代谢需求,但在高血压、高脂血症和冠心病等心血管高风险因素存在情况下,NADPH氧化酶活性明显提高[4-5]。氨氯地平和缬沙坦是治疗心血管疾病的常用药,被报道具有抗氧化应激作用。但是此两种药物降低氧化应激水平的具体途径与机制尚不明确。该研究旨在探讨氨氯地平和缬沙坦对人冠状动脉内皮细胞(human coronary artery endothelial cell,HCAEC)内 NADPH氧化酶亚基 gp91phox和 p22phox的影响。
1 材料与方法
1.1 材料
1.1.1细胞株 HCAEC购自上海拜力生物科技有限公司。
1.1.2主要试剂 胎牛血清、DMEM培养基、胰蛋白酶购自美国 Hyclone公司;小鼠抗人单克隆抗体p22phox(ab80896)、兔 抗 人 多 克 隆 抗 体 gp91phox(ab31092)购自英国 Abcam公司;小鼠抗人单克隆抗体 β-actin、辣根酶标记山羊抗小鼠 IgG、辣根酶标记山羊抗兔 IgG购自北京中杉金桥生物技术有限公司;Bradford蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;膜蛋白提取试剂盒购自南京凯基生物公司;氨氯地平和缬沙坦购自大连美仑生物技术有限公司;ECL发光试剂盒购自美国 Pierce公司;蛋白 Marker购自北京全式金公司。
1.2 方法
1.2.1HCAEC复苏、培养和传代 将水浴箱预热至37℃,做好细胞复苏前准备。从液氮中取出冻存的 HCAEC,快速放入水浴箱中,不停摇晃,使其迅速溶解。在超净台中,把溶解的细胞移入 10 ml离心管,加 DMEM完全培养液 4 ml(90%DMEM+10% FBS+青霉素 100 U/ml+链霉素 100 U/m l),1 000 r/min离心 5 min,吸去上清液,再次加入完全培养液 4 ml,轻轻吹打、重悬细胞,待细胞悬液分布均匀后吸取适当细胞悬液转入细胞培养皿,置于 37℃、5%CO2培养箱中培养。待细胞长满培养皿底面约90%,弃上清液,无菌 PBS洗 2次,加胰酶2m l,放入培养箱消化约 30 s后取出,吸去胰酶,加入完全培养液4 ml轻轻吹打,直到贴壁细胞完全脱落,吸取细胞悬液转入 10 ml离心管,步骤同上。以一定密度传代。
1.2.2HCAEC培养及药物处理 将 HCAEC以 1 ×105个/m l的密度接种到 12个直径为 100 mm细胞培养皿,待细胞铺满整个培养皿面积的 80%,吸去培养液,随机将细胞分为两组。氨氯地平组:根据所含药物浓度分为对照组、1×10-5mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L 6组;缬沙坦组:根据所含药物浓度分为对照组、1 ×10-4mol/L、1×10-5mol/L、1×10-6mol/L、1× 10-7mol/L、1×10-8mol/L 6组。分别在不同培养皿中加入含相应药物浓度的 1%FBS完全培养基,对照组加入与实验组相同体积不含药物的 1%FBS完全培养基,培养 24 h后,收取细胞备用。
1.2.3Western blot法 测 定 细 胞 膜 中 p22phox和gp91phox水平 根据膜蛋白提取试剂盒使用说明提取膜蛋白,以 Bradford法测定蛋白浓度,加入上样缓冲液,100℃水浴 5 min,置于冰上待用。SDS-聚丙烯酰胺凝胶电泳分离蛋白质,5%浓缩胶以120 V电压电泳,15%分离胶以 150 V电压电泳,待所需目的条带相应位置分开。后取出凝胶,以 300 mA恒流低温转膜 1.5 h,取出 PVDF膜,5%脱脂奶粉室温封闭 2 h,后加入相应抗体,一抗于 4℃孵育过夜,TBST洗膜 5次,每次 5 min,二抗室温孵育 2 h,再以TBST洗膜 5次,每次 5 min,压片曝光。
1.3 统计学处理应用统计软件 SPSS 13.0进行分析,数据用 ¯x±s表示;多组间样本均数的比较采用单因素方差分析,组间两两比较用 SNK-q检验,P<0.05为差异有统计学意义。Western blot结果目的条带应用软件 photoshop进行灰度计算。
2 结果
2.1 氨氯地平对HCAEC膜蛋白p22phox表达的影响各浓度组与对照组比较,差异均有统计学意义(P<0.05),随着氨氯地平浓度的降低 p22phox表达显示升高的趋势(P<0.05)。见图1。

图1 不同氨氯地平浓度对 HCAEC膜蛋白 P22phox表达的影响1:对照组;2:氨氯地平(1×10-5mol/L)组;3:氨氯地平(1× 10-6mol/L)组;4:氨氯地平(1×10-7mol/L)组;5:氨氯地平(1× 10-8mol/L)组;6:氨氯地平(1×10-9mol/L)组;与对照组比较:*P<0.05;与氨氯地平(1×10-5mol/L)组比较:#P<0.05;与氨氯地平(1×10-6mol/L)组比 较:△P<0.05;与 氨氯地平(1×10-7mol/L)组比较:▽P<0.05;与氨氯地平(1×10-8mol/L)组比较:○P<0.05
2.2 氨氯地平对HCAEC膜蛋白gp91phox表达的影响在 1×10-9~1×10-8mol/L范围内 gp91phox的表达量呈现升高趋势,与对照组以及两浓度组之间比较差异有统计学意义(P<0.05);在(1×10-7~1×10-5mol/L)浓度范围内 gp91phox表达量呈现下降趋势(P<0.05),但只有在氨氯地平浓度达到1× 10-5mol/L时与对照组比较差异有统计学意义(P<0.05)。见图2。
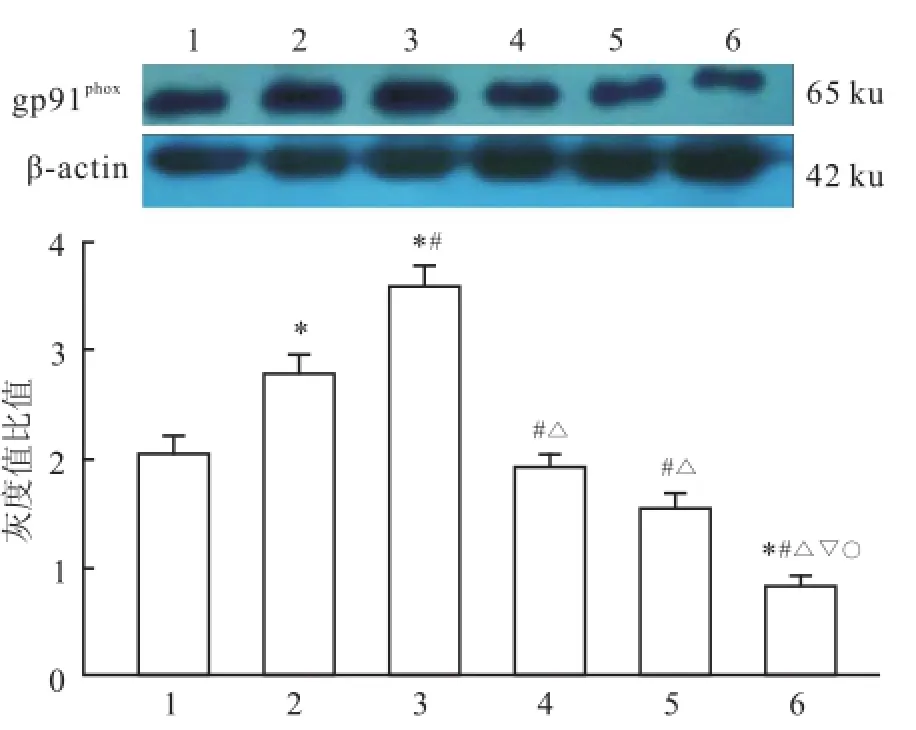
图2 不同氨氯地平浓度对 HCAEC膜蛋白 gp91phox表达的影响1:对照组;2:氨氯地平(1×10-9mol/L)组;3:氨氯地平(1× 10-8mol/L)组;4:氨氯地平(1×10-7mol/L)组;5:氨氯地平(1× 10-6mol/L)组;6:氨氯地平(1×10-5mol/L)组;与对照组比较:*P<0.05;与氨氯地平(1×10-9mol/L)组比较:#P<0.05;与氨氯地平(1×10-8mol/L)组比较:△P<0.05;与氨氯地平(1×10-7mol/L)组比较:▽P<0.05;与氨氯地平(1×10-6mol/L)组比较:○P<0.05
2.3 不同缬沙坦浓度对HCAEC膜蛋白p22phox表达的影响不同缬沙坦浓度 p22phox的表达量与对照组比较均下降,差异均有统计学意义(P<0.05);各浓度组之间变化不明显。见图3。
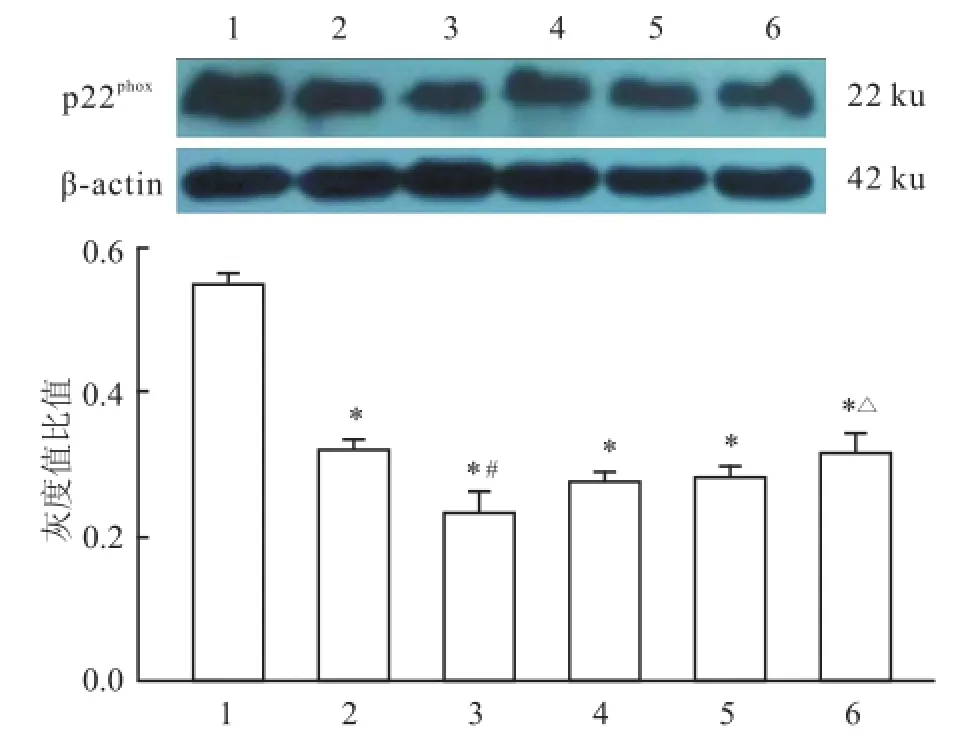
图3 不同缬沙坦浓度对 HCAEC膜蛋白 p22phox表达的影响1:对照组;2:缬沙坦(1×10-4mol/L)组;3:缬沙坦(1×10-5mol/L)组;4:缬沙坦(1×10-6mol/L)组;5:缬沙坦(1×10-7mol/L)组;6:缬沙坦(1×10-8mol/L)组;与对照组比较:*P<0.05;与缬沙坦(1×10-4mol/L)组比较:#P<0.05;与缬沙坦(1×10-5mol/L)组比较:△P<0.05
2.4 不同缬沙坦浓度对HCAEC膜蛋白gp91phox表达的影响随着缬沙坦浓度的增加,gp91phox表达量呈现下降趋势,差异有统计学意义(P<0.05)。见图4。
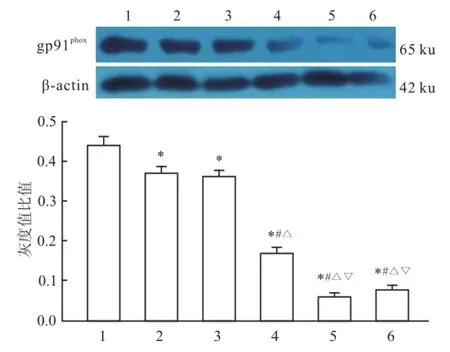
图4 不同缬沙坦浓度对 HCAEC膜蛋白 gp91phox表达的影响1:对照组;2:缬沙坦(1×10-8mol/L)组;3:缬沙坦(1×10-7mol/L)组;4:缬沙坦(1×10-6mol/L)组;5:缬沙坦(1×10-5mol/L)组;6:缬沙坦(1×10-4mol/L)组;与对照组比较:*P<0.05;与缬沙坦(1×10-8mol/L)组比较:#P<0.05;与缬沙坦(1×10-7mol/L)组比较:△P<0.05;与缬沙坦(1×10-6mol/L)组比较:▽P<0.05
3 讨论
血管内皮细胞是血管壁的重要组成部分,完成血液和组织液的物质交换,合成和分泌多种生物活性物质,保证血管正常的收缩和舒张,起到维持血管张力,调节血压以及凝血与抗凝平衡等功能,进而保持血液的正常流动和血管的长期通畅。动脉内皮细胞功能障碍可能是导致多种心血管疾病发病的始动或促进因素,在动脉粥样硬化、高血压、心力衰竭等心血管疾病中都涉及到内皮细胞的功能障碍和凋亡。冠状动脉斑块的形成以及破裂与 ROS的氧化性损伤有关,其作用于血管内皮细胞和血管平滑肌细胞,引起多种细胞因子的产生及活化,导致内皮细胞发生凋亡以及血管平滑肌细胞产生迁移,最终引起冠状动脉内斑块的形成以及破裂[6]。氧化应激反应可能是心血管疾病中内皮细胞损伤主要机制,而 NADPH氧化酶是内皮细胞产生 ROS的主要来源。本研究选取目的蛋白 gp91phox和 p22phox是 NADPH氧化酶的两个重要亚基,对反映内皮细胞内氧化应激水平有一定代表性。氨氯地平和缬沙坦是临床上常用的降血压药物,两种药物的临床降压疗效已得到肯定。国内外很多临床和基础研究都提示氨氯地平和缬沙坦有抗动脉粥样硬化的作用,氨氯地平是一类长效钙通道阻滞剂,是由左、右旋对映异构体等比组成的外消旋体化合物,CAMELOT和 PREVENT研究均显示氨氯地平可以延缓冠状动脉粥样硬化的进展[7-8]。对高血脂兔的研究[9]显示氨氯地平能够降低心脏和血液中氧化应激和改善血脂水平。对卒中型自发性高血压大鼠的研究[10]表明氨氯地平通过恢复 Cu/ZnSOD活性起到抗动脉硬化作用。对自发性大鼠的肾皮质的研究[11]表明氨氯地平对 NADPH氧化酶亚基的表达无影响。缬沙坦是特异性的血管紧张素Ⅱ(AT1)受体拮抗剂,ARB类药物可以降低氧化应激水平[12]。临床中运用 ARB类与他汀类药物联合用药治疗心血管系统疾病,可以更好的降低组织的氧化应激水平,比两者单独使用更加有效[13]。研究[14]显示厄贝沙坦和氨氯地平的临床剂量联合治疗能显著防止冠状动脉粥样硬化病变的形成和 AMI的发病率,改善了小鼠的预后。研究[15]表明缬沙坦能有效抵消高血压相关的血脂异常和氧化应激,并可逆转所有与高血压有关的脂质变化和氧化还原变化,尤其是在高血压伴有高甘油三酯血症和严重氧化应激状态的患者。因此,缬沙坦作为临床常用的 ARB类药物有降低氧化应激的作用。
本研究是系列研究课题中的初步试验,旨在了解不同浓度的缬沙坦和氨氯地平对氧化应激的影响,结果表明缬沙坦可以显著降低 NADPH氧化酶gp91phox和 p22phox亚基的表达,在一定 浓度范 围内随着缬沙坦浓度的增高抗氧化应激能力增强,呈浓度依赖性,提示缬沙坦有抗氧化应激的作用。本试验结果还显示氨氯地平仅在高浓度时对 gp91phox有抑制作用,而对 p22phox亚基无抑制作用,低浓度时对gp91phox和 p22phox亚基均有促 进增加 的作用,表明氨氯地平抗氧化应激作用不强,且与浓度有关,适当的浓度才能对部分 NADPH亚基(gp91phox)有抑制作用,低浓度的氨氯地平可能会促进氧化应激的发生。由此试验结果也可以解释既往报道的氨氯地平有抗氧化应激作用和无抗氧化应激作用的矛盾结果,可能与不同研究的设计、目的指标和药物浓度有关。
本研究局限于实验室基础研究,细胞的体外培养不能完全反应正常机体的情况,而且,缺少对NADPH氧化酶其他亚基的研究。因此,尚需进行进一步研究验证,并探讨缬沙坦抗氧化应激的可能机制。
[1]Deng B,Xie S,Wang J,et al.Inhibition of protein kinase Cβ(2)prevents tumor necrosis factor-α-induced apoptosisand oxidative stress in endothelial cells:the roleof NADPH oxidase subunits[J].JVasc Res,2012,49(2):144-59.
[2]Gardiner G J,Deffit SN,McLetchie S,et al.A role for NADPH oxidase in antigen presentation[J].Front Immunol,2013,4:295.
[3]Selemidis S,Sobey C G,W ingler K,et al.NADPH oxidases in the vasculature:molecular features,roles in disease and pharmacological inhibition[J].Pharmacol Ther,2008,120(3):254-91.
[4]Souza H P,Laurindo FR,Ziegelstein R C,et al.Vascular NAD(P)H oxidase is distinct from the phagocytic enzyme and modulates vascular reactivity control[J].Am JPhysiol Heart Circ Physiol,2001,280(2):H658-67.
[5]Jones SA,O′Donnell V B,Wood JD,et al.Expression of phagocyte NADPH oxidase components in human endothelial cells[J]. Am JPhysiol,1996,271(4 Pt2):H1626-34.
[6]王 成,韩卫星,吴继军,等.缬沙坦对人冠脉内皮细胞氧化应激过程中 gp91Phox的影响[J].安徽医科大学学报,2014,49(6):739-42.
[7]Zhang X P,Loke K E,Mital S,etal.Paradoxical release of nitric oxide by an L-type calcium channel antagonist,the R+enantiomer of am lodipine[J].JCardiovasc Pharmacol,2002,39(2):208-14.
[8]Nissen SE,Tuzcu EM,Libby P,etal.Effectofantihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure:the CAMELOT study:a randomized controlled trial[J].JAMA,2004,292(18):2217-25.
[9]Salehi I,MohammadiM,Mirzaei F,et al.Amlodipine attenuates oxidative stress in the heart and blood of high-cholesterol diet rabbits[J].Cardiovasc JAfr,2012,23(1):18-22.
[10]Umemoto S,Tanaka M,Kawahara S,etal.Calcium antagonist reduces oxidative stress by upregulating Cu/Zn superoxide dismutase in stroke-prone spontaneously hypertensive rats[J].Hypertens Res,2004,27(11):877-85.
[11]Fan Y Y,Kohno M,Nakano D,et al.Cilnidipine suppresses podocyte injury and proteinuria in metabolic syndrome rats:possible involvementof N-type calcium channel in podocyte[J].JHypertens,2010,28(5):1034-43.
[12]Aoyama T,Minatoguchi S.The effectof ARB on prevention ofatherosclerosis[J].Nihon Rinsho,2011,69(1):92-9.
[13]Kim-Mitsuyama S.Pharmacological characteristicsof ARB and potential strategy to develop novel ARB[J].Nihon Rinsho,2009,67(4):812-8.
[14]Uchida T,Furuno Y,Tanimoto A,et al.Development of an experimentally usefulmodel of acutemyocardial infarction:2/3 nephrectomized triple nitric oxide synthases-deficient mouse[J].J Mol Cell Cardiol,2014,77:29-41.
[15]El Hassar C,Merzouk H,Merzouk S A,et al.Long-term use of angiotensinⅡ receptor antagonists and calcium-channel antagonists in Algerian hypertensive patients:effects on metabolic and oxidative parameters[J].Free Radic Biol Med,2015,79:147-53.
Effect of am lodipine and valsartan on expression of the NADPH oxidase subunits gp91phoxand p22phoxin human coronary artery endothelial cell
Lu Nuonuo1,Han Weixing1,Liu Chao2,et al
(1Dept of Cardiovascular Medicine,The First Affiliated Hospital of Anhui Medical University,Hefei 230032;2Dept of Histology and Embryology,AnhuiMedical University,Hefei 230032)
Objective To study the effect of amlodipine and valsartan on expression of Nicotinamide adenine dinu-cleotide phosphate(NADPH) oxidase subunits gp91phoxand p22phoxin human coronary artery endothelial cells(HCAEC).Methods HCAEC were preincubated for 24 h,and the control group remained untreated,and the test groupswere treated with different concentrations of am lodipine(1×10-5,1×10-6,1×10-7,1×10-8,1×10-9mol/L)and different concentrations of valsartan(1×10-4,1×10-5,1×10-6,1×10-7,1×10-8mol/L).The NADPH oxidase subunits protein expression were assessed by Western blot analysis.Results Expressions of gp91phoxand p22phoxwere significant in the experimental group and the control group.Am lodipine induced the expession of NADPH oxidase subunit p22phox(P<0.05).High concentrations of amlodipine significantly reduced expression of gp91phox,while low concentration promoted the expression of gp91phox(P<0.05).p22phoxand gp91phoxwere significantly inhibited by valsartan(P<0.05),and the higher the concentration of valsartan,the greater the inhibiton(P<0.05).Conclusion Valsartan can inhibit oxidative stress.The higher the concentration,the greater the inhibition.Amlodipine suppresses part of NADPH oxidase subunit(gp91phox)only at high concentrations,but it may increase oxidative stress in low concentrations.
am lodipine;valsartan;human coronary artery endothelial cell;xidative stress;p22phox;gp91phox
R 541.4;R 972+.4
A
1000-1492(2016)02-0176-05
时间:2016-1-20 10:32:26
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.012.htm l
2015-11-17接收
国家自然科学基金(编号:81070210)
1安徽医科大学第一附属医院心血管内科,合肥 230032
安徽医科大学2基础医学院组织与胚胎学教研室、3第一临床学院诊断学教研室,合肥 230032
卢挪挪,女,硕士研究生;
韩卫星,女,教授,主任医师,博士生导师,责任作者,E-mail:ayhwx57@163.com

