胸腺素 β4对大鼠骨髓源性内皮祖细胞功能的影响
刘 杰,杜怡斌,张 辉,李小波,王少斌,尹宗生
胸腺素 β4对大鼠骨髓源性内皮祖细胞功能的影响
刘 杰1,杜怡斌1,张 辉1,李小波1,王少斌2,尹宗生1
目的观察梯度浓度胸腺素 β4(Tβ4)对大鼠骨髓源性内皮祖细胞(EPCs)生物学行为的影响。方法设置梯度浓度的 Tβ4分别处理 EPCs,同时在统一浓度下干预不同时间后进行细胞功能学实验。采用 CCK-8细胞增殖试剂盒检测靶细胞的增殖能力,Transwell细胞迁移检测靶细胞迁移能力以及黏附能力。结果Tβ4能够显著增强体外培养 EPCs的增殖、迁移和黏附能力,并且呈现一定的量效关系,与对照组相比,在 1 000 ng/m l时其增殖、迁移及黏附能力均显著增强(P<0.05)。在 1 000 ng/m l时随着干预时间的推移,各时间点的 EPCs增殖能力均显著增强且优于对照组(P<0.05);与对照组相比,黏附能力在 48 h达到最大效应(P<0.05)。结论Tβ4可增强体外培养的 EPCs的功能,并且呈现一定的量效关系,1 000 ng/m l Tβ4预处理 48 h可获得最优效应。
内皮祖细胞;胸腺素 β4;增殖;迁移;黏附
内皮 祖细胞 (endothelial progenitor cells,EPCs)是一种能够分化为成熟内皮细胞,有自我增殖、向缺血区域“归巢”、促进内皮修复及新生的潜能[1]。神经损伤研究[1-2]显示 EPCs能够分泌多种细胞因子促进神经生发,减轻炎症反应。研究[3]表明 EPCs移植治疗脑损伤能够显著减少神经胶质细胞生成,减轻炎症反应,促进神经功能恢复。然而 EPCs功能的不完整和数量的缺乏等问题严重制约着这一策略在脊髓损伤(spinal cord injury,SCI)治疗中的应用。胸腺素 β4(thymosin beta4,Tβ4)系由 43个氨基酸组成的高度保守的多肽[4],能够与 G肌动蛋白结合调节其聚合反应,介导血管及神经轴突再生、抑制炎症反应等功能。研究[5]表明,Tβ4可增强多种干细胞的增殖、迁移及黏附、分化等功能。该实验拟观察 Tβ4对大鼠骨髓源性 EPCs增殖、迁移及黏附能力的影响,为后续实验性的 EPCs移植治疗 SCI提供实验基础。
1 材料与方法
1.1 实验动物SPF级 SD大鼠 90~100 g,雌雄不限,购自安徽省实验动物中心。
1.2 主要仪器及试剂CD133抗体、VEGFR-2抗体购自美国 Biorbyt公司;Dil标记的乙酰化低密度脂蛋白(Dil-ac-LDL)购自美国 Invitrogen公司;异硫氰酸荧光素荆豆凝集素-1(FITC-UEA-1)购自美国Sigma公司;Transwell(孔径为 8μm)购自美国 Corning公司;重组胸腺肽 β-4(Recombinant)购自美国Peprotech公司;EGM-2完全培养基购自瑞士 Lonza公司;鼠纤维连接蛋白(Rat FN)购自瑞士 Gene Operation公司;大鼠淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;免疫荧光二抗均购自北京中杉金桥生物技术有限公司;CCK-8细胞增殖试剂盒(Cell Counting Kit)购自南京诺唯赞生物科技有限公司。
1.3 方法
1.3.1EPCs的分离、培养及鉴定
1.3.1.1EPCs的分离及 培养 参照 文献[1,6]方法,脱颈椎处死大鼠,无菌条件下取出完整的双下肢股骨及胫骨,暴露骨髓腔并用 F液反复冲洗,收集后以 1 800 r/min离心 20 min,弃上清液,5 m l F液 1 800 r/min离心 20 min。另取一无菌离心管量取 C液 5 ml,将上述离心所得液体弃上清液,以 5 m l全血组织稀释液重悬后逐滴缓慢滴加于上述C液之上,1 500 r/min,离心 25 min(第 20 min时关闭电源待其自然静止)。小心吸取单个核细胞层,细胞洗涤液洗涤 2次,EGM-2完全培养基重悬并计数,接种于预先以 FN(10μg/ml)包被的 24孔板中,37℃、5%CO2温箱培养,48 h后首次换液弃上清液祛除未贴壁细胞,隔3 d换液1次,细胞融合达90%以上即可传代。
1.3.1.2EPCs免疫细胞化学 CD133及 VEGFR-2双抗体荧光检测 参考文献[1,6]方法,取细胞融合达到 90%以上的 EPCs,PBS漂洗 3遍,免疫染色固定液固定 20 min;PBS漂洗,0.3%TritonX-100破膜10 min;PBS漂洗,10%山羊血清封闭 1 h;PBS漂洗,加入 CD133(1∶100)及 VEGFR-2(1∶100)一抗,4℃冰箱过夜;PBS漂洗,滴加相对应二抗(1∶100),37℃避光孵育 1 h;PBS漂洗,加入终浓度 10 μg/ml Hoechst33342核染 5 min;PBS漂洗,抗荧光淬灭液封片,免疫荧光倒置显微镜观察。
1.3.1.3EPCs的 FITC-UEA-1和 Dil-ac-LDL荧光检测 参考文献[1,6]方法,取细胞融合达到 90%以上的 EPCs,PBS漂洗,加入 10μg/m l的 Dil-ac-LDL,37℃避光孵育 4 h;PBS漂洗,免疫染色固定液固定20 min;PBS漂洗,加入 10μg/ml的 FITC-UEA-1,37℃避光孵育 1 h;PBS漂洗,抗荧光淬灭液封片,免疫荧光倒置显微镜观察。
1.3.2EPCs体外细胞功能学实验分组 Tβ4梯度浓度组:终浓度分别为 1 000 ng/ml(T1000)、100 ng/m l(T100)、10 ng/m l(T10)、1 ng/m l(T1)的条件培养基;对照组:含 10%胎牛血清的 EGM-2完全培养基(T0)。
1.3.3CCK-8法测定 EPCs增殖能力 参考文献[7]方法,取原代培养 7 d的细胞,0.25%胰蛋白酶消化收集贴壁细胞,EGM-2完全培养基重悬并计数,以 1×105个/m l的密度接种于预先以 FN包被的 96孔板,每孔 100μl,37℃温箱过夜使细胞贴壁。加入梯度浓度的 Tβ4条件培养基(分组见前述)干预 24 h,每组设 6个复孔,并设置对照组(完全培养基和细胞)和空白组(完全培养基)。温箱孵育 24 h,每孔加入 10μl CCK-8继续孵育 4 h后肉眼观察显色程度,并用酶标仪检测450 nm处的光密度(optical delnsity,OD)值。参考文献[7-8]方法,消化收集细胞同上,1×105个/ml的密度接种于预先以FN包被的 96孔板,每孔 100μl,37℃温箱过夜使细胞贴壁。加入含 1 000 ng/ml Tβ4条件培养基分别干预 24、48、72 h,每组设 6个复孔,并设置对照组和空白组。温箱孵育,每孔加入 10μl CCK-8继续孵育4 h后肉眼观察显色程度,并用酶标仪检测450 nm处的 OD值。
1.3.4EPCs迁移实验 参考文献[9]方法,消化收集细胞并调整浓度 5×105个/ml备用,将梯度浓度的 Tβ4条件培养基加入 Transwell的下室(600μl/孔),100μl细胞悬液加入 Transwell的上室,然后将上室小心地挂入已加培养液的下室,温箱培育 6 h。小心刮除滤膜内面未迁移的细胞,免疫染色固定液固定 20 min,加入终浓度 10μg/ml Hoechst33342核染 5 min,PBS漂洗,免疫荧光倒置显微镜观察并计数迁移到滤膜外面的细胞。
1.3.5EPCs黏附能力 参考文献[8]方法,培养第7天时加入梯度浓度的 Tβ4条件培养基继续干预24 h,消化收集贴壁细胞并计数。接种相同数目的EPCs于预先包被的培养板中,温箱培育 30 min,洗去未贴壁细胞,倒置显微镜下观察并计数。参考文献[8]方法,于末次换液时加入含 1 000 ng/ml Tβ4条件培养基分别干预 24、48、72 h,消化收集贴壁细胞并计数。接种相同数目的 EPCs于预先包被的培养板中,温箱培育 30 min,洗去未贴壁细胞,倒置显微镜下观察并计数。
1.4 统计学处理采用 SPSS 13.0软件进行分析,计量资料以 ¯x±s表示,各组间比较采用 ANOVA检验,两两比较采用 SNK法检验,检验水准 α=0.05。各组实验重复3~5次。
2 结果
2.1 EPCs的培养及鉴定原代分离的单个核细胞呈圆形,体积较小,约 7 d呈纺锤样,条索状排列生长的内皮样细胞形态特征;收集生长良好的第2代 EPCs行 CD133和 VEGFR-2双抗体荧光染色以及结合 FITC-UEA-1和摄取 Dil-ac-LDL荧 光检测,可见目的细胞 CD133和 VEGFR-2抗原表达阳性,结合 FITC-UEA-1和摄取 Dil-ac-LDL表达阳性(图1),表明目的细胞为典型的 EPCs。
2.2 Tβ4对骨髓源性EPCs增殖活性的影响
2.2.1CCK-8法检测梯度 Tβ4对骨髓源性 EPCs增殖活性的影响 方差分析结果显示,与对照组相比,Tβ4能够显著增强骨髓源性 EPCs的活性(F= 49.96,P<0.01),呈一定的剂量效应关系,两两比较结果显示在 1 ng/ml Tβ4作用时与对照组相比差异无统计学意义[(0.31±0.14)vs(0.30±0.12)];与对照组相比,在 1 000 ng/ml Tβ4时作用最为显著(0.40±0.13 vs0.30±0.12,P<0.05)。见图2。
2.2.2CCK-8法检测不同时间点 Tβ4(1 000 ng/m l)对骨髓源性 EPCs增殖活性的影响 结果显示在 1 000 ng/ml Tβ4条件培养基下随着培养时间的延长,实验组与对照组 EPCs增殖能力均增强,且各时间点实验组均明显优于对照组。与对照组相比,在 72 h达到最大效应(0.53±0.19 vs0.39±0.23,P<0.05)。见图3。
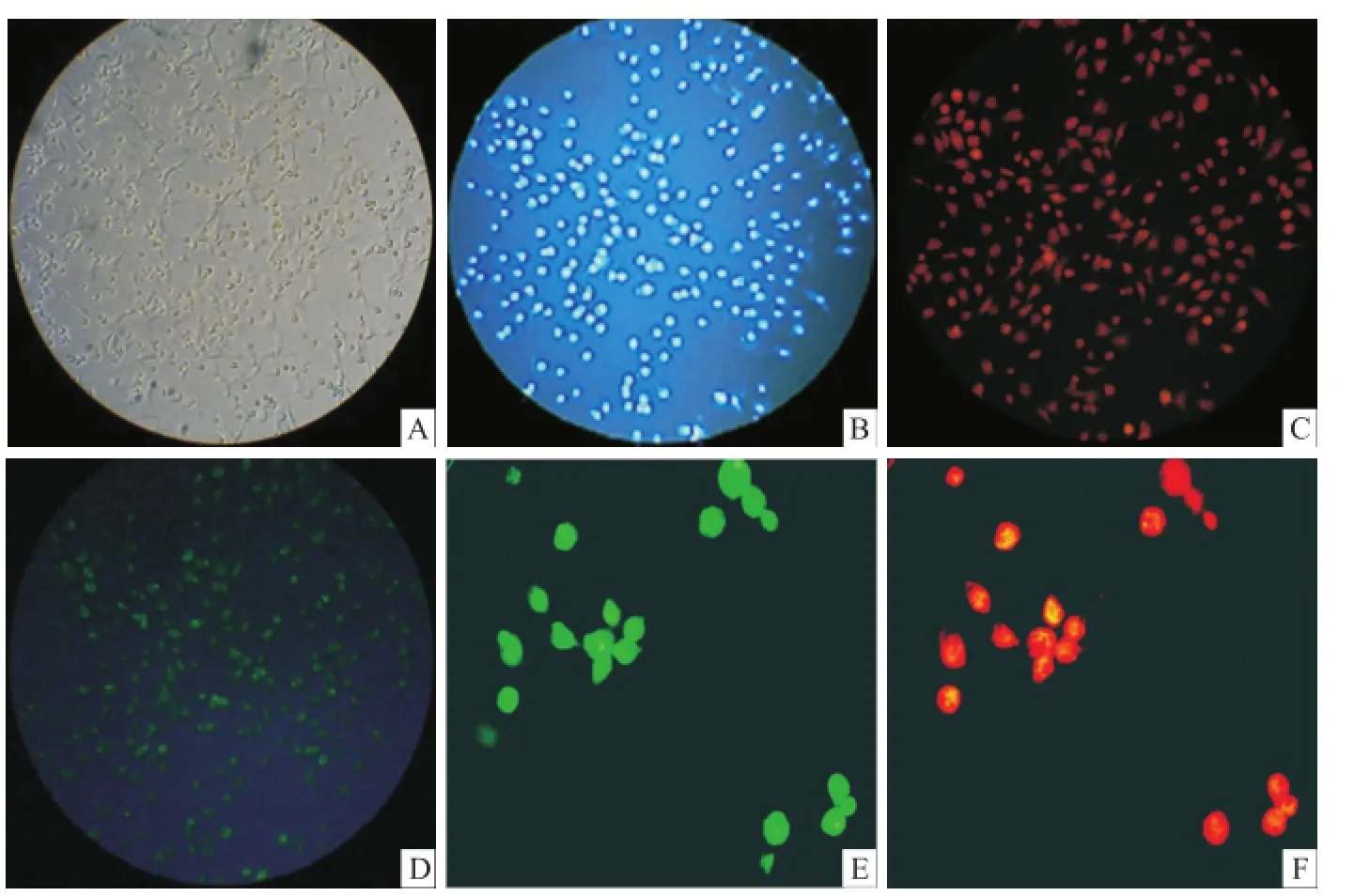
图1 EPCs形态学鉴定A:原代培养 EPCs7 d纺锤形分化贴于孔底 ×100;B:Hoechst33342细胞核染,阳性 ×100;C:TRITC标记的 CD133染色,阳性 ×100;D:FITC标记的 VEGFR-2染色,阳性 ×100;E:结合 FITC-UEA-1能力,阳性 ×200;F:摄取 Dil-ac-LDL能力,阳性 ×200
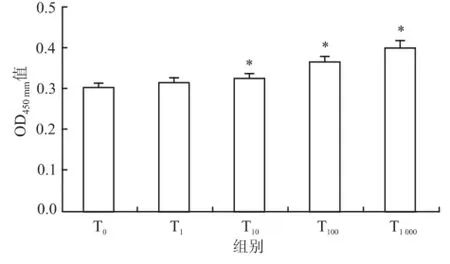
图2 梯度浓度 Tβ4处理 EPCs与对照组比较:*P<0.05
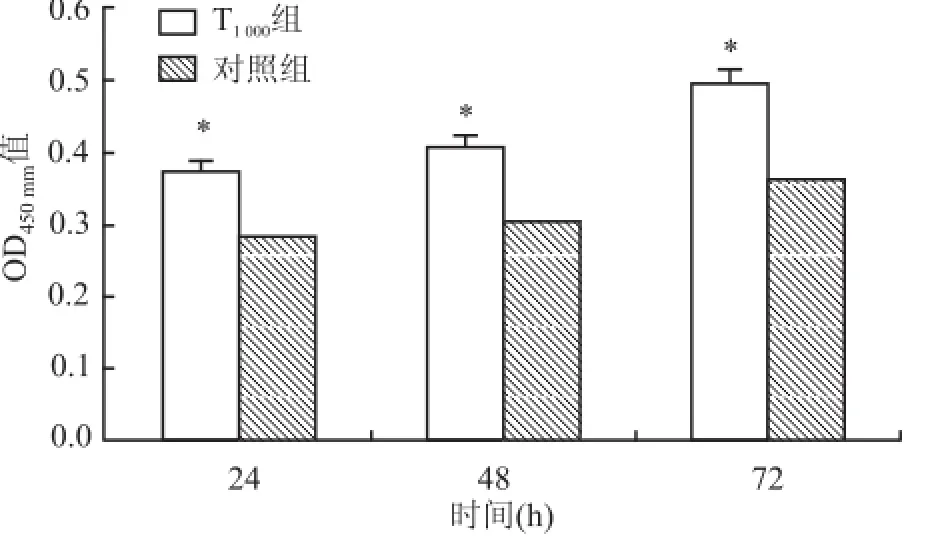
图3 Tβ4(1 000 ng/m l)不同时 长处 理 EPCs与对照组比较:*P<0.05
2.3 Transwell法检测Tβ4对骨髓源性EPCs迁移能力的影响方差分析结果显示,与对照组相比,Tβ4能够显著增强骨髓源性 EPCs的迁移活性(F= 156.42,P<0.05),且呈一定的剂量效应关系,两两比较结果显示各组与对照组相比差异均有统计学意义,且在 1 000 ng/ml Tβ4时作用最为显著[(74.44 ±9.32)vs(13.11±4.01),P<0.01]。见图4、5。
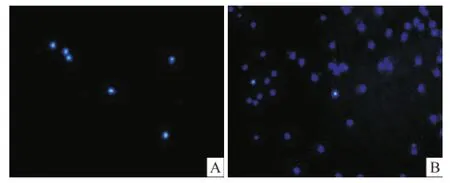
图4 Hoechst33342核染 ×100A:对照组随机选取一个视野下的迁移细胞;B:T1000组随机选取一个视野下的迁移细胞
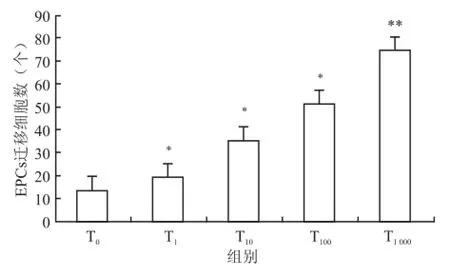
图5 梯度浓度 Tβ4处理下 EPCs迁移能力与对照组比较:*P<0.05,**P<0.01
2.4 梯度浓度Tβ4干预24 h对骨髓源性EPCs黏附能力的影响方差分析结果显,与对照组相比,Tβ-4能够显著增强骨髓源性 EPCs的黏附活性(F =111.74,P<0.05),且呈一定的剂量效应关系,两两比较结果显示各组与对照组相比均有统计学差异,与对照组相比,在 1 000 ng/ml Tβ-4时作用最为显著(42.00±6.64 vs17.38±2.89,P<0.01)。见图6、7。
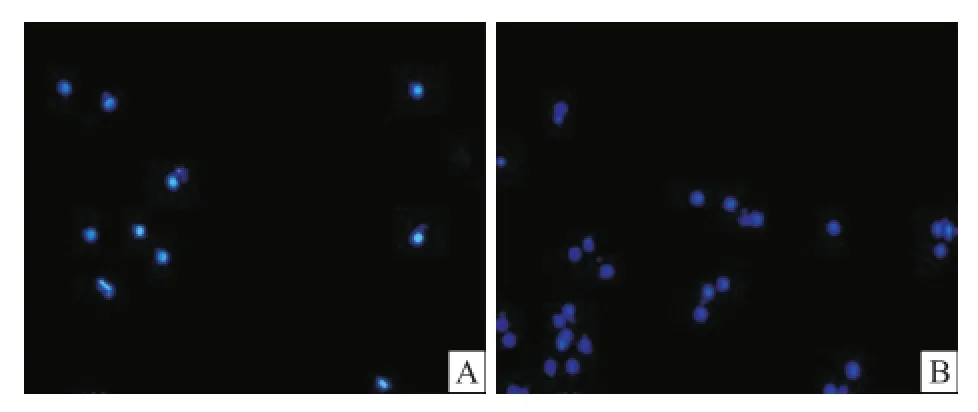
图6 Hoechst33342核染 ×100A:对照组随机选取一个视野下的黏附细胞;B:T1000组随机选取一个视野下的黏附细胞
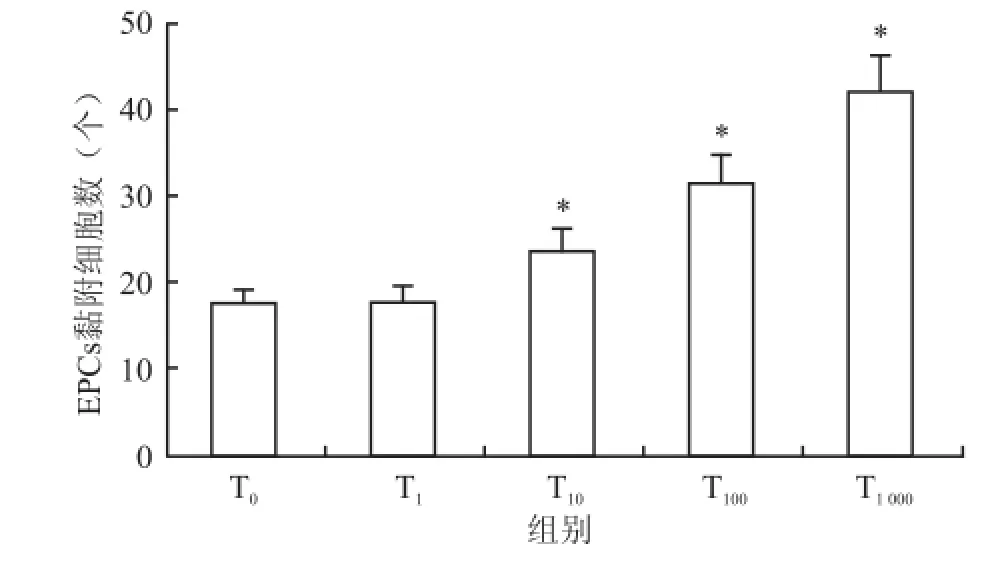
图7 梯度浓度 Tβ4处理下 EPCs黏附能力对比 ×100与对照组比较:*P<0.05
2.5 不同时间点Tβ4(1 000 ng/m l)对骨髓源性EPCs黏附能力的影响在1 000 ng/ml Tβ4条件培养基下随着干预时间的增加,EPCs的黏附能力表现为先增高后减低,48 h作用最为显著,与对照组相比差异有统计学意义[(50.04±5.38)vs(29.92± 4.37),P<0.05]。见图8。
3 讨论
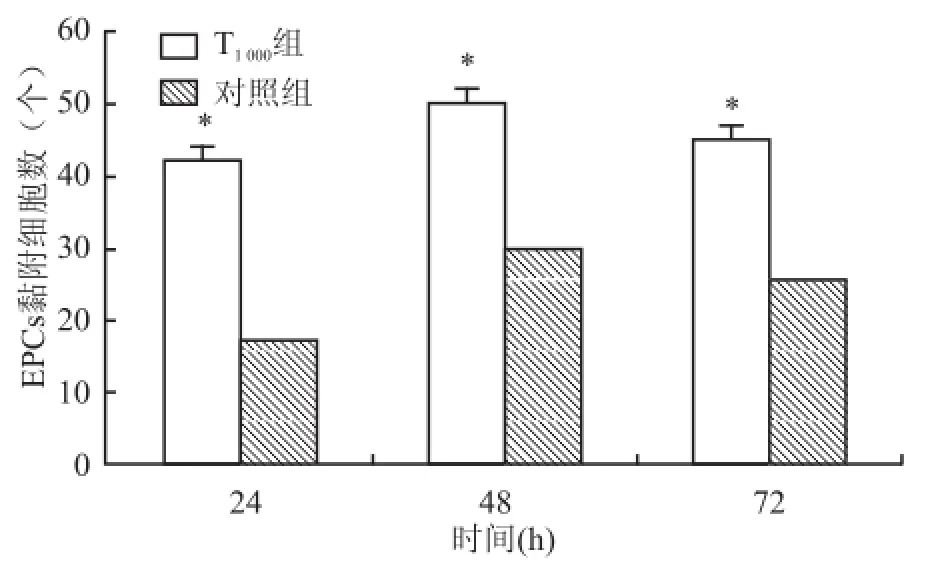
图8 不同 时间 点 Tβ4(1 000 ng/m l)对骨髓源性EPCs黏附能力的影响 ×100与对照组比较:*P<0.05
NSC移植治疗 SCI一直以来都是研究的热点,然而,大量实践表明移植的 NSC大部分分化为星形胶质细胞参与瘢痕形成,神经元生发的比例很低[10]。随着研究的深入,有学者[11]发现,脊髓本身含有一定数目的 NSC(内源性 NSC)。它规避了外源性NSC所面临的诸如来源受限、伦理学问题及免疫排异反应等多种应用难题,成为中枢神经系统损伤修复天然“原材料”的最佳来源,其重要性正被越来越多的专家学者所正视。最新研究[12]表明 NSC移植治疗 SCI是通过改变局部微环境,通过对内源性 NSC的“移植性诱导神经生发”作用,促进损伤部位神经功能的重建。就本质而言即移植的外源性NSC通过分泌神经营养因子及发挥免疫调节等作用,创造无数个“热点区域”,富集周围的内源性NSC并使之活化,协同增强神经组织的再生修复能力。可见,这种“内生外源性微环境”的改变对 NSC的定向分化至关重要。
EPCs系一群能够增殖分化为幼稚内皮细胞的前体细胞,它能够向缺血区域定向“归巢”,有明显促进血管内皮新生及修复的作用。研究[13]表明在急性心梗等实验模型中,通过输注 EPCs可促进缺血部位血运重建、改善左室功能和延缓动脉粥样硬化进程。脑损伤的研究[5,14]表明神经生发往往于血管生发之后,血管生发为神经生发提供了良好的支持与辅助,二者相辅相成,它们所处的环境称为神经血管微环境。EPCs经静脉输注后在损伤部位聚集并分化为血管内皮细胞,参与构建新生血管,大大改善了受损部位的局部微环境,不仅稀释了炎症反应所产生的大量抑制神经干细胞分化的炎性介质,减轻炎症反应,同时 EPCs能够分泌诸如血管内皮生长因子等细胞因子协同 NSC的增殖和分化,表现出明显的神经保护作用。然而上述功能的执行,有赖于 EPCs功能的完整和数目的完备,因而,增强EPCs的生物学效应显得尤为重要。
目前发现,诸多细胞因子、激素及药物等[14]都能够参与动员 EPCs、增强其生物学效应的。Tβ4作为一种多功能多肽,介导多种生物学效应诸如血管及神经轴突再生、伤口愈合和抑制炎症反应等功能。Morrisetal[15]报道了 Tβ4能够通过动员少突胶质细胞生成髓鞘的方式促进脑卒中大鼠神经功能的恢复,同时伴随着微血管密度的增加。
本研究显示外源性 Tβ4能够增强骨髓源性EPCs的多种生物学活性。目前,在 EPCs移植中所面临的一个突出的问题即是数目的不足,因而移植到损伤局部的 EPCs无法发挥应有的生物学效应,本研究表明梯度浓度的 Tβ4对 EPCs的增殖能力有明显的促进作用,且与作用浓度及作用时间呈正相关,1 000 ng/ml作用时间 72 h取得最大效应,这与EPCs传代的初期 1~2 d表现为明显的“潜伏抑制”状态,而3~4 d进入指数增长期的生长曲线相符。此外 EPCs有向缺血区域迁移“归巢”的能力,其功能的行使有赖于黏附和迁移能力,本实验表明梯度浓度的 Tβ4对 EPCs的黏附及迁移有明显的促进作用,与作用浓度呈正相关。黏附能力的实验显示,随着作用时间的推移,Tβ4对其黏附能力表现为先促进后抑制的效应,1 000 ng/ml作用 48 h达到最大效应。
综上所述,Tβ4能够增强骨髓源性 EPCs的多种生物学活性诸如增殖、黏附和迁移的能力,而这些功能直接影响 EPCs向损伤部位 “归巢”、促进血管新生、改善局部微环境及协同促进神经功能恢复的作用。因此,本研究进一步认识了 Tβ4的生物学效应,并通过 Tβ4干预增强 EPCs的功能,从而改善EPCs移植治疗中枢神经系统损伤这一策略的有效性,为推动 EPCs移植为主体的治疗手段在临床中的应用提供更为广泛的思路。
[1]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-7.
[2]King A,Balaji S,Keswani SG,et al.The role of stem cells in wound angiogenesis[J].Adv Wound Care(New Rochelle),2014,3(10):614-25.
[3]Xue S,Zhang H T,Zhang P,et al.Functional endothelial progenitor cells derived from adipose tissue show beneficial effect on cell therapy of traumatic brain injury[J].Neurosci Lett,2010,473(3):186-91.
[4]Kim S,Kwon J.Thymosin beta 4 improves dermal burn wound healing via downregulation of receptor of advanced glycation end products in db/db mice[J].Biochim Biophys Acta,2014,1840(12):3452-9.
[5]Yang X T,Bi Y Y,Feng D F.From the vascularmicroenvironment to neurogenesis[J].Brain Res Bull,2011,84(1):1-7.
[6]Amini A R,Laurencin C T,Nukavarapu SP.Differential analysis of peripheral blood-and bonemarrow-derived endothelial progenitor cells for enhanced vascularization in bone tissue engineering[J].J Orthop Res,2012,30(9):1507-15.
[7]Qiu F Y,Song X X,Zheng H,et al.Thymosin beta4 induces endothelial progenitor cellmigration via PI3K/Akt/eNOS signal transduction pathway[J].JCardiovasc Pharmacol,2009,53(3):209 -14.
[8]Wang X,Chen J,Tao Q,et al.Effects of ox-LDL on number and activity of circulating endothelial progenitor cells[J].Drug Chem Toxicol,2004,27(3):243-55.
[9]Garcia-Vicuna R,Gomez-Gaviro M V,Dominguez-Luis M J,et al.CC and CXC chemokine receptorsmediatemigration,proliferation,and matrixmetalloproteinase production by fibroblast-like synoviocytes from rheumatoid arthritis patients[J].Arthritis Rheum,2004,50(12):3866-77.
[10]沈 政,尹宗生,高维陆,等.脊髓损伤后反应性星形胶质细胞的分离培养及多能性鉴定[J].安徽医科大学学报,2012,47(6):638-41.
[11]Obermair F J,Schroter A,Thallmair M.Endogenous neural progenitor cells as therapeutic target after spinal cord injury[J]. Physiology(Bethesda),2008,23:296-304.
[12]Jin K,Xie L,Mao X,etal.Effectofhuman neuralprecursor cell transplantation on endogenous neurogenesis after focal cerebral ischemia in the rat[J].Brain Res,2011,1374:56-62.
[13]Rufaihah A J,Haider H K,Heng B C,et al.Therapeutic angiogenesis by transplantation of human embryonic stem cell-derived CD133+endothelial progenitor cells for cardiac repair[J].Regen Med,2010,5(2):231-44.
[14]Xiong Y,Mahmood A,Chopp M.Neurorestorative treatments for traumatic brain injury[J].Discov Med,2010,10(54):434-42.
[15]Morris D C,Chopp M,Zhang L,et al.Thymosin beta4 improves functional neurological outcome in a rat model of embolic stroke[J].Neuroscience,2010,169(2):674-82.
Effects of thymosin beta4 on activity of bonemarrow-derived endothelial progenitor cells
Liu Jie,Du Yibin,Zhang Hui,et al
(Dept of Orthopedics,The First Affiliated Hospital of AnhuiMedical University,Hefei 230032)
Objective To investigate the effects of thymosin beta4(Tβ4)on biological behaviors of bonemarrow-derived endothelial progenitor cells(EPCs).Methods First,EPCswere stimulated by Tβ4 with different concentration gradients,then processed by Tβ4 with the same concentration for gradient time.The capacities of proliferation,migration and adhesion were determined by CCK-8 assay,Transwellmigration assay and adhesion assay respectively.Results We found Tβ4 could significantly enhance the proliferative,migratory and adhesive capacities of EPCs,the effects of experimentgroup were significantwith the concentration of1 000 ng/m lwhen compared with the control group(P<0.05).As time went by,the proliferative capacity of experiment group was better than the control group ateach time point(P<0.05);the adhesive capacity was themost significantat the time pointof48 h when compared with the control group(P<0.05).Conclusion These results suggest that Tβ4 can increase the proliferative,migratory and adhesive capacities of EPCs,preprocessing with Tβ4(1 000 ng/ml)for 48 h can obtain the optimal effect.
endothelial progenitor cells;thymosinβ4;proliferation;migration;adhesion
R 681.54
A
1000-1492(2016)02-0166-06
时间:2016-1-20 10:32:26
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.008.htm l
2015-11-11接收
国家自然科学基金(编号:81171173);安徽省自然科学基金(编号:11040606Q25)
1安徽医科大学第一附属医院关节与骨肿瘤科,合肥230032
2安徽医科大学第四附属医院骨科,合肥 230032
刘 杰,男,硕士研究生;
尹宗生,男,主任医师,教授,博士生导师,责任作者,E-mail:yinzongsheng1961@126.com

