果葡糖浆生产过程中常见污染微生物的鉴定
李存治,毛灵琪,闫达中
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
果葡糖浆生产过程中常见污染微生物的鉴定
李存治,毛灵琪,闫达中
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
摘要:针对某企业生产的果葡糖浆在生产过程中出现的产品微生物污染情况,通过对生产果葡糖浆的不同环节取样进行微生物检测,对主要污染菌进行16S rDNA或26S rDNA D1/D2区域序列分析比对,鉴定为杆菌和酵母。通过污染微生物鉴定结果,结合实际生产过程中的情况,从不同生产环节入手,最后确定出污染源,从而为有效地控制生产工艺过程中潜在的微生物危害提供帮助。
关键词:果葡糖浆;污染源分析;菌种鉴定;杆菌;酵母
1引言
果葡糖浆是以酶法糖化淀粉得到的糖化液,经葡萄糖异构酶的作用后,将其中的部分葡萄糖异构成果糖[1]。随着国内市场对果葡糖浆需求的不断增加,对产品质量要求也不断提高。为了保证食品安全,我国质量监督管理部门和企业品质控制部门需要经常对各种产品进行微生物的检测,以防止变质产品进入流通领域。如果在生产过程控制不当,或者管道使用时间较长没有及时清理,就会出现批量微生物污染现象,造成巨大损失。因此,在生产过程中对污染产品的微生物进行快速鉴定,进而判断出污染来源显得非常重要。在实际生产中,可定期对产品进行取样检测,研究样品中污染微生物的种类及其生长、分布特性,根据其表型特征从而进行分类,或者利用其基因型(特别是rDNA)的序列分析和比对,鉴定出污染微生物的种类,从而及时、有效地帮助企业消除污染源头、阻断污染途径或调整杀菌工艺,这对生产厂家阻断微生物的污染途径,设计并改良生产工艺,以及加强生产过程管理具有重要的意义[2-4]。果葡糖浆的生产工艺主要经过以下步骤流程:淀粉→液化→糖化→过滤→脱色→离子交换→一次蒸发→异构化→脱色→离子交换→成品蒸发→果葡糖浆[5],不同生产企业可能会有细微的差别,但关键步骤不能缺少。笔者采用rDNA序列分析和形态学分析,对某企业生产过程中工艺路线不同环节的果葡糖浆样品进行微生物鉴定,取样点主要是水来源、糖化、脱色、离子交换、蒸发和异构等环节,并分析其可能的来源。
2材料与方法
2.1样品
某企业生产的某批次果葡糖浆不同环节样品。
2.2培养基
改良培养基:NaCl 5 g,Trptone10 g,Yeast Extract 5 g,3 g牛肉膏,加水定容至1 L,pH 6.0 , 121 ℃灭菌25 min。
2.3材料
PCR主要试剂:PCR Buffer、dNTP、Taq 酶及Goldview 荧光染料由TaKaRa 公司提供;TAE缓冲液、琼脂糖、Tris、Trptone、Yeast Extract为进口分装的分析纯,NaCl为国产分析纯。
2.4仪器
PCR仪(T-GRADIENT),德国Biometra 公司;振荡培养箱(ZQLY300F),上海知楚仪器有限公司;生化培养箱(SPX-3008SH-Ⅱ),上海新苗医疗器械制造有限公司;电泳槽(DYCZ)、电泳仪(DYY-6C),北京六一仪器厂;超净工作台(SW-CJ-IBM),苏州安泰空气有限公司;台式高速冷冻离心机(5417R),德国 Eppendorf 公司;分析天平(BS224S)、pH计(EC20),梅特勒-托利多仪器(上海)有限公司;三重纯水蒸馏器(SZ-97),北京瑞邦兴业科技有限公司;凝胶成像系统(GBoX-HR-E-M),英国Syngene 公司。
3实验方法
3.1菌种的分离纯化
采用涂布分离法。在无菌条件下,将果葡糖浆生产工艺中不同操作单元的十个样品分别取10 mL经过0.22 mm的无菌滤膜过滤,将滤膜上的微生物用200 μL无菌水冲洗,稀释并涂布于改良培养基上,并将培养皿在37 ℃下培养2—3 d。挑取单菌落进行相关形态学分析和分子生物学鉴定。
3.2细菌分离株的16S rDNA 序列分析[6]
16S rDNA细菌通用引物:27F-AGAGTTTGATCATGGCTCAG,1492R-TACGGCTACCTTGTTACGAC-TT[7]。
通过煮沸法提取细菌DNA模板:挑取活化的单菌落,接入液体改良培养基中过夜培养,取200 μL菌液于EP管中,离心后去上清用无菌水洗菌体2次,再加入50 μL无菌水重新悬浮,沸水煮10 min,冰浴5 min,12 000 r/min 离心5 min,将上清液转入离心管内,制成菌裂解液作为PCR模板,4 ℃条件下保存[8]。
PCR反应体系为50 μL:Taq酶0.25 μL;10×PCR Buffer 5 μL;2.5 mmol /L 的dNTP 4 μL;上游引物及下游引物各1 μL(10 mmol /L);菌裂解液模板5 μL;无菌去离子水33.75 μL。
PCR条件为:94 ℃预变性10 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1.5 min,循环30 次,72 ℃ 8 min。
3.3酵母菌株的26S rDNA D1/D2区域序列分析
26S rDNA D1/D2区域序列扩增引物为:NL1 5′-GCATATCAATAAGCGGAGGAAAAG-3′;NL4 5′-GGTCCGTGTTTCAAGACGG-3′[9]。
对于用细菌通用引物没有扩增出来的模板样品再用扩增真菌26S rDNA D1/D2区域引物进行PCR扩增。首先通过煮沸法提取真菌DNA模板:挑取活化的单菌落,接入液体改良培养基中培养16 h,取200 μL菌液于离心管中,离心后弃上清,用无菌水洗沉淀的菌体2次,再加入50 μL无菌水重新悬浮细胞,沸水煮10 min,-80 ℃低温冷冻15 min,冰浴5 min,再用沸水煮10 min,冰浴5 min,12 000 r/min 离心5 min,将上清液转入小EP管中,作为PCR扩增的模板,4 ℃保存。
PCR反应体系与3.2的PCR反应体系相同。
PCR条件为:94 ℃预变性10 min;94 ℃变性1 min,59 ℃退火1 min,72 ℃延伸1.5 min,循环30次,72 ℃8 min。
PCR产物经过0.8%的琼脂糖凝胶电泳,凝胶成像分析仪观察PCR扩增结果。PCR产物送上海生工生物工程股份有限公司测序。
4实验结果
4.1样品污染菌的形态分析
对10个已经编号的样品涂布后,肉眼分别观察其在培养基上生长情况。其中有三个平板分别生长出来大小形状不同的菌落。其微生物指标见表1。
4.2分子生物学鉴定结果
对提取的模板全部用细菌通用引物进行扩增,扩增结果如图1所示。对于用细菌通用引物没有扩增出来的模板改用真菌引物NL1、NL4扩增,结果如图2所示。
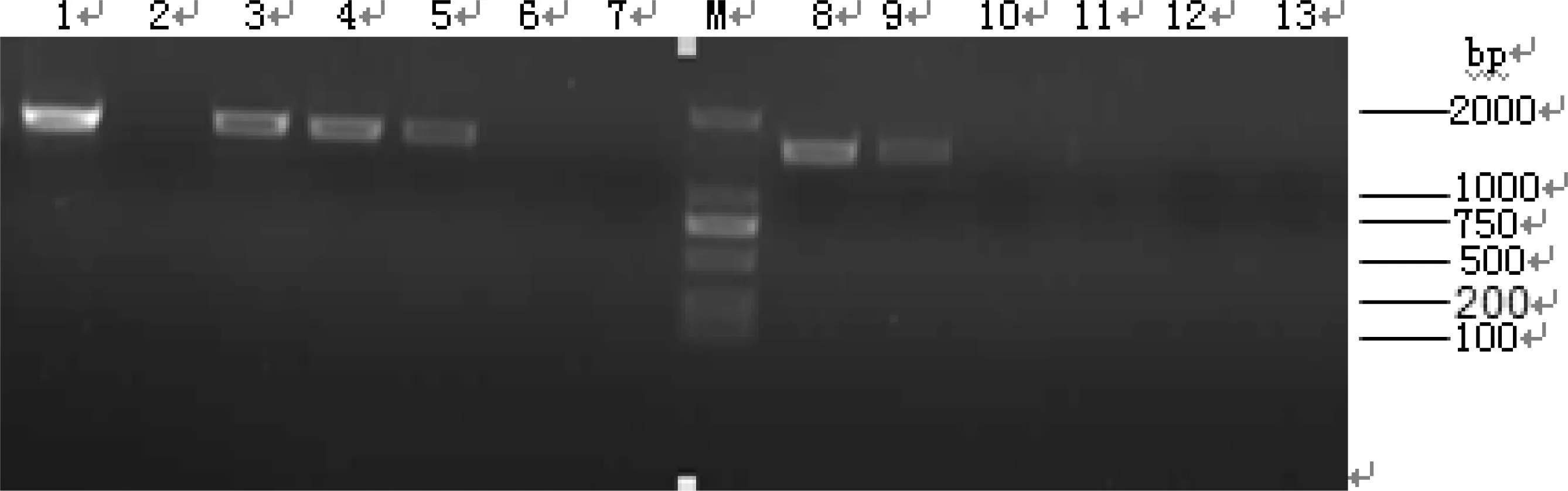
1:S1 膜过滤水;2:A16一套离子交换;3:S2 二套离子交换;4:S4 异构;5:S5 三套蒸发;6:A11 一套脱色;7:A12 一套脱色;M:DL 2000 DNA Marker;8:S9 糖化;9:S15 二套蒸发;10:A3异构;11:A17 糖化;12:A7混床;13:A14 二套脱色图1 16S rDNA PCR扩增结果
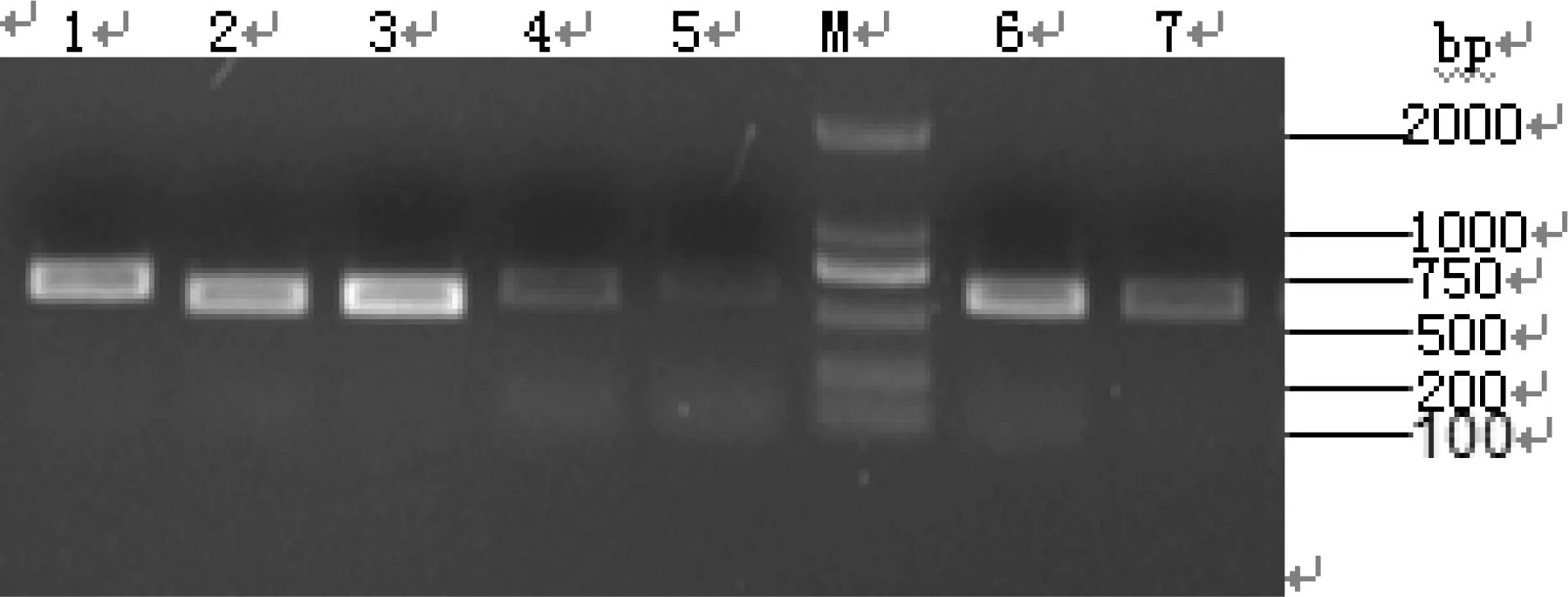
1:A7混床;2:A16一套离子交换;3:A11 一套脱色;4:A12 一套脱色;5:A3异构;M:DL 2000 DNA Marker;6:A17 糖化;7:A13 二套脱色图2 引物NL1,NL4扩增26S rDNA结果
扩增产物经过测序后,其测序结果序列参考文献[10]进行BLASTN比对,结果见表1。
5结果与讨论
从测序结果来看,该产品的主要污染菌为酵母和杆菌。结合该工厂生产的工艺流程,首先在水处理环节,企业在生产中由于不能及时更换水处理的滤芯,导致了所用水的污染。在糖化和一套脱色环节取样检测到的A17和A11,序列比对分析均为马克斯克鲁维酵母,且它们26S rDNAD1/D2区一致性为100%,在异构和二套脱色环节中检测到的A3和A13,序列比对分析结果均为耐热克鲁维酵母,它们的26S rDNAD1/D2区一致性也为100%。所以推测工艺上游微生物的污染延续到下游,具有很大的关联性,因此控制上游的糖化和异构环节的微生物污染是解决问题的关键。
表1不同样品对应的理化指标和微生物指标及测序比对分析结果
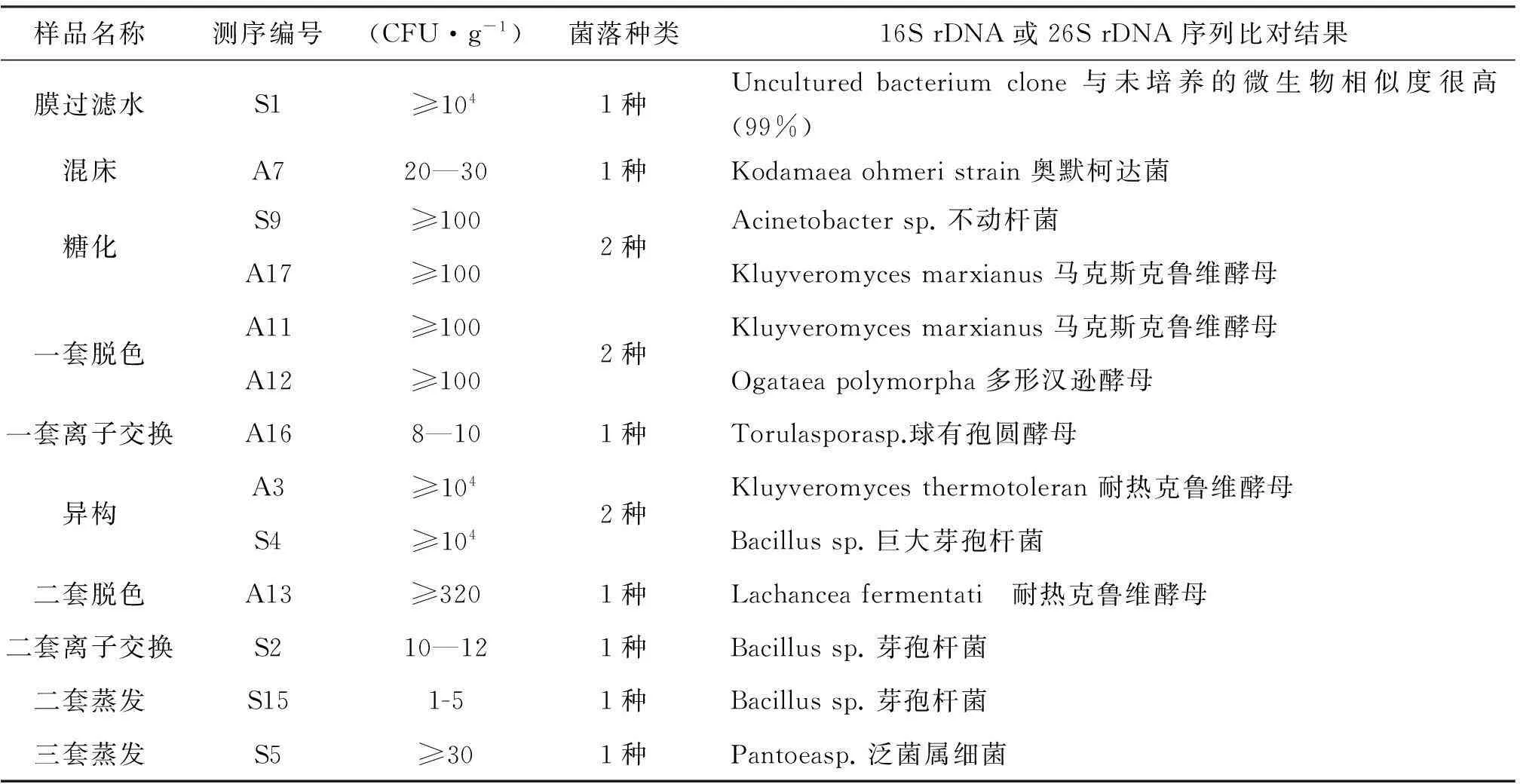
样品名称测序编号(CFU·g-1)菌落种类16SrDNA或26SrDNA序列比对结果膜过滤水S1≥1041种Unculturedbacteriumclone与未培养的微生物相似度很高(99%)混床A720—301种Kodamaeaohmeristrain奥默柯达菌糖化S9≥100A17≥1002种Acinetobactersp.不动杆菌Kluyveromycesmarxianus马克斯克鲁维酵母一套脱色A11≥100A12≥1002种Kluyveromycesmarxianus马克斯克鲁维酵母Ogataeapolymorpha多形汉逊酵母一套离子交换A168—101种Torulasporasp.球有孢圆酵母异构A3≥104S4≥1042种Kluyveromycesthermotoleran耐热克鲁维酵母Bacillussp.巨大芽孢杆菌二套脱色A13≥3201种Lachanceafermentati 耐热克鲁维酵母二套离子交换S210—121种Bacillussp.芽孢杆菌二套蒸发S151-51种Bacillussp.芽孢杆菌三套蒸发S5≥301种Pantoeasp.泛菌属细菌
在软饮料生产领域中,最常见的是酵母污染,由于它耐受二氧化碳,喜欢在有糖或者偏酸的环境中生长繁殖,而且生产过程中的各种容器及管道等设备内的糖液残留物正好给酵母菌提供了生长繁殖的条件。本批次产品取样时间在夏天,夏天温度较高,微生物极易繁殖。另外,环境湿度大,换气不足,经常有糖液洒在地上,致使酵母大量生长繁殖,漂浮于空气之中,造成空气被污染[11-14]。因而在饮料生产的全过程中,它无孔不入,成为饮料生产的大敌。在工艺环节中,只要稍有不慎,酵母会很快入侵并迅速繁殖,导致大量产品变质,给企业带来严重的经济损失。因此企业对各车间内及工艺管道的定期清理及消毒是非常必要的,这在很大程度上会遏制微生物的生长进而保护产品不被污染。
另一方面,由于芽孢杆菌的芽孢抗逆性极强,可在高温条件下生长繁殖。不动杆菌属于革兰氏阴性菌,广泛分布于外界环境中,而且非常容易在潮湿的环境中生存。该菌多数菌株有荚膜,黏附力极强,易在管道内壁上黏附而成为贮菌源[15-16]。而本批次产品恰好在糖化和异构环节中检测到了大量的杆菌,因此推测污染该产品的细菌关键点在于异构和糖化的控制点中。异构是整个果葡糖浆生产工艺中最关键之处,有很多因素影响异构过程,葡萄糖液经过装有固定化异构酶的反应器即可被异构化,异构酶在灌柱之前,必须先彻底清洗异构柱并用蒸汽灭菌,等到其温度冷却至60 ℃以后才能灌入异构酶。而在经过一段时间后,异构化反应柱应停止使用,更换新酶,一般来说,异构酶制剂的运行周期最长为120—200 d,因此要及时对无利用价值的固定化异构酶要及时从异构柱中排出,且清洗异构柱以防止细菌的滋生。另外,在糖化过程中加入糖化酶,在缓慢搅拌下60 ℃保温一定的时间达到糖化终点后,必须立即升温到80 ℃以上进行灭酶处理[17-18],如果不进行灭酶处理或者灭酶不彻底,那么酶制剂中带入的微生物就非常可能进入下一个工艺环节。综上,对异构柱和工艺管道及时进行清理,排出剩余的废弃酶制剂并及时进行高温彻底灭菌是解决细菌及真菌酵母污染的关键手段。
参考文献:
[1]杨海军. 果葡糖浆的特性及应用[J]. 食品科学, 2002, 23(2): 154-156.
[2]郝建明. 果葡糖浆及其生产工艺要点[J]. 食品工业科技, 2006, (8): 204-205.
[3]杨晓瑞, 梁金花, 徐文龙, 等. 果葡糖浆的制备工艺研究[J]. 食品与发酵科技, 2013(2): 40-43.
[4]李纪亮. F-55高果葡糖浆厂设计和生产[J]. 食品工业科技, 2008, 29(10): 170-173.
[5]王乃强,尹月玲,杨海军,等.固体果葡糖生产工艺研究及前景展望[J].中国乳业,2013(7):62-64.
[6]王洋, 周帼萍. 一例茶饮料污染源的分析[J]. 食品与发酵工业, 2011, 37(5): 230-233.
[7]Weisburg W G, Barns S M, Pelletier D A, et al. 16S Ribosomal DNA amplification for phylogenetic study [J]. Journal of Bacteriology, 1991, 173(2): 697-703.
[8]沈萍, 范秀容, 李广武. 微生物学试验(第三版) [M]. 北京: 高等教育出版社, 1999: 44-46.
[9]Lopandic K, Zelger S, Banszky L K, et al. Identification of yeasts associated with milk products using traditional and molecular techniques [J]. Food Microbiology. 2006, 23(4): 341-50.
[10]程德勇,缪礼鸿.高产蛋白酶活性的枯草芽孢杆菌筛选及鉴定[J].武汉轻工大学学报,2014,33(1):6-10.
[11]项雷文, 许锦华, 陈文韬, 等. PET瓶装菊花茶生产污染菌分离鉴定及污染源分析[J]. 中国酿造, 2013, 32(7): 112-114.
[12]郭伟鹏, 张菊梅, 邓梅清, 等. 桶装饮用水生产中微生物污染菌株的分离鉴定及消毒试验[J]. 中国卫生检验杂志, 2008, 18(12): 2605-2607.
[13]王犇, 宁玉娟, 李克贤, 等. 果葡糖浆生产技术的研究进展[J]. 大众科技, 2014(1): 38-41.
[14]李辉, 刘光全, 程池, 等. 2株酸梅汤饮料污染霉菌的分离与鉴定研究[J]. 中国食品学报, 2009, 9(6): 182-187.
[15]蒋荣荣, 赵炜, 王洋, 等. 酸菜包外包膜污染菌分析[J]. 中国酿造, 2013, 32(1): 133-136.
[16]郭伟鹏, 吴清平, 张菊梅, 等. 果汁饮料中耐热霉菌的分离和鉴定研究[J]. 生物技术通报, 2008(z1): 244-247,257.
[17]赵国群, 周雪艳, 胡弢, 等. 活化条件对固定化葡萄糖异构酶酶活的影响[J]. 食品研究与开发, 2012, 33(10): 156-159.
[18]严奉伟. 全酶法F-42型果葡糖浆生产工艺的关键控制点[J]. 饮料技术, 1997, 14(5): 26-28.
Analysis and identification of spoilage bacteria from the production process of fructose syrups
LICun-zhi,MAOLing-qi,YANDa-zhong
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
Abstract:Fructose syrups produced in a factory were contaminated with microorganism partly. Samples at different operational units in fructose syrup production were collected and the main microorganisms were identified by analyses of 16S rDNA or 26S rDNA sequences, and identified as Bacillus sp. and Kluyveromyces sp. Through the identification of spoiled strains, combined with actual production process, the sources of pollution were found. This study can provide the reasonable and effective scientific basis for controlling the potential microorganisms in production process.
Key words:fructose syrups; pollutant source analysis; strain identification; Bacillus sp; Kluyveromyces sp
中图分类号:Q 93.331
文献标识码:A
DOI:10.3969/j.issn.2095-7386.2016.01.007
文章编号:2095-7386(2016)01-0030-04
作者简介:李存治(1990-),男,硕士研究生,E-mail:cunzhili@163.com.通信作者:闫达中(1968-),男,副教授,博士,E-mail: yandz6808@163.com.
收稿日期:2015-10-12.

