酶联免疫吸附试验与化学发光免疫分析法检测乙型肝炎5项血清标志物的对比分析
王新莉
(青海省黄南州藏医院检验科,青海黄南 811399)
·临床研究·
酶联免疫吸附试验与化学发光免疫分析法检测乙型肝炎5项血清标志物的对比分析
王新莉
(青海省黄南州藏医院检验科,青海黄南 811399)
摘要:目的对酶联免疫吸附试验(ELISA)和化学发光免疫分析法(CLIA) 检测乙型肝炎5项血清标志物的结果和重复性进行比较和分析。方法分别用ELISA和CLIA检测了500份临床血清标本,其中HBsAg、HBsAb、HBeAg、HBeAb、HBcAb各100例,对两种方法的阳性率和符合率进行了统计分析,对CLIA与ELISA结果不符的标本用第三种方法进行了复测;另用60例HBsAb标本对两种方法的重复性进行了比较。结果CLIA检测HBsAg和HBcAb的阳性率高于ELISA的检测结果,差异有统计学意义(χ2=4.308、5.637,P<0.05);而HBsAb、HBeAg、HBeAb的阳性率与ELISA的检测结果相比差异无统计学意义(χ2=0.361、0.785、0.180,P>0.05)。重复性试验表明CLIA的批内CV(1.04%~2.8%)、批间CV(4.19%~8.19%)都明显优于ELISA的批内CV(3.81%~12.56%)、批间CV(10.31%~18.90%)。结论CLIA检测乙型肝炎5项血清标志物比ELISA重复性好,HBsAg和HBcAb项目的灵敏度更高,总体结果更准确。
关键词:乙型肝炎;化学发光法;酶联免疫吸附试验;血清标志物
我国是乙型肝炎的高发区,1992年全国血清流行病学调查显示人群乙型肝炎病毒(HBV)感染率达60%[1],近年来有所下降。提高乙型肝炎的诊治水平,对保障我国人民健康具有重要意义。过去,我国中、基层医院做乙型肝炎5项血清标志物的主要方法是酶联免疫吸附试验(ELISA)。进入21世纪后,以化学发光为主的自动化检测系统逐渐兴起,且以国外进口的设备和试剂居多。近年来,国产的化学发光仪器和配套试剂也开始使用,它在我国中、基层医院的推广价值较高。本文的目的是对一种国产化学发光仪及配套乙型肝炎5项血清标志物试剂与传统ELISA进行对比,就阳性率、符合率、准确性、重复性等主要指标进行比较。
1材料与方法
1.1标本来源收集检测了HBV标志物[HBV表面抗原(HBsAg)、HBV表面抗体(HBsAb)、HBV核心抗体(HBcAb)、HBVe抗原(HBeAg)、HBVe抗体(HBeAb)]血清标本各100例,用ELISA测定阴、阳性各50例。所有标本都来自本院2014年1~12月住院部和门诊部的患者。其中男312例、女188例,年龄10~75岁、中位年龄42岁。
1.2仪器与试剂MA-96A型酶标仪为深圳迈瑞生物医疗电子股份有限公司生产,ELISA试剂及阴阳性对照品均为英科新创(厦门)科技有限公司生产;IS1200化学发光仪及配套试剂、校准品、质控品、一次性枪头/反应杯等,均为四川迈克生物科技股份有限公司生产;复测用雅培Architect I2000SR及配套乙型肝炎5项血清标志物试剂盒。
1.3方法收集的临床标本分别用ELISA及化学发光免疫分析法(CLIA)进行检测,两种方法检测间隔的时间不超过24 h。ELISA法严格按照试剂说明书操作,用450/630 nm测定各孔OD值,阴性对照孔OD平均值×2.1作为临界值(CO);HBsAg、HBsAb、HBeAg标本S/CO≥1者为阳性(+),S/CO<1者为阴性(-),HBeAb和HBcAb标本S/CO≤1者为阳性(+),S/CO>1者为阴性(-)。CLIA法按仪器说明书严格操作,仪器根据校准品的发光值自动计算CO值,自动输出标本的COI或浓度值及阴阳性;HBsAg、HBeAg标本COI≥1者为阳性(+),否则为阴性(-),HBeAb、HBcAb标本COI≤1者为阳性(+),否则为阴性(-);HBsAb检测值>10 mIU/mL为阳性(+),否则为阴性(-)。雅培Architect I2000SR复测在青海省人民医院检验科测定。重复性试验:用HBsAb项目进行重复性评价,选择3份不同浓度的血清标本,连续测定20次,计算批内CV;另外3份不同浓度血清标本分装冻存,每天测定1次,共20 d,计算批间变异系数(CV)。
1.4统计学处理使用MedCalc(V14.8.1)医学统计软件进行分析。计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两种方法的检测结果见表1。CLIA检测HBsAg阳性率为64%,ELISA的阳性率为36%;CLIA检测HBcAb的阳性率为67%,ELISA阳性率为33%:CLIA检测这2个项目的阳性率结果明显高于ELISA的检测结果,差异有统计学意义(χ2=4.308、5.637,P<0.05)。而CLIA检测HBsAb阳性率为54%,ELISA检测阳性率为46%;CLIA检测HBeAg阳性率为46%,ELISA检测阳性率为54%;CLIA检测HBeAb的阳性率为47%,ELISA阳性率为53%:两种方法检测结果相比,差异无统计学意义(χ2=0.361、0.785、0.180,P>0.05)。

表1 ELISA和CLIA检测乙型肝炎5项血清
+:阳性,-:阴性。
2.2ELISA与CLIA不符标本用雅培Architect I2000SR复测结果见表2。结果显示CLIA在HBsAg和HBcAb项目的灵敏性要明显高于ELISA。
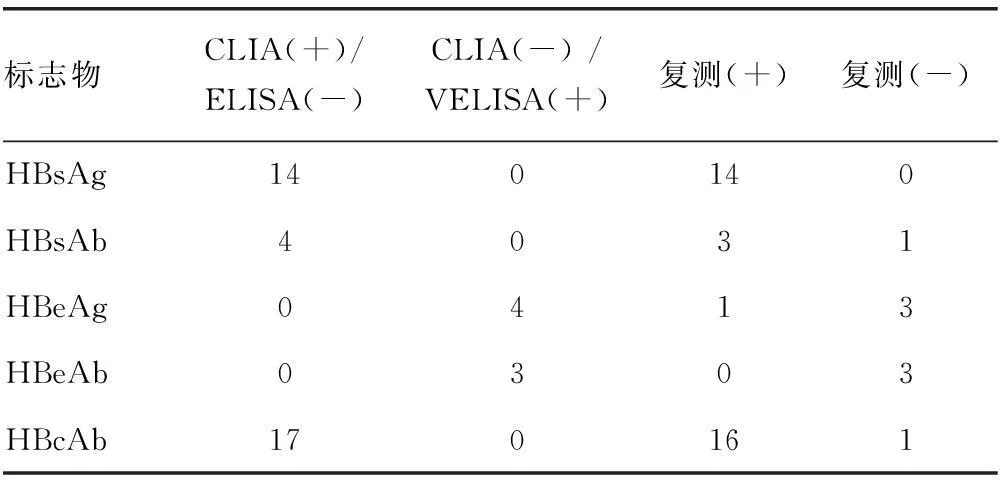
表2 ELISA与CLIA不符标本用雅培Architect
+:阳性,-:阴性。
2.3两种方法重复性试验结果见表3。试验结果表明CLIA的批内CV(1.04%~2.8%)、批间CV(4.19%~8.19%)都明显优于ELISA的批内CV(3.81%~12.56%)、批间CV(10.31%~18.90%)。
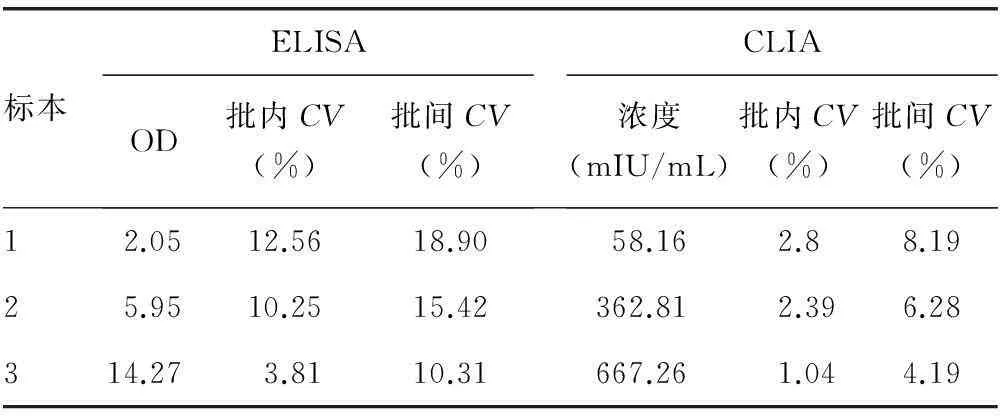
表3 ELISA与CLIA重复性试验结果
3讨论
目前国内普遍采用ELISA检测乙型肝炎5项血清标志物,作为临床诊断HBV感染和观察疗效的重要依据。近年来自动化化学发光检测也进入了基层医院,但很多医检人员对这两种技术的异同还不很了解。本研究中HBsAg和HBcAb的阳性率差异有统计学意义(P<0.05),在50例ELISA阴性标本中CLIA分别检出了14例HBsAg阳性和17例HBcAb阳性,而ELISA阳性标本CLIA也全部为阳性;经雅培Architect I2000SR复测,这14例HBsAg均为阳性,17例HBcAb中16例都为阳性;证明CLIA的灵敏度显著高于ELISA,这与以前的文献报道基本一致[2-3]。CLIA的HBsAg灵敏度达到了0.13 IU/mL,普遍认为要比ELISA高4~10倍[3],而且CLIA的清洗效率高、人为误差小,这可能是其阳性检出率高的原因;因为这些有差异的标本ELISA很多都在灰区,标本多有高胆红素、高血脂、溶血现象,有报道认为这些因素可能干扰ELISA的结果[4]。
本研究中HBsAb、HBeAg、HBeAb的阳性率差异无统计学意义(P<0.05),这与以前的有些文献报道略有不同[2-3],可能是因为ELISA检测这些年也在不断地改良提高。但ELISA检测中HBsAb仍然存在少量假阴性,HBeAg、HBeAb也存在少量假阳性;ELISA检测的假阳性问题与其抗体来源、纯化工艺有关[3,5]。本研究中的这些假阳或假阴大多都在临界值附近,因此也可能与ELISA方法学的局限性、重复性较差有关。
ELISA虽然成本低廉,但由于灵敏度低、需要反复洗板、孔间差异、孔间污染、结果判定有主观性等原因,容易出现较多的假阳性及假阴性[6-9],因此不适用于低浓度标本和窗口期标本的检测。CLIA全面实现了自动化和标准化,HBsAg、HBeAg、HBeAb、HBcAb 4项检测结果以COI指数来量化,HBsAb结果是溯源至国际单位的定量结果,质控采用厂家的原装配套质控品[10-11]。全程自动化加样,减少了人为误差,本研究也证明了CLIA的批内CV和批间CV都要优于ELISA。CLIA的高灵敏度和高特异性对于低浓度标本和窗口期标本不容易漏检,也可降低少见模式[4-5],其量化结果方便患者的追踪治疗。随着国家对医疗行业的投入不断加大,CLIA可为基层医院提供更准确、可靠的依据[12-14]。
参考文献
[1]郑怀亮,韩松.临床检验ELISA指南[M].北京:北京医科大学中国协和医科大学联合出版社,1994:14.
[2]叶应妩,王毓三.全国临床检验操作规程[M].2版.南京:东南大学出版社,1997:410-411.
[3]吴健民.临床化学自动化免疫分析[M].北京:科学出版社,2000:241-243.
[4]杨凡,单咏梅,周虹,等.不同方法学检测乙型肝炎血清标志物结果的评价分析[J].检验医学,2010,25(9):723-726.
[5]吴星,周诚,黄维金,等.对四种国产乙型肝炎酶联免疫试剂盒的灵敏度和特异性分析[J].中华流行病学杂志,2008,29(9):915-918.
[6]王巧莲.化学发光法与ELISA法检测乙肝病毒血清标志物结果比较[J].包头医学院学报,2006,22(1):82-84.
[7]张玉梅.探讨乙肝五项定量检测在临床中的应用效果[J].当代医学杂志,2007,13(2):46-47.
[8]吴正林,何英,叶军,等.电化学发光法和ELISA法检测乙肝血清标志物结果对比分析[J].现代检验医学杂志,2010,25(4):103-104.
[9]鲍俊杰,杨红玲,郭彩娇,等.酶联免疫吸附测定法与化学发光微粒子免疫分析法检测广州地区儿童HBsAb结果分析[J].中西医结合肝病杂志,2009,19(1):44-46.
[10]Petra E,Angela M,Herbert S,et al.Detection of serotype-specific antibodies to the four dengue viruses using an immune complex binding (ICB) ELISA[J].PloS Neglected Tropical Diseases,2013,7(12):1151-1154.
[11]Zidane N,Dussart P,Bremand L,et al.Cross-reactivities between human IgMs and the four serotypes of dengue virus as probed with artificial homodimers of domain-Ⅲ from the envelope proteins[J].Bmc Infectious Diseases,2013,13(1):1-10.
[12]Mollenhauer B,Cullen V,Kahn I,et al.Direct quantification of CSF α-synuclein by ELISA and first cross-sectional study in patients with neurodegeneration[J].Experim Neur,2008,213(2):315-325.
[13]Machado AM,Figueiredo GG,Campos GM,et al.Standardization of an ELISA test using a recombinant nucleoprotein from the Junin virus as the antigen and serological screening for arenavirus[J].Revista Da Sociedade Brasileira De Medicina Tropical,2010,43(3):229-233.
[14]Wang SQ,Zhao X,Khimji I,et al.Integration of cell phone imaging with microchip ELISA to detect ovarian cancer HE4 biomarker in urine at the point-of-care[J].Lab A Chip,2011,11(20):3411-3418.
(收稿日期:2015-12-23)
DOI:10.3969/j.issn.1673-4130.2016.06.039
文献标识码:A
文章编号:1673-4130(2016)06-0807-02

