绿色荧光蛋白基因转染示踪比格犬体内骨髓间充质干细胞分化
张海峰 杜子婧 赵丹阳 韩修国 韩冬
200011, 上海交通大学医学院附属第九人民医院整复外科(张海峰、杜子婧、赵丹阳、韩冬);200011, 上海市骨科内植物重点实验室(张海峰、韩修国)
·实验研究·
绿色荧光蛋白基因转染示踪比格犬体内骨髓间充质干细胞分化
张海峰杜子婧赵丹阳韩修国韩冬
200011,上海交通大学医学院附属第九人民医院整复外科(张海峰、杜子婧、赵丹阳、韩冬);200011,上海市骨科内植物重点实验室(张海峰、韩修国)
【摘要】目的运用绿色荧光蛋白(GFP)标记技术,观察骨组织工程中种子细胞的变化和转归。方法使用重组腺病毒(Ad-GFP)将GFP基因转染比格犬骨髓间充质干细胞(BMSC),倒置相差显微镜下观察BMSC形态、碱性磷酸酶(ALP)和茜素红染色情况;荧光显微镜下观察细胞GFP表达状况。待细胞标记成功后将其离心,接种于β-磷酸三钙(β-TCP)上,回植于比格犬胫骨内侧骨膜囊内,构建组织工程骨记为A组;单纯β-TCP植入对称胫骨内侧骨膜囊记为B组;单纯β-TCP植入皮下记为C组。术后2周取材,分别行组织学观察、免疫组化检测,同时激光共聚焦显微镜下观察GFP表达情况。结果体外成骨诱导实验显示,ALP染色以及茜素红染色阳性。组织学观察可见,A组新生骨组织以及新生血管均较B组明显,C组未见新生骨组织。免疫组化检测显示,A组Ⅰ型胶原、血小板内皮细胞黏附分子CD31染色阳性;B组Ⅰ型胶原、CD31染色部分阳性;C组未见阳性表达。免疫组化半定量检测显示,A、B两组Ⅰ型胶原、CD31定量有统计学差异(P<0.05)。激光共聚焦显微镜观察结果显示,A组新生骨组织内可见GFP表达,B、C组未见GFP标记细胞。结论BMSC是组织工程骨早期形成的重要来源,但周围成骨细胞并非新生骨组织主要来源;移植BMSC于骨膜下可促进新生血管形成。
【关键词】骨组织工程;绿色荧光蛋白;骨髓间充质干细胞
骨髓间充质干细胞(BMSC)是造血微环境中的一种重要细胞成分,获取相对容易,在特定的理化环境和细胞因子诱导下,可分化为成骨细胞、软骨细胞、脂肪细胞、内皮细胞等多种类型细胞,且免疫原性弱,是组织工程理想的种子细胞来源[1-4]。然而,新生组织工程骨的细胞来源是体外植入BMSC还是体内周围组织中的成骨细胞,或两者兼有,目前尚存争议。绿色荧光蛋白(GFP)在体内可稳定而较长时间持续表达,因此以腺病毒为载体的GFP体外标记BMSC可直接追踪植入BMSC的分化与转归,为BMSC对骨组织工程的成骨作用提供有力证据,同时也可为组织工程种子细胞的标记提供一种可靠的方法。
1材料与方法
1.1实验动物及材料
实验动物:普通级成年雄性比格犬6只,体重10~15 kg(上海交通大学医学院附属第九人民医院动物中心)。
实验材料:重组腺病毒(Ad-GFP);β-磷酸三钙(β-TCP,上海交通大学材料科学与工程学院);Dulbecco改良的Eagle培养基(DMEM,美国Gibco公司);胎牛血清(美国HyClone公司);地塞米松、β-磷酸甘油钠、L-2-磷酸抗坏血酸、茜素红(美国Sigma公司);Ⅰ型胶原、CD31试剂(英国Abcam公司);Masson三色法染色试剂盒、碱性磷酸酶(ALP)检测试剂盒(南京建成生物制品有限公司);荧光光学显微镜(日本OLYMPUS公司);显微摄影数码相机(美国KODAK公司);激光共聚焦显微镜(德国莱卡公司)。
1.2实验方法
1.2.1Ad-GFP扩增与纯化
使用Ad-GFP转染HEK293A细胞,待90%细胞出现病变时收集细胞和上清,在 37℃与-80℃条件下反复冻融、裂解细胞,离心收集上清,获取病毒,同法进行大量扩增;采用氯化铯密度梯度离心法纯化病毒,采用病毒噬菌斑形成实验测定病毒滴度(PFU),然后-80℃冻存备用。
1.2.2BMSC分离培养、扩增以及诱导分化鉴定
比格犬麻醉后常规备皮、消毒、铺巾,于髂后上棘穿刺抽取骨髓液4~5 mL,加入50 mL肝素化的无菌离心管内,与20 mL 10%胎牛血清和青霉素、链霉素双抗DMEM培养基(青霉素100 U/mL、链霉素100 U/mL)混匀,接种于100 mm培养皿中,置于37℃、5%CO2培养箱孵育。分别于3、6 d后半量换液,9 d后完全换液,以后每3日完全换液1 次。待原代培养细胞长满瓶底面积的90%时,进行传代培养,按1∶3接种于新细胞培养皿内。传至第3代进行细胞计数。将第2代纯化的BMSC细胞悬液(调整细胞密度为l×105/mL)接种于十二孔板中,待细胞长到容器底部的60%~70%时,一部分孔内加入10%胎牛血清、10 nmol/L地塞米松、10 mmol/L β-磷酸甘油钠、50 μmol/L L-2-磷酸抗坏血酸的DMEM成骨条件培养液;另一部分细胞作为阴性对照,仍用普通含胎牛血清培养基进行培养。每3日完全换液1次。成骨诱导1~2周后行ALP染色,3周后行茜素红染色。倒置相差显微镜下观察细胞形态及ALP染色、茜素红染色钙结节形成情况[5]。
1.2.3Ad-GFP标记BMSC
取第3代BMSC,待细胞长至60%~70%融合时,在其培养液中加入PFU为1×109(每皿细胞数为1×107个)的Ad-GFP,继续培养48 h,荧光显微镜下观察[6]。
1.2.4BMSC与β-TCP体外复合培养
Ad-GFP标记的BMSC体外扩增后3 d,行细胞计数。采用0.25%胰蛋白酶消化并收集腺病毒转染的细胞,离心后将1 mL DMEM 培养基制成细胞悬液接种于β-TCP上,接种密度约2×107个/cm3。
1.2.5比格犬模型建立及分组
比格犬以2.5%异戊巴比妥钠(30~50 mg/kg)静脉麻醉后,后肢及背部常规备皮并消毒铺巾。于胫骨内侧纵行切开皮肤,弧形切开骨膜后,剥离胫骨内侧骨膜,将植入材料置于骨膜下,最后将骨膜囊状缝合(图1);于比格犬背侧行弧形小切口,将材料置于皮下,缝合皮肤。根据放置材料部位的不同以及植入材料是否为复合细胞分成以下3组:A组为将复合BMSC的β-TCP植入于比格犬胫骨内侧骨膜囊内;B组为单纯植入β-TCP于比格犬胫骨内侧骨膜囊内;C组为单纯植入β-TCP于比格犬皮下,术后肌肉注射青霉素80万U/次,每日2次,持续3 d。术后3周取材,进行检测。
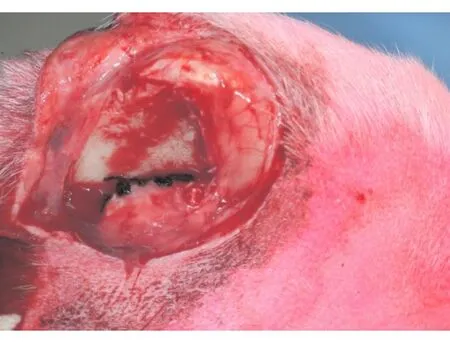
图1 手术缝合比格犬胫骨内侧骨膜囊
1.3检测指标
1.3.1ALP及茜素红染色观察
体外成骨诱导后第1~2周行ALP染色观察,第3周行茜素红染色观察。
1.3.2组织学观察
取材后肉眼观察新生组织结构。将标本用4%甲醛溶液固定后,脱钙、石蜡包埋、切片、HE 染色及Masson 三色法染色,显微镜下观察骨膜下及皮下新生组织。
1.3.3免疫组化检测
比格犬胫骨内侧骨膜下取材,采用4%甲醛溶液固定,10%乙二胺四乙酸(EDTA)脱钙4周,行石蜡切片;正置显微镜下观察Ⅰ型胶原、CD31染色情况。
1.3.4GFP表达检测
术后3周全部取材,4%甲醛溶液固定,10%EDTA脱钙4周,行冰冻切片;激光共聚焦显微镜下观察新生组织GFP表达情况。
1.4 统计学方法
采用Stata/SE12.0统计软件包进行分析。数据以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2结果
2.1Ad-GFP扩增与纯化
Ad-GFP感染HEK293A细胞,细胞出现贴壁不牢,部分细胞漂浮或死亡;荧光显微镜下,24 h后发荧光细胞数达到高峰,转染率超过80%(图2),48 h 后有较多细胞漂浮,仍可发出绿色荧光。
2.2BMSC分离培养及GFP 标记
原代培养BMSC 24 h后细胞开始贴壁,48 h后大量细胞贴壁,细胞呈短小梭形或多角形,排列不规则;培养1周左右,细胞生长迅速并互相融成集落,呈旋涡状排列(图3a)。Ad-GFP感染BMSC后,细胞仍贴壁生长,呈梭形、三角形或多角形,但其增殖速度有所降低,部分BMSC漂浮。荧光显微镜下,24 h后可见绿色荧光表达,48 h后细胞发出强烈荧光,呈现全细胞分布,感染率达到60%~80%(图3b)。

图2 24 h后荧光显微镜下腺病毒转染率超过80%(×40)

图3BMSC分离培养及GFP 标记后情况a. 光镜下BMSC培养1周情况(×40)b.Ad-GFP转染BMSC24 h后转染率为60%~80%(×100)
2.3BMSC与β-TCP体外复合培养结果
将GFP标记的BMSC接种到β-TCP材料48 h后,荧光显微镜下观察发现BMSC在材料上生长良好,细胞荧光表达较强(图4)。

图4 48 h后荧光显微镜下BMSC在材料上生长情况(×100)
2.4ALP及茜素红染色观察
成骨诱导培养BMSC后1~2周,ALP染色呈阳性,细胞质呈紫色(下页图5a);3周时茜素红染色阳性,细胞外基质中可见典型红色矿化结节(下页图5b)。
2.5大体观察及组织学观察
术后2 d,全部比格犬均存活,无异常死亡。切口均干燥、无分泌物,未见明显感染。
术后取材, A组肉眼见骨膜下新生骨明显(图6a),B组仅见部分新生软骨样组织及纤维样组织结构(图6b),C组未见新生骨及软骨样组织。
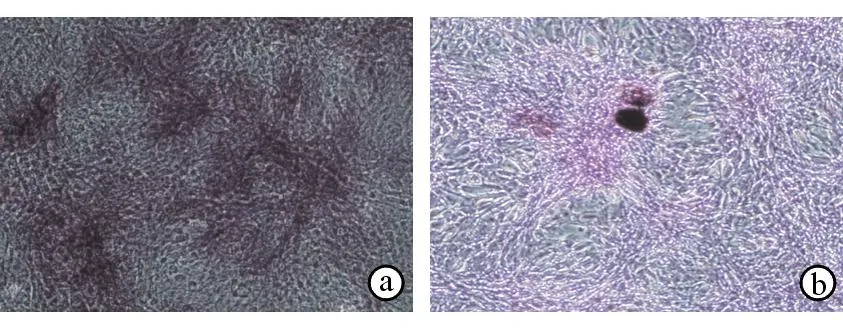
图5BMSC成骨诱导后ALP染色及茜素红染色情况
a. BMSC成骨诱导2周后ALP染色阳性(×100) b. BMSC成骨诱导3周后茜素红染色阳性(×100)
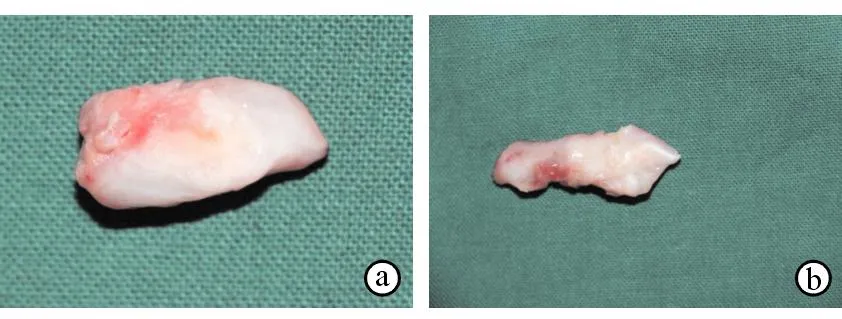
图6A、B组大体观察a. A组大体观察b. B组大体观察
A组光镜下HE染色以及Masson染色可见:胫骨骨膜下大量新生编织骨明显存在,且新生血管较B组明显,B组、C组骨膜下未见明显骨组织形成(图7)。

图7术后A、B组组织学观察a. A组HE染色(×40) b. B组HE染色(×40) c. A组Masson染色(×100) d. B组Masson染色(×100)
2.6免疫组化检测结果
免疫组化染色显示A组Ⅰ型胶原以及CD31检测阳性(图8a、8b);B组Ⅰ型胶原、CD31染色部分阳性(图8c、8d);C组未见阳性表达。
免疫组化半定量法[7]检测显示A组表达Ⅰ型胶原、CD31较 B组明显,且差异有统计学意义(表1)。

图8免疫组化染色结果a. A组Ⅰ型胶原免疫组化染色(×100) b. A组CD31免疫组化染色(×100) c. B组Ⅰ型胶原免疫组化染色(×100)d. B组CD31免疫组化染色(×100)

表1 免疫组化半定量检测A、B组Ⅰ型胶原、CD31比较
2.7GFP对BMSC的体内示踪结果
在激光共聚焦显微镜下观察发现A组骨膜下新生骨组织细胞仍能表达GFP(图9),B组、C组均未见GFP表达。
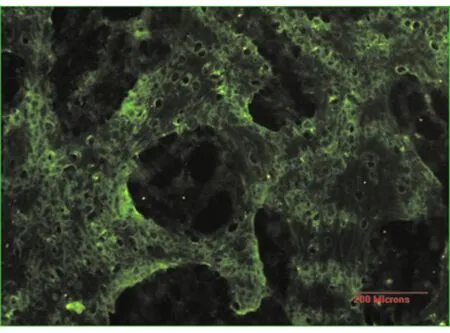
图9激光共聚焦显微镜下A组新生骨组织表达GFP (×200)
3讨论
3.1骨组织工程新生骨细胞来源
BMSC为骨髓中非造血干细胞,具有横向或跨胚层向多种组织细胞分化的潜力,是骨、软骨等组织工程较理想的种子细胞[8-9];由于其免疫原性低,可作为基因转染的适宜细胞载体, 同时也可提供建立在细胞基础上的治疗方法,其中包括自体及异体细胞治疗,其应用前景乐观[10-16]。近年来,在骨组织工程研究新生骨组织细胞来源及其作用方面的观点存在许多争议。新生组织工程骨细胞来源主要为外植入的BMSC还是体内周围细胞,目前尚不明确。
3.2支架材料及细胞标记方法的选择
目前关于骨组织工程支架材料如人工合成材料、天然衍生材料、新型复合材料等的研究较多[17-19]。无机材料中β-TCP在骨组织工程中应用广泛,其主要成分类似于骨基质的无机成分,具有良好的生物相容性、降解性以及骨传导性,其降解产物钙离子可促进局部骨生成[20-22]。本实验所使用的β-TCP为经特定材料制备技术形成的多孔结构,平均孔径400 μm,孔隙率大于70%,有利于BMSC生长,提高成骨能力[21]。采用该材料构建组织工程骨时,若无合适的种子细胞标记方法,势必干预最终的效果评估。目前常用GFP标记干细胞的方法主要包括:病毒载体转染、质粒载体转染以及直接从GFP转基因动物中获取[23-24],其中荧光蛋白标记技术是近年来迅速发展的一种新型细胞示踪技术,具有易于检测、表达稳定以及可实现活细胞观察等优势,现已广泛使用[25]。研究表明,以GFP示踪、腺病毒为载体转染BMSC,腺病毒不会对BMSC产生毒性,BMSC感染率较高,且不影响其体外多向分化潜能,为研究BMSC在体内分化和转归较好的方法[26-27]。
3.3实验结果分析
多项研究[28]表明,骨膜内富含成骨细胞和骨祖细胞,是形成新生骨的重要来源。实验选用比格犬研究种子细胞分化和转归,将标记细胞的材料不通过细胞体外成骨诱导而直接植入骨膜囊内,在此特定环境内促进骨生成[29-31]。A组新生组织来自于外植入的BMSC以及自体骨膜下的成骨细胞;B组新生组织来源于自体骨膜囊内的成骨细胞;C组单纯将材料植入皮下,可避免体内、外成骨细胞的长入。实验结果显示,A组新生骨组织具备表达GFP的能力,并且新生骨组织以及新生血管较B、C两组明显。这表明外植入的BMSC在生成组织工程骨的过程中发挥重要作用,同时也提示移植BMSC能够在骨膜下促进新生骨内微血管生成。
3.4问题及展望
由于在生成骨组织过程中,转染的BMSC表达GFP的能力随时间增加而逐渐下降[32],为GFP标记技术长期检测带来困难。为了进行更长时间的观察以明确BMSC在体内的长期转归,需在此实验基础上,继续探索出一种更为有效的种子细胞标记方法,对骨组织内新生微血管的数量以及血管内皮生长因子进行更为精确的检测。
参考文献
[ 1 ]Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411):143-147.
[ 2 ]Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4):1815-1822.
[ 3 ]Friedenstein AJ, Chailakhyan RK, Latsinik NV, et al. Stromal cells responsible for transferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo[J]. Transplantation, 1974, 17(4):331-340.
[ 4 ]Owen M. Marrow stromal stem cells[J]. J Cell Sci Suppl, 1988, 10:63-76.
[ 5 ]Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The international society for cellular therapy position statement[J]. Cytotherapy, 2006, 8(4):315-317.
[ 6 ]许刚,徐如祥,姜晓丹,等. 绿色荧光蛋白基因腺病毒载体转染大鼠骨髓间充质干细胞的实验研究[J]. 广东医学, 2008, 29(2):188-190.
[ 7 ]Wang L, Jin F, Qin A, et al. Targeting notch1 signaling pathway positively affects the sensitivity of osteosarcoma to cisplatin by regulating the expression and/or activity of caspase family[J]. Mol Cancer, 2014, 13:139.
[ 8 ]Czernik M, Fidanza A, Sardi M, et al. Differentiation potential and GFP labeling of sheep bone marrow-derived mesenchymal stem cells[J]. J Cell Biochem, 2013, 114(1):134-143.
[ 9 ]Wittenburg G, Flade V, Garbe AI, et al. Scaffold preferences of mesenchymal stromal cells and adipose-derived stem cells from green fluorescent protein transgenic mice influence the tissue engineering of bone[J]. Br J Oral Maxillofac Surg, 2014, 52(5):409-414.
[10]Kassem M. Mesenchymal stem cells: biological characteristics and potential clinical applications[J]. Cloning Stem Cells, 2004, 6(4):369-374.
[11]Bianco P, Riminucci M, Gronthos S, et al. Bone marrow stromal stem cells: nature, biology, and potential applications[J]. Stem Cells, 2001, 19(3):180-192.
[12]Seamon J, Wang X, Cui F, et al. Adenoviral delivery of the VEGF and BMP-6 genes to rat mesenchymal stem cells potentiates osteogenesis[J]. Bone Marrow Res, 2013, 2013:737580.
[13]Chamberlain JR, Schwarze U, Wang PR, et al. Gene targeting in stem cells from individuals with osteogenesis imperfecta[J]. Science, 2004, 303(5661):1198-1201.
[14]Horwitz EM, Prockop DJ, Fitzpatrick LA, et al. Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta[J]. Nat Med, 1999, 5(3):309-313.
[15]Studeny M, Marini FC, Champlin RE, et al. Bone marrow-derived mesenchymal stem cells as vehicles for interferon-beta delivery into tumors[J]. Cancer Res, 2002, 62(13):3603-3608.
[16]Nakamizo A, Marini F, Amano T, et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas[J]. Cancer Res, 2005, 65(8):3307-3318.
[17]马新芳,张静莹. 骨组织工程支架材料的研究现状与应用前景[J]. 中国组织工程研究, 2014, 18(30):4895-4899.
[18]Stevens MM. Biomaterials for bone tissue engineering[J]. Mater Today, 2008, 11(5):18-25.
[19]Bandyopadhyay A, Bose S, Das S. 3D printing of biomaterials[J]. MRS Bull, 2015, 40(2):108-115.
[20]Han D, Guan X, Wang J, et al. Rabbit tibial periosteum and saphenous arteriovenous vascular bundle as an in vivo bioreactor to construct vascularized tissue-engineered bone: a feasibility study[J]. Artif Organs, 2014, 38(2):167-174.
[21]Han D, Sun X, Zhang X, et al. Ectopic osteogenesis by ex vivo gene therapy using beta tricalcium phosphate as a carrier[J]. Connect Tissue Res, 2008, 49(5):343-350.
[22]Kokemueller H, Spalthoff S, Nolff M, et al. Prefabrication of vascularized bioartificial bone grafts in vivo for segmental mandibular reconstruction: experimental pilot study in sheep and first clinical application[J]. Int J Oral Maxillofac Surg, 2010, 39(4):379-387.
[23]宁昌,胡锴勋,余长林. 增强型绿色荧光蛋白基因转染小鼠骨髓间充质干细胞的研究[J]. 中国美容医学, 2011, 20(2):257-260.
[24]李洋,田瑜,武志超,等. 稳定转染增强型绿色荧光蛋白大鼠骨髓间充质干细胞系的建立[J]. 中国组织工程研究, 2012, 16(41):7607-7611.
[25]江汕,江千里,裴国献. 荧光基因标记技术在骨组织工程中的应用[J]. 国际骨科学杂志, 2006, 27(1):5-7.
[26]Bertone AL, Pittman DD, Bouxsein ML, et al. Adenoviral-mediated transfer of human BMP-6 gene accelerates healing in a rabbit ulnar osteotomy model[J]. J Orthop Res, 2004, 22(6):1261-1270.
[27]边素艳,盖鲁粤,叶平,等. 腺病毒载体对骨髓间充质干细胞体外分化能力的影响[J]. 中国现代医学杂志, 2010, 20(8):1152-1156.
[28]Augustin G, Antabak A, Davila S. The periosteum. Part 1: anatomy, histology and molecular biology[J]. Injury, 2007, 38(10):1115-1130.
[29]胡运生,马保安,张勇,等. 绿色荧光蛋白报告基因转染示踪体内骨髓间充质干细胞的分化[J]. 中国医师杂志, 2006, 8(10):1300-1302.
[30]Chen AC, Lin SS, Chan YS, et al. Osteogenesis of prefabricated vascularized periosteal graft in rabbits[J]. J Trauma, 2009, 67(1):165-167.
[31]Dailiana ZH, Shiamishis G, Niokou D, et al. Heterotopic neo-osteogenesis from vascularized periosteum and bone grafts[J]. J Trauma, 2002, 53(5):934-938.
[32]Oshima Y, Watanabe N, Matsuda K, et al. Behavior of transplanted bone marrow-derived GFP mesenchymal cells in osteochondral defect as a simulation of autologous transplantation[J]. J Histochem Cytochem, 2005, 53(2):207-216.
(收稿:2015-05-28;修回:2015-10-01)
(本文编辑:李昱霏)
Green fluorescent protein genes transdution and tracer the differentiation of bone mesenchymal stem cells in beaglesZHANGHai-feng1,2,DUZi-jing1,ZHAODan-yang1,HANXiu-guo2,HANDong1
.DepartmentofPlasticandReconstructiveSurgery,ShanghaiNinthPeople’sHospital,ShanghaiJiaotongUniversitySchoolofMedicine1,Shanghai200011,China;ShanghaiKeyLaboratoryofOrthopaedicImplants2,Shanghai200011,China
【Abstract】ObjectiveTo observe differentiation and transformation of bone mesenchymal stem cells (BMSCs) labeled with green fluorescent protein (GFP) technology in bone tissue engineering. Methods Adenoviral delivery of GFP genes (Ad-GFP) transfected to canine BMSCs. The morphology of BMSCs, alkaline phosphatase (ALP) and alizarin red staining were observed with the help of invert light microscope, and the expression of GFP was scrutinized by using fluorescence microscope. Once succeeding, the centrifuged BMSCs were collected and mixed with beta-tricalcium phosphate (β-TCP), then they were transplanted under tibial periosteum. The beagles using the above way to construct tissue engineering bone were marked group A, which only with β-TCP transplated into tibial periosteum were marked group B, and which with β-TCP subcutaneously placed were marked group C. In the postoperative 2 weeks, histology and immunohistochemistry results were studied and the expression of GFP was observed by laser scanning confocal microscope. Results After induced differentiation in vitro, observing BMSCs found that ALP staining and alizarin red mineralization nodules staining were positive. Histology observation revealed that compared with group B, abundant bone formed and neovascularized significantly in group A, and bone formation did not exist in group C. Immunohistochemistry staining showed that type Ⅰ collagen and platelet endothelial cell adhesion molecule-1 (CD31) were positive in group A, type Ⅰ collagen and CD31 were positive partly in group B rather than group C. The expression of typeⅠcollagen and CD31 were analyzed in group A and group B by the way of semi-quantitative immunohistochemical staining. The value of type Ⅰ collagen and CD31 had significant differences between group A and group B. The expression of GFP was observed by laser scanning confocal microscope in group A not in group B nor group C. Conclusion BMSCs is the important factor to accelerate the generation of tissue engineering bone instead of osteoblasts in surrounding. They could promote endothelial cell tube formation inside periosteum.
【Key words】Bone tissue engineering; Green fluorescent protein; Bone mesenchymal stem cells
Corresponding author:HAN DongE-mail: handong12000@163.com
DOI:10.3969/j.issn.1673-7083.2016.02.012
通信作者:韩冬E-mail: handong12000@163.com
基金项目:国家自然科学基金(81272132)

