腐植酸、EDTA、Cr(Ⅵ)调控猪粪尿废水异化Fe(Ⅲ)还原偶联VFAs的转化能力比较
何清明,邬红东,石广军,罗 颖
(1.泰州学院医药与化学化工学院,江苏泰州225300;2.重庆大学三峡库区生态环境教育部重点实验室,重庆400045)
腐植酸、EDTA、Cr(Ⅵ)调控猪粪尿废水异化Fe(Ⅲ)还原偶联VFAs的转化能力比较
何清明1,2,邬红东2,石广军1,罗颖1
(1.泰州学院医药与化学化工学院,江苏泰州225300;2.重庆大学三峡库区生态环境教育部重点实验室,重庆400045)
摘要:以人工合成Fe(OH)3作为电子受体,在猪粪尿废水中添加具有铁还原能力的菌株,厌氧恒温培养,通过对猪粪尿废水中添加不同浓度腐植酸、EDTA、Cr(Ⅵ),揭示3种典型理化因素调控猪粪尿废水中异化Fe(Ⅲ)还原偶联挥发性脂肪酸(Volatile fatty acids,VFAs)转化能力。结果表明,电子穿梭体腐植酸促进Fe(Ⅲ)还原,加速VFAs降解,而络合剂EDTA和重金属Cr(Ⅵ)则会阻碍Fe(Ⅲ)还原,减缓VFAs降解。虽然三种影响因子影响机理不同、途径不同,但最终Fe(Ⅲ)还原和VFAs平衡点不变。
关键词:异化Fe(Ⅲ)还原;EDTA;腐植酸;Cr(Ⅵ);VFAs
何清明,邬红东,石广军,等.腐植酸、EDTA、Cr(Ⅵ)调控猪粪尿废水异化Fe(Ⅲ)还原偶联VFAs的转化能力比较[J].农业环境科学学报, 2016, 35 (3):590-595.
HE Qing-ming, WU Hong-dong, SHI Guang-jun, et al. A comparative study on ability of humic acids, EDTA and Cr(Ⅵ)to regulate dissimilatory Fe(Ⅲ)-mediated transformation of VFAs in swine wastewater[J]. Journal of Agro-Environment Science, 2016, 35(3): 590-595.
畜禽养殖业集约化、规模化发展在为市场提供丰富畜禽产品的同时,也由于畜禽粪尿产生量大且集中,且得不到快速处理而极易产生恶臭。与畜禽粪尿引发的土壤、水体污染相比,恶臭是一种多组分混合物形成的感官污染,很难量化和评价。研究表明[1],恶臭的强度与其组成物分子浓度的对数成正比,这就意味着即使恶臭的组成物浓度下降了90%,而人的感觉却只有50%。恶臭的这些特征增加了其控制的难度和复杂性。近几十年来,许多研究者尽力阐明畜禽粪尿恶臭各组分气体之间的关系,试图寻找到恶臭的指示物。Anja等[2]报道,虽然氨在猪粪尿中浓度较高,但氨在评估粪尿恶臭强度时却被证明是一个很差的参数;Zhang等[3]的研究结果显示,相对于其他指标,长链或具有分支的挥发性脂肪酸(Volatile fatty acids,VFAs)在畜禽废水中作为恶臭的指示性参数更为合适;Zahn等[4]在对29个养猪场的调查发现C2~C9VFAs的存在与猪场空气质量下降存在着最大相关性。因此,减少VFAs的形成或及时对其转化可能在猪场粪尿恶臭污染的控制过程中起到重要作用。
异化Fe(Ⅲ)还原通常也叫Fe(Ⅲ)呼吸,是一种以Fe(Ⅲ)为终端电子受体的微生物代谢过程,这种微生物呼吸形式是水中沉积物、淹水土壤及水生植物中最具地球化学意义的过程之一[5]。除Fe(Ⅲ)外,许多异化Fe(Ⅲ)还原菌还可利用其他的一种或多种电子受体[6],并在这些电子受体还原过程中偶联芳香烃、卤代芳烃化合物[7]、染料化合物[8]以及长链脂肪酸[9]等多种有机化合物的降解。异化Fe(Ⅲ)还原过程的这些特点可能在畜禽粪尿废水挥发性脂肪酸(VFAs)等重要恶臭指示物的污染控制中发挥重要作用。
国内外许多学者[10-11]发现,不仅异化Fe(Ⅲ)还原菌在厌氧或兼性厌氧条件下能以Fe(Ⅲ)为电子受体氧化VFAs,Lovley等[12]还发现,Fe(Ⅲ)还原在水或土壤中的有机污染物生物降解过程中也有巨大的潜力。Coates等[13]发现,异化Fe(Ⅲ)还原可以加速挥发性脂肪酸的降解。猪粪尿废水成分复杂多样,并且含有油分、盐分等多种生物抑制性因子。近年来,Sven、Jing和David等分别通过研究发现电子穿梭体[14]、络合物络合剂[15]和重金属[16]等环境理化因子会对异化Fe(Ⅲ)还原过程反应产生不同程度的影响。因此,深入探讨腐植酸、EDTA、Cr(Ⅵ)调控畜禽废水中异化Fe(Ⅲ)还原偶联VFAs转化能力影响,对于猪粪尿废水中污染物降解及其特征具有重要的理论和实际意义。
1 材料和方法
1.1样品采集与铁还原微生物富集
供试猪粪尿样品采自重庆大学北门附近养猪场化粪池底部废水,该养猪场为规模化养猪场,在附近具有一定的代表性。将采集的猪粪尿废水样品用丁基合成橡胶塞快速塞上,加铝盖密封,并用黑色包装纸包裹使其避光,带回实验室后放入4℃冰箱备用。猪粪尿样品理化性质:pH 7.67,总铁226.96 mg·L-1,Fe(Ⅱ)122.33 mg·L-1,Fe(Ⅲ)104.63 mg·L-1,总VFAs 2976 mg·L-1。
试验所用的腐植酸密封保存,其中灰分10%、含铁量0.3%,含水率8%;试验所用的电子受体Fe(OH)3参照Schwertman等[17]的方法制备。铁还原菌富集培养基[18]成分:NaHCO32.50 g·L-1,NH4Cl 0.25 g·L-1, NaH2PO4·H2O 0.60 g·L-1,KCl 0.10 g·L-1。维生素复合溶液组成:生物素2 mg·L-1,叶酸2.0 mg·L-1,维生素B6 10.0 mg·L-1,核黄素10.0 mg·L-1,硫胺素5 mg·L-1,烟酸5.0 mg·L-1,泛酸5.0 mg·L-1,B-12 0.1 mg·L-1,氨基苯甲酸5.0 mg·L-1,硫辛酸5.0 mg·L-1。矿物质复合溶液组成:MgSO43.0 g·L-1,MnSO4·H2O 0.5 g·L-1,NaCl 1.0 g·L-1,FeSO4·7H2O 0.1 g·L-1,CaCl2·2H2O 0.1g·L-1,CoCl2·6H2O 0.1 g·L-1,ZnCl20.13 g·L-1,CuSO4·5H2O 0.01 g·L-1,AlK(SO4)2·12H2O 0.01 g·L-1,H3BO30.01 g· L-1。
将上述液体培养基成分灭菌后,分装入100 mL血清瓶,每瓶加入液体培养基50 mL,接种加入猪粪尿废水10 mL,每个血清瓶通氮气2 min后,加塞密封,塞外用两层封口膜密封。将血清瓶2个一组用避光纸包裹,放于厌氧培养箱中于30℃培养3 d,当血清瓶底部均出现白色氢氧化亚铁沉淀时,表明血清瓶中含有异化铁还原菌。照此方法富集6次以上,以便得到富集程度较高的异化Fe(Ⅲ)还原微生物。
1.2试验设计及测定方法
试验以人工合成Fe(OH)3作为电子受体,在10 mL血清瓶中加入1 mL人工合成Fe(OH)3,加盖后高压灭菌30 min;冷却后分别加入液体培养基1.0 mL,50 mmol·L-1的K2HPO4-KH2PO4缓冲液2 mL,控制体系的pH值为7.0左右,富集培养菌液1 mL,猪粪尿2 mL,分别添加不同浓度影响因子处理:腐植酸浓度分别为0、200、300、500 mmol·L-1;重金属Cr(Ⅵ)浓度为0、0.1、0.05、0.025 mmol·L-1;EDTA浓度为0、200、300、500 mmol·L-1。最终溶液体积控制在7 mL。将已配置好的血清瓶通氮气3~5 min除氧,避光密封,置于恒温培养箱中30℃培养。试验时间为2个月,分别在第0、1、3、6、10、15、22、30、40、50、60 d进行测定。采样时,每次取出不同处理各1瓶,摇匀,测定pH、VFAs、Fe(Ⅱ)、Fe(Ⅲ)。
结合实验样品的理化性质及各测定方法的适用范围选用各指标的测定方法。反应器内料液的pH值采用PHS-3C型pH计测定,Fe(Ⅱ)和Fe(Ⅲ)分别采用邻菲罗啉分光光度法和原子吸收分光光度法测定,VFAs采用挥发性脂肪酸总量的比色测定法测定[19]。
2 结果与分析
2.1不同浓度电子穿梭体腐植酸对异化铁还原偶联VFAs能力的影响
猪粪尿废水中添加Fe(OH)3作为主要电子受体,研究不同浓度电子穿梭体腐植酸对Fe(Ⅲ)还原的影响,结果如图1所示。30℃厌氧条件下添加不同浓度的腐植酸可在一定程度上增加Fe(Ⅲ)还原速率,相对于未添加腐植酸的空白组可以发现,在1~2 d内,空白组Fe(Ⅱ)值几乎没有变化,而添加腐植酸的猪粪尿废水中Fe(Ⅱ)值呈指数性增长。但腐植酸浓度在200~500 mmol·L-1内时,添加腐植酸浓度的大小对Fe(Ⅲ)还原速率影响不大。Fe(Ⅲ)还原速率依次为V高腐植酸≈V中腐植酸≈V低腐植酸>V空白。从实验曲线可以看出,曲线并不是光滑圆弧状,而是呈上下起伏波浪状,可能是受到猪粪尿废水中一种或多种制约因素影响所造成。从图1还可以明显看出,到第22 d后,腐植酸对Fe(Ⅲ)还原影响逐渐减少,最终各组的Fe(Ⅱ)和Fe(Ⅲ)值趋于稳定且很接近。
猪粪尿废水中,添加不同浓度腐植酸对异化Fe(Ⅲ)还原偶联VFAs影响的变化曲线如图2所示。反应初期,VFAs值有较大的上升,到第6 d开始有明显的回落。由图1和图2可知,在第10~25 d,Fe(Ⅲ)迅速被还原过程中VFAs值大幅度下降,并且添加腐植酸浓度越大这种现象越明显。研究发现:添加不同浓度的腐植酸均可以加快猪粪尿中VFAs降解速率,但与加入腐植酸的浓度大小无关。
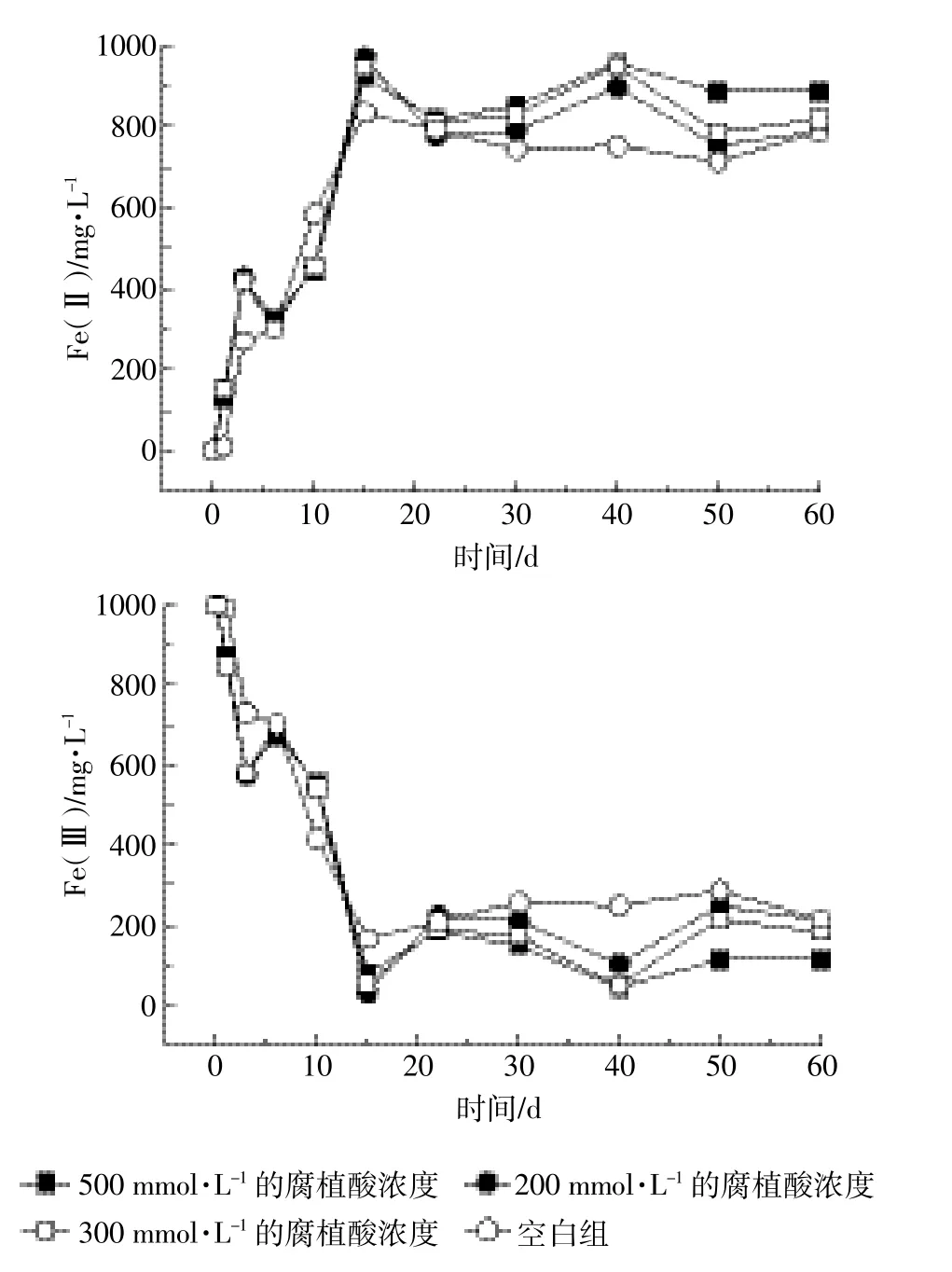
图1 厌氧条件下添加不同浓度腐植酸后Fe(Ⅱ)和Fe(Ⅲ)变化曲线Figure 1 Effect of adding humic acids at different concentrations on Fe(Ⅱ)and Fe(Ⅲ)dynamics under anaerobic conditions
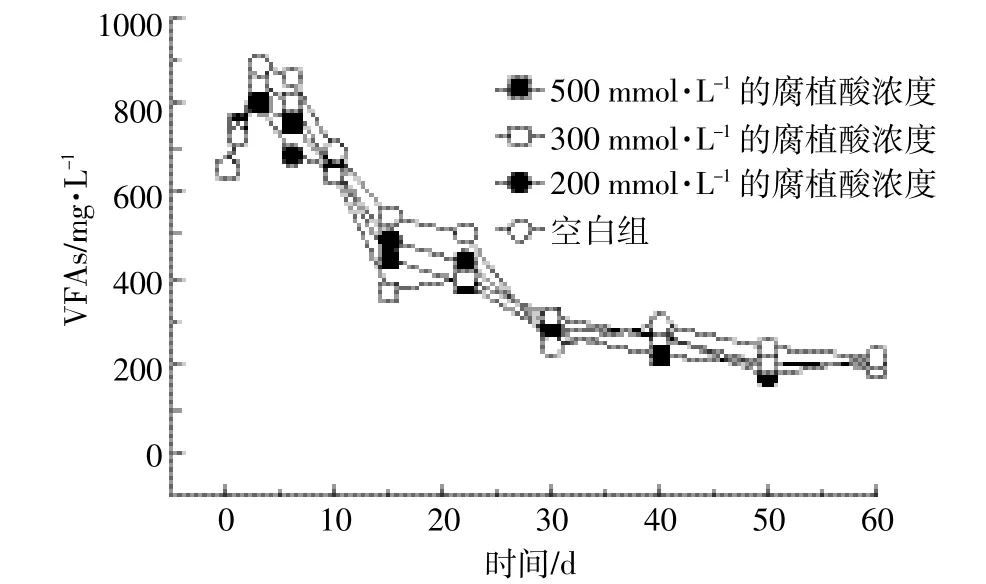
图2 厌氧条件下添加不同浓度腐植酸后VFAs变化曲线Figure 2 Effect of adding humic acids at different concentrations on dynamics of VFA degradation
2.2不同浓度Cr(Ⅵ)对异化铁还原偶联VFAs能力的影响
通过厌氧恒温培养试验添加不同浓度的重金属离子对异化Fe(Ⅲ)还原偶联降解VFAs过程的影响如图3和图4所示。
从图3可以看出,在Fe(OH)3为主要电子受体情况下,添加不同浓度Cr(Ⅵ)对猪粪尿废水中异化Fe(Ⅲ)还原影响与未添加Cr(Ⅵ)的空白组相比,添加Cr(Ⅵ)可以抑制Fe(Ⅱ)的生成,并且在一定范围内,随着Cr(Ⅵ)浓度增加,Fe(Ⅲ)还原受到抑制程度增大。在初始1~3 d中,异化Fe(Ⅲ)细菌生长并没有太大的滞后性,相对来说能较快地适应环境。但是在第3 d以后,Cr(Ⅵ)对异化Fe(Ⅲ)的还原抑制性开始显现出来,添加Cr(Ⅵ)的猪粪尿中Fe(Ⅱ)的产生明显有相对的滞后性,到第35 d以后,Cr(Ⅵ)对Fe(Ⅲ)还原抑制作用减小,最终Fe(Ⅱ)累积量接近1000 mg·L-1。
由图4可以看出,在猪粪尿废水中加入Cr(Ⅵ),VFAs的降低趋势被抑制,并且随着Cr(Ⅵ)浓度增加这种现象越明显。由图3和图4可知:在Fe(Ⅱ)浓度呈指数性增长同时,VFAs也相应地发生了较大的变化,并且在第40 d左右,猪粪尿废水中各值趋于平稳,到第60 d左右,不同浓度间Fe(Ⅱ)、Fe(Ⅲ)、VFAs值已相差无几。
2.3络合剂EDTA对异化Fe(Ⅲ)还原偶联VFAs能力的影响
通过厌氧恒温培养试验添加不同浓度EDTA对异化Fe(Ⅲ)还原的影响如图5所示。在1~10 d内,Fe(Ⅱ)累计明显被抑制,颜色从浑浊变为清澈,并出现黄色透明物质。在实验过程中,异化Fe(Ⅲ)还原过程中变化曲线出现明显波动现象,可能是由于猪粪尿废水中存在的一些还原类离子干扰了Fe(Ⅲ)的还原过程,到10 d以后,这种“EDTA抑制效应”开始减弱,最终各个曲线达到稳定的同一平衡值。
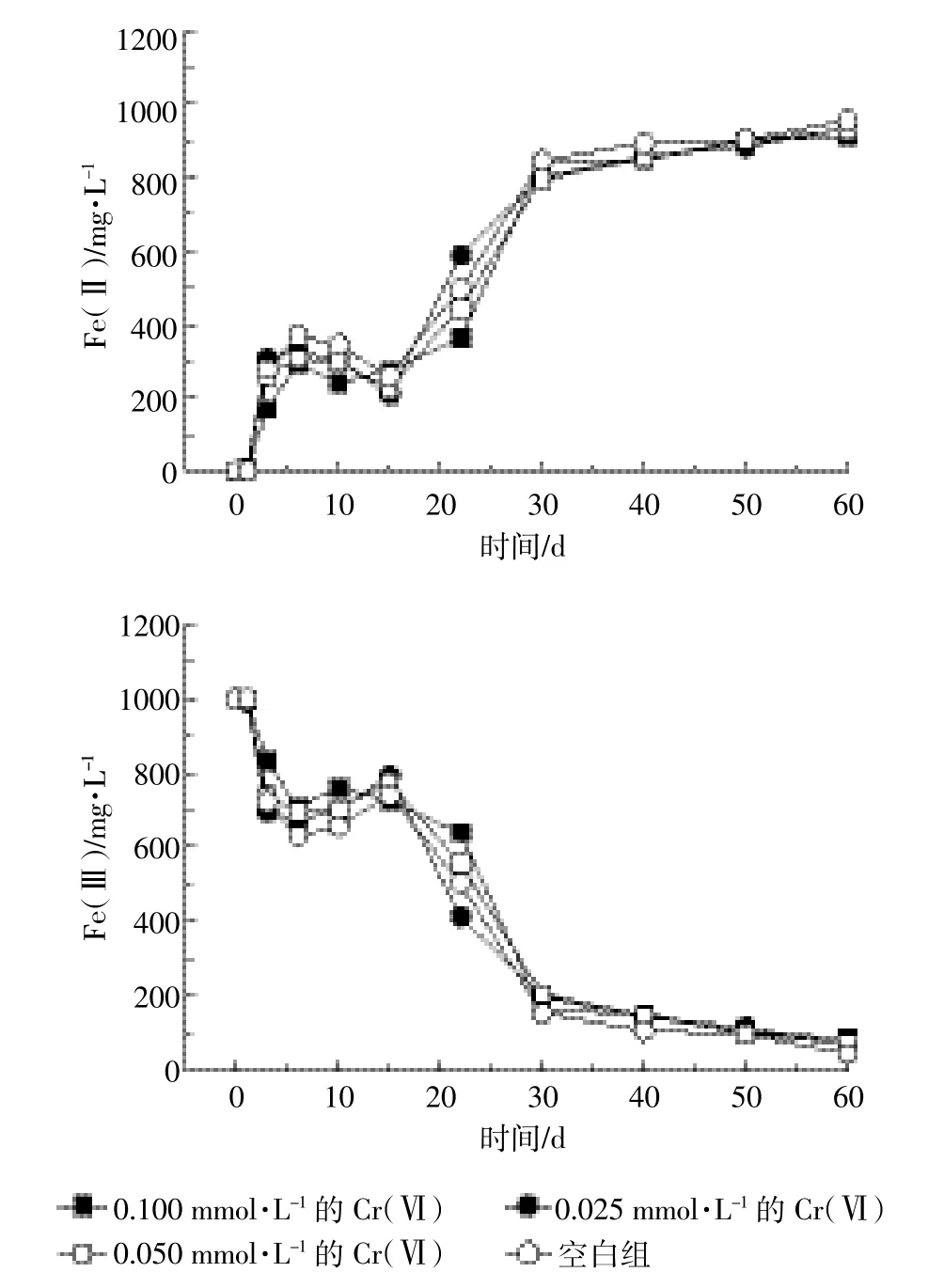
图3 30℃厌氧条件下添加不同浓度Cr(Ⅵ)后Fe(Ⅱ)和Fe(Ⅲ)变化曲线Figure 3 Effect of adding Cr(Ⅵ)at different concentrations on Fe(Ⅱ)and Fe(Ⅲ)dynamics under anaerobic conditions
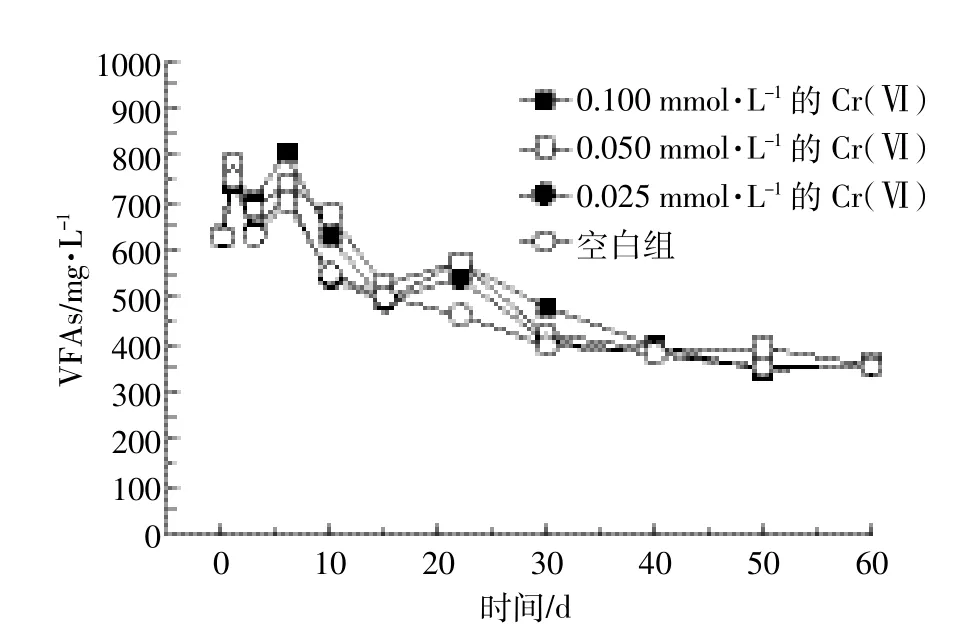
图4 30℃厌氧条件下添加不同浓度Cr(Ⅵ)后VFAs变化曲线Figure 4 Effect of adding Cr(Ⅵ)at different concentrations on dynamics of VFA degradation under anaerobic conditions
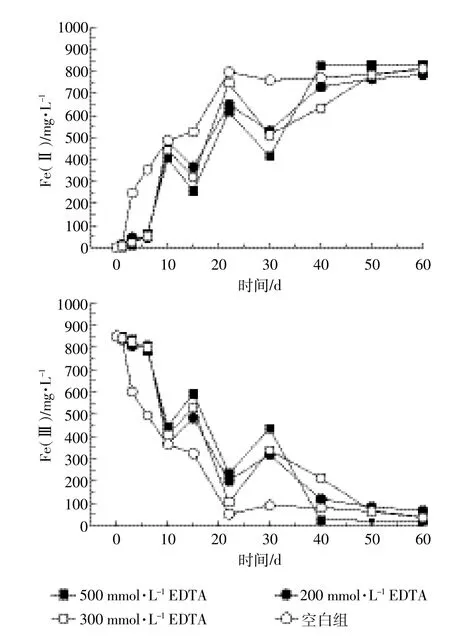
图5 30℃厌氧条件下添加不同浓度EDTA后Fe(Ⅱ)和Fe(Ⅲ)变化曲线Figure 5 Effect of adding EDTA at different concentrations on Fe(Ⅱ)and Fe(Ⅲ)dynamics under anaerobic conditions
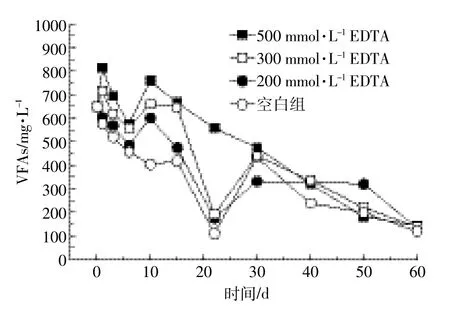
图6 厌氧条件下添加不同浓度EDTA后VFAs变化曲线Figure 6 Effect of adding EDTA at different concentrations on dynamics of VFA degradation under anaerobic conditions
由图6可以看出,添加500 mmol·L-1EDTA的试样VFAs降解速率最慢,空白组VFAs降解速率最快,VFAs降解速率与添加EDTA浓度大小成反比。由图5和图6对比可知,VFAs的快速降解和Fe(Ⅲ)还原都是在10 d左右开始有较大幅度的变化,到40~50 d左右VFAs和Fe(Ⅱ)值趋于一定值。
3 讨论
腐植酸可促使异化Fe(Ⅲ)还原细菌快速适应新的环境,腐植酸能通过螯合、离子交换、吸附等形式与铁氧化物形成配合物,从微生物膜蛋白接受电子,然后将电子传递给Fe(Ⅲ)复合物,从而加速Fe(Ⅲ)的还原。本实验中添加腐植酸可以加速Fe(Ⅲ)还原,但还原速率相差不大,是因为腐植酸浓度相对于Fe(Ⅲ)还原电子过量,造成Fe(Ⅲ)还原速率不受电子穿梭体加入浓度的影响,也可能是由于猪粪尿废水自身所特有的高抗生素、高氨氮等因素对细菌活性有抑制作用。到反应后期由于Fe(Ⅲ)几乎被还原殆尽,腐植酸作为电子穿梭体的作用逐渐减少,致使最终反应平衡点一样。实验开始时,由于在厌氧条件下,粪便中的高分子有机物水解发酵降解产生大量VFAs,VFAs的产生速率大于它的降解速率,致使初期VFAs值有上升趋势,但是随着蛋白质等高分子有机物消耗殆尽,VFAs值明显回落。在Fe(Ⅲ)迅速被还原过程中,VFAs值大幅度下降,并且添加腐植酸浓度越大这种现象越明显。腐植酸自身具有氧化还原作用,能够在有机污染物化学降解转化过程中作为电子传递媒介,添加腐植酸会改变铁表面的活性位点,从而影响污染物的去除效率[20]。从图2和图3可以看出,不论是否添加不同浓度腐植酸并不影响最终的平衡点。这证实了腐植酸起到传递电子的作用不影响最终平衡点位,对Fe(Ⅲ)的还原偶联VFAs降解有促进作用。
由于Cr(Ⅵ)/Cr(Ⅲ)的氧化还原电位要低于Fe(Ⅲ)/Fe(Ⅱ),很多异化铁还原菌同时具备还原重金属Cr(Ⅵ)的能力。因此,在厌氧反应过程中,可能以Fe(Ⅲ)/Fe(Ⅱ)作为电子穿梭体,促进Cr(Ⅵ)的还原,从而使得Fe(Ⅱ)的浓度在反应前期没有发生明显的变化。另一方面,重金属Cr(Ⅵ)的存在也在一定程度上对微生物具有毒害作用,从而抑制微生物的活性。Cr(Ⅵ)被还原促使异化Fe(Ⅲ)细菌不能有效地将Fe(Ⅲ)作为电子受体,进而降低异化Fe(Ⅲ)还原偶联VFAs的能力。在猪粪尿废水中本来就存在抗生素、高盐分等因素抑制异化铁细菌的生长,所以添加Cr(Ⅵ)虽然可以抑制异化铁细菌生长,浓度高的相对于浓度低的有微幅的减少,但不同浓度间Fe(Ⅱ)差异不大。反应后期由于Cr(Ⅵ)被还原,致使在Cr(Ⅵ)影响下的异化铁细菌活性逐渐恢复并最终达到平衡。
基于统计学分析,同时对腐植酸、Cr(Ⅵ)、EDTA进行显著差异性分析发现,在反应波动期(第1~16 d):腐植酸和重金属Cr(Ⅵ)虽然分别可在一定程度上促进和抑制异化Fe(Ⅲ)还原,但二者对VFAs降解的差异性不是很显著;添加不同浓度的EDTA对猪粪尿废水中的VFAs具有极显著差异性(P=0.002 1<0.05)。结合不同Cr(Ⅵ)、EDTA对VFAs的影响试验不难发现,重金属Cr(Ⅵ)和EDTA都可以抑制Fe(Ⅲ)还原,但在一定浓度范围内重金属对异化Fe(Ⅲ)还原和VFAs降解的抑制性明显不如EDTA。添加络合剂EDTA对猪粪尿废水中异化Fe(Ⅲ)还原有表面上的“抑制作用”。由于铁离子与EDTA形成稳定的黄色络合物,EDTA与邻菲罗啉显色剂竞争亚铁离子,促使造成测定的Fe(Ⅱ)值比实际的Fe(Ⅱ)值要低,加入的EDTA浓度越大,这种“抑制”现象越明显。在异化铁还原过程中出现明显波动现象,可能是由于猪粪尿废水中存在的一些还原类离子干扰了Fe(Ⅲ)的还原过程,到第10 d以后,这种“EDTA抑制效应”开始减弱,原因可能是后期EDTA络合能力达到饱和。在一定浓度范围内,向猪粪尿废水中添加的EDTA浓度越高,VFA降解速率越慢,EDTA可以明显抑制VFAs的降解。造成这种现象的原因是EDTA和金属Fe元素络合,EDTA与Fe(Ⅲ)的络合常数几乎是它与Fe(Ⅱ)的络合常数的2倍,因而降低了EDTA对异化Fe(Ⅲ)还原偶联VFAs的可实现性。后期这种现象有所减少,可能是Fe(Ⅲ)离子络合物还原酶作用下,被还原成Fe(Ⅱ)离子络合物,然后Fe2+被输送到细胞体内得以利用,使得不同浓度EDTA影响下最终的VFAs值接近。综上可证实:络合剂EDTA对异化Fe(Ⅲ)初期还原偶联VFAs有明显的抑制作用,但这种抑制作用不会改变后期的平衡点。
4 结论
(1)腐植酸不仅可以作为电子穿梭体还可作为螯合剂,促进异化Fe(Ⅲ)还原;重金属Cr(Ⅵ)和EDTA可以抑制Fe(Ⅲ)还原,在一定浓度范围内,重金属对异化Fe(Ⅲ)还原和VFAs降解的抑制性明显不如EDTA。
(2)Fe(Ⅲ)还原量与VFAs降解有密切关系。虽然三种影响因子的影响机理不同、途径不同,但最终都可以使多数Fe(Ⅲ)还原并使猪粪尿废水中的VFAs降解。
(3)尽管畜禽废水成分复杂多样,含有较多的抑制性因子制约异化铁还原菌代谢,但通过添加铁还原菌株和不同影响因子,异化铁还原和VFAs的降解颇为显著。这同时表明,利用异化Fe(Ⅲ)还原偶联VFAs的生物修复过程存在巨大的研究潜力。
参考文献:
[1]黄灿,唐新燕,彭绪亚,等.猪粪尿中添加不同底物对挥发性脂肪酸和本土菌群的影响研究[J].农业环境科学学报, 2009, 28(2):388-392. HUANG Can, TANG Xin-yan, PENG Xu-ya, et al. Effect of adding different substrates to swine waste slurries on volatile fatty acid sand indigenousbacterial genera[J]. Journal of Agro-Environment Science, 2009, 28(2):388-392.
[2] Anja K, Kristina H P, Per H N, et al. Bacterial community structure of a full-scale biofilter treating pig house exhaust air[J]. Systematic and Applied Microbiology, 2011, 34(5):344-352.
[3] Zhang Z J, Zhu J. Characteristics of solids, BOD5and VFAs in liquid swine manure treated by short-term low-intensity aeration for longterm storage[J]. Bioresource Technology, 2006, 97(1):140-149
[4] Zahn J A, DiSpirito A A, Brooks B E, et al. Correlation of human olfactory responses to airborne concentrations of malodorous volatile organic compounds emitted from swine effluent[J]. Journal of Environmental Quality, 2001, 30(2):624-634.
[5] Hossain M A, Kevin T Finneran. Ferric iron amendment increases Fe(Ⅲ): Reducing microbial diversity and carbon oxidation in on-site wastewater systems[J]. Chemosphere, 2013, 90(4):1435-1443.
[6] Cao J Y, Li Y Y, Zhang G J, et al. Effect of Fe(Ⅲ)on the biotreatment of bioleaching solutions using sulfate-reducing bacteria[J]. International Journal of Mineral Processing, 2013, 125(10):27-33.
[7] Dong X Y, Zhang Y, Zhou J T. Fe(Ⅱ)EDTA-NO reduction coupled with Fe(Ⅱ)EDTA oxidation by a nitrate- and Fe(Ⅲ)-reducing bacterium[J]. Bioresource Technology, 2013, 138(1):339-344.
[8] Coates J D, Cole K A, Michaelidou U, et al. Biological control of hog waste odor through stimulated microbial Fe(Ⅲ)reduction[J]. Applied and Environmental Microbiology, 2005, 71(8):4728-4735
[9] Nahm K H. Environmental effects of chemical additives used in poultry litter and swine manure[J]. Critical Reviews in Environmental Science and Technology, 2005, 35(5):487-513.
[10] Zhou Z M, Jing G H, Zheng X J. Reduction of Fe(Ⅲ)EDTA by Klebsiella sp. strain FD-3 in NOx scrubber solutions[J]. Bioresource Technology, 2013, 132:210-216.
[11] Zhang J X, Zhang Y B, Chang J H, et al. Biological sulfate reduction in the acidogenic phase of anaerobic digestion under dissimilatory Fe(Ⅲ)reducing conditions[J]. Water Research, 2013, 47(6):2033-2040.
[12] Lovley DR, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ)and Mn(Ⅳ)reduction[J].Advance in Microbiology Physiology,2004,49:219-286.
[13] Coates J D, Lonergan D J, Philips E J, et al. Desulfuromonas palmitatis sp. nov., a marine dissimilatory Fe(Ⅲ)reducer that can oxidize longchain fatty acids [J]. Arch Microbiol, 1995, 164(6):406-413.
[14] Sven N H, Li X Z, Basen M, et al. Humic substance-mediated Fe(Ⅲ)reduction by a fermenting Bacillus strain from the alkaline gut of a humus-feeding scarab beetle larva[J]. Systematic and Applied Microbiology, 2012, 35(4):226- 232.
[15] Jing G H, Zhou J, Zhou Z M, et al. Reduction of Fe(Ⅲ)EDTA in a NOx scrubbing solution by magnetic Fe3O4chitosan microspheres immobilized mixed culture of iron-reducing bacteria[J]. Bioresource Technology, 2012, 108:169-175.
[16] Iwahori K, Watanabe J I, Tani Y, et al. Removal of heavy metal cations by biogenic magnetite nanoparticles produced in Fe(Ⅲ)-reducing microbial enrichment cultures[J]. Journal of Bioscience and Bioengineering, 2014, 117(3):333-335.
[17] Schwertmann U, Cornll R M. Iron oxides in the laboratory[M]. Prepartion and Charcterization, VCH , Weinheim, 1991:69-144.
[18] Lovley D. Dissimilatory Fe(Ⅲ)-and Mn(Ⅳ)-reducing prokaryotes[J]. Prokaryotes, 2006, 2:635-658.
[19]任南琪,王爱杰.厌氧生物技术原理与应用[M].北京:化学工业出版社, 2004:315-317. REN Nan-qi, WANG Ai-jie. Anaerobic biological technology principle and application[M]. Beijing:Chemical Industry Press, 2004:315-317.
[20] Mayumi H, Katsumi S, Motoyuki M. Reduction process of Cr(Ⅵ)by Fe(Ⅱ)and humic acid analyzed using high time resolution XAFS analysis[J]. Journal of Hazardous Materials, 2015, 285(21):140-147.
A comparative study on ability of humic acids, EDTA and Cr(Ⅵ)to regulate dissimilatory Fe(Ⅲ)-mediated transformation of VFAs in swine wastewater
HE Qing-ming1,2, WU Hong-dong2, SHI Guang-jun1, LUO Ying1
(1. College of Pharmacy and Chemistry & Chemical Engineering, Taizhou University, Taizhou 225300, China; 2. Key Laboratory of the Three Gorges Reservoir Region's Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China)
Abstract:Research has showed that environmental factors influence dissimilatory Fe(Ⅲ)-mediated transformation of VFAs in water. Here we examined the effects of humic acids, EDTA and Cr(Ⅵ)at different concentrations on the ability of dissimilatory Fe(Ⅲ)to regulate the degradation of VFAs in swine wastewater at constant temperatures. The reduction of Fe(Ⅲ)oxides was promoted by addition of humic acid to swine wastewater, and the rate of VFAs degradation was accelerated by increasing amount of humic acid. However, trisodium EDTA and Cr(Ⅵ)inhibited the reduction of Fe(Ⅲ)and slowed down the degradation of VFAs. Although these three factors had different mechanisms and processes influencing Fe(Ⅲ)reduction, the final reduction of Fe(Ⅲ)and the balance points of VFAs remained same.
Keywords:dissimilatory Fe(Ⅲ)reduction; EDTA; humic acids; Cr(Ⅵ); VFAs
作者简介:何清明(1987—),男,河南新乡人,博士,主要从事有机固体废物处理和环境微生物方面的研究。E-mail:123heqingming@163.com
基金项目:泰州市科技支撑计划(社会发展)项目(SSF20150075);江苏省高校自然科学研究面上项目(15KJD610005);江苏省高等学校大学生创新创业训练计划项目(201512917009Y)
收稿日期:2015-03-27
中图分类号:X713
文献标志码:A
文章编号:1672-2043(2016)03-0590-06
doi:10.11654/jaes.2015.03.024

