布氏杆菌感染性腹主动脉瘤腔内治疗1例——病例报道及文献复习
刘 端,刘 秀,刘 暴,宋晓军,郑月宏
布氏杆菌感染性腹主动脉瘤腔内治疗1例——病例报道及文献复习
刘 端,刘 秀,刘 暴*,宋晓军,郑月宏
(中国医学科学院北京协和医院血管外科,北京 100730)
感染性动脉瘤较为罕见,而布氏杆菌感染引起腹主动脉瘤极为罕见。感染性主动脉瘤经典的治疗术式是彻底清创,解剖外建立血管通路,结合围术期应用抗生素治疗。但近年来主动脉腔内修复术的应用逐渐有了较多的报道,且取得较好的疗效。我们报道了感染性腹主动脉瘤患者行腔内修复术1例并进行相关文献复习。作者回顾1例布氏杆菌引起的感染性腹主动脉瘤患者的临床资料。该患者为76岁男性,之前无相关感染病史。主要表现为发热、腹部搏动性包块和腰腹部疼痛。术前外周血培养提示布氏杆菌感染,给予多西环素治疗有效。CT血管造影提示腹主动脉远端假性动脉瘤。入院后行腔内修复术,术后继续应用敏感抗生素治疗,定期随访。回顾之前发表的其他病例数据,总结布氏杆菌感染性腹主动脉瘤腔内治疗的相关经验。经血管腔内放置覆膜支架修复联合抗生素治疗,手术成功;出院后随访4个月,随访4个月后,患者生命体征正常。因此,对于布氏杆菌引起的感染性动脉瘤,在术前充分抗感染、控制血压,术后长期应用抗生素的前提下,进行腔内修复治疗的思路是可行的。
动脉瘤,感染性;腹主动脉瘤;血管腔内治疗;布氏杆菌
感染性腹主动脉瘤(infected abdominal aortic aneurysm,IAAA)在人群中较为罕见,其发病率约占所有腹主动脉瘤的0.85%~1.30%[1]。由于动脉壁及其周围组织感染的进展,动脉瘤可迅速扩张导致破裂;而患者往往合并脓毒症以及多种严重的基础疾病,因而此种动脉瘤较难治愈,预后差,致死率高。传统治疗IAAA的方法主要是人工血管建立旁路,感染灶彻底清创,术后长期应用抗生素[1]。但该术式创伤大,难度高,在临床上难于推广。近年许多学者报道了IAAA的腔内治疗,取得较好疗效。本文报道1例布氏杆菌引起的IAAA患者,急诊行腔内治疗成功,现报道如下。
1 病例摘要
1.1 一般资料
患者男性,76岁,主因“间断发热1年,发现腹部搏动性包块5个月,腰腹部疼痛2个月”入院。患者于1年前无明显诱因出现间断发热,中低热为主(37.4℃~38.5℃)。5个月前偶然发现左下腹搏动性包块,约7cm×7cm大小,质韧,不可推动,无腹痛、腹泻、恶心、呕吐,无尿频、尿急症状。2个月前患者出现持续性腹痛,伴腰背部疼痛,疼痛为撕裂样跳痛,严重时影响睡眠,变动体位后疼痛不能缓解。外院行胃、肠镜检查提示“胃溃疡、结肠黑变病”,行对症止痛治疗无效。后患者反复低热,且上述疼痛症状逐渐加重。入院前2周腹部疼痛明显加重,就诊于外院,给予头孢哌酮/舒巴坦(舒普深,cefoperazone sulbactam,Sulperazone)等抗生素治疗无效;同时行血培养,之后培养结果提示布氏杆菌感染,遂给予多西环素(doxycycline)抗感染治疗,体温逐渐下降至36.5℃~37.0℃。同时严格控制患者血压在<130mmHg(1mmHg=0.133kPa),控制心率在<90次/min。入院前2d患者诉腹痛加重,行腹主动脉CT血管造影(CT angiography,CTA)检查提示:腹主动脉远端假性动脉瘤(图1),遂转入我院急诊科。患者既往发现高血压20余年,最高达170/100mmHg,现口服厄贝沙坦氢氯噻嗪片(irbesartan and hydrochlorothiazide tablets)150mg/12.5mg,1次/d,控制良好。入院后追问患者病史提示:患者曾因做“贩售羊皮”生意以及屠宰工作,长期接触羊群及其肉制品,可能为布氏杆菌感染的重要途径。
1.2 入院查体
体温36.7℃,心率80次/min,血压144/66mmHg。腹部偏左可触及直径约7cm搏动性包块,伴轻压痛,全腹无反跳痛、肌紧张,四肢动脉搏动均良好。入院后相关检查结果如下。血常规:白细胞10.54×109/L,中性粒细胞70.5%。红细胞沉降率13mm/h,C反应蛋白1.24mg/L,降钙素原0.11μg/L,血电解质基本正常。入院后给予保守治疗维持生命体征平稳,同时给予利福平(rifampicin)、米诺环素(minocycline)、莫西沙星(moxifloxacin)等抗生素控制感染,积极完善术前准备后急诊行腹主动脉瘤腔内修复术治疗。
1.3 手术方式
取仰卧位,双侧股动脉逆行穿刺,预埋血管缝合器。肝素化后,沿右股动脉导管鞘置入标记导管,上行达L1水平,血管造影显示:肾下腹主动脉近远端双髂动脉分叉处巨大偏心性动脉瘤,测量肾下腹主动脉直径约23mm,双侧髂总动脉直径约12mm(图2)。导管置入瘤腔内,紧靠瘤壁吸取血液样本送检细菌培养。右侧股动脉置入Lunderquist导丝,沿导丝植入28-16-145覆膜支架主体(Medtronic,ENDURANT,置入前经多西环素浸泡处理),覆膜支架上缘平双肾动脉开口以远释放。释放完毕后,自左侧股动脉置入导丝、导管,尝试选择进入主体左侧髂支,未果。造影显示:左侧髂支进入假性动脉瘤瘤腔内(图3,图4)。尝试自右侧髂支选择进入左髂支,未果。遂穿刺左肱动脉,置入导管鞘,导丝、导管配合上行达主动脉弓,沿降主动脉、腹主动脉下行,选择进入覆膜支架左髂支,导丝自左髂支进入假性动脉瘤瘤腔内。至左股动脉置入导丝、导管,配合进入瘤腔内,更换为抓捕器,捕捉住自上而入的导丝(图5),建立左肱−左股动脉导丝系统。更换为Lunderquist导丝,沿导丝置入16-16-80覆膜支架髂支,远端瞄定左髂内、髂外动脉分叉处释放。以CODA球囊分别于近端瘤颈、远端瘤颈、支架重叠处扩张,之后造影显示:腹主动脉假性动脉瘤被完全隔绝,未见造影剂外溢,双侧肾动脉及髂内、髂外动脉显影良好(图6)。拔除导管鞘,血管缝合器封闭穿刺点,外加压包扎。左肱动脉穿刺点压迫止血后外加压包扎。

图1 术前CTA示腹主动脉迂曲,远端胶囊隆起,瘤体紧靠腹主动脉左侧
Figure 1 Preoperative CTA shows the tortuous abdominal aorta with the distal abdomimal aorta expanded and the aneurysm body just at the left of the abdominal aorta
1.4 术后处理及结果
术后返回急诊抢救室,体温正常。术后2周腰腹部疼痛消失。术后血培养结果再次证实为布氏杆菌。继续应用利福平+米诺环素+莫西沙星抗感染治疗4个月,随访时患者腹部肿块搏动逐渐消失,发热、腹痛等症状未再复发,腰痛持续至术后3个月,但程度减轻[术前视觉模拟评分(visual analogue scale,VAS)8分,术后随访时VAS减为5分];术后4个月时复查腰痛明显缓解,复查腹主动脉CTA提示支架位置良好,动脉瘤完全隔离,瘤体明显缩小,支架周围无异常软组织影(图7)。
2 临床病理讨论
宋晓军经治医师 该患者为老年男性,慢性病程,急性加重,以间断发热,腹部搏动性包块,以及腰腹部疼痛急诊来我院就诊。在外院查CTA提示腹主动脉下段感染性假性动脉瘤,因患者出现腰腹部疼痛加重,给予抗生素控制感染,以及控制血压治疗。患者发热缓解,复查血常规以及各项感染指标下降,感染得到抑制,但根据腹痛明显加重症状考虑动脉瘤先兆破裂可能性大。瘤壁随时可能发生破裂,危及生命,故有急诊手术指征。患者高龄,手术耐受能力差,如行传统的开放清创、血管重建手术,患者获益低,风险太高,可考虑腔内治疗。目前国内外腔内修复术治疗感染性动脉瘤成功的报道已较多,随访效果较好。本例在充分术前应用抗生素感染控制良好的情况下行腔内修复术应相对安全。术后需要严格随访,定时复查CT,一旦出现感染加重现象应及时处理。
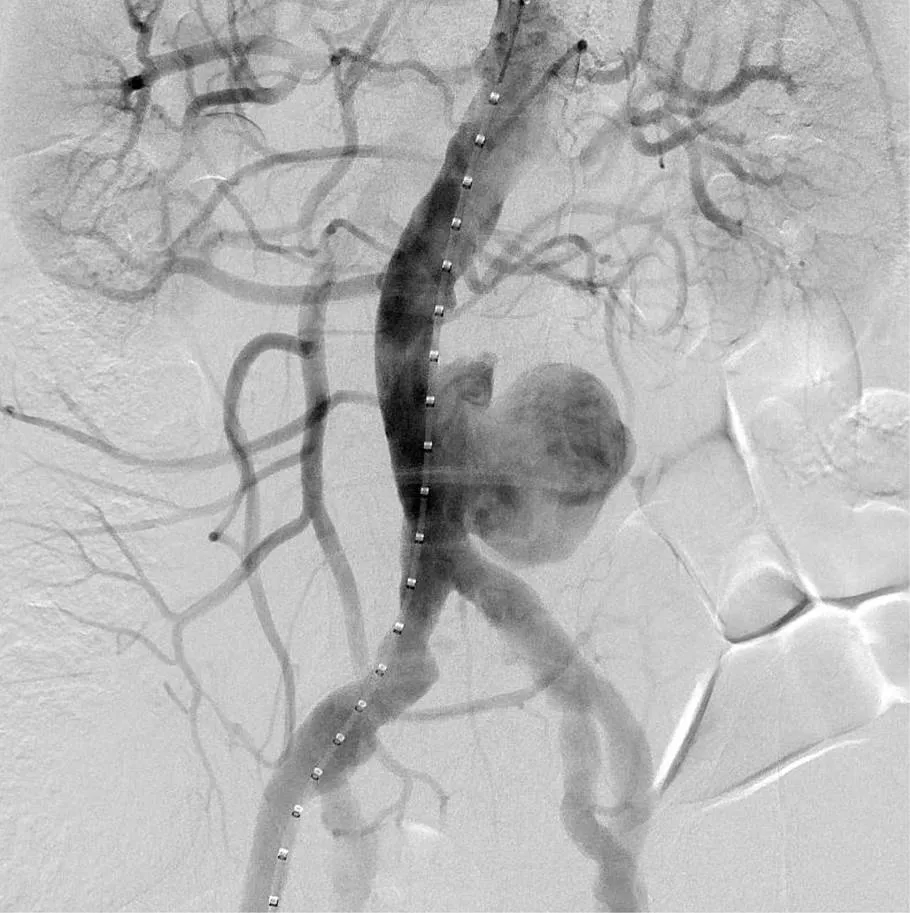
图2 术中血管造影示巨大偏心性动脉瘤
Figure 2 Intraoperative CTA shows the presentation of the aneurysm

图3 打开支架主体后自左侧置入导丝入主体失败
Figure 3 After opening the stent graft, we failed to put the guide wire into the graft from the left limb

图4 再次造影图像示左侧髂支进入假性动脉瘤瘤腔内
Figure 4 CTA shows that the opening of the left limb within the aneurysm cavity

图5 放置捕捉器建立通路
Figure 5 Putting a snare into the aorta from the left femoral artery to catch the guide-wire from the left brachial artery so as to establish the operational lumen system
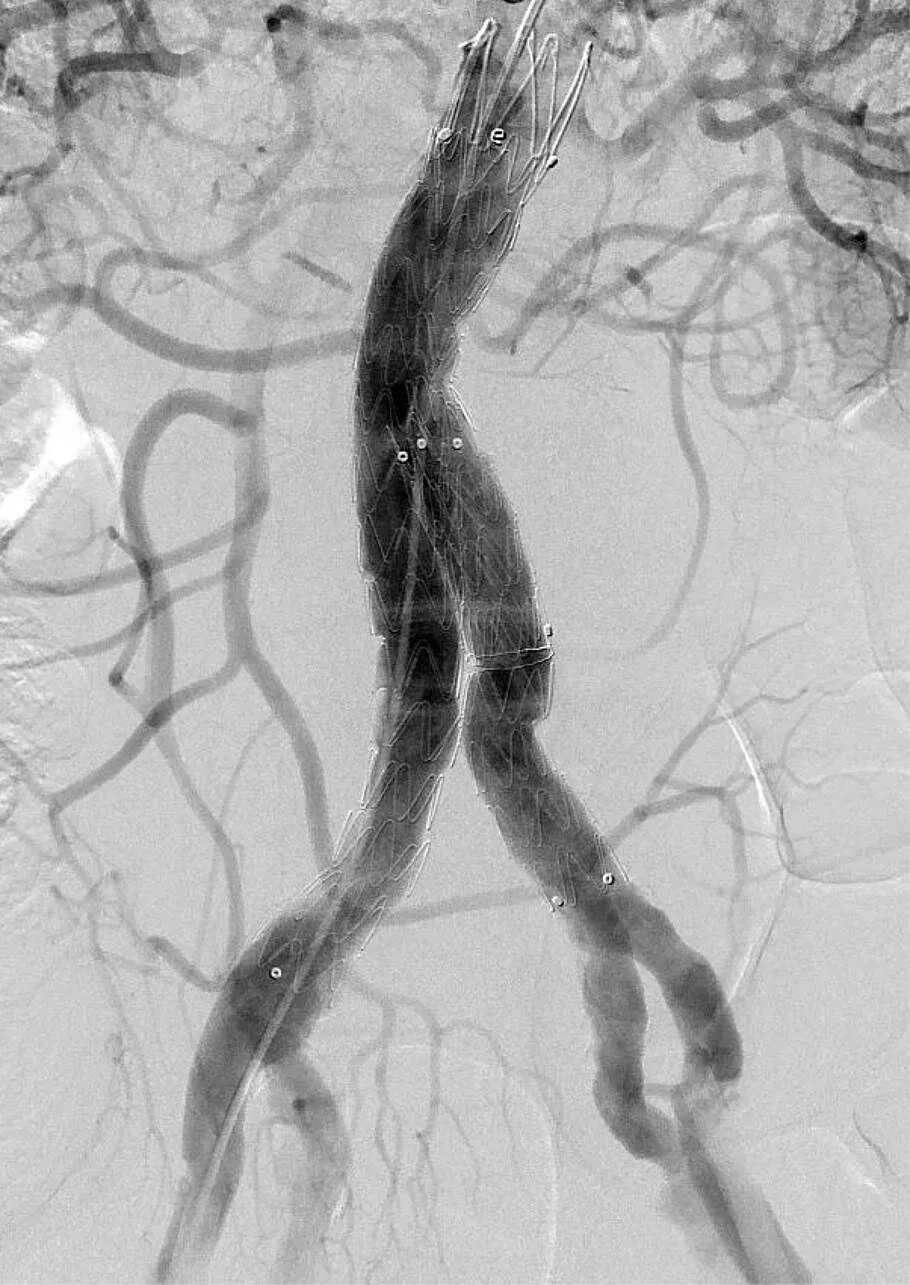
图6 术后即刻造影示假性动脉瘤完全隔绝,未见造影剂外溢,双侧肾动脉及髂内髂外动脉通畅
Figure 6 Postoperative CTA shows complete isolation of the aneurysm, no contrast medium leakage, and patenty of the renal arteries, internal and lateral iliac arteries
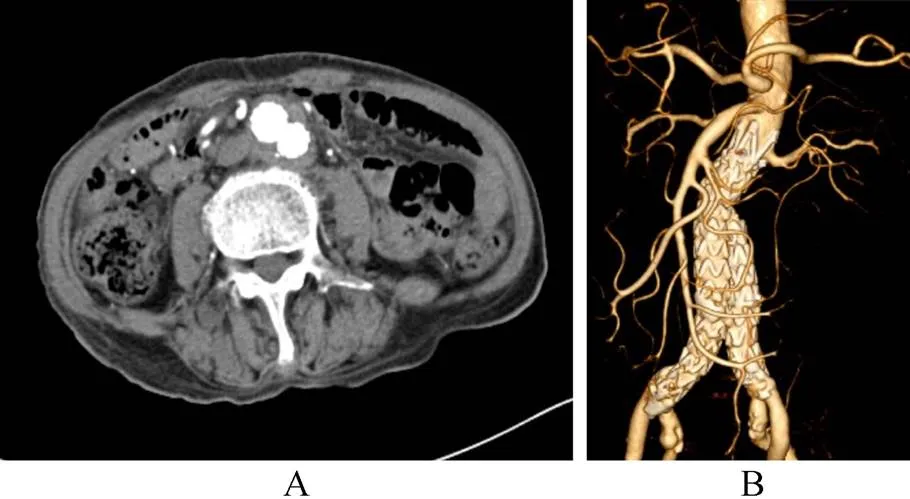
图7 术后4个月随访CTA示支架位置良好,动脉瘤完全隔离,瘤体明显缩小,支架周围无异常软组织影
Figure 7 The CTA of the patient at the 4 months of follow-up A: from the cross section of CTA at the level of the aneurysm, that the aneurysm shrinks, and the soft tissue around the graft has no inflammatory signs; B: 3D reconstruction of the abdominal aorta, shows the prosthetic graft in suitable place without drift
刘端主管医师 同意宋医师意见。IAAA较为罕见,在所有主动脉瘤中仅占0.85%~1.3%[1],因而该病诊疗尚缺乏规范的流程。加之该病起病较为隐匿,常难于早期诊断,而发病时较为凶险、瘤体增大迅速且易破裂,故其病死率较高。感染性动脉瘤常伴发于感染性心内膜炎,多种病原体可导致腹主动脉感染性动脉瘤,最常见的致病菌为沙门菌属、链球菌属和金黄色葡萄球菌,偶见结核分枝杆菌性假性动脉瘤的报道[2]。布氏杆菌病是一种人畜共患病,常由牲畜传染给人类,人与人之间很少相互传播,所以该病在人群中少见,故而布氏杆菌导致感染性腹主动脉瘤则更为少见。全世界SCI收录文献中报道布氏杆菌引起的主动脉瘤患者迄今为止仅13例[1−13],其中腔内治疗的病例仅1例[11]。该菌对多西环素、利福平等药物均敏感。该患者术前应用多西环素治疗有效,感染控制良好,为腔内修复术打下良好基础。
对于感染性动脉瘤的发病机制目前尚无系统性的研究结果。多数学者认为感染性动脉瘤一般继发于其他感染灶(最常见的是心内膜炎),细菌随血流从感染灶播散到已存在的动脉瘤或动脉斑块上,导致动脉瘤感染或动脉壁薄弱从而导致瘤样变;部分学者认为,感染性动脉瘤可从局部感染灶蔓延过来。本例患者为高龄男性,CTA提示主动脉硬化较为严重,动脉斑块较多,且外周血培养亦提示布氏杆菌感染,故考虑细菌通过血流定植可能性大。此外,尚有一些学者认为细菌可能通过血流感染大动脉壁的滋养血管,从而导致感染性动脉瘤。不论以何种感染方式,细菌入侵动脉壁后,逐渐引起动脉壁外膜、中膜平滑肌层的炎症反应,因此感染性动脉瘤通常瘤壁较脆弱,进展较快,且极易破裂形成假性动脉瘤或导致大出血。该患者如继续保守治疗,动脉瘤破裂风险极大,应及时手术治疗。
刘暴主诊医师 同意两位医师意见。IAAA的治疗包括抗生素治疗和手术治疗。因单独行保守治疗的患者1周内动脉破裂率高达53%[13],故手术治疗几乎是IAAA的主要治疗方式,而抗生素治疗则贯穿于整个术前准备以及术后长期随访过程中。
多年来多数学者主张治疗IAAA采取瘤体切除、扩大清创加解剖外重建的标准术式,结合术后长期应用抗生素治疗。该术式完全清除感染灶,避开了感染灶进行动脉重建。但病例报道显示,其远期效果并不尽如人意,术后发生吻合口漏、吻合口假性动脉瘤形成以及桥血管内再栓塞率较高。而越来越多的学者开始质疑这一观点,认为采用瘤体切除、扩大清创加原位重建更符合主动脉流体力学,术后并发症少。该术式在彻底清创的前提下,较之解剖外重建确有一定优势。然而以上两种术式均对人体造成较大创伤,对于高龄、血流动力学不稳定、或动脉瘤先兆破裂的患者(如本例患者)来说并不适用。随着材料科学的发展,血管腔内动脉瘤修复术(endovascular aneurysm repair,EVAR)治疗以其微创、简化操作的特点,在高危IAAA患者中逐渐得到应用。最先报道EVAR术治疗感染性主动脉瘤的学者是Semba等[14],他们描述了3例患者,所有患者均获手术成功,术后随访17个月均无感染复发。近年关于IAAA进行血管腔内治疗成功,并随访>2年的文献报道也在逐渐增加。但这种方法的治疗效果及安全性,业内尚存在争论。主要担心其术后并发症,包括持续感染或感染复发、移植物闭塞、动脉破裂等。这种担心是合理的,在一个尚未清创的感染灶内放置血管内置物,与IAAA的经典治疗原则不符。脓肿未进行清创,感染则未能完全控制,此时在血管腔内放置支架有可能使感染灶持续存在,术后有可能感染加重造成灾难性后果。且目前对于该术式成功的报道均仅限于个案和小样本的病例报道,缺乏高级别的临床证据。但EVAR术式的确能在患者病情危重时提供一套可行的创伤小疗效好的治疗方案,该术式充分地发挥其微创优势,避免了大范围切开、体外循环、主动脉阻断等操作,减少了术中出血,在患者血流动力学不稳定的情况下,减少对其造成的袭扰。作为应急措施,在短时间内即可将动脉瘤隔绝,达到防止动脉瘤破裂、破裂后即刻止血的效果。
目前认为EVAR术式治疗IAAA成功的原因有以下几点。(1)一旦怀疑感染性动脉瘤时,立即应用广谱抗生素治疗,并按培养结果及时改用敏感抗生素。因此很多学者认为术前只要抗生素能控制菌血症,EVAR治疗是可行的。(2)据Jones等[15]和Kan等[16]报道,25%~40%的感染性动脉瘤患者血培养甚至组织培养均为阴性,血管腔内放置支架尚不至于隐藏感染灶。(3)术后长期应用抗生素治疗是感染性动脉瘤EVAR治疗成功的关键。(4)此外,近年临床上应用抗生素包被支架以及EVAR术后再次行脓肿清创等,也增加了EVAR在IAAA中的应用[17]。抗生素的应用在整个治疗过程中极为重要,常规的术前用药虽不能完全清除体内细菌,但一段时间的术前给药可抑制细菌活性,抑制细菌在支架内的定植;而术后应用抗生素虽然也不能保证将感染灶清除,但其目的亦旨在长期应用以抑制细菌繁殖。应用腔内修复术式治疗IAAA,在急诊条件下是一个最佳的选择,这已被越来越多的临床报道中良好的术后疗效所证实。首先描述腔内支架治疗感染性主动脉瘤的是Semba等[14],他们成功地应用腔内支架治疗了3例,所有患者在术后的17个月随访中均未见再感染迹象。最大的一组单中心病例研究是Patel等[18]报道的27例(均行TEVAR或EVAR术)感染性主动脉瘤患者,其住院生存率为88.5%,术后3年生存率为57.8%。Johnstone等[19]报道单中心7例感染性胸主动脉瘤,均行腔内修复治疗,其住院生存率为85.7%(1/7的患者死亡),术后1年生存率为71.4%(2/7的患者死亡)。术后3年生存率为57.1%(3/7的患者死亡),其术后生存率大致与Patel等的报道相当。Kritpracha等[20]报道感染性主动脉瘤行腔内修复术治疗21例,其中5例合并动脉−消化道瘘,死亡率60%(3/5);另16例较轻,未合并消化道瘘,亦无动脉瘤破裂,腔内修复术后死亡率为6%(1/16),总体近期死亡率19%(4/21)。本例患者为高龄,术前身体弱,难以耐受开放性清创及主动脉修复术,且患者术前抗感染治疗效果较好,有效控制患者发热症状,全身脓毒症得到抑制,成功行EVAR术。
郑月宏主任医师 同意腔内修复术术式以及其后续治疗、随访方案。关于IAAA的抗感染治疗,目前普遍认为一旦疑有IAAA应立即应用广谱抗生素,直到培养出特定细菌再选择敏感抗生素,药物抗感染治疗应贯穿于治疗的整个过程,包括术前、术中和术后,部分患者甚至需终身应用抗感染治疗。目前关于术前及术后应用抗生素的持续时间尚未达成共识,一般认为术前约1周的抗生素较为合适,术后至少应用6~8周。Kan等[16]首次在总结了较大样本的IAAA EVAR疗效以后认为,EVAR术后感染持续存在是多因素的,其相关性最强的因素是瘤体破裂和手术时发热。因此,术前应用抗生素控制体温至正常水平极其重要。本例患者在诊断腹主动脉瘤之前因长期低热,后血培养结果提示布氏杆菌感染,即开始针对布氏杆菌应用抗生素治疗,故术前已于外院行1周的抗生素治疗,手术时体温已恢复正常。之所以急诊手术,是因为患者疼痛加重,出现先兆破裂症状。本例还尝试主动脉支架以敏感抗生素浸泡、在支架置入后于瘤腔内注射敏感抗生素等措施。但因目前尚无针对感染性动脉瘤腔内治疗的专用抗生素涂层支架,故此方面文献尚未见报道。本例患者支架在置入前经抗生素处理是一个创新之举,但其效果如何尚待进一步研究。该患者出院后已继续应用抗生素治疗了4个月,随访时患者症状明显缓解。本例为布氏杆菌感染,文献报道在充分清创的情况下应用抗生素应至少6周;但本例为腔内治疗,感染灶未明确清除,故要适当延长抗感染治疗时间,同时密切观察,一旦发现再感染迹象,应果断及时采取处理措施,包括手术清创。
[1] Goudard Y, Pierret C, de La Villeon B,.repair of a primary-infected abdominal aortic aneurysm: long-term follow-up[J]. Ann Vasc Surg, 2013, 27(2): 241. e1−e5.
[2] Amiri RS, Hanif H, Ahmadi A,.-related multiple cerebral aneurysms: report of a case and review of the literature[J]. Surg Neurol Int, 2014, 5: 152.
[3] Gillet M, Sava P, Camelot G,.aneurysm of abdominal aorta[J]. Nouv Presse Med, 1976, 5(32): 2083.
[4] Aguado JM, Barros C, Gomez Garces JL,. Infective aortitis due to[J]. Scand J Infect Dis, 1987, 19(4): 483−484.
[5] Bergeron P, Gonzales-Fajardo J, Mangialardi N,. False aneurysm of the abdominal aorta due to[J]. Ann Vasc Surg, 1992, 6(5): 460−463.
[6] Kumar N, Prabhakar G, Kandeel M,.mycotic aneurysm of ascending aorta complicating discrete subaortic stenosis[J]. Am Heart J, 1993, 125(6): 1780−1782.
[7] Blain H, Laraki R, Levy-Soussan M,. Aneurysm of the thoracic aorta and spondylodiscitis disclosing brucellosis[J]. Rev Med Interne, 1997, 18(11): 876−881.
[8] Quaniers J, Durieux R, de Leval L,. Abdominal aortic aneurysm due to[J]. Acta Chir Belg, 2005, 105(1): 93−95.
[9] Tsioufis K, Stefanadis C, Kallikazaros I. A footprint ofinfection: enormous saccular aneurysm of the ascending aorta[J]. Heart, 2006, 92(9): 1308.
[10] Park SJ, Kim MN, Kwon TW. Infected abdominal aortic aneurysm caused by: a case report[J]. J Vasc Surg, 2007, 46(6): 1277−1279.
[11] Benedetto F, Lentini S, Passari G,. Endovascular repair of aortic rupture due toaortitis[J]. Vasa, 2011, 40(2): 150−156.
[12] Kakkos SK, Papadoulas S, Lampropoulos G,. Aorto-iliac aneurysm infected by: distinctive presentation patterns of a rare entity[J]. Vascular, 2013. [Epub ahead of print]
[13] Youn JK, Kim SM, Han A,. Surgical treatment of infected aortoiliac aneurysm[J]. Vasc Specialist Int, 2015, 31(2): 41−46.
[14] Semba CP, Sakai T, Slonim SM,. Mycotic aneurysms of the thoracic aorta: repair with use of endovascular stent-grafts[J]. J Vasc Interv Radiol, 1998, 9(1 Pt 1): 33−40.
[15] Jones KG, Bell RE, Sabharwal T,. Treatment of mycotic aortic aneurysms with endoluminal grafts[J]. Eur J Vasc Endovasc Surg, 2005, 29(2): 139−144.
[16] Kan CD, Lee HL, Yang YJ. Outcome after endovascular stent graft treatment for mycotic aortic aneurysm: a systematic review[J]. J Vasc Surg, 2007, 46(5): 906−912.
[17] Kloppenburg GT, van de Pavoordt ED, de Vries JP. Endograft-preserving therapy of a patient with-infected abdominal aortic aneurysm: a case report[J]. J Med Case Rep, 2011, 5: 565.
[18] Patel HJ, Williams DM, Upchurch GR Jr,. Thoracic aortic endovascular repair for mycotic aneurysms and fistulas[J]. J Vasc Surg, 2010, 52(4 Suppl): 37S−40S.
[19] Johnstone JK, Slaiby JM, Marcaccio EJ,. Endovascular repair of mycotic aneurysm of the descending thoracic aorta[J]. Ann Vasc Surg, 2013, 27(1): 23−28.
[20] Kritpracha B, Premprabha D, Sungsiri J,. Endovascular therapy for infected aortic aneurysms[J]. J Vasc Surg, 2011, 54(5): 1259−1265; discussion 1265.
(编辑: 周宇红)
Endovascular repair for-infected abdominal aortic aneurysm: one case report and literature review
LIU Duan, LIU Xiu, LIU Bao*, SONG Xiao-Jun, ZHENG Yue-Hong
(Department of Vascular Surgery, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China)
Infected aortic aneurysm (IAA) are very rare, and those caused byare extremely rare. The conventional treatment for IAA is wide debridement of necrotic tissue, establishment of vascular bypass, and perioperative antibiotic treatment. But in recent years, much evidence showed that endovascular treatments were gradually applied as alternatives to open surgery, and the treatments have good outcomes. To summarize our treatment experience of endovascular repair for infected abdominal aorta aneurysm, we reported a case of a 76-year-old male patient and reviewed the articles concerning this disease. The patient had no primitive infectious source (area), and mainly presented fever, abdominal pulsatile mass and waist and abdomen pain. Preoperative peripheral blood culture suggestedinfection, and doxycycline treatment was effective. CT angiography displayed a pseudoaneurysm of the distal abdominal aorta. After admission, he underwent endovascular repair treatment followed by sensitive antibiotic therapy, and then was followed up regularly. We also reviewed other cases in the previously published data to summarize the experience on endovascular treatment for-related abdominal aortic aneurysm, that is, endovascular repair of coated stent graft combined with antibiotic therapy. The patient was followed up for 4 months, and he has normal vital signs at the end of follow-up. On the condition of strict preoperative blood pressure and infection control, and postoperative long-term antibiotic therapy, endovascular treatment is a feasible approach to treat-caused IAA.
aneurysm, infected; abdominal aneurysm; endovascular therapy;
R654.3; R592
A
10.11915/j.issn.1671-5403.2016.03.055
2015−12−02;
2015−12−28
刘 秀, 为共同第一作者
刘 暴, E-mail: liubao72@aliyun.com

