大鼠脑、肝组织3种RNA相对表达量与死亡时间的关系
董智杰,陈 亮,吴 岳△
(1.青海大学医学院;2.青海省公安厅刑事技术研究管理中心)
大鼠脑、肝组织3种RNA相对表达量与死亡时间的关系
董智杰1,陈 亮2,吴 岳1△
(1.青海大学医学院;2.青海省公安厅刑事技术研究管理中心)
目的 研究大鼠脑、肝脏组织3种RNA相对表达量与死亡时间的关系,比较两组织用于死亡时间推断的适用性。方法 将48只Wistar大鼠随机分为6组,断颈处死,分别于死后0、24、48、72、120、168 h取大鼠脑皮质及肝右外叶。提取脑、肝组织总RNA,采用实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)技术检测两组织中miR(脑特异性miR-124、肝特异性miR-122)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、β-肌动蛋白(β-actin)mRNA的循环阈值(cyclic threshold,Ct)。用BestKeeper程序筛选内参,对目的RNA的Ct值进行2-ΔΔCt转换,用SPSS及GraphPad软件对其进行单因素方差分析,并对ΔCt值进行曲线回归分析。结果 miR-124和miR-122分别为脑、肝组织的内参。脑组织GAPDH、β-actin mRNA的相对表达量在死后72 h内逐渐增加,并于死后72 h达到峰值,之后逐渐下降(P<0.05);而肝GAPDH、β-actin mRNA的相对表达量从死后48 h开始逐渐下降(P<0.05)。所有分子的最适回归模型均为三次模型,且肝组织的相关系数r大于脑组织。结论 大鼠脑、肝组织中GAPDH、β-actin mRNA的相对表达量与死亡时间具有相关性,肝组织比脑组织更适用于死亡时间推断。
大鼠脑肝脏组织RNA表达量死亡时间
准确推断死亡时间(postmortem interval,PMI)是刑事技术的一大挑战,而传统的PMI推断方法易受外界环境因素、个体差异及检验者主观因素和经验的影响,准确性较差。近年来,研究者以分子生物学指标为研究对象,将核酸(DNA、RNA)的降解[1]情况应用于PMI推断的研究中,但研究结果不一。本研究采用RT-qPCR技术检测大鼠脑、肝脏组织miR(脑特异性miR-124、肝特异性miR-122)和GAPDH、β-actin mRNA的相对表达量,并分析其与PMI的关系,进一步明确不同组织中不同RNA分子在PMI推断中的应用价值。
1 材料与方法
1.1 实验动物分组与处理
健康成年雄性Wistar大鼠48只,体重(250±20)g,购于甘肃中医药大学实验动物中心,许可证号SCXK(甘)2015-0002;于青海大学医学院动物房适应性饲养7天(自由进食进水)。将大鼠随机分为死后0、24、48、72、120、168 h六组,每组8只。将大鼠断颈处死,置于温度12±1 ℃、湿度40±2%的环境中,于死后相应时间点取大鼠脑皮质及肝右外叶,一部分组织冻存(-80℃),一部分组织制片(4%多聚甲醛固定,HE染色)。
1.2 实验试剂选择
4%多聚甲醛(北京Solarbio公司),无水乙醇、二甲苯(上海广诺化学科技有限公司),浓盐酸、氨水、冰醋酸(西安三浦化学试剂有限公司),苏木素、伊红(上海诚凛生物科技有限公司),中性树胶、50×TAE(北京biotopped公司),氯仿、异丙醇(上海中泰化学试剂有限公司),Trizol(美国Sigma公司),GeneGreen核酸染料、RNase-Free H2O、5*RNA电泳Loading Buffer(北京TIANGEN公司),BiowestAgarose(西班牙Biowest公司),RevertAid First Strand cDNA Synthesis Kit(美国Thermo公司),gDNA Eraser、SYBR® Premix Ex TaqTMII (TliRNaseH Plus)(日本Takara公司)。
1.3 实验仪器选择
Leica TP1020型全自动脱水机、Leica EG1150型石蜡包埋机、Leica EG1150C冷冻台、Leica RM2126型轮转式切片机、摊片机、Leica H1220型烘片机(德国Leica公司),Thermo PrintMate150型组织盒书写仪、NanoDrop 2000c核酸分析仪(美国Thermo公司),OLYMPUS BX41型系统显微镜(日本OLYMPUS公司)、IKAVortex Genius 3震荡器(德国IKA集团),SCILOGEXD1008E掌上离心机(美国SCILOGEX公司),Eppendorf Centrifuge 5424 R离心机、EppendorfMastercyclerpro S梯度PCR仪(德国eppendorf公司),F6/10 匀浆机(上海净信科技),ABI 7500RT-qPCR仪(美国ABI公司),BIO-RAD GelDocXR+凝胶成像仪(美国Bio-Rad公司),DYY-8C型电泳仪(北京市六一仪器厂)。
1.4 实验
1.4.1 总RNA提取
取50~100 mg脑或肝组织,加入1 mL Trizol,冰上匀浆,室温放置10 min。加0.2 mL氯仿,剧烈振荡15 s,室温放置10 min。4 ℃,12000×g离心15 min。取上层无色水相至新1.5 mL EP管中,加入0.5 mL异丙醇,颠倒混匀,室温放置10 min。4 ℃,12000×g离心10 min,管底可见白色沉淀。弃上清,加入75%乙醇1 mL,涡旋混合,4 ℃,12000×g离心5 min。重复上一步骤,弃上清。在滤纸上倒置吸干,室温干燥5 min。脑组织总RNA中加入90 μLRNase-Free H2O使其溶解,肝加入360 μL。用NanoDrop 2000 c核酸分析仪检测RNA的浓度及纯度、1%琼脂糖凝胶电泳检测RNA的完整性。分装后冻存(-80℃)。
1.4.2 引物合成
miR反转录采用茎环引物,miR-124:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATA
CGACGGCATT-3',miR-122:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCAAA
CA-3'。miR-124、miR-122及GAPDH、β-actinmRNART-qPCR的引物序列均引自参考文献[2-5],并由上海生工生物工程股份有限公司合成,其序列见表1。

表1 各RNA指标RT-qPCR引物序列
1.4.3 gDNA去除与cDNA合成
用gDNA Eraser去除总RNA中的gDNA,反应体系10 μL:RNA 1 μg,gDNA Eraser 1 μL,5×gDNA Eraser Buffer 2 μL,RNase-Free H2O补足至10 μL;反应条件:42 ℃ 2 min。用RevertAid First Strand cDNA Synthesis Kit试剂盒对上述RNA进行反转录,反应体系20 μL:①RNA 1 μg,miR加入茎环引物2 μL(10 pmol/μL),GAPDH、β-actin mRNA加入Oligo(dT)18 primer 1 μL,RNase-Free H2O补足至12 μL;反应条件:65 ℃ 5 min,冰上冷却。②向上述12 μL体系中加入5×Reaction Buffer 4 μL,RiboLockRNase Inhibitor(20 U/μL)1 μL,10 mMdNTP Mix 2 μL,RevertAid M-MuLV RT(20 U/μL)1 μL;反应条件:42 ℃ 60 min,70 ℃ 5 min。将上述反转录cDNA按1:10稀释,分装后冻存(-20℃)。
1.4.4 RT-qPCR检测
用SYBR® Premix Ex TaqTMII 试剂盒进行RT-qPCR反应,反应体系20 μL:SYBR Premix Ex Taq II(2×)10 μL,PCR Forward Primer(10 μM)0.8 μL,PCR Reverse Primer(10 μM)0.8 μL,ROX Reference Dye II(50×)0.4 μL,cDNA模板2 μL,RNase-Free H2O 6 μL。用ABI 7500RT-qPCR仪进行扩增,扩增条件:①Stage 1:95 ℃ 30 s;②Stage 2:95 ℃ 5 s,60 ℃ 34 s,40 Reps;③ Stage 3:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样本3个复孔。Ct值由7500 Software v2.0.6软件测得。
1.5 统计学分析
运用BestKeeper程序筛选脑、肝脏组织的内参基因,将同一组织各候选基因的Ct值导入软件,计算各基因标准差(SD)和变异系数(CV)的大小,其值越小,则该基因越稳定。因此,选取标准差和变异系数最小的RNA分子为内参基因。除内参外,以其余各RNA分子为目的基因,以大鼠死后0 h组为对照组,其余各组为处理组。将目的RNA分子的Ct值进行2-ΔΔCt[ΔΔCt=(Ct目的RNA-Ct内参)处理组-(Ct目的RNA-Ct内参)对照组]转换,表示处理组各样本的表达量相对于对照组的倍数,之后运用SPSS 21.0及GraphPad Prism 5软件进行单因素方差分析,检验水准α=0.05。并对内参校正后的目的RNA分子的ΔCt(ΔCt=Ct目的RNA-Ct内参)与PMI进行曲线回归分析。
2 结果
2.1 HE染色情况
组织大体改变:死后24、48 h时,脑、肝脏的形态未见明显变化,之后组织变软,色泽较晦暗。脑组织在死后72 h开始糊化,120 h及168 h时糊化加重,脑组织结构尚完整。
镜下结果:死后不同时间脑和肝脏组织形态学变化分界不明显。死后即刻,脑组织形态学变化较肝组织明显,脑组织可见神经元肿胀及红色神经元。各组脑、肝脏组织实质细胞均可见空泡形成,核固缩、碎裂、溶解。随着死亡时间的延长,肝细胞染色质边集逐渐明显,死后168 h时,肝细胞结构不清,肝索排列紊乱,细胞核溶解消失,核数量明显减少。见图1~2。

A:0 h;B:24 h;C:48 h;D:72 h;E:120 h;F:168 h

A:0 h;B:24 h;C:48 h;D:72 h;E:120 h;F:168 h
2.2 RNA纯度、浓度、完整性检测及RT-qPCR结果
用NanoDrop 2000c核酸分析仪检测总RNA的纯度及浓度,测得所有样本的OD260/280在1.8~2.1之间,表明RNA的纯度良好。浓度在356 ng/μL~933 ng/μL之间。琼脂糖凝胶电泳结果见图3。表明脑组织总RNA在死后168 h内未见明显降解,而肝组织总RNA在死后120 h开始明显降解。
所有样本的cDNA均进行了有效扩增,扩增曲线良好,均得到Ct值。溶解曲线均为单峰,表明无引物二聚体及非特异性扩增。

图3 脑(左)和肝(右)组织总RNA琼脂糖凝胶电泳图
2.3 内参基因筛选结果
运用BestKeeper程序筛选脑、肝脏的内参基因,结果见表2。表2显示,脑组织中miR-124的标准差和变异系数最小,肝组织中miR-122的标准差和变异系数最小。因此,将miR-124作为脑的内参基因、miR-122作为肝的内参基因。对两组织中的GAPDH、β-actin mRNA的Ct值进行内参校正,得到ΔCt值。

表2 脑和肝组织3种候选内参基因表达稳定性结果(Ct值)
2.4 各RNA的相对表达量2-ΔΔCt与PMI的单因素方差分析结果
大鼠死后不同时间脑和肝脏组织各RNA的相对表达量2-ΔΔCt的组间差异性比较结果见表3。大鼠脑组织GAPDH、β-actin mRNA的相对表达量在死后72 h内逐渐增加,并于死后72 h达到峰值,之后逐渐下降(P<0.05);而肝GAPDH、β-actin mRNA的相对表达量从死后48 h开始逐渐下降(P<0.05)。其变化趋势见图4。

表3 死后不同时间各RNA的相对表达量
*:与同组织该分子0 h组相比P<0.05;△:与同组织该分子72 h组相比P<0.05.

图4 脑(左)和肝(右)组织各RNA相对表达量随PMI的变化趋势图
2.5 各RNA的ΔCt值与PMI的曲线回归分析结果
对脑和肝组织的GAPDH、β-actin mRNA的ΔCt值进行统计分析,以PMI为自变量x、ΔCt值为因变量y进行曲线回归分析,构建一次、二次和三次模型,结果见表4,曲线图见图5。以脑GAPDH mRNA为例(见表4),相关系数r三次(0.659)>r二次(0.645)>r一次(0.310),且三个模型P<0.05。因此,三次模型可作为脑GAPDH mRNA的最适模型。同理,脑β-actin mRNA及肝GAPDH、β-actin mRNA的最适模型均为三次模型。脑组织与肝组织相比,脑组织两RNA最适模型的相关系数r介于0.4~0.7之间,为中度相关,而肝组织的大于0.7,为高度相关。因此,肝组织比脑组织更适用于PMI推断。

表4 各RNA的ΔCt值与PMI的回归模型
注:#为RNA指标的最适模型.
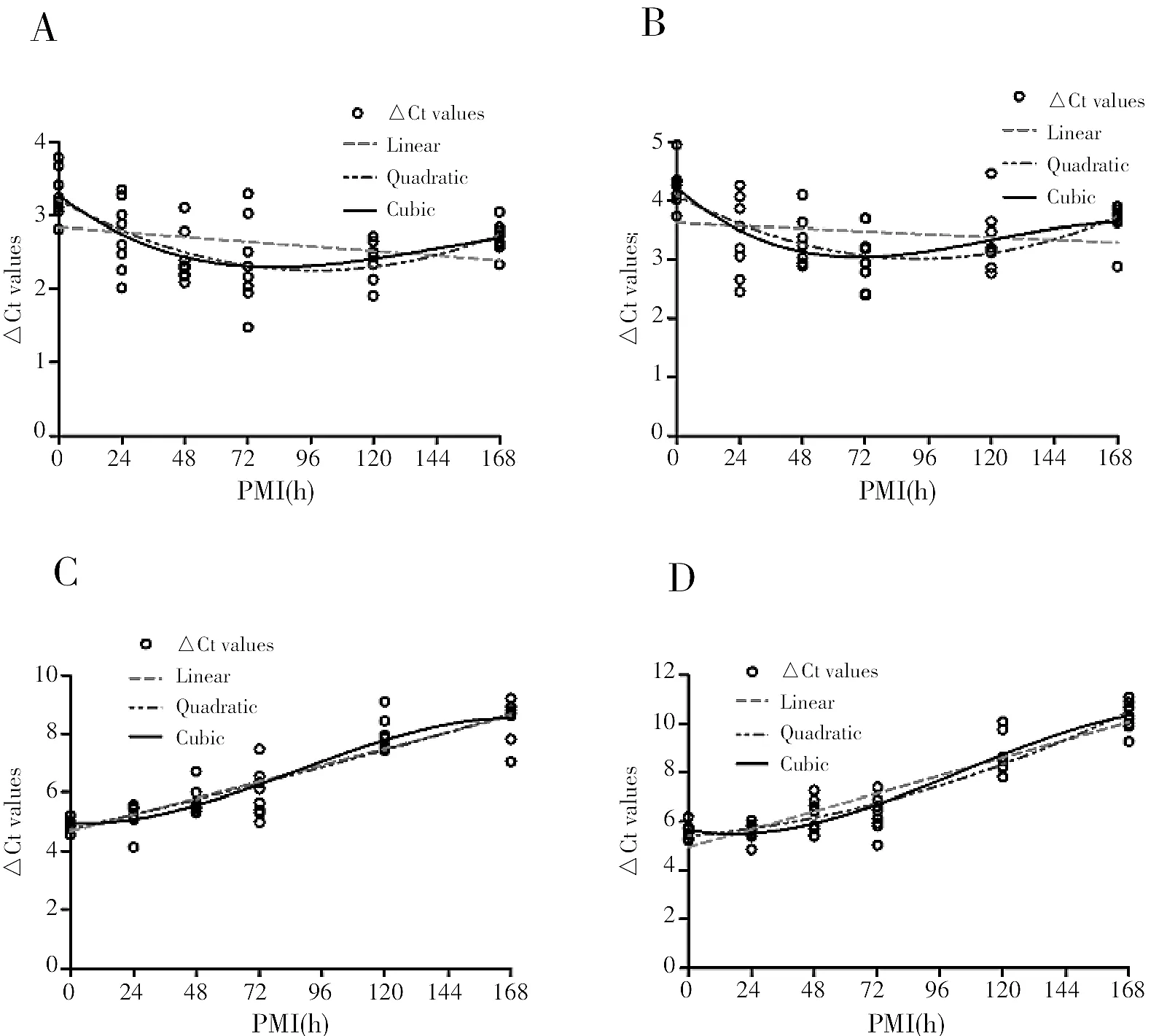
图5 脑(A、B)和肝(C、D)组织GAPDH(A、C)、β-actin(B、D)mRNA的ΔCt值与PMI的回归曲线图
3 讨论
本研究结果显示,大鼠神经元与肝细胞形态随PMI发生变化,且大鼠脑和肝组织中GAPDH、β-actin mRNA的相对表达量与PMI具有相关性,肝脏比脑组织更适用于PMI推断。
大鼠死后,各组织缺血缺氧,膜稳定性下降,溶酶体膜破裂,释放出各种水解酶,使核酸、蛋白质等物质逐渐降解,表现为核固缩、碎裂、溶解,随着PMI的延长,自溶加重,表现为细胞形态结构不清直至消失。由于脑组织对缺氧更敏感,因此死后即刻神经元的形态学变化较肝细胞更为明显。由于死后各组织缺血缺氧,导致细胞氧化磷酸化过程受阻,使ATP的合成减少,Na+-K+-ATP酶的功能下降,导致细胞内水、钠潴留,表现为细胞肿胀。
近年来,RNA的稳定性[6]得到证实,通过RNA的降解情况尤其是定量检测RNA的相对表达量推断PMI成为研究的热点。本研究通过RT-qPCR技术定量检测大鼠死后不同时间脑和肝组织3种RNA的相对表达量来推断PMI,不像普通RT-PCR技术只能在扩增结束后进行粗略定量(分析扩增产物的琼脂糖凝胶电泳图像),而RT-qPCR技术可实时监测扩增全程,通过在DNA双链间嵌入荧光基团增加荧光信号强度,进而监测模板的表达量,更方便、准确。RT-qPCR技术具有灵敏、快速、高效等优点[7],但其结果的准确性依赖于内参的正确选择和较小的操作误差。本研究应用BestKeeper程序,通过计算各分子的标准差和变异系数,以最小者作为内参,并非在实验前默认某个分子作为内参,有效避免了因实验处理因素导致的内参表达量的变化而引起的误差;同时对每个样本做3个复孔以减少人为操作误差。本研究中脑和肝脏组织均选取3个候选内参基因,miR在两组织中表达最为稳定,说明其受PMI的影响较小,与Lv等[8-9]研究结果一致。miR的表达具有保守性和组织特异性,miR-124和miR-122分别在脑和肝脏组织中特异性高表达,可有效减少个体差异引起的误差;且其仅含有22个左右核苷酸,片段小,稳定性强,这些因素决定了miR为较理想的内参,可提高实验结果的准确性。本实验中miR在反转录的过程中采用茎环引物而非线性引物,茎环引物特异性高,可以区分miR前体及仅有个别碱基差异的miR分子[10]。
本研究选取管家基因GAPDH和β-actin推断PMI,因为管家基因是维持细胞基本生命活动所必需的基因,在所有组织细胞中高丰度且恒定表达,可减少个体差异造成的误差。GAPDH是糖酵解过程中的酶,在缺氧条件下,机体通过上调GAPDH的表达量增加对葡萄糖的利用,以增加机体的能量供应。机体死后一段时间,各组织细胞残存部分活性,尚能感受机体缺氧状态,此时GAPDH的增加速率大于降解速率。因此,GAPDH mRNA的相对表达量在死后一段时间内升高;随着PMI的延长,糖酵解过程逐渐减弱,GAPDH的增加速率小于降解速率,表现为下降。脑组织处于相对封闭的环境中,有颅骨作为天然屏障,受外界因素影响较小[11],因此脑组织GAPDH mRNA的相对表达量表现为先升高后下降;而肝脏位于腹腔中,与肠管相邻,所处环境含有大量细菌,且肝脏本身含有大量的酶,均加速GAPDH mRNA的降解,因此肝脏中降解速率大于脑组织,肝脏GAPDH mRNA没有出现升高而是逐渐下降。β-actin参与构成细胞骨架,是微丝的组成成分,在缺氧条件下,细胞骨架结构可能遭到破坏或成分发生改变,使其相对表达量升高;β-actinmRNA在脑组织和肝脏中的变化原因同GAPDH。
本实验研究结果与Lv[5]、Pan[12]、吕叶辉[13]等不同,可能与死因、环境、组织类型等有关。在后续研究中应添加动物及人体验证模型,以检验实验结果的准确性。目前,用RNA的相对表对量推断PMI仍处于理论研究阶段,如何将理论研究结果应用于法医实践将是未来研究的重点。
[1]Mundorff A,Davoren J M.Examination of DNA yield rates for different skeletal elements at increasing postmortem intervals[J].Forensic Science International:Genetics,2014,8(1):55-63.
[2]刘越.MicroRNA-124与脑缺血后脑室下区神经干细胞增殖分化关系的初步探讨[D].南昌大学,2012.
[3]王成刚.rno-miR-122与rno-miR-182在对ACI大鼠移植性肝癌经动脉栓塞的相关功能性研究[D].复旦大学,2013.
[4]刘季,宋贞柱,谢润红,等.大鼠死后脑组织RNA降解与死亡时间推断的研究[J].中国法医学杂志,2007,22(4):226-228.
[5]Lv Y H,Zhang H,Pan H,et al.Relationship between PMI and relative expression of myocardial various RNAs in rats died of different causes[J].Fayixuezazhi,2014,30(1):7-12.
[6]Bauer M.RNA in forensic science[J].Forensic Science International:Genetics,2007,1(1):69-74.
[7]纪冬,辛绍杰.实时荧光定量PCR的发展和数据分析[J].生物技术通讯,2009.
[8]Lv Y,Ma K,Zhang H,et al.A time course study demonstrating mRNA,microRNA,18S rRNA,and U6 snRNA changes to estimate PMI in deceased rat's spleen[J].Journal of forensic sciences,2014,59(5):1286-1294.
[9]Ma J,Pan H,Zeng Y,et al.Exploration of the R code-based mathematical model for PMI estimation using profiling of RNA degradation in rat brain tissue at different temperatures[J].Forensic Science,Medicine,and Pathology,2015,11(4):530-537.
[10]王正,张霁,唐丹舟,等.microRNA的检测技术及其法医学应用前景[J].法医学杂志,2014,30(1):55-59.
[11]安志远,张晓东,郑吉龙,等.脑组织与法医学死亡时间推断[J].中国法医学杂志,2009,24(4):257-259.
[12]Pan H,Zhang H,Lü Y H,et al.Correlation between five RNA markers of rat′s skin and PMI at different temperatures[J].Fayixuezazhi,2014,30(4):245-249.
[13]吕叶辉,李志宏,托娅,等.不同温度下大鼠脑组织RNA降解与早期 PMI 的相关性[J].法医学杂志,2016,32(3):165-170.
Relationship among relative expression levels of 3 kinds of RNA and postmortem intervalin brain and livertissues of rats
DONG Zhi-jie1,CHEN Liang2,WU Yue1
(1.Qinghai University Medical College;2.Department of Criminal Technology Research and Management Center,Qinghai Provincial Public Security)
Objective To study the relationship between the relative expression levels of 3 kinds of RNA and postmortem intervalin two different tissues of brain and liver in rats,and to compare the applicability of the two tissues in the estimation of PMI.Methods 48 Wistar rats were randomly divided into 6 groups,and all of them were killed by neck dislocation.Atthe postmortem 0 h,24 h,48 h,72 h,120 h,168 h,cerebral cortex and right hepatic lobe were taken.Thentotal RNA of brain and liver tissues were extracted,and the cyclic thresholds(Ct values)of miR(brain specific miR-124,liver specific miR-122)and glyceraldehyde-3-phosphate dehydrogenase(GAPDH),beta -actin(β-actin)mRNA in the two tissues were detected by real-time fluorescence quantitative PCR(RT-qPCR).Theinternal reference was selected by BestKeeper program,and the Ct value of target RNA was converted into 2-ΔΔCt.Single factor variance analysis was used to examine 2-ΔΔCtby SPSS and GraphPad software,and the curve regression analysis was used to examine ΔCtvalue.Results MiR-124 and miR-122 were the most suitable internal reference in brain and liver tissues respectively.The relative expression levels of brain tissue GAPDH and β-actin mRNA increased gradually within the postmortem72 h,and the peak was reached at the postmortem 72 h,after the postmortem 72 h the relative expression levels decreased gradually(P< 0.05).The relative expression levels of hepatic GAPDH and β-actin mRNA decreased gradually after the postmortem 48h(P<0.05).The optimal regression models of all RNA were the cubic model.The correlation coefficient of liver tissue was larger than that of the brain tissue.Conclusion The relative expression levels of GAPDH and β-actin mRNA in brain and liver tissues of rats are correlated with PMI.The liver tissue is more suitable forthe estimation of PMI than the brain tissue.
rats brain liver tissue RNA expression level postmortem interval
R89
A
10.13452/j.cnki.jqmc.2016.04.008
2016-06-12
※:董智杰(1990~),女,汉族,河南籍,青海大学医学院2014级硕士研究生.△:通信作者,硕士生导师,E-mail:1577697749@qq.com

