聚乙二醇模拟干旱胁迫对细叶云南松种子萌发及生理的影响
韦秋思,徐圆圆,郑党斌,赵毅辉,杨 梅*
(1.广西雅长林场,广西百色533209;2.广西大学林学院,广西南宁530004)
聚乙二醇模拟干旱胁迫对细叶云南松种子萌发及生理的影响
韦秋思1,徐圆圆2,郑党斌1,赵毅辉2,杨 梅2*
(1.广西雅长林场,广西百色533209;2.广西大学林学院,广西南宁530004)
为探明细叶云南松种子萌发期对干旱胁迫的耐受性,采用不同浓度的PEG-6000溶液(0%,0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%)模拟干旱条件研究其种子萌发、保护酶活性的变化。结果表明:1)随着干旱胁迫程度的加剧,细叶云南松种子的发芽率、发芽势和发芽指数总体呈先升高后下降趋势,在前15d,0.5%PEG浓度下发芽率最高,为29.50%,说明低浓度(0.5%)PEG胁迫可以在一定程度上促进细叶云南松种子萌发。2)随着PEG浓度的升高,细叶云南松种子中MDA含量呈低—高—低的变化,PEG浓度为1.0%和2.5%时MDA含量分别为最低和最高,为对照的0.90倍和1.85倍;SOD活性先升高再降低,1.0%PEG胁迫下SOD活性达最高,为222.30U/g FW,4.0%PEG胁迫下最低,为对照的0.50倍;CAT活性逐渐降低,4.0%PEG胁迫下其活性最低,为对照的49.34%。结论:轻度干旱(0.5% PEG浓度)对细叶云南松种子萌发有一定的促进作用,但细叶云南松种子的抗旱能力不强。
细叶云南松;种子萌发;聚乙二醇;干旱胁迫
细叶云南松(Pinus yunnanensis var.tenuifolia)是云南松的一个地理变种,主要分布在南盘江下游两岸海拔300~1 600m的丘陵山地[1]。细叶云南松树干通直,出材率高,结构适中,细腻,有松脂,较抗病虫害,是一种重要的南方材脂两用树种,也是广西松科资源中重要的一个变种和重要的木材生产原料[2]。细叶云南松生长于黔滇桂交界处,北纬23°50′~25°40′,东经104°10′~107°10′,范围狭窄,属于微域分布类型[3];其对气候和土壤的适应性较强,常以天然林形式存在,人工林较少。广西雅长林区地处南盘江河谷东侧,属广西丘陵向云贵高原过渡的山原地带,焚风效应明显,是桂西北干热河谷地区的一部分,年均气温20.9℃,年蒸发量(1 585.4mm)大于降雨量(1 054.1mm),属半干燥气候区[4]。随着生态环境遭受破坏,细叶云南松的天然更新面临着严峻考验。目前,对细叶云南松的研究主要集中在其天然林的地理分布及群落特征等方面[1,3-7],关于细叶云南松在干旱土壤适应性方面的研究仍较少,揭示细叶云南松种子萌发期的耐旱特性对其天然更新或人工促进天然更新具有重要意义。
聚乙二醇(polyethylene glycol,PEG)是一种亲水性很强的大分子有机物,使用PEG-6000溶液渗透方法模拟干旱条件具有简单易行、重复性好、周期短等特点,近年来被广泛用于植物种子萌发期耐旱性研究[8]。细叶云南松一般通过种子繁殖,其种子能否在干旱条件下萌发成苗是其能否完成天然更新的前提条件,也是今后实行人工繁殖的关键。笔者采用不同浓度PEG-6000溶液模拟不同程度干旱胁迫,分析细叶云南松种子萌发、生长及保护酶系统等指标的变化,旨在为评价细叶云南松种子萌发期的耐旱特性及在干旱立地条件下的种植栽培提供理论依据。
1材料与方法
1.1试验材料
供试种子采自位于细叶云南松分布区的百色市雅长林场,2012年11月采摘种子,去除空粒和夹杂物后阴干,选取大小均匀、饱满的种子保存于4℃冰箱中备用。
1.2种子胁迫处理
选取充实、成熟饱满且大小均一的种子,用自来水冲洗干净,经0.5‰的高锰酸钾消毒30min,用蒸馏水清洗种子3~4次。用吸水纸吸干种子表面的水分后,将种子播种于置入2层纱布和1层滤纸的发芽盒中。根据预实验及参考文献[9-10]设置相应的PEG浓度,每个发芽盒分别移入蒸馏水配制的质量分数(0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%)的PEG-6000溶液中,每个处理4次重复,每个重复100粒,用蒸馏水作对照,将发芽盒置于25℃的恒温培养箱中培养27d。
1.3相关指标的测定
1.3.1生长指标测定

式中:Gt为第t天的发芽数,Dt为相应的发芽天数。
1.3.2生理指标测定 待发芽结束后,取发芽种子的胚根0.2g,置于预冷的研钵中,加10mL 0.05mol/L pH 7.0磷酸缓冲液,可视研磨情况分次少量加入0.1g聚乙烯吡咯烷酮(PVP)及少许石英砂,在冰浴中研磨成匀浆,于0~4℃,5 000r/min下离心20min,上清液即为粗酶提取液。丙二醛(MDA)含量采用硫代巴比妥酸法测定[11],超氧化物歧化酶(SOD)活性采用NBT法测定[12],过氧化氢酶(CAT)活性采用紫外分光法[13]。
1.4数据分析
采用Microsoft Excel、SPSS 21.0等数据处理软件对所得数据进行整理汇总、单因素方差分析、LSD多重比较分析。
2结果与分析
2.1PEG胁迫对细叶云南松种子萌发的影响
2.1.1发芽率和总发芽率 细叶云南松种子在不同PEG浓度胁迫下的发芽率变化见图1所示。其种子的发芽率较低,萌发能力较弱,在1~9d各浓度处理下种子发芽率升高较快,9d后升高较缓慢,16d后基本停止发芽。在前15d,0.5%PEG浓度下发芽率高于对照,其他各浓度下种子发芽率均较对照低。前期种子发芽形势相近,说明在中高浓度下,种子萌发前期受到PEG的影响较小。3.0%和3.5%浓度下种子停止发芽的时间最早(15d),而CK停止发芽最迟。在发芽结束(20d)后,细叶云南松种子总发芽率随PEG胁迫的增强呈直线式变化,各PEG浓度下发芽率均较对照低,随着PEG浓度的升高,种子发芽率呈下降趋势;而1.5%~3.0%浓度其发芽率变化较为平缓,在较低浓度(0%~1.5%)发芽率降幅大于高浓度(3.0%~4.0%),在1.0%PEG浓度下种子发芽率较0.5%PEG浓度下低,降幅达18.64%,两浓度间存在显著差异。PEG浓度在1.5%、2.0%、2.5%和3.0%时,其发芽率呈下降趋势,但各浓度间差异均不显著。相同梯度处理下,中高浓度(1.5%~3.0%)的PEG对种子发芽率变化的影响较小,低浓度PEG对细叶云南松种子发芽率的影响较大。
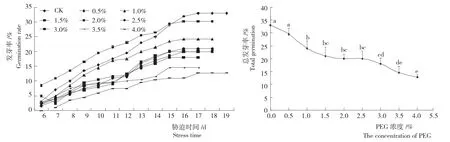
图1 PEG胁迫下细叶云南松种子的发芽率Fig.1 Seed germination rate of P.yunnanensis under different PEG stress
2.1.2发芽势和发芽指数 发芽势是指在种子发芽过程中发芽种子数达到高峰时,正常发芽种子数占供检验种子数的百分率,其用来表示种子发芽的速度和整齐程度[14]。发芽势或发芽指数能较灵敏地反映种子在不同浓度处理下的发芽整齐度和种子活力[15]。从表1看出,PEG浓度为0.5%时,其发芽势和发芽指数最高,达0.27和11.77;不同浓度的PEG与细叶云南松发芽过程中发芽势、发芽指数间存在极显著差异。随PEG胁迫浓度的升高,细叶云南松种子发芽势和发芽指数均呈先升高后降低的趋势,两者在低浓度(0.5%)PEG胁迫下均高于对照,在0.5%PEG时达最大值,分别为对照的1.04倍和1.28倍;其他较高浓度(1.0%~4.0%)PEG胁迫下细叶云南松种子发芽势和发芽指数均较对照低,发芽势在3.5%和4.0%时与对照差异显著,发芽指数均与对照差异显著,在4.0%浓度时发芽势与发芽指数均降至最低值,分别是对照的34.62% 和31.96%。可见,较低浓度(0.5%)PEG胁迫对细叶云南松种子发芽势和活力指数有促进作用,而高浓度PEG对种子萌发的速度及整齐度有抑制作用,总体表现为浓度越高抑制作用越强。
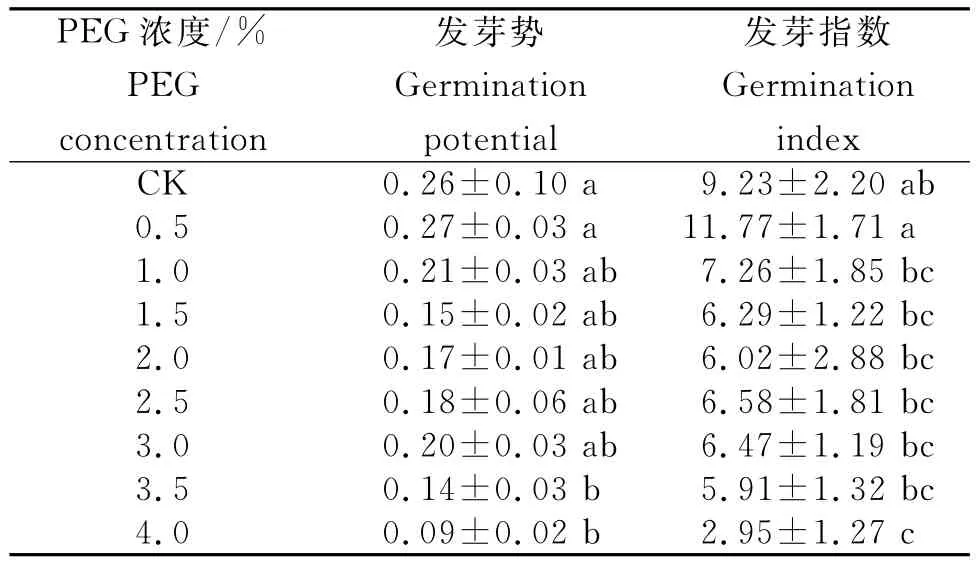
表1 不同浓度PEG胁迫下细叶云南松种子的发芽势和发芽指数Table 1 Germination potential and index of P.yunnanensis seeds under different
2.2PEG胁迫对细叶云南松种子丙二醛含量及保护酶活性的影响
丙二醛(MDA)是膜质过氧化的产物,其含量的高低能直接表现植物膜质过氧化程度,MDA含量越低,说明膜受损的程度越小,反之,越大[16]。而植物体内的SOD、POD和CAT等植物体内重要的抗氧化酶,其在清除金属等胁迫诱发产生的氧自由基和过氧化物、抑制膜脂过氧化、保护细胞免遭伤害等方面起着重要作用[17]。在许多作物抗性机理研究中,SOD、PPO、CAT和POD等酶活性的变化已广泛作为指示植物抵御逆境胁迫伤害的指标[18-19]。
2.2.1丙二醛含量 在PEG处理下,细叶云南松种子受到不同程度的伤害,诱发膜脂过氧化作用产生MDA。如图2所示,细叶云南松种子MDA含量随着PEG浓度的升高呈低—高—低的变化趋势,且不同PEG浓度间种子MDA含量存在极显著差异,PEG浓度为0.5%、1.0%、3.5%和4.0%时MDA含量相对较低,与对照0.79μmol/g接近,且此浓度间无显著差异;PEG浓度为1.0%和2.5%时MDA含量分别达最低和最高,其含量分别为对照的0.90倍和1.85倍。由此可见,PEG浓度在0.5%~1.0%时细叶云南松种子膜脂过氧化作用较小,且其MDA含量较对照低,说明在此浓度下PEG未对种子萌发造成伤害,相反,有一定的促进作用;而PEG浓度在1.5%~3.0%时,种子MDA含量升高,说明其对种子的萌发造成了伤害,在PEG浓度2.5%时种子膜脂过氧化作用最强,而后种子对干旱的抵抗能力逐渐减小。
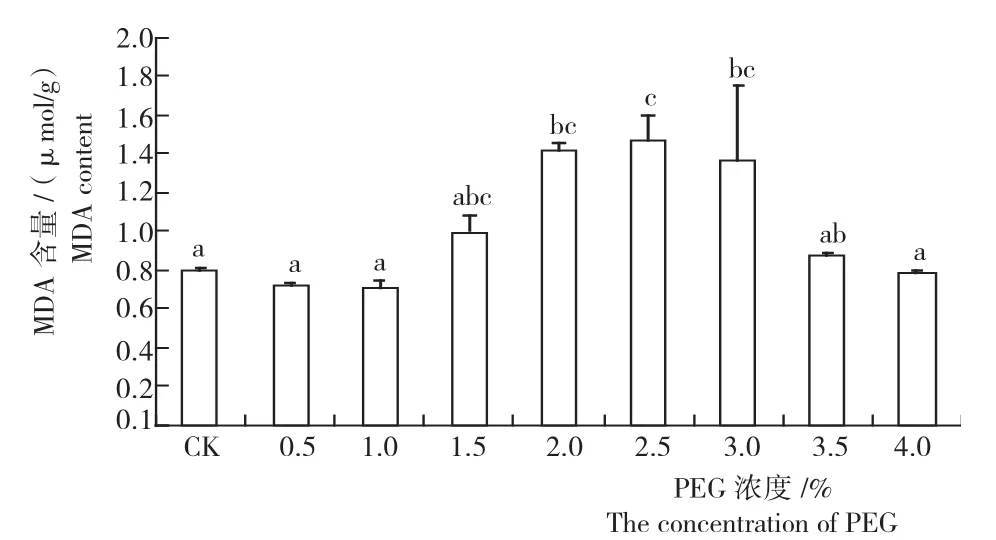
图2 不同浓度PEG胁迫下细叶云南松种子的MDA含量Fig.2 MDA content of P.yunnanensis seeds under different PEG stress
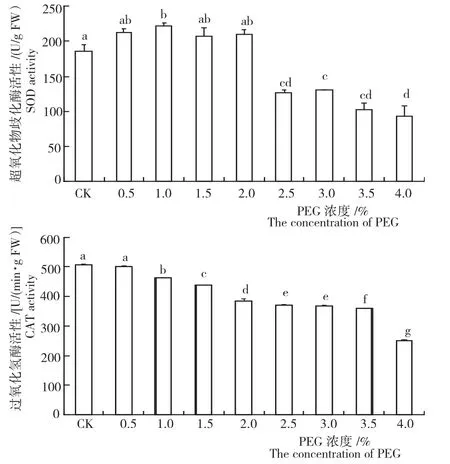
图3 不同浓度PEG胁迫下细叶云南松种子的SOD和CAT活性Fig.3 SOD and CAT activity of P.yunnanensis seeds under different PEG stress
2.2.2保护酶活性 超氧化物歧化酶(SOD)是植物抗氧化酶系统的第一道防线[20],可在细胞质、线粒体与叶绿体中催化超氧化物发生歧化反应生成H2O2和分子氧,使种子对外来胁迫起到保护作用。由图3可知,随PEG胁迫浓度的升高,细叶云南松种子SOD活性先升高再降低。1.0%PEG胁迫下SOD活性达最高,为222.30U/g FW,是对照的119.47%;4.0%PEG胁迫下SOD活性最低,为对照的0.50倍,其与对照均存在显著差异;0.5%、1.5%~2.0%PEG胁迫下SOD活性均升高,但与对照无显著差异;2.5%~3.5%PEG胁迫下SOD活性均较对照低,且与对照均存在显著差异。由此可见,在PEG模拟水分胁迫条件下,细叶云南松种子可以通过增加体内的SOD活性提高抵抗干旱环境的能力。
过氧化氢酶(CAT)为重要的保护酶。由图3还可知,随PEG胁迫浓度的升高,细叶云南松种子CAT活性逐渐降低。对照CAT活性最高,为506.73U/(min·g FW);4.0%PEG胁迫下CAT活性最低,为对照的49.34%;0.5%PEG胁迫下CAT活性与对照相近,为502.13U/(min·g FW),与对照无显著差异,说明此胁迫下种子所受伤害较小,基本不产生伤害;1.0%~4.0%PEG胁迫下CAT活性均较对照低,且与对照均存在显著差异。在PEG模拟水分胁迫条件下,细叶云南松种子的CAT活性降低。
3结论与讨论
种子的萌发大致可划分为吸胀、萌动、发芽3个阶段,种子发芽期受干旱胁迫,种子内一系列生理生化反应将会受到一定的破坏,影响种子萌发[21]。在正常条件下,植物能有效地清除体内的活性氧自由基,使细胞免受伤害,但在逆境或胁迫条件下,植物体内的活性氧自由基产生速度超过植物清除活性氧的能力,便会引起伤害[22],积累的活性氧会引发或者加剧细胞膜脂过氧化,造成膜系统的损伤,甚至导致细胞死亡,自由基可导致膜脂过氧化作用,SOD 和CAT活性下降,同时产生过多的膜脂过氧化产物(如MDA等),膜完整性被破坏[23]。为了降低胁迫所造成的氧化伤害,植物进化出一套抗氧化保护系统,其中包括非酶类低分子量抗氧物质,及抗氧化酶系统(如SOD,APX,POD等),作为抗氧化保护的一个组成部分,整个抗氧化保护酶系防御能力取决于各酶活性及其彼此间的综合协调[24]。种子萌发是种子植物生活史中的第一阶段,同时也是衡量植物抗旱性的重要时期[25],种子能否在一定的干旱条件下有较高的发芽率和出苗率,直接影响到以后的生长发育和生长状况[26]。有关研究指出,轻度干旱对文冠果、青稞、甘草、云南松等植物种子的萌发表现为促进作用[27-30],表明部分植物对干旱条件有相应的适应性。本试验中,0.5%PEG浓度下种子发芽率略低于对照,发芽势和发芽指数均高于对照,随着PEG胁迫浓度的升高,细叶云南松种子的停止萌发时间缩短,萌发率、发芽势、发芽指数等指标均呈逐渐下降趋势,且与对照相比存在极显著差异;且在0.5%PEG浓度下MDA含量较低,SOD和 CAT活性较高,低浓度的PEG对细叶云南松种子的萌发有一定的促进作用,说明细叶云南松种子萌发对轻度干旱胁迫具有一定的适应性;而随着干旱程度的增加,较高浓度(2.5%~4.0%)胁迫下,MDA含量增加,SOD、CAT活性均下降且保持较低水平,可能种子已受到破坏。干旱胁迫对细叶云南松种子萌发具有一定的抑制作用,而在一定程度干旱胁迫内,细叶云南松种子可通过自身调整和发生一系列生理反应,如保护酶活性增高,保护机理不受干旱环境的损害。水分在细叶云南松种子的萌发过程中有很重要的作用,这与湿地松[31]、紫穗槐[32]、香果树[33]等植物种子进行水分胁迫时,随着PEG浓度增加,种子萌发率、发芽势、萌发活力等下降的结果相一致。不同植物种子萌发对干旱胁迫的响应存在差异,同种植物中不同酶对干旱胁迫的响应也不同,低浓度胁迫有促进也有抑制作用,但高浓度胁迫都是抑制作用。本研究说明,轻度干旱(0.5%PEG浓度)对细叶云南松种子萌发有一定的促进作用,但总体而言,细叶云南松种子的抗旱能力不强。
采用PEG-6000模拟不同程度干旱胁迫对细叶云南松种子萌发、生长及保护酶系统等的影响进行了初步探索,有助于探讨细叶云南松的抗旱性,对于其在雅场林场干热河谷环境下的自然更新具有重要意义,同时,也可为人工促进天然更新和为人工造林选择合适的季节育苗、合理的水分管理等提供相应的理论依据。
[1]王献溥.广西细叶云南松林的群落学特点[J].植物研究,1991,11(3):91-103.
[2]杨章旗,冯源恒,吴东山.细叶云南松天然种源林遗传多样性的SSR分析[J].广西植物,2014(1):10-14.
[3]李治基,王献溥.广西细叶云南松的地理分布和环境的关系[J].植物生态学与地植物学丛刊,1981(1):28-37.
[4]杨炳强,李大南.广西雅长细叶云南松分布区土壤的肥力特性[J].广西农学院学报,1988(3):27-33.
[5]吴 敏,李春叶,秦武明,等.72年生细叶云南松天然林生长规律研究[J].广东农业科学,2014(2):61-65.
[6]严 理,刘晓璐,秦武明,等.广西百色细叶云南松天然林生物量研究[J].西部林业科学,2014,43(3):134-138.
[7]田玉红,李 梓,梁 才.拉雅松和细叶云南松松针挥发油的化学成分[J].中国实验方剂学杂志,2012,18 (1):51-55.
[8]李志萍,张文辉,崔豫川.PEG模拟干旱胁迫对栓皮栎种子萌发及生长生理的影响[J].西北植物学报,2013,10:2043-2049.
[9]杨敏生,裴保华,张树常.树木抗早性研究进展[J].河北林果研究,1997,12(1):87-93.
[10]Hsiao T C.Plantres Ponsestowaterstress[J].A,n.Rev.PlaotPhy,1973,24:519-570.
[11]许长成,赵世杰,邹 琦.植物组织内丙二醛的分离与鉴定[J].浙江大学学报:理学版,2011,38(3):207-210.
[12]时连辉,牟志美,姚 健.不同桑树品种在土壤水分胁迫下膜伤害和保护酶活性变化[J].蚕业科学,2005,31(1):13-18.
[13]刘凤权,王金生.水杨酸对水稻叶片抗氧化酶系的影响[J].农业生物技术学报,2001,9(4):396-399.
[14]沈国舫,翟明普.森林培育学[M].北京:中国林业出版社,2012:9-123.
[15]王娟娟,张文辉,刘新成.NaCl胁迫对3种不同处理四翅滨藜种子萌发的影响[J].西北农业学报,2010 (1):104-111.
[16]马书燕,李吉跃,彭祚登.干旱胁迫对柔枝松幼苗丙二醛含量的影响[J].安徽农业科学,2012(4):2099-2100.
[17]曹 莹,黄瑞冬,曹志强.铅胁迫对玉米生理生化特性的影响[J].玉米科学,2005,13(3):61-64.
[18]于 力,孙 锦,郭世荣,等.铝胁迫对豇豆幼苗根尖抗氧化系统的影响[J].西北植物学报,2012(11):2299-2304.
[19]克热木,伊 力,袁 琳,等.盐胁迫对阿月浑子SOD、CAT、POD活性的影响[J].新疆农业科学,2004,41(3):129-134.
[20]王文斌.植物活性氧代谢及其利用[M].北京:中国农业科学技术出版社,2011:114-150.
[21]吴文荣,刘晓艳,吴桂丽,等.不同干旱胁迫对胡麻种子萌发特性的影响[J].作物杂志,2012(2):134-137.
[22]郑世英,张秀玲,王丽燕.Cd2+胁迫对蚕豆抗氧化酶活性及丙二醛含量的影响[J].河南农业科学,2007 (2):35-37.
[23]戴金平.低温锻炼对黄瓜幼苗几种酶活性的影响[J].植物学报,1991,33(8):627-632.
[24]王文斌.植物活性氧代谢及其利用[M].北京:中国农业科学技术出版社,2011:114-150.
[25]李培英,孙宗玖,阿布来提.PEG模拟干旱胁迫下29份偃麦草种质种子萌发期抗旱性评价[J].中国草地学报,2010,32(1):32-39.
[26]潘春柳,黄燕芬,邓志军,等.PEG处理对新鲜和老化穿心莲种子萌发及幼苗生长的影响[J].种子,2013,3 (12):30-34.
[27]周 玲,王乃江,张丽楠.PEG胁迫对文冠果种子萌发和幼苗生理特性的影响[J].西北植物学报,2012,32(11):2293-2298.
[28]姚晓华,吴昆仑.PEG预处理对青稞种子萌发和幼苗生理特性的影响[J].西北植物学报,2012,32(7):1403-1411.
[29]刘长利,王文全,魏胜利.干旱胁迫对甘草种子吸胀萌发的影响[J].中草药,2004,35(12):1402-1405.
[30]蔡年辉,许玉兰,张瑞丽,等.云南松种子萌发及芽苗生长对干旱胁迫的响应[J].种子,2012,31(7):44-46.
[31]张 聃,曹 昀,郑 林.湿地松种子萌发对模拟水分胁迫的响应[J].水土保持研究,2011(1):188-191.
[32]马玉心,满秀玲,崔大练.紫穗槐种子萌发对水分胁迫的响应[J].种子,2009(2):46-49.
[33]刘延惠,崔迎春.香果树种子发芽对水分胁迫的响应[J].中国林副特产,2008(6):26-28.
(责任编辑:刘 海)
Effects of PEG Simulated Drought Stress on Seed Germination and Physiology of Pinus yunnanensis
WEI Qiusi1,XU Yuanyuan2,ZHENG Dangbin1,ZHAO Yihui2,YANG Mei2*
(1.Guangxi Yachang Forest Farm,Baise,Guangxi 533209;2.College of forestry,Guangxi University,Nanning,Guangxi 530004,China)
The seed germination and protective enzyme activity of P.yunnanensis seeds were determined under different PEG concentration(0%,0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%and 4.0%)to study the drought tolerance of P.yunnanensis at seed germination stage.Results:1)The germination rate,germination potential and germination index of P.yunnanensis seeds present the first rising and then declining trend overall with increase of drought stress.The germination rate of P.yunnanensis seeds under 0.5%PEG is 29.50%(maximum)prior to 15d,which indicates that 0.5%PEG stress can promote germination of P.yunnanensis seeds to a certain extent.2)The DNA content in P.yunnanensis seeds shows the low-high-low trend with increase of PEG concentration.The MDA content of P.yunnanensis seeds under 1.0%and 2.5%PEG is 0.90time and 1.85times that of CK respectively.The SOD activity of P.yunnanensis seeds shows a first rising and then declining trend with increase of PEG concentration and the SOD activity of P.yunnanensis seeds under 1.0%PEG is the maximum (222.30U/gFW)but the SOD activity of P.yunnanensis seeds under 4.0%PEG is 0.50time that of CK.The CAT activity of P.yunnanensis seeds reduces gradually with increase of PEG concentration and the SOD activity of P.yunnanensis seeds under 4.0%PEG is the minimum,50.66%lower than CK.In conclusion,Mild drought(0.5%PEG concentration)has a certain promotion effect on germination of P.yunnanensis seeds but the drought resistance of P.yunnanensis seeds is not strong.
Pinus yunnanensis var.Tenuifolia;seed germination;PEG;drought stress
S791.257
A
1001-3601(2016)02-0061-0043-05
2015-07-07;2016-01-01修回
广西林业厅科技项目“细叶云南松幼林栽培技术及林木综合利用研究”
韦秋思(1975-),女,工程师,从事森林培育与经营方面的生产与科研工作。E-mail:364769714@qq.com
*通讯作者:杨 梅(1970-),女,教授,博士,从事森林培育领域的科研与教学工作。E-mail:fjyangmei@126.com

