miRNA-126对肺癌A549细胞的增殖、迁移、侵袭及EGFR/AKT/mTOR信号通路的影响*
唐夏莉, 焦德敏, 陈 君, 王 剑, 陈清勇
(中国人民解放军第一一七医院呼吸内科,浙江 杭州 310004)
miRNA-126对肺癌A549细胞的增殖、迁移、侵袭及EGFR/AKT/mTOR信号通路的影响*
唐夏莉,焦德敏,陈君,王剑,陈清勇△
(中国人民解放军第一一七医院呼吸内科,浙江 杭州 310004)
[摘要]目的: 探讨微小RNA(microRNA,miRNA)-126对肺癌A549细胞功能的影响及相关的作用机制。方法: 利用脂质体试剂Lipofectamine 2000将miRNA-126转染入肺癌A549细胞中,采用real-time PCR法检测转染后各组细胞中miRNA-126的表达;MTT法检测细胞活力;台盼蓝拒染实验检测细胞存活数目;细胞集落培养实验观察转染后细胞集落形成;划痕愈合实验检测细胞的迁移能力;Transwell小室实验检测细胞侵袭能力;Western blot法检测EGFR/AKT/mTOR通路中各蛋白水平的变化。结果: Real-time PCR结果显示,转染miRNA-126组细胞中的miRNA-126表达水平显著高于阴性对照组和空白对照组(P<0.01),而阴性对照组与空白对照组无显著变化;A549细胞转染miRNA-126模拟物后,细胞增殖和集落形成能力均呈明显下降(P<0.01);肺癌细胞的迁移和侵袭能力也受到明显抑制(P<0.01);Western blot结果显示,转染miRNA-126组细胞中EGFR/AKT/mTOR通路相关蛋白p-EGFR、p-AKT和p-mTOR的水平均有明显降低(P<0.01)。结论: miRNA-126可以显著降低肺癌A549细胞中p-EGFR、p-AKT和p-mTOR的蛋白水平,进而可能抑制其细胞增殖和迁移侵袭能力。
[关键词]微小RNA-126; EGFR/AKT/mTOR通路; 肺癌; 细胞增殖
肺癌是目前世界上最常见的恶性肿瘤,研究表明其发病率和死亡率逐年升高[1]。在肺癌的许多分类中,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%~85%[2]。肺癌早期诊断困难,大多确诊已在晚期,因此迫切需要寻找一种灵敏度高、特异性强的早期肺癌诊断标记。微小RNA(microRNA,miRNA)是近年来发现的一大类内源性的非编码单链小分子RNA。已有大量的研究表明microRNA参与肿瘤发生发展的全过程,在细胞增殖、凋亡、迁移等多个生物进程中发挥着类似癌基因或抑癌基因的作用。如miRNA-34a促进甲状腺癌细胞增殖[3],而miRNA-206则抑制肺癌细胞增殖和转移[4]。本课题组在前期研究工作中利用miRNA表达谱芯片技术,发现miRNA-126在肺癌组织与癌旁组织中差异表达,并将miRNA-126转染于肺癌A549细胞其增殖能力受到明显抑制。因此,进一步观察miRNA-126在肺癌中的功能及其作用机制,不仅有助于肺癌的早期诊断,也有助于为肺癌的临床治疗提供有效的干预靶点,为发展新型抗肺癌基因药物提供理论依据。
材料和方法
1材料
非小细胞肺癌A549细胞购自中国科学院上海细胞所;has-miRNA-126-3p agomir引物序列、DMSO购自Sigma;胰蛋白酶和RPMI-1640培养基购自Gibco;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、台盼蓝染色细胞存活率检测试剂盒购于碧云天生物公司;GAPDH、表皮生长因子受体(epidermal growth factor receptor,EGFR)、p-EGFR、AKT、p-AKT、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和p-mTOR抗体购自CST。倒置荧光显微镜购自Leica; 凝胶成像系统和iMARK型全自动酶标仪购自Bio-Rad。
2主要方法
2.1细胞的瞬时转染转染前1 d,接种适量的细胞于不含抗生素的培养基中,根据脂质体Lipo-fectamine 2000的说明书进行细胞的转染。分别用适量的Opti-MEM无血清培养液稀释脂质体和has-miR-126-3p agomir,室温孵育5 min后混合,室温静置20 min,将混合液加入到每孔中,轻轻晃动培养板混匀液体。将培养板放入培养箱中,6 h后替换为原培养基继续培养。转染带荧光的FAM-NC时,所有操作均需避光操作,并以锡箔纸包被培养板放置培养箱中培养,转染48 h后用PBS冲洗1次,荧光显微镜下观察转染效率。
2.2Real-time PCR检测miRNA-126的表达各组A549细胞经转染48 h后,按照TRIzol说明书中步骤抽提细胞总RNA,取RNA于紫外分光光度计下测A260/A280,比值处于1.8~2.1之间则符合纯度要求,按miRNA逆转录试剂盒说明配制逆转录试剂,逆转录合成cDNA,将合成的cDNA稀释10倍,按real-time PCR说明书配制反应体系,每个样本设3个复孔。PCR反应步骤:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。反应以U6为内参照。Has-miR-126-3p agomir的上游序列为5’-UCG UAC CGU GAG UAA UAA UGC G-3’,下游序列为5’-CAU UAU UAC UCA CGG UAC GAU U-3’。记录各孔Ct值,取各孔平均值作为结果,并采用2-ΔΔCt法对结果进行分析。
2.3MTT法检测细胞活力取对数生长期细胞以5.0×107/L的浓度接种于96孔细胞培养板中,每孔100 μL,置于37 ℃、5% CO2饱和湿度培养箱中培养24 h,待细胞贴壁后,按上述转染方法转染肺癌A549细胞,另于标准空白孔中加不含细胞的完全培养液。转染48 h后,每孔加入20 μL MTT(2 g/L),继续孵育4 h后,终止培养。吸去培养液,每孔加DMSO 150 μL,在酶标仪490 nm波长处测定各孔吸光度(A)值。每组平行重复6孔,重复实验3次。按以下公式计算:细胞存活率(%)=A实验组/A对照组×100%。
2.4细胞存活数目检测于6孔板中将miRNA-126转染入肺癌A549细胞48 h后, 0.25%胰酶消化,用0.04%台盼蓝分别对control、negative control和miRNA-126组A549细胞进行染色,显微镜下计数活细胞数(其中着色细胞为死细胞),每个样品计数3次。
2.5细胞集落培养实验于6孔板中转染各组A549细胞24 h后,用0.25%胰酶消化,1 000 r/min离心5 min收集细胞,重悬细胞并计数,将细胞悬液作梯度倍数稀释,以适当的细胞密度接种于培养皿中,并尽量使细胞均匀分布于板底,放入培养箱中连续培养10 d至肉眼可见集落时,弃原培养液,PBS洗涤1次后加10%甲醛固定15 min,PBS洗2次后用结晶紫染色30 min,PBS洗净后晾干,拍照。重复实验3次。
2.6划痕愈合实验将miRNA-126转染肺癌A549细胞24 h后接种6孔板,待细胞铺满孔底,用10 μL枪头小心在孔底划痕,PBS清洗3次,加入含有2.5%低血清的新鲜培养基, 倒置显微镜下拍照,沿划痕边缘等间距取3处测量划痕宽度,取平均值。24 h后继续拍照,在相同观察点测量划痕宽度。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
2.7Transwell小室实验将miRNA-126转染肺癌A549细胞24 h后,消化细胞于无血清培养基,将含有8×107/L细胞的200 μL细胞悬液加入铺有基质胶的Transwell 小室上室,下室中加入600 μL含10%胎牛血清的培养基, 每组设置3个复孔,于37 ℃、5% CO2条件下培养24 h。取出Transwell小室,用棉签擦掉Matrigel及上室未穿膜细胞,甲醇固定10 min,0.1%结晶紫染色40 min。100倍镜下随机选取5个视野计数穿膜细胞数目,取平均值。
2.8Western blot法检测相关蛋白水平变化各组细胞经RIPA裂解液(1 mL RIPA+10 μL PMSF+10 μL aprotinin)裂解30 min,冰上进行操作。收集到EP管,BCA蛋白定量法测定蛋白浓度定量。每个泳道蛋白样品10 μg,经10% SDS-PAGE分离后,利用湿法将蛋白转移至PVDF膜上,用含5% BSA的PBST封闭1 h,分别加入对应I 抗4 ℃孵育过夜,TBST洗膜3次后,加入对应II 抗室温摇床孵育2 h,TBST洗膜3次,ECL发光试剂盒发光显影,定影后进行分析。
3统计学处理
所有实验均重复3次,实验数据用均数±标准差(mean±SD)表示,应用SPSS 17.0统计软件进行数据分析。多组间比较应用单因素方差分析,组间两两比较应用Bonferroni检验,以P<0.05为差异有统计学意义。
结果
1miRNA-126 agomir转染肺癌A549细胞后上调miRNA-126的表达量
转染miRNA-126 agomir可显著提高miRNA-126在肺癌A549细胞中的表达量。miRNA-126组中miRNA-126的表达量相对阴性对照组及空白对照组明显上调(P<0.01),而阴性对照组和空白对照组之间差异不明显。肺癌A549细胞经转染48 h后,40 nmol/L的agomir可使肺癌A549细胞的miRNA-126表达量上调约800倍,见图1。
2miRNA-126对肺癌A549细胞活力的影响
MTT法检测结果显示,miRNA-126组的生存率与NC组和control组相比,差异有统计学显著性(P<0.01),而NC组和control组相比差异无统计学显著性。结果表明,上调miRNA-126表达后肺癌A549细胞的增殖能力被显著抑制,见图2。
3miRNA-126对肺癌A549细胞增殖的影响
miRNA-126转染入肺癌A549细胞48 h后,用0.04%台盼蓝分别对A549细胞进行染色后,计算细胞的存活数目。miRNA-126组的细胞存活数目明显减少,较空白对照组与阴性对照组比较差异有统计学显著性(P<0.01),见图3。
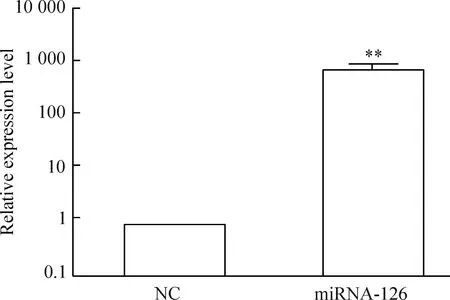
Figure 1.The expression on miRNA-126 in the lung cancer A549 cells after transfection with miRNA-126 agomir. Mean±SD.n=3.**P<0.01vsNC.
图1定量PCR方法检测细胞转染miRNA-126 agomir 48 h后miRNA-126表达量的上调情况
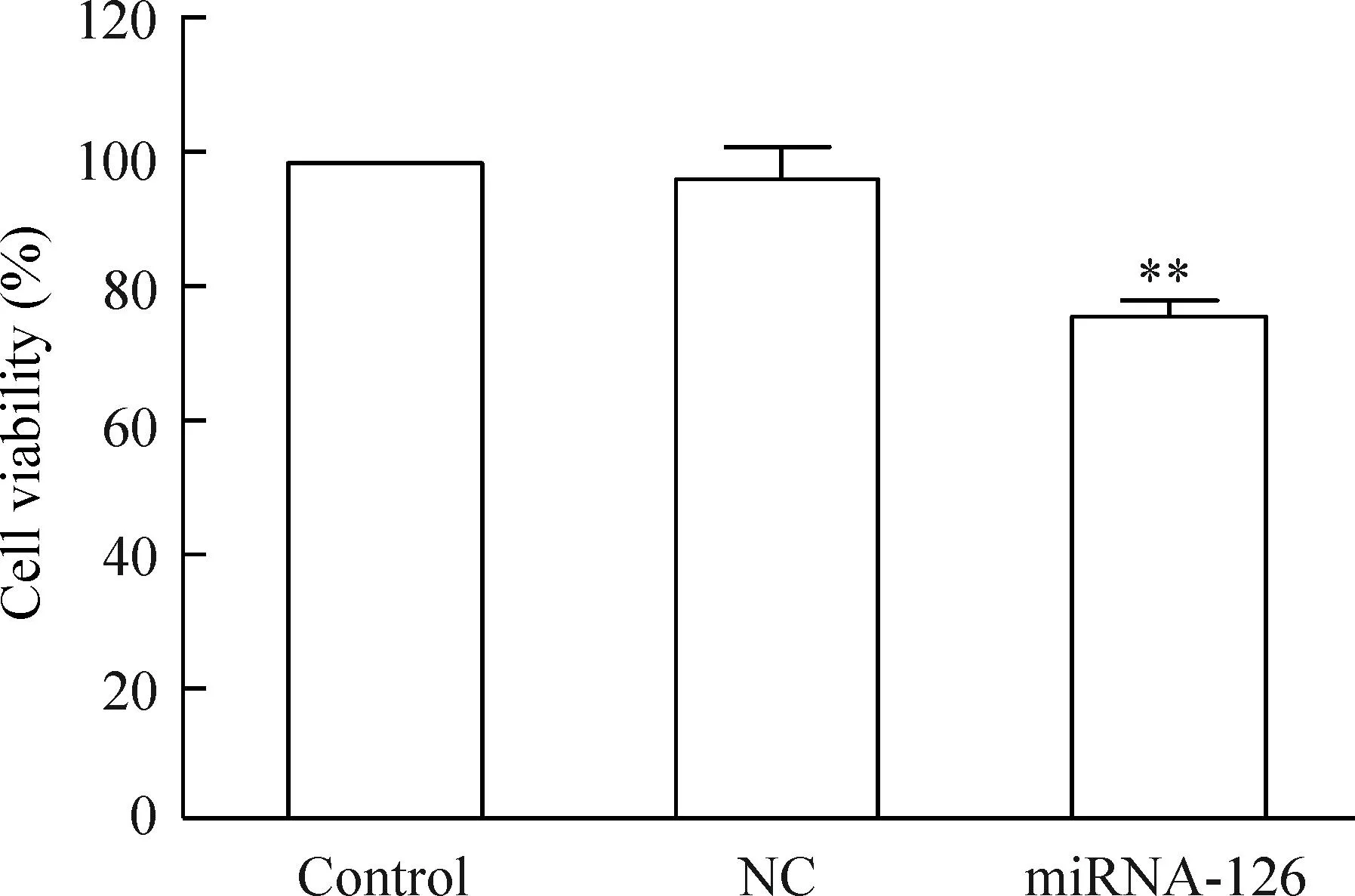
Figure 2.The cell activity of lung cancer A549 cells after transfection with miRNA-126 by MTT assay. Mean±SD.n=3.**P<0.01vsNC.
图2MTT法检测miRNA-126对肺癌A549细胞活力的影响

Figure 3.The number of viable A549 cells was counted by the method of Trypan blue exclusion. Mean±SD.n=3.**P<0.01vsNC.
图3台盼蓝拒染法检测活细胞数目
4miRNA-126对肺癌A549细胞集落形成的影响
细胞集落培养实验结果显示,miRNA-126组集落形成数与NC组相比明显减少(P<0.01),细胞的增殖能力明显受抑制,而NC组和control组集落形成数量的差异无统计学显著性,见图4。
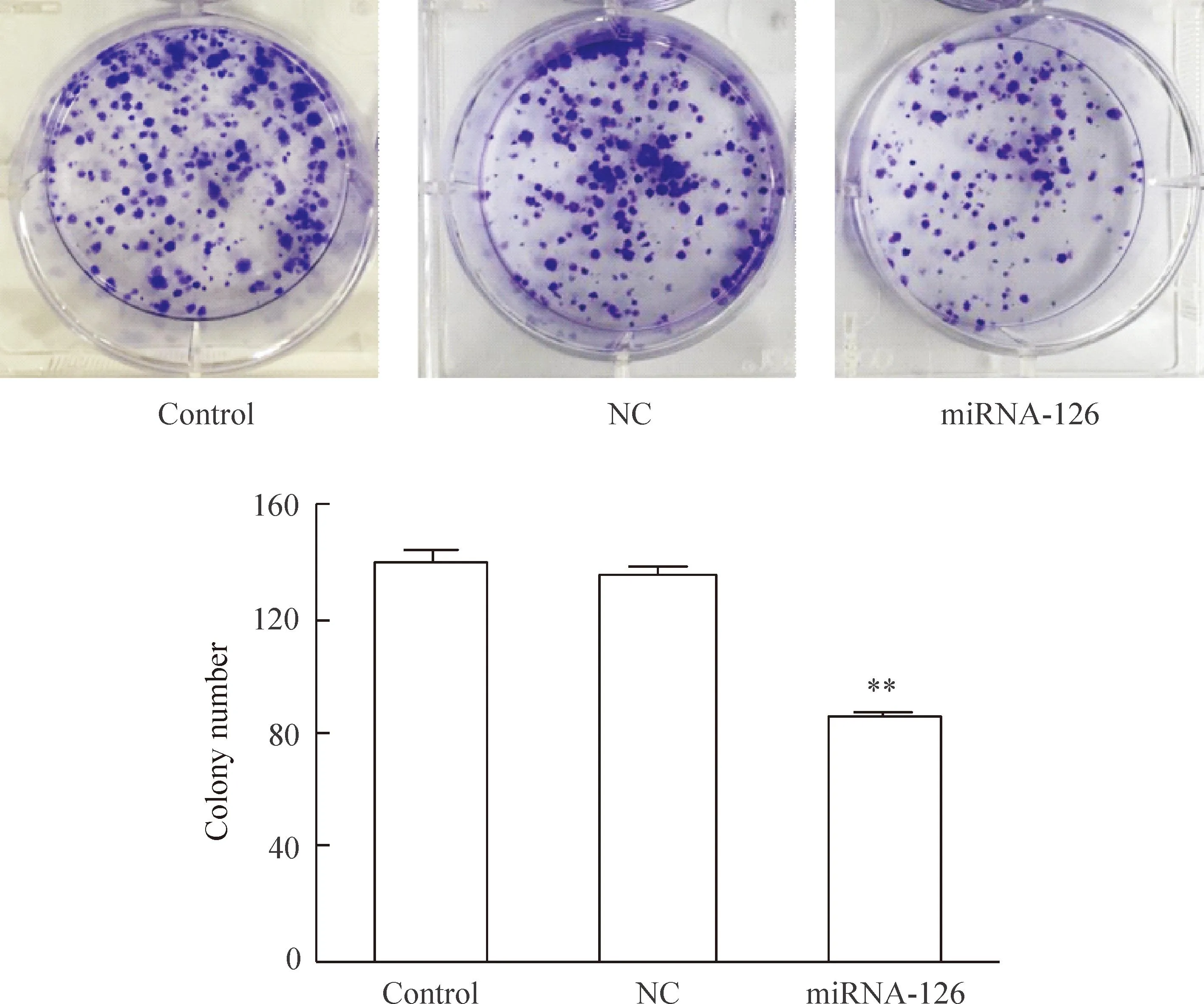
Figure 4.Cell colony formation after transfection with miRNA-126. Mean±SD.n=3.**P<0.01vsNC.
图4转染miRNA-126后细胞集落形成情况
5miRNA-126对肺癌A549细胞迁移侵袭能力的影响
划痕愈合实验及Transwell小室实验检测对肺癌A549细胞迁移侵袭能力的变化。结果显示转染miRNA-126后,肺癌A549细胞的迁移侵袭能力受到明显的抑制。划痕愈合实验结果显示,miRNA-126组划痕愈合率较control组和NC组分别下降了24.76%和23.44%,但NC组和空白组之间的差异无统计学显著性。miRNA-126组侵袭至Transwell小室滤膜下表面的细胞数为48.00±4.82,明显低于control组(109.00±6.63)和NC组(107.00±5.25),NC组和空白组之间的差异无统计学显著性,见图5。
6miRNA-126对EGFR/AKT/mTOR信号通路的影响
Western blot法检测结果显示,miRNA-126组与NC组相比, p-EGFR、p-AKT和p-mTOR水平均显著下降(P<0.01),NC组与对照组相比, p-EGFR、p-AKT和p-mTOR水平的差异无统计学显著性,见图6。
讨论
MicroRNA是一类由内源基因编码的长度约为22 个核苷酸的非编码双链RNA 分子,在细胞增殖凋亡迁移等多个生物进程中发挥着类似癌基因或抑癌基因的作用。目前研究发现在多种肿瘤中表达下调,如肺癌[5]、骨肉瘤[6]、食管鳞癌[7]、肝癌[8]、胃癌[9]等肿瘤的研究中发现癌组织较正常组织表达下降。Liu等[10]研究甲基化测序分析发现miRNA-126位于EGFL7基因的内含子中,EGFL7基因启动子的高甲基化导致miRNA-126的表达下调,过表达miRNA-126或抑制ADAM9的表达可下调EGFR/AKT信号活化,抑制食管磷癌细胞的体内外生长及迁移,该研究说明miRNA-126在肿瘤表达下调为表观遗传学机制所致。我们在前期研究中利用miRNA基因芯片技术也发现miRNA-126在肺癌组织与癌旁组织中差异表达,我们推测其在非小细胞肺癌组织中表达下调极可能也是由表观遗传学机制所致。
目前有关miRNA-126在肺癌中的研究较少,如Edit等[11]认为miRNA-126靶向作用于SLC7A5,延迟H69细胞G1期,从而抑制细胞增殖。Crawford等[12]的研究报道miRNA-126可能通过介导Crk蛋白的表达而抑制肺癌细胞的侵袭和迁移。Liu等[13]研究认为miRNA-126通过作用于VEGF表达抑制肺癌细胞增殖。本研究通过转染miRNA-126使肺癌细胞中miRNA-126的表达量增加探讨其对肺癌A549细胞增殖、迁移、侵袭等生物学行为的变化,结果显示过表达miRNA-126能显著抑制肺癌A549细胞的增殖、迁移和侵袭。
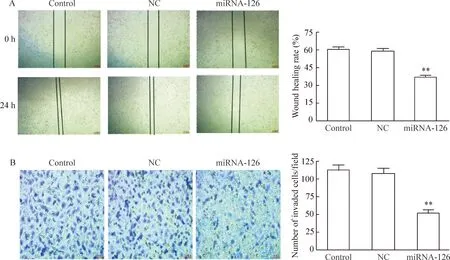
Figure 5.The effect of miRNA-126 on A549 cell migration and invasion. A: the migration ability of A549 cells transfected with miRNA-126 was examined by wound healing assay; B: the invasion ability of A549 cells transfected with miRNA-126 was measured by Transwell assay. Mean±SD.n=3.**P<0.01vsNC.
图5miRNA-126对肺癌A549细胞迁移和侵袭能力的影响
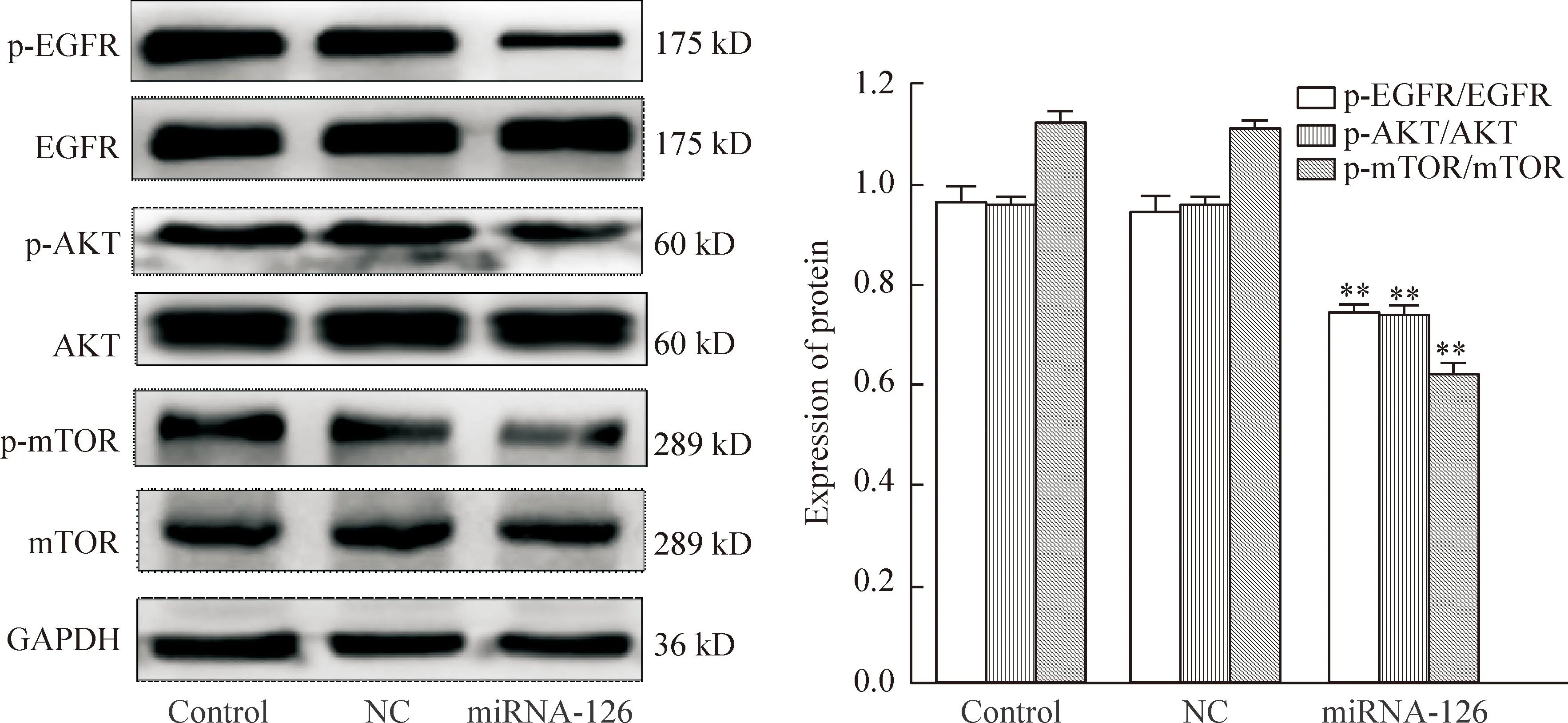
Figure 6.The protein levels of p-EGFR, p-AKT and p-mTOR in the lung cancer A549 cells transfected with miRNA-126. Mean±SD.n=3.**P<0.01vsNC.
图6转染miRNA-126对肺癌A549细胞EGFR/AKT/mTOR通路相关蛋白水平的影响
EGFR是表皮生长因子(epidermal growth factor,EGF)细胞增殖和信号传导的受体。在多种恶性肿瘤中,EGFR发挥了重要作用,包括促进增殖、减少凋亡、提高肿瘤细胞运动能力和促进血管新生[14-15]等。EGFR突变导致其表达或活性异常,进而会促进肿瘤的发生。EGFR下游信号主要包括 PI3K/AKT、Ras/Raf/MEK/MAPK、STAT3等通路。Schettino等[16]研究认为 EGFR 在肺癌中过表达的发生率为37%~60%,并且临床分期越晚,EGFR的表达越强,说明EGFR 的表达与肺癌的发生发展密切相关。然而,目前miRNA-126在肺癌中有关EGFR的信号通路研究尚不清楚。本实验通过分析miRNA-126与EGFR信号通路分子间的相互关系,进一步明确miR-126在肺癌中的作用机制。研究结果显示miRNA-126可以显著降低肺癌A549细胞中p-EGFR、p-AKT和p-mTOR蛋白水平。说明miRNA-126可能通过下调EGFR/AKT/mTOR信号通路影响肺癌A549细胞的增殖、迁移和侵袭。
综上所述,本实验通过细胞转染使肺癌A549细胞miRNA-126过表达,分析肺癌细胞的增殖、迁移、侵袭等生物学行为变化,并探讨引起这一变化的可能作用机制。实验结果表明miRNA-126能够抑制肺癌A549细胞的增殖、迁移和侵袭,同时抑制了EGFR/AKT/mTOR信号通路。我们还将继续研究miRNA-126的靶基因,通过基因敲除或过表达该靶基因,进而构建稳定的细胞株,分析EGFR/AKT/mTOR信号通路与miRNA-126的靶基因之间的相互作用,将为miRNA-126应用于肺癌的临床治疗提供实验依据。
[参考文献]
[1]Chen QY, Zheng Y, Jiao DM, et al. Curcumin inhibits lung cancer cell migration and invasion through Rac1-dependent signaling pathway[J].J Nutr Biochem,2014, 25(2):177-185.
[2]Feng B, Zhang K, Wang R, et al. Non-small-cell lung cancer and miRNAs: novel biomarkers and promising tools for treatment[J]. Clin Sci, 2015, 128(10):619-634.
[3]Ma YF, Qin HD, Cui YF. MiR-34a targets GAS1 to promote cell proliferation and inhibit apoptosis in papillary thyroid carcinoma via PI3K/AKT/Bad pathway[J]. Biochem Biophys Res Commun, 2013,441(4):958-963.
[4]Wang X, Ling C, Bai Y, et al. MicroRNA-206 is associated with invasion and metastasis of lung cancer [J]. Anat Rec, 2011, 294(1):88-92.
[5]Edin J, Matija R, Dragan K, et al. let-7b and miR-126 are down-regulated in tumor tissue and correlate with microvessel density and survival outcomes in non-small-cell lung cancer[J]. PLoS One, 2012,7(9): 45577-45586.
[6]Jiang LD, He AY, Zhang Q, et al. miR-126 inhibits cell growth, invasion, and migration of osteosarcoma cells by down regulating ADAM-9[J]. Tumour Biol, 2014, 35(12): 12645-12654.
[7]Nie ZC, Weng WH, Shang YS, et al. MicroRNA-126 is down-regulated in human esophageal squamous cell carcinoma and inhibits the proliferation and migration in EC109 cell via PI3K/AKT signaling pathway[J]. Int J Clini Exp Pathol, 2015, 8(5): 4745-4754.
[8]Zhao CF, Li Y, Zhang M, et al. miR-126 inhibits cell proliferation and induces cell apoptosis of hepatocellular carcinoma cells partially by targeting Sox2[J]. Human Cell, 2015, 28(2):91-99.
[9]Wang JQ, Chen XH, Su LP, et al. MicroRNA-126 inhibits cell proliferation in gastric cancer by targeting LAT-1[J]. Biomed Pharmacother, 2015, 72(6): 66-73.
[10]Liu RH, Gu J, Jiang P, et al. DNMT1-microRNA126 epigenetic circuit contributes to esophageal squamous cell carcinoma growth via ADAM9-EGFR-AKT signaling[J]. Clin Cancer Res, 2015, 21(4):854-863.
[11]Edit M, Zoltán M, Zsolt C, et al. miR-126 inhibits proliferation of small cell lung cancer cells by targeting SLC7A5[J]. FEBS Lett, 2011, 585(8): 1191-1196.
[12]Crawford M, Brawner E, Batte K, et al. MicroRNA-126 inhibits invasion in non-small cell lung carcinoma cell lines[J]. Biochem Biophys Res Commun, 2008, 373(4):607-612.
[13]Liu BO, Peng XC, Zheng XL, et al. MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell linesinvitroandinvivo[J]. Lung Cancer, 2009, 66(2):169-175.
[14] Lee JG, Wu R. Erlotinib-cisplatin combination inhibits growth and angiogenesis through c-MYC and HIF-1α in EGFR-mutated lung cancerinvitroandinvivo[J]. Neoplasia, 2015, 17(2): 190-200.
[15]Xiao H, Tong RL, Ding CF, et al. γ-H2AX promotes hepatocellular carcinoma angiogenesis via EGFR/HIF-1α/VEGF pathways under hypoxic condition[J]. Oncotarget, 2015, 6(4):2180-2192.
[16]Schettino C, Bareschino MA, Sacco PC, et al. New molecular targets in the treatment of NSCLC[J]. Curr Pharm Des, 2013, 19(30):5333-5343.
(责任编辑: 陈妙玲, 罗森)
miRNA-126 inhibits proliferation, migration and invasion of human lung cancer A549 cells via EGFR/AKT/mTOR pathway
TANG Xia-li, JIAO De-min, CHEN Jun, WANG Jian, CHEN Qing-yong
(DepartmentofRespiratoryMedicine,The117thHospitalofPLA,Hangzhou310004,China.E-mail:cqy117@163.com)
[ABSTRACT]AIM: To investigate the effects of microRNA (miRNA)-126 on the proliferation, migration and invasion of human lung cancer cell lines, and to explore its mechanism. METHODS: The A549 cells were transfected with miRNA-126 agomir by Lipofectamine 2000. The expression of miRNA-126 was detected by real-time PCR. The cell activity was detected by MTT assay. The number of viable A549 cells was counted by the method of Trypan blue exclusion. The cell colony-forming capability was determined by cell colony formation test. The cell migration and invasion abilities were assayed by wound healing and Transwell methods, respectively. The protein levels of p-EGFR, EGFR, p-AKT, AKT, p-mTOR and mTOR were determined by Western blot. RESULTS: The expression level of miRNA-126 was significantly increased in the A549 cells compared with negative control (NC) group and control group (P<0.01). The proliferation of A549 cells was decreased extremely after transfected with the miRNA-126 agomir (P<0.01), so did the result of the cell colony-formation test. The migration and invasion abilities of the lung cancer cells were also significantly inhibited. The protein levels of p-EGFR, p-AKT and p-mTOR were significantly down-regulated compared with NC group and control group (P<0.01). CONCLUSION: Over-expression of miRNA-126 significantly inhibits the proliferation, migration and invasion ability of human lung cancer A549 cells by down-regulation of EGFR/AKT/mTOR pathway.
[KEY WORDS]MicroRNA-126; EGFR/AKT/mTOR pathway; Lung cancer; Cell proliferation
doi:10.3969/j.issn.1000- 4718.2016.03.012
[中图分类号]R730.23
[文献标志码]A
通讯作者△Tel: 0571-28084872; E-mail: cqy117@163.com
*[基金项目]浙江省公益性技术应用研究计划(No.2013C33209;No.2014C33277);杭州市医疗卫生科研项目(No.20130633B29;No.20140633B40)
[收稿日期]2015- 09- 22[修回日期] 2015- 12- 03
[文章编号]1000- 4718(2016)03- 0458- 06
杂志网址: http://www.cjpp.net

