羟乙基淀粉对大鼠心肌缺血再灌注后无复流的影响*
黄崇安, 何丽娜, 孙嘉利, 应安娜, 叶永挺, 蔡 琪, 袁琳波, 花春艳
(温州医科大学生理学教研室,浙江 温州 325035)
羟乙基淀粉对大鼠心肌缺血再灌注后无复流的影响*
黄崇安,何丽娜,孙嘉利,应安娜,叶永挺,蔡琪,袁琳波△,花春艳△
(温州医科大学生理学教研室,浙江 温州 325035)
[摘要]目的: 探讨羟乙基淀粉(HES 130/0.4)对大鼠心肌缺血再灌注中无复流现象的影响及机制。方法:36只SD大鼠随机分为缺血-再灌注组(IR组),生理盐水组(NS-IR组),羟乙基淀粉组(HES-IR组)和假手术组(sham组)。NS-IR 和HES-IR 组在缺血30 min时分别静注生理盐水和HES 130/0.4,再灌注180 min 后以Evans blue、Thilflavin S和TTC染色测定心肌梗死面积与无复流范围,同时检测心肌肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白I(cTnI)含量和髓过氧化物酶(MPO)活性。培养心肌微血管内皮细胞,随机分为正常对照组(Con组),缺氧-复氧组(H/R组),生理盐水组(NS-H/R组)和羟乙基淀粉组(HES-H/R组),以缺氧复氧法模拟急性缺血再灌注,测定游离钙离子浓度、细胞活力和凋亡率。结果:HES-IR 组大鼠心肌梗死面积、无复流范围、心肌酶CK-MB、cTnI和MPO与IR 组相比均减少(P<0.05)。HES-H/R组细胞内游离钙离子浓度和细胞凋亡率较H/R组亦明显减少(P<0.05),而细胞活力增高(P<0.05)。结论:HES 130/0.4能改善心肌缺血-再灌注后的无复流现象,其机制不仅涉及对中性粒细胞激活、浸润的抑制,还与减轻内皮细胞钙超载有关。
[关键词]羟乙基淀粉; 心肌再灌注损伤; 无复流; 髓过氧化物酶; 钙离子
经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是目前急性心肌梗死(acute myocardial infarction,AMI)时冠脉再通的首选方法,能够早期恢复心肌灌注。但经PCI使冠脉再通后, 约有 30%~50%的患者仍可发生心肌组织再灌注不足或无灌注[1],即无复流现象(no-reflow phenomenon)。此现象严重影响AMI的预后,可使患者住院病死率增加5~10倍,还是多种重要心脏事件的独立预测因子,因此无复流的防治已成为AMI治疗的关键。然而由于其发生机制复杂,往往同时涉及缺血-再灌注(ischemia-reperfusion,IR)损伤、内皮和组织水肿、多形核中性粒细胞(polymorphonuclear neutrophils,PMN)浸润和微循环栓塞等多种过程,许多现有药物的疗效并不十分确定。
羟乙基淀粉(hydroxyethylstarch,HES)是临床最常用的血浆代用品之一,能够迅速稳定渗透压,封堵毛细血管漏,扩充血容量。近年来许多研究表明,HES还可通过抑制中性粒细胞激活和黏附[2-3]的抗炎作用减轻脑和心肌的缺血-再灌注损伤。但HES能否以此影响AMI再灌注时无复流的发生尚未见报道。本研究应用大鼠模型,以病理学染色方法和心肌酶活性检测评价了HES对心脏缺血再灌注后无复流的影响,并根据髓过氧化物酶(myeloperoxidase,MPO)活性及进一步测得心肌微血管内皮细胞内钙离子浓度([Ca2+]i)的变化,对HES的作用机制进行了探讨。
材料和方法
1动物
36只SD大鼠由温州医科大学动物中心提供,体重(240±20)g, 雌雄不拘,按体重从大到小排序,按随机数字表法分为4组,每组9只。
2主要试剂
HES 130/0.4氯化钠注射液购自山东华鲁制药有限公司;Thilflavin S 购自Bioluminor;Evans blue 购自Abcam;TTC染液购自南京建成生物公司;大鼠肌酸激酶同工酶(creatine kinase MB isoenzyme,CK-MB)、心肌肌钙蛋白Ⅰ(cardiac troponin Ⅰ,cTnI)、MPO试剂盒均购自R&D;DMEM/F12 培养基、胰蛋白酶购自 Gibco;胎牛血清购自 HyClone;CCK-8 试剂购自Dojindo;PI 溶液和Fluo-2/AM 购自 Sigma。SPD-66A紫外检测器购自Shimadzu;流式细胞仪购自Beckman Coulter。
3主要方法
3.1大鼠AMI再灌注模型的制备20%乌拉坦腹腔注射(每100g重0.6 mL)以麻醉大鼠,切开气管,连接呼吸机辅助呼吸。消毒铺巾,打开胸腔,纵行切开心包膜,充分暴露心脏,于冠状动脉左前降支(left anterior descending,LAD)近段结扎。缺血90 min后切断结扎线,根据局部心肌颜色变化证实再灌注,再灌注时间为120 min。缺血-再灌注组(IR组)不做其它处理。HES-缺血-再灌注组(HES-IR组)在缺血30 min时尾静脉注射1 mL HES,生理盐水-缺血-再灌注组(NS-IR组)用等剂量的生理盐水替代。假手术组(sham组)不结扎冠状动脉左前降支,仅尾静脉注射等量的生理盐水。
3.2病理染色与心肌无复流程度、梗死程度的测定恢复灌注后,左心室经导管注入6% Thioflavin S溶液(1 mg/kg)以标记再灌注心肌。结扎原冠脉,再次经导管注入左心室Evans blue溶液(1 mg/kg),取出心脏,分离左心室,快速深低温冷冻。冷冻心脏复温解冻,沿房室沟平行切为8~10层。未被染成蓝色的心肌属于结扎冠脉供血范围,其中在紫外灯下无荧光的心肌为无复流心肌,后者与前者的比例即为无复流的比例。将各层心肌行TTC染色,红色阳性区为非梗死心肌,灰白阴性区为梗死心肌。
3.3cTnI、MPO和CK-MB的检测大鼠均于再灌注结束后取梗死及梗死周边区心肌组织置于匀浆器内,剪碎,制备匀浆。3 000 r/min离心15 min后,取上清液,用酶联免疫试剂盒分别测定CK-MB、cTnI和MPO的含量。
3.4心肌微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)的分离培养、鉴定与模型建立采用酶消化法分离大鼠CMECs,具体步骤参考文献[4]。采用免疫荧光方法检测细胞中第Ⅷ因子相关抗原,对分离培养的CMECs进行鉴定。CMECs 染色后细胞质呈现绿色荧光,细胞核呈现蓝色荧光。取稳定生长的第2~ 3 代细胞于37 ℃、5% CO2、饱和湿度环境培养3~ 4 d后,按照完全随机化法分为: (1)正常对照(control,Con)组:正常培养液培养,不加干预;(2)缺氧/复氧(hypoxia/reoxygenation, H/R)组:CMECs置于培养箱内缺血小室,通以95% N2+5% CO2混合气体1.5 L/min,15 min 后调节流速至0.5 L/min,持续缺氧2 h,模拟缺血;取出细胞去上清液,加入空气饱和含10%胎牛血清的DMEM/F12培养液,于培养箱内复氧4 h,即缺氧2 h/复氧4 h,模拟在体心肌急性缺血再灌注;(3)HES-H/R组:复氧时加入1 mL HES;(4)NS-H/R组:复氧时加入等量生理盐水。
3.5激光共聚焦测量内皮细胞内游离钙的变化将各组细胞样品滴加Fura-2负载溶液,在37 ℃下避光负载20~30 min,制片。放置于激光共聚焦显微镜的载物台上,连续动态扫描选定细胞内Ca2+荧光强度的变化。发射波长为380 nm,采样频率为488 Hz, 激发波长为340 nm,每隔10 s 扫描 1 次。将细胞内Ca2+荧光强度变化图像进行分析处理,得相对荧光强度值的时间~效应曲线,再转换为时间~[Ca2+]i曲线。在相同的环境下,每实验组先后重复3次。Fura-2检测 [Ca2+]i的计算公式为 [Ca2+]i=Kd[(R-Rmin)/(Rmax-R)](Fmin/Fmax)。
3.6CCK-8 检测细胞活力制备各组细胞悬液,将CDn、H/R、NS- H/R、HES-H/R 4组分别接种到96孔板中,每个样本加3个孔,每孔100 μL细胞悬液,做3个重复,放入培养箱预培养。每孔加入10 μL CCK-8溶液,经过1~4 h后,酶标仪检测450 nm处的吸光度(A)值,从而测定细胞活力的变化。
3.7流式细胞术检测细胞凋亡率收集悬浮细胞于离心管中,600×g离心5 min。弃上清,加入生理盐水,使细胞浓度为4×109/L,加入预冷的70% 乙醇固定,4 ℃保存1 h。用PBS离心,去除固定液,加1% RNase,37 ℃水浴30 min。用800 μL PI 染色液混匀,4 ℃避光30 min后用流式细胞仪检测,以波长488 nm 氩离子激发荧光,记录红色荧光,分析凋亡细胞百分率。
4统计学处理
采用SPSS 19.0软件进行统计学分析,各组数据均以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,多样本均数之间的两两比较用SNK-q检验,表1的计数资料用2检验。以P<0.05为差异有统计学意义。
结果
1HES对大鼠再灌注性心律失常的影响
IR组大鼠心肌ST段明显抬高,而且合并缺血引起的心律失常;HES-IR组大鼠心肌再灌注性心律失常发生率显著低于IR组,其持续时间较短,差异有统计学显著性(P<0.05);NS-H/R组较IR组差异无统计学显著性;Sham组未见再灌注心律失常发生。见图1、表1。
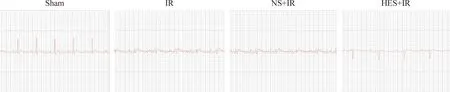
Figure 1.The rat ECG recorded during reperfusion in each group.
图1各组大鼠心肌再灌注性心律失常的监测
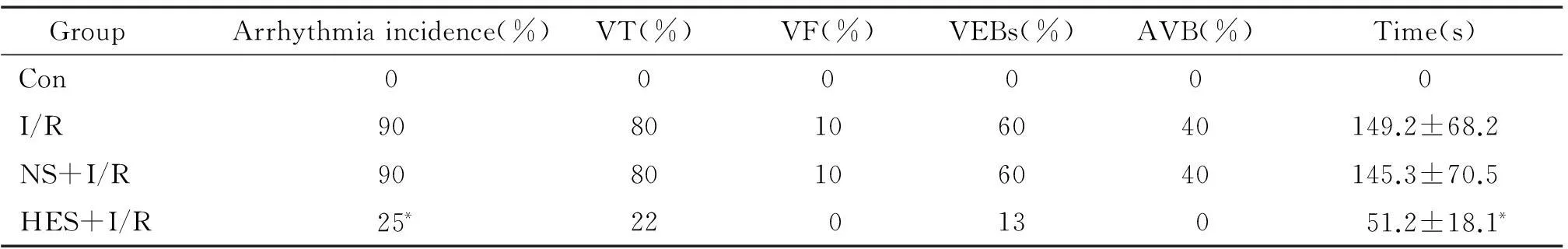
表1 各组大鼠心肌再灌注性心律失常的监测
VT: ventricular tachyarrhythmia; VF: ventricular fibrillation; VEBs: ventricular ectopic beats; AVB: atrioventricular block.*P<0.05vsI/R group.
2各组梗死范围及无复流范围比较
病理染色结果显示,IR组和NS-IR组的心肌均出现了明显的梗死和无复流,提示无复流模型成功,其梗死范围分别为(33.6±7.0)%和(33.3±7.5)%,无复流范围分别为(16.0±2.0)%和(14.6±3.2)%,两组间差异无统计学显著性。HES-IR组心肌的梗死和无复流范围为(18.0±3.6)%和(8.5±2.0)%,与IR组相比均显著降低,差异有统计学显著性(P<0.05)。见图2~4。
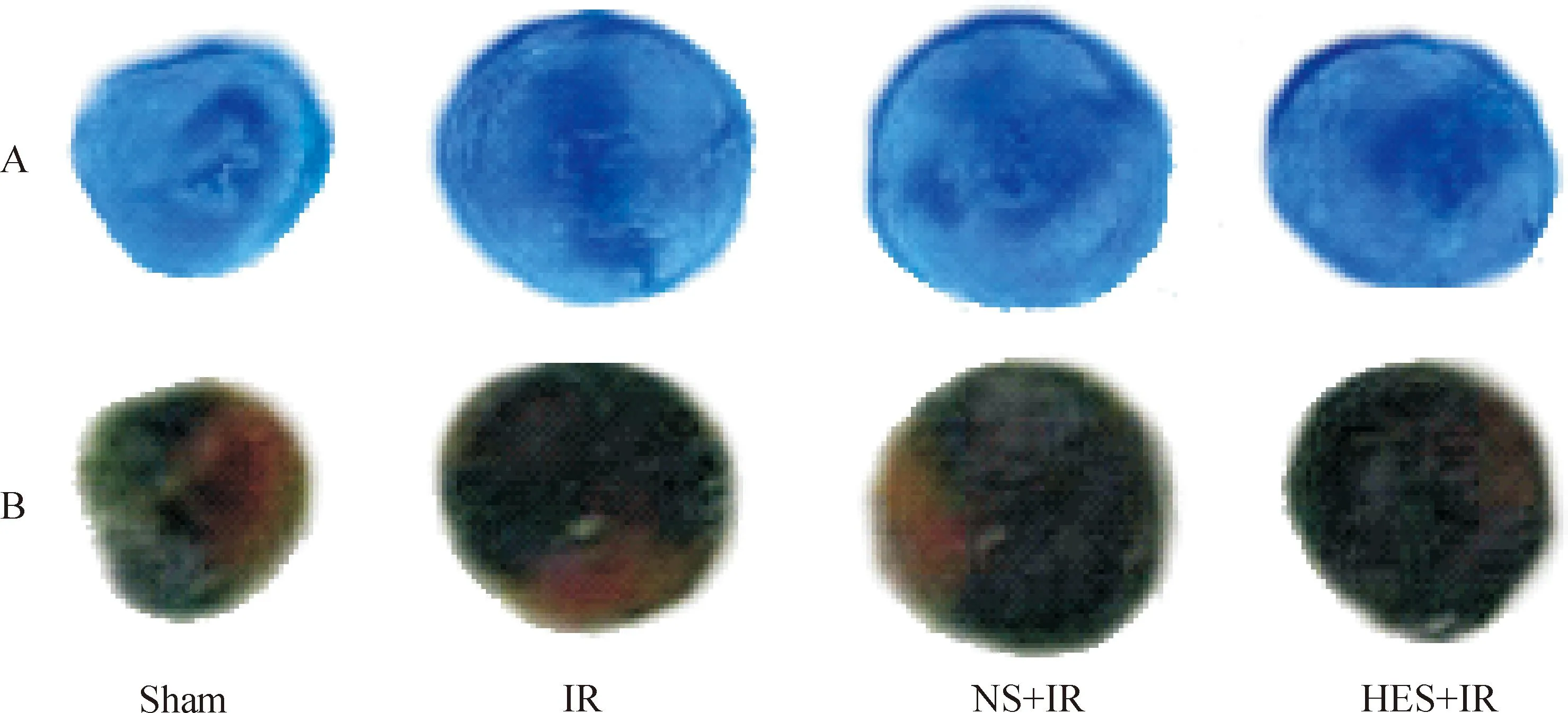
Figure 2.The range of myocardial infarction and no-reflow phenomenon in each group. A:the Thioflavin S-negative staining regions represent no-reflow; B: the TTC-negative staining regions represent myocardial infarction.
图2各组大鼠心肌梗死、无复流面积的评估
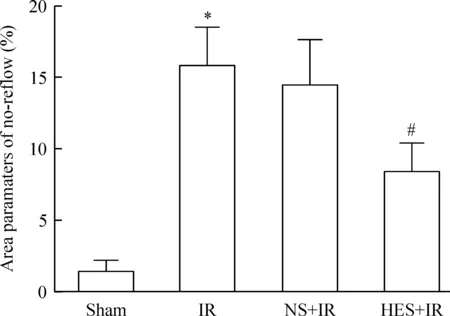
Figure 3.Comparison of the range of no-reflow in each group. Mean±SD.n=9.*P<0.05vssham group;#P<0.05vsIR group.
图3各组大鼠心肌无复流范围比较
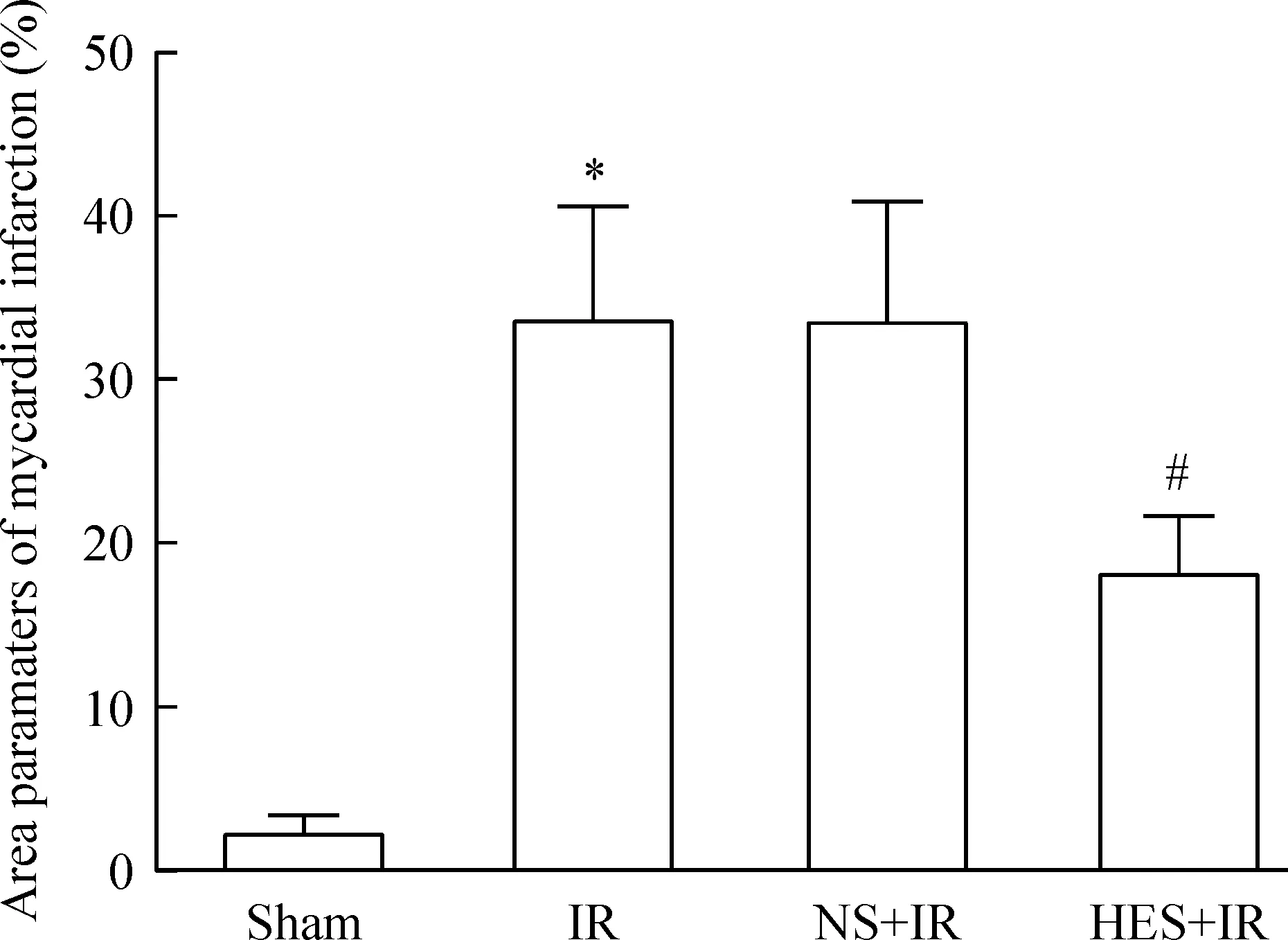
Figure 4.The range of myocardial infarction in each group. Mean±SD.n=9.*P<0.05vssham group;#P<0.05vsIR group.
图4各组大鼠心肌梗死范围比较
3各组心肌酶含量的比较
酶联免疫试剂盒检测结果显示,IR组心肌的CK-MB、cTnI和 MPO分别为(128.95±12.38)U/L、(65.54±4.32)U/L和(832.10±29.20)U/g,均显著增高;NS-IR组3种酶分别为(124.39±8.68)U/L、(64.84±4.21)U/L和(823.31±25.98)U/g,两组间差异无统计学显著性,均提示心肌损伤,且出现了明显的中性粒细胞浸润聚集。HES-IR组3种酶含量分别为(88.01±3.35)U/L、(43.27±4.82)U/L和(567.21±19.53)U/g,与IR组相比显著降低,差异有统计学显著性(P<0.05),提示HES对缺血再灌注后的心肌损伤和无复流现象有改善作用,见图5。
4各组内皮细胞活力的比较
心肌微血管内皮细胞的分离培养鉴定结果见图6。CCK-8法检测细胞活力情况,H/R组、NS-H/R组的A值分别为0.428±0.068和0.429±0.039,明显低于正常对照组,提示内皮细胞活力降低。HES-H/R组的A值为0.607±0.043,与H/R组相比显著增高,差异有统计学显著性(P<0.05),见图7。
5各组微血管内皮细胞流式检测凋亡率的比较
流式细胞术检测凋亡率显示,H/R组和NS-H/R组内皮细胞的凋亡率增高,其值分别为(8.4±1.4)%和(8.4±0.9)%,两组间差异无统计学显著性。HES-H/R组内皮细胞凋亡率为(3.4±0.7)%,较H/R组显著降低,差异有统计学显著性(P<0.05),见图8。
6各组微血管内皮细胞钙离子浓度的比较
激光共聚焦观察显示,H/R组和NS-H/R组的内皮细胞内钙离子浓度增高,其值分别为(226.44±18.83) nmol/L和(229.53±6.25) nmol/L,2组间差异无统计学显著性。HES-H/R组细胞内的钙离子浓度为(145.00±18.53)nmol/L,与H/R组相比显著降低,差异有统计学显著性(P<0.05),见图9。
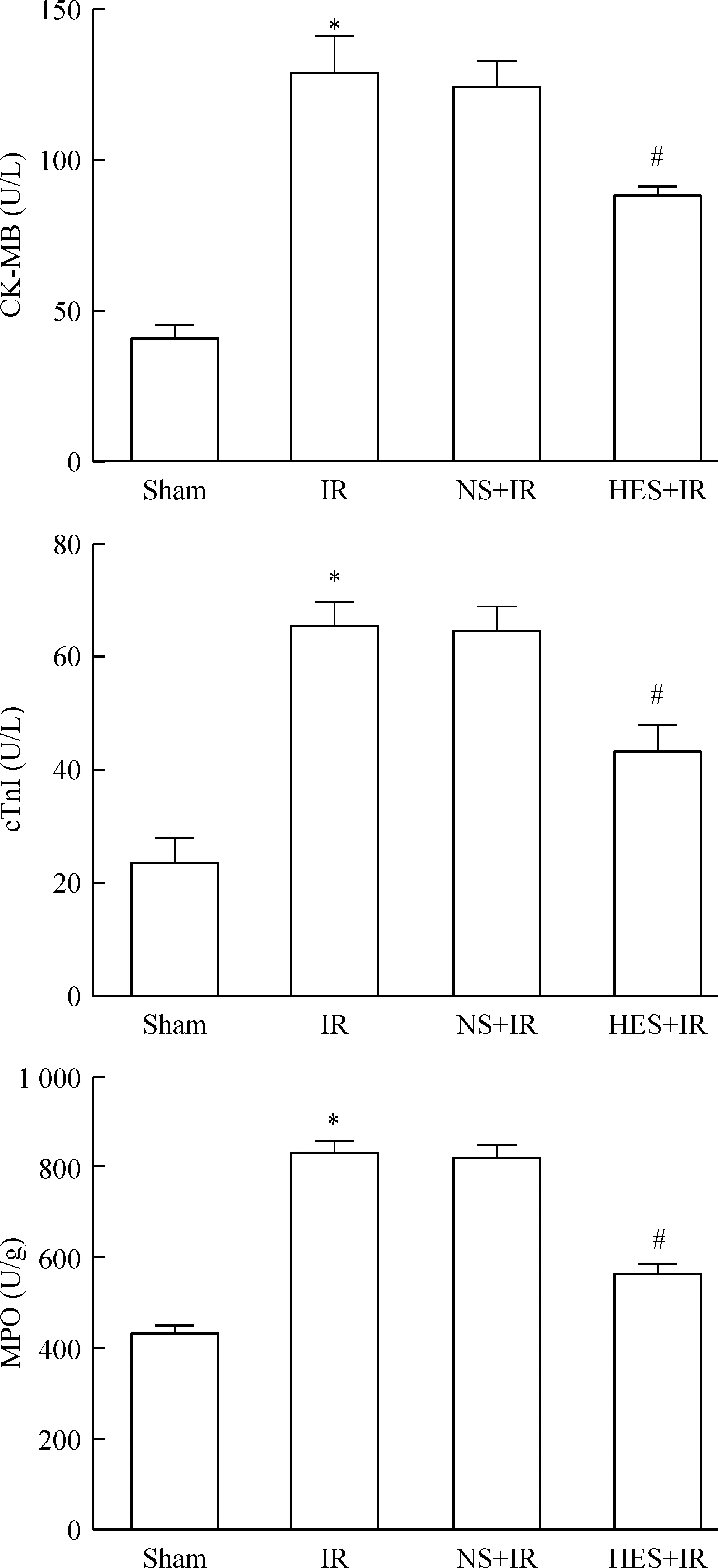
Figure 5.The levels of CK-MB, cTnI and MPO in each group. Mean±SD.n=9.*P<0.05vssham group;#P<0.05vsIR group.
图5各组大鼠心肌 CK-MB、cTnI和 MPO 水平的比较
讨论
PCI术后无复流的发生已成为当今 AMI治疗中实现心肌有效再灌注的最大障碍,然而其机制至今尚未阐述清楚,这严重制约着无复流防治的进展。目前较认可的机制中,PMN介导的炎症反应可能是心肌缺血再灌注损伤众多机制的共同效应环节或途径[5]。首先,PMN体积较大,变形能力弱,极易嵌顿。
Figure 6. Appraisement of rat cardiac microvessel endothelial cells.
图6第Ⅷ因子抗原检测鉴定大鼠心肌微血管细胞
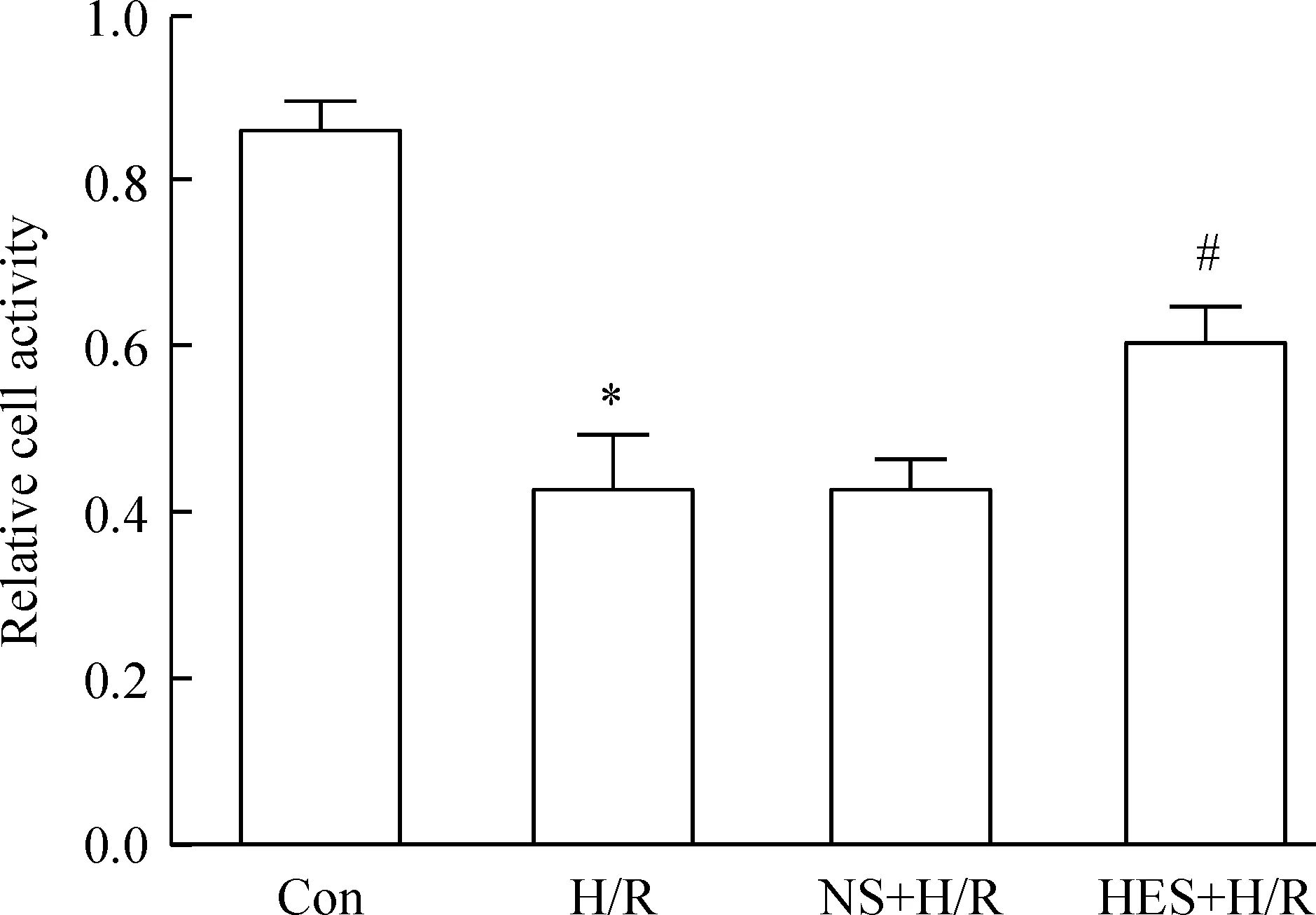
Figure 7.The cell activity of rat microvascular endothelial cells in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsH/R group.
图7各组大鼠微血管内皮细胞活力的比较
再灌注时毛细血管内PMN的数量可增加10~20倍,大量PMN沿血管内皮细胞附壁滚动、在黏附分子参与下紧密黏附并浸润于内皮下,引起血小板聚集并机械性堵塞毛细血管[6],导致无复流的发生。其次,PMN激活产生的炎症介质和蛋白水解酶、氧自由基、花生四烯酸等还可通过多种机制妨碍组织有效再灌注:直接损伤内皮细胞、心肌细胞;受损的内皮、PMN和血小板可释放大量缩血管物质,导致微血管痉挛,血流受阻[7];血管通透性增加使大量浆液渗出、局部血液浓缩、黏度增高,加重心肌缺血缺氧;严重渗出可引起组织间隙水肿、压迫毛细血管从而加剧微循环障碍,这些均利于无复流的发生。此外,PMN还可诱导细胞黏附分子和血管细胞黏附分子广泛表达,促进自身的黏附、滚动、激活和浸润。
MPO是PMN的特异性标志物[8],通过测定MPO 的活性即可灵敏、定量地反映PMN 的含量及其在组织中的浸润。本实验结果显示,大鼠心肌缺血再灌注后出现了明显的梗死灶和无复流区,其MPO活性显著增高,提示PMN大量浸润,与过往研究一致;而HES干预组的PMN心肌浸润明显减轻,梗死程度和无复流面积均明显减少,说明HES不仅能够减轻心肌缺血再灌注损伤,还能通过减少PMN的心肌浸润抑制心肌无复流的发生。其机制可能与PMN参与的上述一系列炎症反应被抑制有关。此前,周大春等[9]就发现 HES 通过抑制内皮细胞活化和细胞间黏附分子ICAM-1的表达、减少PMN的黏附与迁移来减轻鼠肾缺血再灌注损伤。Matharu 等[10]则观察到 HES通过抑制 E-选择素和 IL-8 的产生来抑制PMN的黏附和激活。陈雪君等[11]还发现HES 能抑制内皮素-1(endothelin-1,ET-1)的产生和释放从而减轻心肌缺血再灌注损伤。但HES具体通过经何种途径抑制上述分子的合成目前尚不清楚,可能涉及到HES对NF-κB活性的抑制[12]。
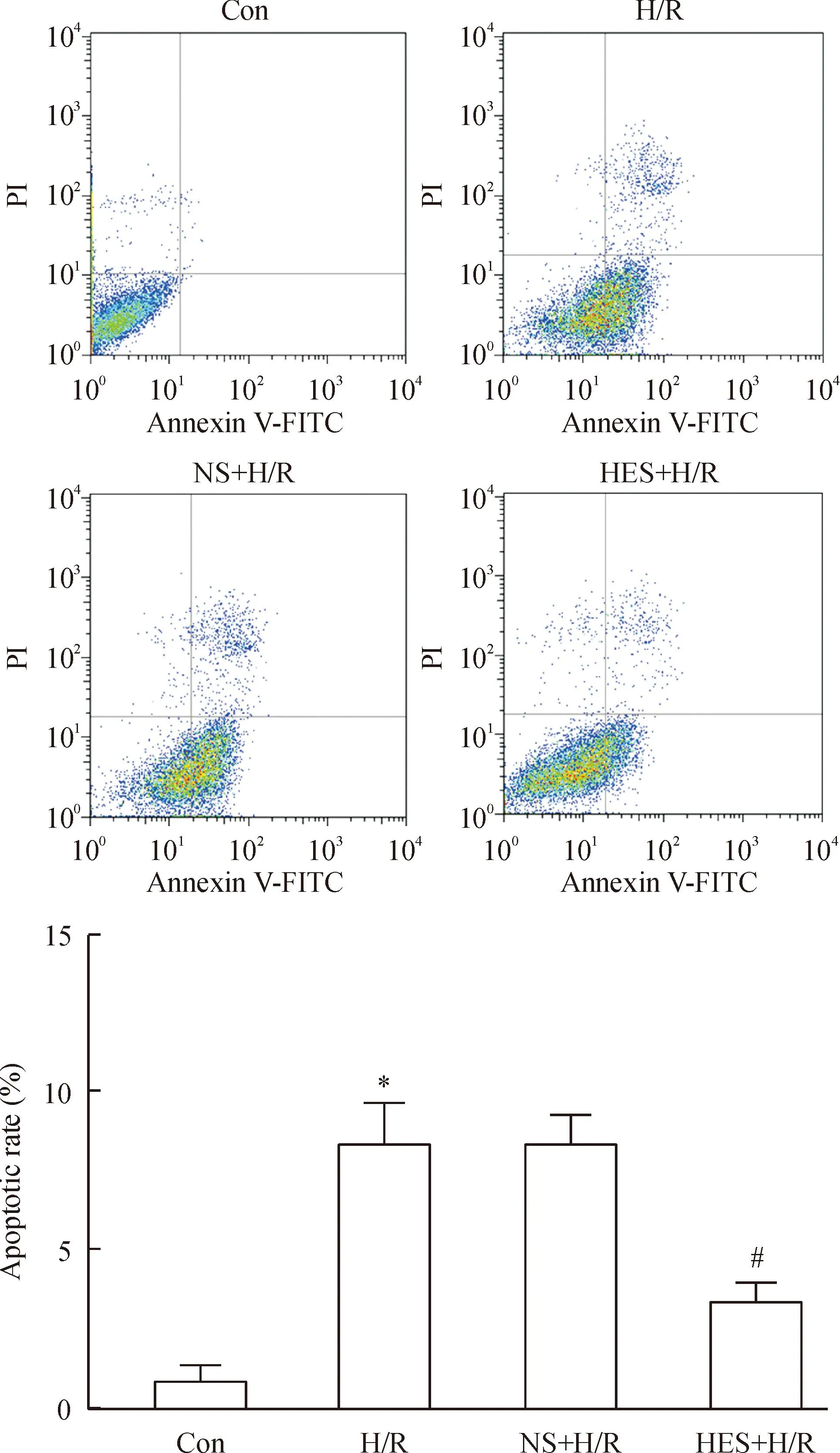
Figure 8.The apoptosis of microvascular endothelial cells detected by flow cytometry in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsH/R group.
图8各组大鼠微血管内皮细胞凋亡检测

Figure 9.The intracellular calcium ion concentration ([Ca2+]i) of microvascular endothelial cells in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsH/R group.
图9各组大鼠微血管内皮细胞内钙离子浓度的比较
钙是最常见的细胞信号转导物质,对细胞的结构、功能影响重大。当内皮细胞的[Ca2+]i增高时,除细胞损伤外,Ca2+还可与钙调蛋白结合并激活肌球蛋白轻链激酶,使肌球蛋白轻链磷酸化,进而重建细胞骨架,引起细胞变形回缩。故通过诱导内皮细胞[Ca2+]i的升高,多形核白细胞可使内皮细胞间隙增加[13],有助于PMN的穿过和浸润。本研究进一步进行心肌微血管内皮细胞实验,发现缺氧/复氧组内皮细胞[Ca2+]i显著增加,且细胞凋亡率明显增高,而HES处理组内皮细胞的[Ca2+]i和细胞凋亡率均较缺氧/复氧组显著降低,说明HES能够阻止缺氧/复氧状态下内皮细胞[Ca2+]i的增加,保护内皮细胞。有趣的是,Ca2+作为第二信使,恰好可引起P-选择素和细胞间黏附分子-I等在内皮细胞的快速表达[14-15],同时也是许多分子如IL-8、内皮素和一氧化氮合酶等合成表达的重要调控物质[16],能够促进白细胞黏附、滚动、穿过血管内皮细胞以及炎症损伤的发生。HES能减低缺氧/复氧内皮细胞[Ca2+]i,则其不仅能抑制内皮细胞骨架改变,还能抑制Ca2+调控的细胞间黏附分子-1等上述分子的合成。这与过去报道的HES通过下调细胞间黏附分子-1等表达抑制PMN激活、浸润和炎症反应的机制基本一致,提示了HES抑制PMN激活、浸润作用的具体途径,可能与减低内皮细胞[Ca2+]i,与线粒体功能恢复或离子通道改变等等有关。
此外,细胞内钙离子增加可激活磷脂酶类,促使膜磷脂降解,导致线粒体膜破坏,加重能量代谢障碍,引起细胞肿胀。肿胀的内皮细胞在再灌注后2 h 之内可大量出现,压迫毛细血管,阻塞微循环。故HES或许还可通过调节内皮细胞 [Ca2+]i、减轻细胞肿胀来改善无复流。
总之,本实验证明HES可通过减少PMN心肌浸润、抑制细胞内钙超载等途径来减轻心肌缺血再灌注后心肌无复流现象的发生。这一工作对HES抗炎作用的具体机制进行了补充,并为今后HES 应用于AMI术后无复流现象防治新策略提供了重要的实验依据。
[参考文献]
[1]Harrison RW, Aggarwal A, Ou FS, et al.Incidence and outcomes of no-reflow phenomenon during percutaneous coronary intervention among patients with acute myocardial infarction[J]. Am J Cardiol, 2013, 111(2):178-184.
[2]Rossaint J, Berger C, Kraft F, et al. Hydroxyethyl starch 130/0.4 decreases inflammation, neutrophil recruitment, and neutrophil extracellular trap formation[J]. Br J Anaesth, 2015, 114(3):509-519.
[3]Catre D, Lopes MF, Bento C, et al. Protective perioperative strategy using a third generation hydroxyethyl starch during surgery in a murine model of liver reperfusion injury[J]. Acta Cir Bras, 2011, 26(6):456-462.
[4]Varga R, Török L, Szabó A, et al. Effects of colloid solutions on ischemia reperfusion-induced periosteal microcirculatory and inflammatory reactions: comparison of dextran, gelatin, and hydroxyethyl starch[J]. Crit Care Med, 2008, 36(10):2828-2837.
[5]陈芳,魏继承. 中性粒细胞激活在心肌缺血再灌注损伤中的作用[J]. 西南军医, 2009, 11(1):117-119.
[6]Niccoli G, Burzotta F, Galiuto L, et al. Myocardial no-reflow in humans [J]. J Am Coll Cardiol, 2009, 54(4):281-292.
[7]Kalogeris T, Baines CP, Krenz M, et al. Cell biology of ischemia/reperfusion injury [J]. Int Rev Cell Mol Biol, 2012, 298:229-317.
[8]San Norberto García EM, Taylor JH, Cenizo N, et al. Beneficial effects of intra-arterial and intravenous prostaglandin E1 in intestinal ischaemia-reperfusion injury[J]. Interact Cardiovasc Thorac Surg, 2014, 18(4):466-474.
[9]周大春,马晓旭,谢俊然,等. 羟乙基淀粉(130/0.4)对大鼠肾脏缺血再灌注损伤的保护[J]. 中华医学杂志, 2007, 87(45):3224-3227.
[10]Matharu NM, Butler LM, Rainger GE, et al. Mechanisms of the anti-inflammatory effects of hydroxyethyl starch demonstrated in a flow-based model of neutrophil recruitment by endothelial cells [J]. Crit Care Med, 2008, 36(5):1536-1542.
[11]陈雪君,雷凡,段薇娜. 羟乙基淀粉对兔缺血-再灌注心肌 MPO 和 ET-1 的影响[J]. 广西医学, 2014, 36(2):158-161.
[12]Tian J, Lin X, Zhou W, et al. Hydroxyethyl starch inhibits NF-kappaB activation and prevents the expression of inflammatory mediators in endotoxic rats[J]. Ann Clin Lab Sci, 2003, 33(4):451-458.
[13]Huang AJ, Manning JE, Bandak TM, et al. Endothelial cell cytosolic free calcium regulates neutrophil migration across monolayers of endothelial cells[J]. J Cell Biol, 1993, 120(6):1371-1380.
[14]Hattori R, Ham ilton KK, Fugate RD, et al. Stimulated secretion of endothelial von Willebrand factor is accompanied by rapid redistribution to the cell surface of the intracellular granule membrane protein GMP-140[J]. J Biol Chem, 1989, 264(14):7768-7771.
[15]袁世荧,张雪平,曾邦雄. 高晶体高胶体渗透压混合液对脂多糖刺激的人血管内皮细胞 ICAM-1mRNA 表达的影响[J]. 中华麻醉学杂志, 2002, 22(5):283-286.
[16]丁自强,李少华. 内皮细胞骨架在血管通透性调节中的作用[J]. 生理科学进展, 1991, 2(3):212-214.
(责任编辑: 陈妙玲, 余小慧)
Effects of HES 130/0.4 on no-reflow after myocardial ischemia-reperfusion injury in rats
HUANG Chong-an, HE Li-na, SUN Jia-li, YING An-na, YE Yong-ting, CAI Qi, YUAN Lin-bo, HUA Chun-yan
(DepartmentofPhysiology,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:yuanlinbo_2011@126.com;florshine@163.com)
[ABSTRACT]AIM: To observe the effects and mechanisms of hydroxyethylstarch (HES) 130/0.4 on no-reflow phenomenon after myocardial ischemia-reperfusion in rats. METHODS: SD rats were randomly divided into 4 groups: sham operation group, ischemia-reperfusion (IR, treated with normal saline) group, normal saline ischemia-reperfusion (NS-IR, treated with NS) group and HES ischemia-reperfusion (HES-IR, treated with HES) group. Myocardial infarct size and no-reflow range were determined by staining methods, and the activities of myocardial enzymes (CK-MB, cTnI and MPO) were measured. Meanwhile, cardiac microvascular endothelial cells of the rat were cultured and divided into 4 groups: control group, hypoxia/reoxygenation (H/R) group, NS-H/R group and HES-H/R group. Acute ischemia reperfusion models were simulated, and the concentration of calcium ions was measured. The relative cell activity was evaluated by CCK-8 assay, and the apoptotic rate was detected by flow cytometry. RESULTS: In HES-IR group, the myocardial infarct size, the no-reflow zone, CK-MB, cTnI and MPO activity were all significantly lower than those in IR group (P<0.05). In microvascular endothelial cells, the concentration of calcium ions and the apoptotic rate in HES-H/R group were significantly decreased, while the relative cell activity increased compared with H/R group (P<0.05). CONCLUSION: HES reduces no-reflow in acute myocardial ischemia-reperfusion. The mechanism may be involved in the inhibition of both the infiltration of neutrophils and the calcium overload of endothelial cells.
[KEY WORDS]Hydroxyethylstarch; Myocardial reperfusion injury; No-reflow phenomenon; Myeloperoxidase; Calcium ions
doi:10.3969/j.issn.1000- 4718.2016.03.005
[中图分类号]R363.2; R541.4
[文献标志码]A
通讯作者△袁琳波 Tel: 0577-86699521; E-mail: yuanlinbo_2011@126.com;花春艳 Tel: 0577-86689769; E-mail: florshine@163.com
*[基金项目]浙江省教育厅资助项目(No.Y201223758);温州市科技计划项目(No.Y20140230);温州医科大学学生新苗课题(No.wyx201401024;No.wyx2015101072)
[收稿日期]2015- 09- 21[修回日期] 2015- 12- 11
[文章编号]1000- 4718(2016)03- 0411- 07
杂志网址: http://www.cjpp.net

